
Плывущий в лабиринте Морриса: тернистый путь моделирования нейродегенерации
26 марта 2024
Плывущий в лабиринте Морриса: тернистый путь моделирования нейродегенерации
- 909
- 0
- 9
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Болезнь Альцгеймера — животрепещущая тема не только для ученых, но и для большинства людей. Ничего удивительного, ведь продолжительность жизни по всему миру растет, и пожилых людей, в том числе с деменцией, становится все больше. А состояние это действительно страшное. Наверняка в вашей семье или у ваших знакомых была (или есть) история подобного заболевания. «Болезнь Альцгеймера — это я, перестающий доверять самому себе, посмешище, периодически не справляющийся даже с такой банальной задачей, как поиск тапочек» — говорил о своем диагнозе известный писатель Терри Праттчет. Говорил он и о том, что завидовал своему отцу, больному онкологией, ведь рак можно победить, а деменцию — нет. Пока что. Чем отличается болезнь Альцгеймера от деменции, с какими сложностями сталкиваются исследователи при изучении нейродегенеративных процессов и мечтают ли ученые об одной волшебной таблетке от деменции, разберем в этой статье.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа заняла второе место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2023/2024.
Эта работа заняла второе место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Партнер номинации — компания «Хеликон».

«Книжный» спонсор конкурса — «Альпина нон-фикшн».
Деменция, или как я встречаю вашу маму каждый день как в первый
Наука и медицина за последнее столетие благодаря шагам маленьким и побольше помогли сделать человечеству огромный скачок в плане значительного увеличения продолжительности жизни по всему миру, преимущественно в развитых странах. Вследствие этих же причин произошли глобальные сдвиги в мировой структуре заболеваемости и причинах смертности, и на первый план вышли заболевания, более характерные для людей пожилого возраста. Так, например, по данным ВОЗ среди десяти наиболее распространенных причин смерти ишемическая болезнь сердца занимает первое место; на втором — инсульты, которые у пожилых людей чаще связаны с атеросклерозом, чем с иными причинами; сахарный диабет 2 типа находится на девятом месте, тогда как болезнь Альцгеймера (БА) и другие причины деменции находятся на седьмом месте. Перечисленные патологические состояния — атеросклероз и ассоциированные с ним сердечно-сосудистые заболевания, сахарный диабет 2 типа и нейродегенеративные заболевания, а также ряд других, — относятся к возраст-зависимым (age-related diseases, ARDs), поскольку при старении риск их развития увеличивается экспоненциально [1]. Двое из трех людей старше 60 имеют в анамнезе одно или более таких заболеваний, а в крупных городах развитых стран — девять из десяти [2].
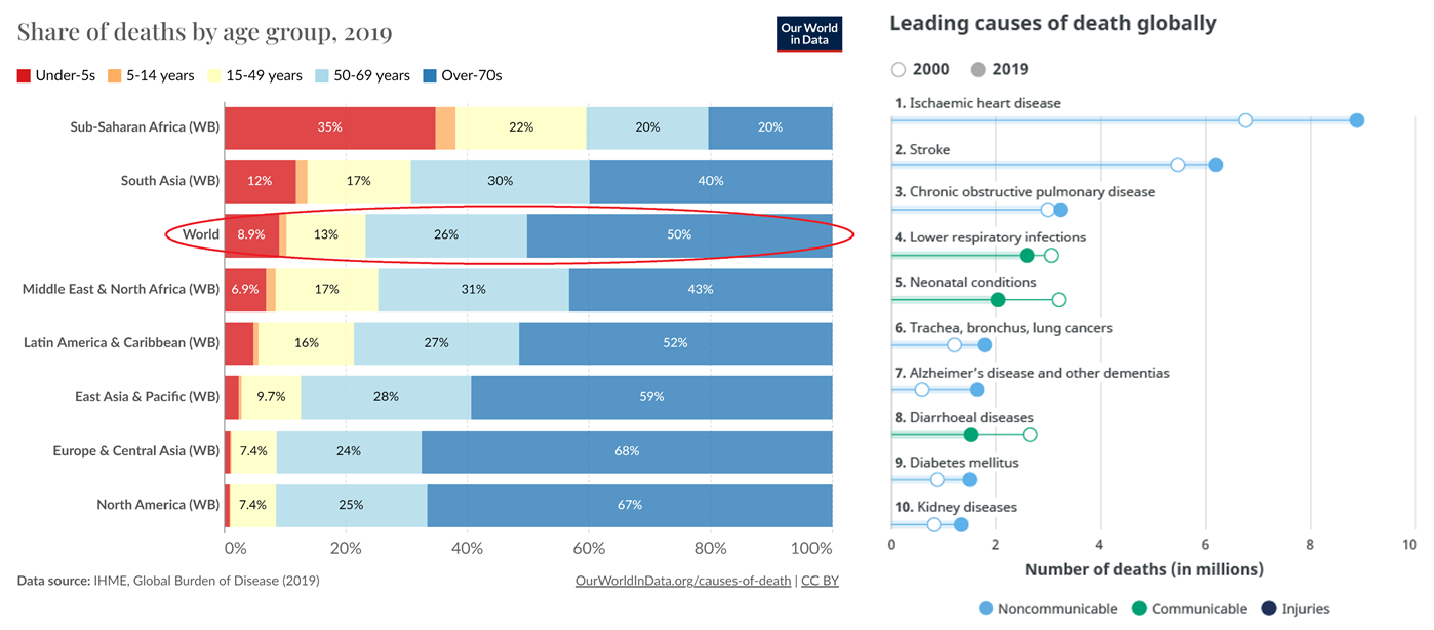
Рисунок 1. Возрастная структура смертности в разных регионах мира и изменение количества случаев от ведущих причин смерти в 2019 году по сравнению с 2000 годом.
Вот только своевременно диагностировать и успешно контролировать артериальную гипертензию, болезни сердца и диабет человечество научилось. Без соблюдения режима приема препаратов, правильного режима питания и физической активности работать таблетки особо не будут, но это тема отдельная. А вот с деменцией все сложнее и печальнее. Деменция — не самостоятельная нозологическая форма (болезнь), а синдром, который является осложнением и исходом различных заболеваний. К ней могут приводить нейродегенеративные заболевания, инсульты, опухоли центральной нервной системы, черепно-мозговые травмы, нейроинфекции (в том числе ВИЧ в стадии СПИДа) и другие. Однако в 60–70% случаев причиной (а не типом деменции, как часто пишут) является именно БА. В 2019 году в мире насчитывалось более 55 млн только диагностированных пациентов с деменцией, а при сохранении этой тенденции к 2050 году их будет более 150 млн. Отдельно стоит отметить, что деменция вне зависимости от этиологии основного заболевания, которое к ней привело, является наиболее распространенной причиной инвалидности во всем мире. Да, это могут быть и относительно молодые люди в возрасте 45–55 лет, однако эти пациенты составляют небольшой процент и у них нейродегенеративные процессы вызваны как раз не возраст-зависимыми причинами [3].
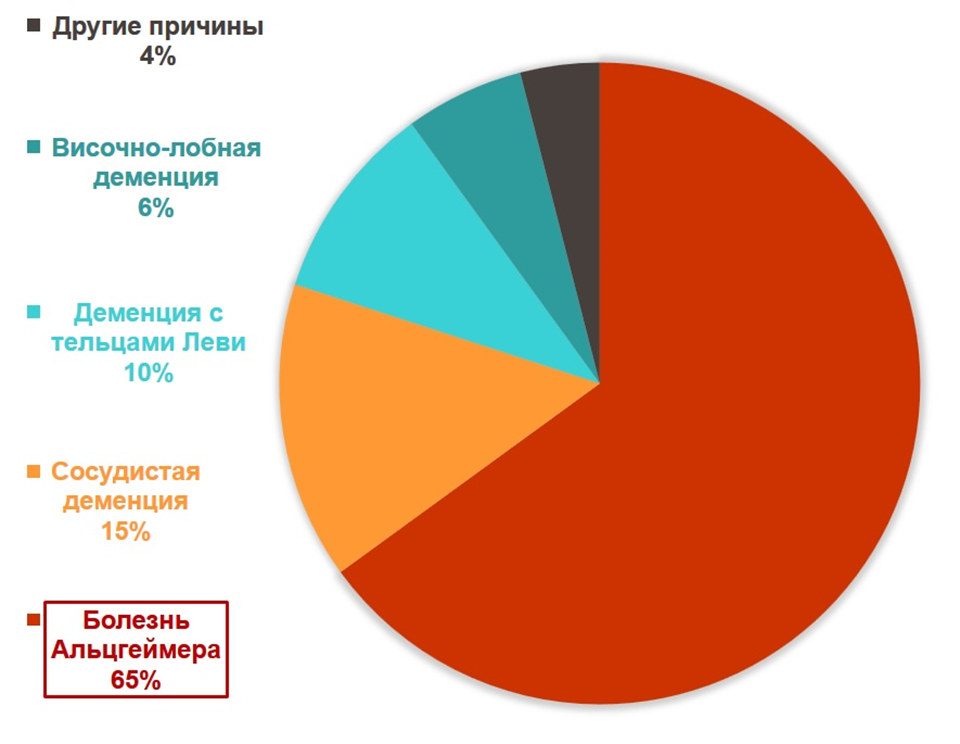
Рисунок 2. Структура причин развития деменции.
Уловить первые тревожные звоночки умеренных когнитивных нарушений часто сложно. Тут что-то забыл, там забыл, здесь отвлекся — ну, заработался, устал, с кем не бывает. И такая «забывчивость» может прогрессировать годами. Но когда человек уже на постоянной основе забывает, что только что сделал или сказал, начинает испытывать затруднения при поиске дороги домой или не узнает родных людей в лицо — это уже неспособность к самообслуживанию, а значит, деменция и инвалидность. Страшно и то, что от столь плачевного исхода, похоже, никто не застрахован, за редким исключением. Наверняка слышали, что не так давно известный актер Брюс Уиллис завершил карьеру из-за прогрессирующей деменции? У него выявили лобно-височную деменцию, которая в бóльшей мере, чем БА, связана с генетическими нарушениями. Однако конечный итог все тот же: нейроны перестают нормально функционировать, утрачивают возможность взаимодействовать друг с другом с помощью синаптических контактов и в конце концов погибают. На рисунке 3 представлены несколько известных людей, которым была диагностирована деменция, в частности вызванная болезнью Альцгеймера.

Рисунок 3. Известные люди с деменцией.
коллаж автора
Казалось бы, люди обеспеченные могут позволить себе качественную еду и хорошее медицинское обслуживание, к тому же образованные (низкий уровень образования и социальной активности является фактором риска развития нейродегенеративных процессов), но и их деменция стороной не обошла. И это лишь несколько примеров. Нужно ли говорить, что деменция остается колоссальным бременем не только для самих пациентов, но и для их семей, а также медицинских и социальных работников. А еще это огромная экономическая нагрузка на большинство стран, так как ежегодные мировые затраты на лечение и социальную поддержку таких пациентов составляют более 1,3 трлн долларов США.
Отчасти столь большие траты связаны с тем, что в настоящее время отсутствуют специфичные и доступные методы диагностики БА. Точнее, методы, конечно, есть. Из доступного, чем чаще всего пользуются специалисты — опросник Mini Mental State Examination, MoCA-тест и углубленное нейропсихологическое исследование, основанные на наблюдении за пациентом и разговоре с ним. Из относительно эффективного — исследование спинномозговой жидкости (ликвора) на наличие специфичных для БА белков — β-амилоида и фосфорилированного тау и их соотношения. Но хоть эта сложная инвазивная манипуляция и является обязательной для верификации именно БА, прибегают к ней нечасто, во всяком случае в нашей стране; а сам факт выявления в ликворе амилоида и тау-белка при наличии у пациента характерных жалоб означает позднюю стадию заболевания. Из очень эффективного — метод ПЭТ/КТ. Круто, специфично, максимально возможно ранняя диагностика. Но оборудование для этого метода крайне сложное и невероятно дорогое, в разы более продвинутое, чем знакомая нам МРТ, и до рутинного скрининга с его помощью дело если однажды и дойдет, то очень нескоро. В итоге доступное недостаточно эффективно, а эффективное — недоступно. Тем не менее, нейровизуализация при помощи МРТ используется для определения степени нейродегенерации и как инструмент дифференциальной диагностики, но опять же лишь на поздней стадии. Панель биомаркеров крови хоть и обсуждается давно, но ее разработка все еще маячит где-то на горизонте. Эффективные подходы к терапии также до сих пор остаются камнем преткновения. Одобренные FDA препараты, включенные в том числе в российские клинические рекомендации, такие как ингибиторы ацетилхолинэстеразы (галантамин, донепезил, ривастигмин) и антагонисты глутаматных NMDA-рецепторов (мемантин), способны лишь ненадолго облегчить симптомы заболевания и замедлить его прогрессию. Почему же так?
Амилоид: (не) догма
В настоящее время инициальные механизмы патогенеза БА до сих пор изучены недостаточно. Амилоидная гипотеза доминировала на поле исследования нейродегенерации долгое время, однако в 2022 году выяснилось, что данные в одной из основных экспериментальных статей (на самом деле не одной, но с этой все началось) были сфабрикованы. Об этом можно почитать здесь [4]. Многочисленные данные последних лет свидетельствуют о том, что это крайне сложный длительный многоступенчатый процесс, где отложения конгломератов β-амилоида являются не причиной запуска всего последующего каскада клеточно-молекулярных процессов нейродегенерации, а лишь одним из промежуточных этапов [5]. Это косвенно подтверждают и исследования леканемаба, препарата на основе анти-амилоидных антител, проходящего финальные клинические испытания, где он показал относительно низкую эффективность при достаточно высоком риске тяжелых побочных эффектов [6].
Но единственной амилоидная гипотеза, конечно, не была. Что только ни пытались обвинить в развитии нейродегенерации: и инфекции, и гормоны, и аутоантитела, и генетические полиморфизмы, и прионные механизмы. Основные теории кратко изложены в нашем обзоре [7]. Как ни крути, факторов, влияющих на инициацию, течение и прогрессию столь сложного процесса, как нейродегенерация, очень много, так что и простого ответа, почему, а главное — как лечить, пока нет. Но чтобы приблизиться к ответу, идти нужно пусть и медленно, но в правильном направлении. Одной из гипотез, имеющих на наш скромный взгляд наибольший потенциал для исследования, является влияние инфламэйджинга (inflammation + aging) — системного хронического вялотекущего возраст-ассоциированного воспаления. Оно является проявлением возраст-ассоциированного секреторного фенотипа (senescence-associated secretory phenotype, SASP) стареющими клетками организма [8]. Такие клетки часто утрачивают свои нормальные функции, но погибают не сразу, а остаются секреторно активными, синтезируя различные про- и противовоспалительные цитокины, хемокины, факторы роста, адгезии и транскрипции [7]. Инфламэйджинг является одним из факторов риска развития возраст-ассоциированных заболеваний; в то же время эти же самые патологические состояния, а также некоторые другие, например, депрессия [9], способствуют дополнительному усилению его провоспалительного фона [10].
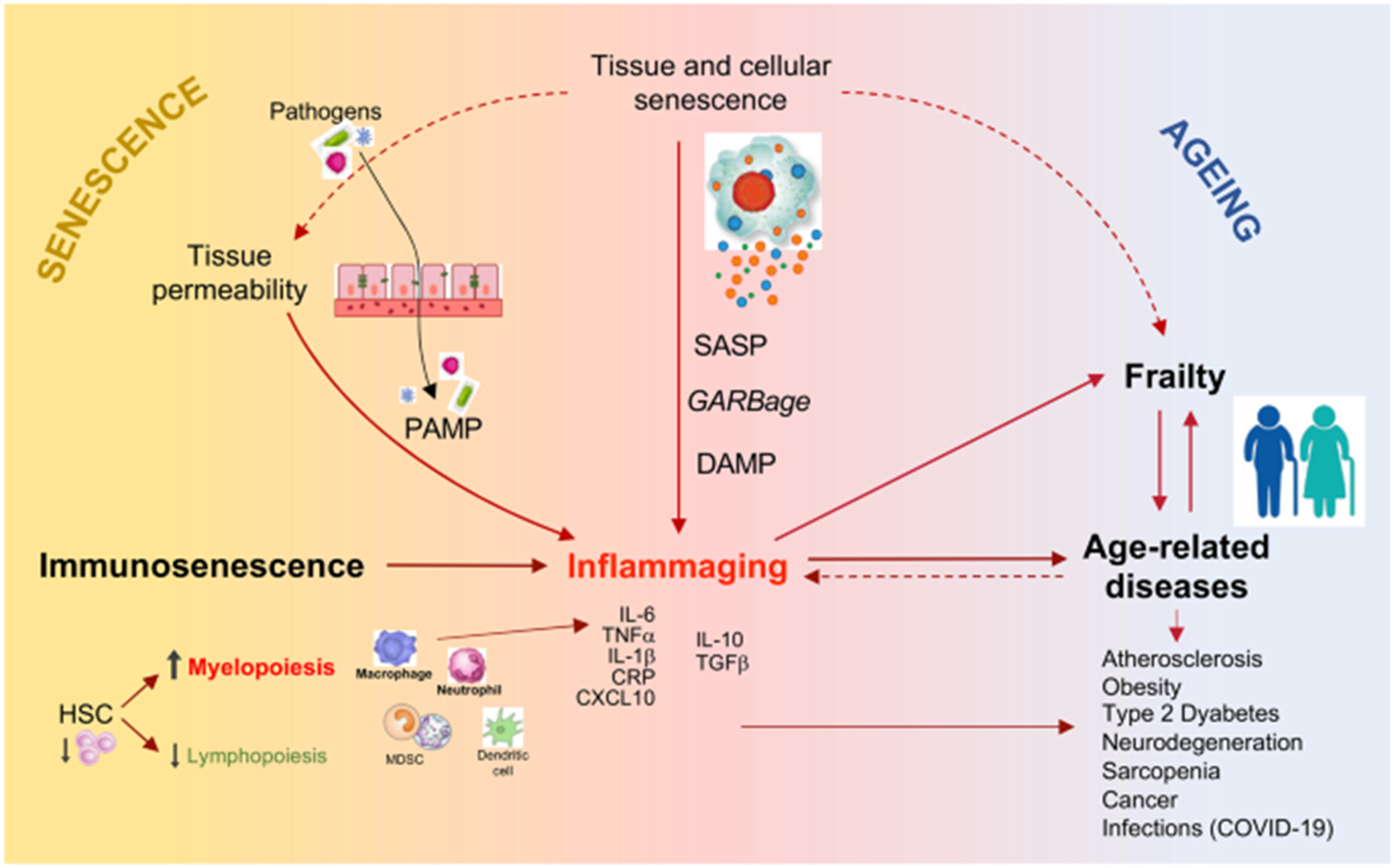
Рисунок 4. Влияние старения на развитие инфламэйджинга и возраст-ассоциированных патологий.
Экспериментальные модели: трансгенные мыши не то, чем кажутся
Почти 95% случаев БА не вызваны наследованием мутаций в генах, связанных с метаболизмом амилоида (ген App кодирует белок-предшественник амилоида (amyloid precursor protein, АРР), а гены Psen1 и Psen2 отвечают за фермент гамма-секретазу, которая «разрезает» АРР для дальнейшего метаболизма) [11], а относятся к спорадической форме, или БА с поздним началом. У таких пациентов болезнь начинает проявляться умеренными когнитивными нарушениями в возрасте старше 60–65 лет [12], что и позволяет отнести ее к группе возраст-ассоциированных патологий. Однако моделирование БА в условиях лабораторий до сих пор проводится в основном на половозрелых животных. Кроме того, множество исследований проводится на различных линиях трансгенных мышей и крыс. Чаще всего используются мыши с мутациями в генах, связанных как раз-таки с метаболизмом амилоида, и активно создавались эти линии, когда амилоидная теория была в тренде. Очевидно, что патологические процессы у таких животных не соответствуют механизмам нейродегенерации у человека. Средняя продолжительность жизни лабораторной мыши/крысы, если ее не задействовали в эксперименте, составляет около двух лет, т.е. 24 месяца, тогда как расчетная продолжительность жизни среднего человека — 70–80 лет. Взрослеют и стареют мыши и люди нелинейно, с разной скоростью в разные периоды жизни (младенчество, препубертат, половая зрелость, старость), и для приблизительных расчетов соотношения возраста мыши в днях и человека в годах существуют исследования и выведены формулы [13]. Подавляющее большинство экспериментов, проводимых для исследования нейродегенеративных процессов, проводится на мышах и крысах возрастом 3 или 6 месяцев, гораздо реже встречаются работы, где возраст животных достигает 12–15 месяцев, а 18 и более месяцев — совсем редко; при этом, хотя мышь, которой 12–15 месяцев, уже считается достаточно старой, активно экспрессировать маркеры клеточного старения мышиные клетки начинают не ранее 18 месяцев жизни животного [13]. С крысами цифры немного отличаются, но принцип тот же. Понятно, почему используют в основном половозрелых животных: если они будут сидеть и стареть год-два, их ведь надо содержать, кормить, менять подстил в клетках, и вообще ждать долго, они вполне могут до желаемого возраста не дожить — особенно если это трансгенные мыши, генетически запрограммированные на раннюю манифестацию морфологических и поведенческих признаков нейродегенерации. Однако, это ключевой момент, и в идеальных условиях ученые не должны ломать голову, за какие деньги содержать мышей и крыс: они должны с этими животными работать, в том числе с животными старыми, если того требует конкретный эксперимент. Потому что если возраст мыши 6 месяцев, ее возраст приблизительно соответствует 30 человеческим годам. К слову, уже довольно давно было обнаружено, что у людей даже в возрасте 30 лет и менее в головном мозге обнаруживается фосфорилированный тау-белок, второй специфичный признак БА, как считалось, образующийся позже амилоидных бляшек, а в действительности — наоборот [14]. Уже в возрасте 6 месяцев трансгенные мыши при проведении поведенческих тестов демонстрируют снижение когнитивных функций, а при гистологическом исследовании у них выявляются отложения амилоида и иногда даже тау-белка. Похоже на нейродегенерацию у людей? Похоже. Вот только эти морфофункциональные изменения у таких мышей — лишь конечная точка, а процессы, которые к ней привели, кардинально от человеческих отличаются, ведь случаи БА с ранним началом, ассоциированные с мутациями, не относятся к возраст-зависимой форме и составляют не более 5%. Важно и то, что инфламэйджинг, характерный для пожилых людей, у мышей и крыс в возрасте 3, 6 и даже 12 месяцев еще не развивается, в том числе у большинства линий с мутациями. Но не у всех: например, коллегами из Новосибирска описана линия крыс OXYS, для которых характерно ускоренное старение [15]; однако это также селективно выведенные животные, запрограммированные стареть неестественно быстро вне зависимости от внешних факторов. Есть и разные нокаутные мыши, и по мере совершенствования технологий, позволяющих редактировать геном, их становится все больше. Важно помнить, что к анализу данных, полученных на таких животных, нужно подходить с большой осторожностью; напрямую экстраполировать их на людей не получится, хотя какие-то интегральные механизмы или неожиданные свойства, казалось бы, знакомых цитокинов или ферментов на таких моделях выявлять и изучать бывает проще.
Активные формы кислорода и микроглия: чем мы заняты в тени
Кажется логичным предположить, что эксперименты по моделированию нейродегенерации на старых животных позволят получить наиболее релевантные данные вследствие наличия у них провоспалительного фона инфламэйджинга и в целом системного «изнашивания» организма по причине самого старения при отсутствии критических генетических нарушений. Но где же искать кнопку запуска этого беспощадного процесса или из чего ее сделать? Моделирование болезней человека на животных называется трансляционными исследованиями. Что это такое и как это работает, на «Биомолекуле» писали ранее [16]. Среди широкого разнообразия экспериментальных моделей БА есть такие, которые основаны на воздействии соединений алюминия. Полвека назад высказывались предположения, что его потребление с едой из консервных банок или алюминиевой посуды может увеличивать риск деменции. Это маловероятно: соединения алюминия, используемые для бытовых целей, не являются водо- или жирорастворимыми и при попадании в организм остаются достаточно инертными, к тому же практически не всасываются. Другой момент — это работа на вредном производстве с соединениями данного металла, однако это случай частный. Потенциально жители экологически неблагополучных регионов могут быть подвержены его (и не только) чрезмерному потреблению, но пока прямой корреляции между воздействием алюминия на человечество в целом (даже в составе вакцин!) и риском развития деменции не выявлено [17]. Тем не менее, в нашем эксперименте, как это делалось и ранее, использовали именно его, а точнее, растворимую соль хлорид алюминия (AlCl3). Почему?
Ионы Al3+ всасываются в ЖКТ при попадании в него растворимых соединений алюминия, хоть и в совсем небольшом количестве — от 0,01 до 1% [18], после чего связываются в крови с белками-транспортерами, например, трансферрином, который обычно катает на себе ионы железа и служит его депо. Несмотря на то, что алюминий — наиболее распространенный металл на нашей планете, его физиологическая роль в организме человека так и не была определена: для нормального функционирования алюминий человеку не нужен, и вы не встретите его в составе БАДов, таких как селен, цинк, магний или все то же железо. Но ионы алюминия об этом не знают — и ничто не мешает им вытеснять своих товарищей, преимущественно ионы железа, а также магния и кальция, из их родных соединений — белков-транспортеров и ферментов [18]. И вот тут начинаются проблемы. С одной стороны, хоть ионы Al3+ и очень похожи по своим физико-химическим свойствам на ионы Fe3+, встраиваясь в биологически активные соединения, требующие присутствия ионов железа, они не могут обеспечить их функциональную активность, и весь последующий каскад реакций из-за этого страдает. А с другой стороны, образуется большое количество свободных заряженных ионов — как Al3+, так и Fe3+, а они за счет своего положительного заряда стимулируют продукцию активных форм кислорода (АФК, reactive oxygen species, ROS). АФК (ROS) нужны организму и выполняют важные физиологические функции, обеспечивая рост и дифференцировку клеток, но действуя в системе сдержек и противовесов с антиоксидантной системой (АОС); в нее входят такие соединения, как каталаза, супероксиддисмутаза, глутатион и другие. Но если АФК становится слишком много, они выходят из-под контроля, начинают напрямую повреждать структуры митохондрий и ДНК, активировать перекисное окисление липидов, опосредованно влиять на усиление экспрессии провоспалительных цитокинов и угнетать активность ферментов антиоксидантной системы, усугубляя состояние гипоксии, вызванное митохондриальной дисфункцией [19]. А это значит, что в клетках, в частности мозга — самой энергоемкой и уязвимой к ее недостатку системы, — возникает сбой в эффективном энергоснабжении, ведь митохондрии по сути своей являются маленькими клеточными электростанциями [20].
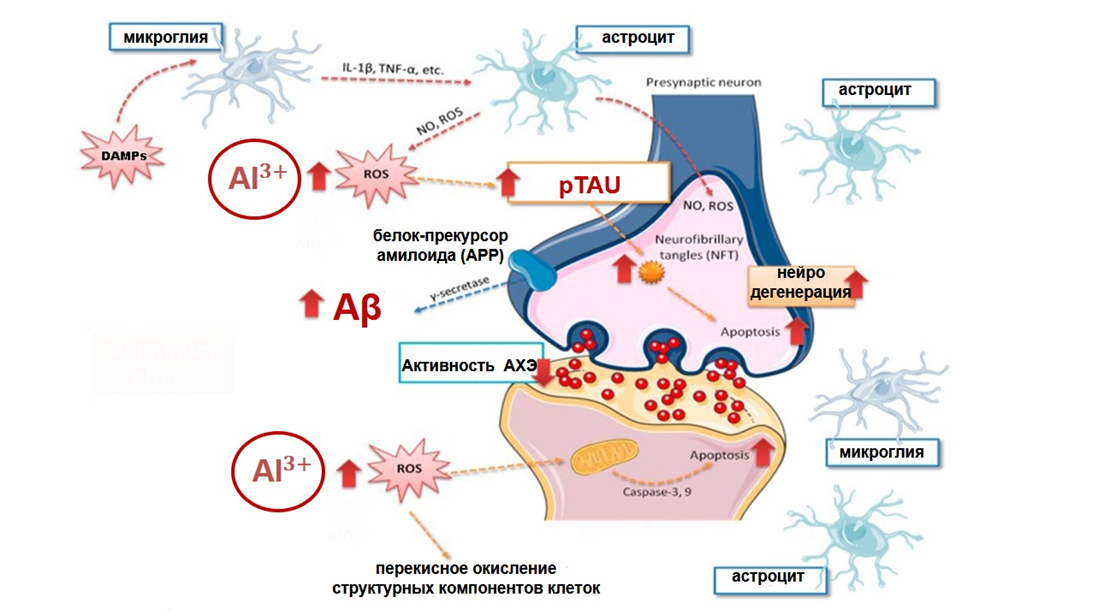
Рисунок 5. Биологическое действие ионов алюминия и активных форм кислорода (АФК, ROS) на нейроны и микроглию.
адаптировано из [20]
Все эти процессы характерны и для старения вследствие все того же инфламэйджинга, поскольку многие каскады реакций взаимосвязаны: провоспалительные цитокины, вырабатываемые стареющими клетками, активируют иммунные клетки, и они сами синтезируют больше АФК, чем организму нужно при физиологических условиях. Особенно, если провоспалительный фон инфламэйджинга усиливают возраст-зависимые заболевания.
Головной мозг — орган иммунопривилегированный. Он ограничен гематоэнцефалическим барьером, и при физиологических условиях иммунные клетки периферической крови его как бы не замечают; если же они массово начинают его замечать, развиваются аутоиммунные заболевания, например, рассеянный склероз. Однако мозгу тоже нужны макрофаги — иммунные «клетки-уборщики». Такими макрофагами в ЦНС являются клетки микроглии. Они имеют такое же происхождение, что и моноциты крови, и макрофаги в других тканях организма, но обитают только в головном мозге. И функций у них немало: помимо иммунного надзора, они отвечают и за «клининг», фагоцитируя (буквально: «поедая») погибшие клетки, неправильно свернувшиеся белки, в том числе пытаются разрушать и амилоидные бляшки (спойлер: получается не очень), а также поддерживают функционирование нейронов, очищая синаптические щели и разрушая лишние межклеточные контакты. Вспомните себя в конце года/семестра/любого другого отчетного периода (вставьте нужное): слишком много дел, отчетов/зачетов, цейтнот, все в мыле, вы в мыле, и в целом ощущение такое, будто вы оказались среди участников того самого чаепития из «Алисы в стране чудес», которые прогневали время, и теперь у вас всегда два дня до дедлайна. Что происходит? Истощение — и моральное, и физическое. Потому что супервысокую производительность невозможно поддерживать в условиях чрезмерного стресса и отсутствия возможности эффективно восстанавливать ресурсы. А теперь представьте, как то же самое происходит с микроглией в условиях гиперпродукции АФК и провоспалительных цитокинов. Клетки микроглии реагируют как на сами АФК, так и на бардак, который эти вещества устраивают. И из состояния функционального покоя переходят в состояние активации. Что это за активация, зачем она нужна и как ее оценить, обсудим чуть позже. Но суть в том, что опять же поддерживать высокий КПД постоянно, особенно в неблагоприятной среде, не получится. У клеток микроглии нет сознания, и выгорания у них тоже не будет, а вот истощение, срыв адаптации и угнетение функций — да.
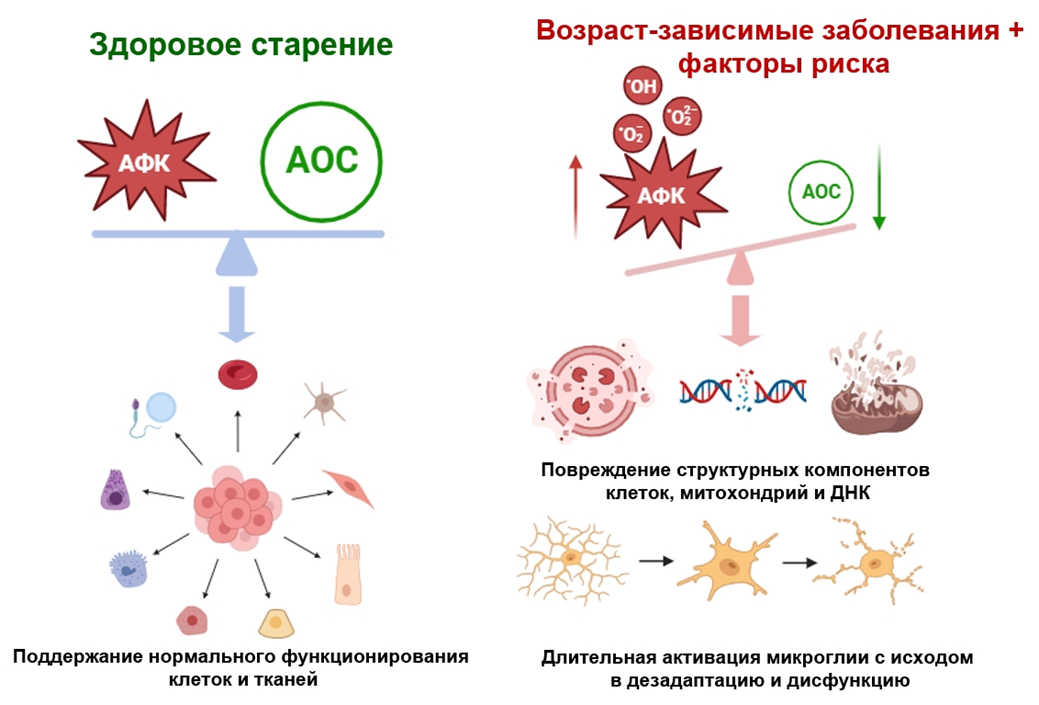
Рисунок 6. Физиологическое действие активных форм кислорода (АФК) и антиоксидантной системы (АОС) при их равновесии и патологическое — при дисбалансе.
Как уже было описано выше, проблема моделирования нейродегенерации в том, что чаще всего это делается на животных, которые либо несут генетические аберрации, которых нет у подавляющего числа пациентов с диагностированной БА, либо на недостаточно старых. Но помимо того, что они недостаточно пожили, чтобы у них манифестировали клеточное старение и инфламэйджинг, они еще и условно здоровы. У основных линий лабораторных мышей и крыс без мутаций и нокаутных генов не разовьется ни артериальная гипертензия, ни атеросклероз, ни сахарный диабет — если не моделировать эти состояния намеренно. А при использовании растворимых соединений алюминия можно вызвать усиление продукции АФК — тот самый аспект, который наблюдается при этих возраст-зависимых заболеваниях, — симулировать их наличие и запустить каскад дальнейших реакций.
Властелин эксперимента: две возрастные группы
Столь объемная теоретическая часть была необходима, чтобы обозначить все важные промежуточные точки в таком сложном деле, как моделирование нейродегенерации. И теперь наконец-то можно переходить к самому интересному: а что, собственно, мы сделали и что получили?
Целью нашего эксперимента было изучение морфофункциональных изменений головного мозга у молодых и старых самцов крыс линии Вистар для оценки возрастных физиологических изменений и выявлении различий в адаптивных реакциях на неблагоприятное внешнее воздействие в зависимости от возраста. Всего в эксперименте использовали 40 животных, 20 из которых были молодыми крысами в возрасте 3 месяцев, и еще 20 — старыми крысами в возрасте 24 месяцев. Случайным образом они были разделены на четыре группы — две опытные и две контрольные. Молодые и старые крысы контрольных групп получали обычную питьевую воду, а животным опытных групп в воду добавляли хлорид алюминия (AlCl3) в дозе 100 мг/кг массы тела/сутки. Всего эксперимент продолжался 60 суток. Доза хлорида алюминия и длительность потребления была подобрана в пилотном эксперименте с учетом литературных данных [21]. Подробная схема эксперимента, результаты и обсуждение изложены в нашей статье [22], здесь же кратко обсудим ключевые моменты.
При исследовании когнитивных функций с помощью водного лабиринта Морриса животных в течение двух дней тренировали искать платформу в бассейне и регистрировали время, необходимое, чтобы платформу найти, таким образом оценивая их способности к обучению, запоминанию «выхода» из неблагоприятной среды и пространственному ориентированию.
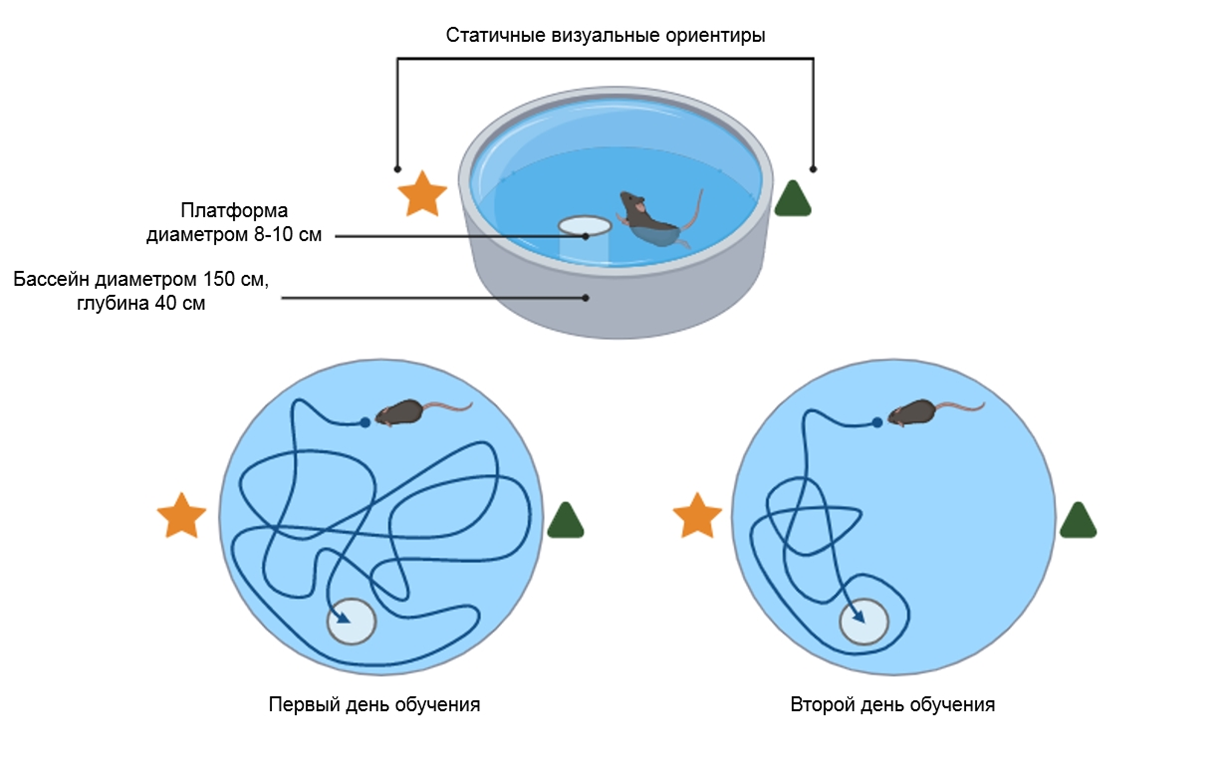
Рисунок 7. Принцип метода оценки когнитивных функций с помощью водного лабиринта Морриса.
Тестирование проводили до начала эксперимента и на 56–57 сутки, перед его окончанием. Молодые крысы, потреблявшие алюминий, стали ориентироваться в бассейне гораздо хуже, а вот старые контрольные — наоборот.
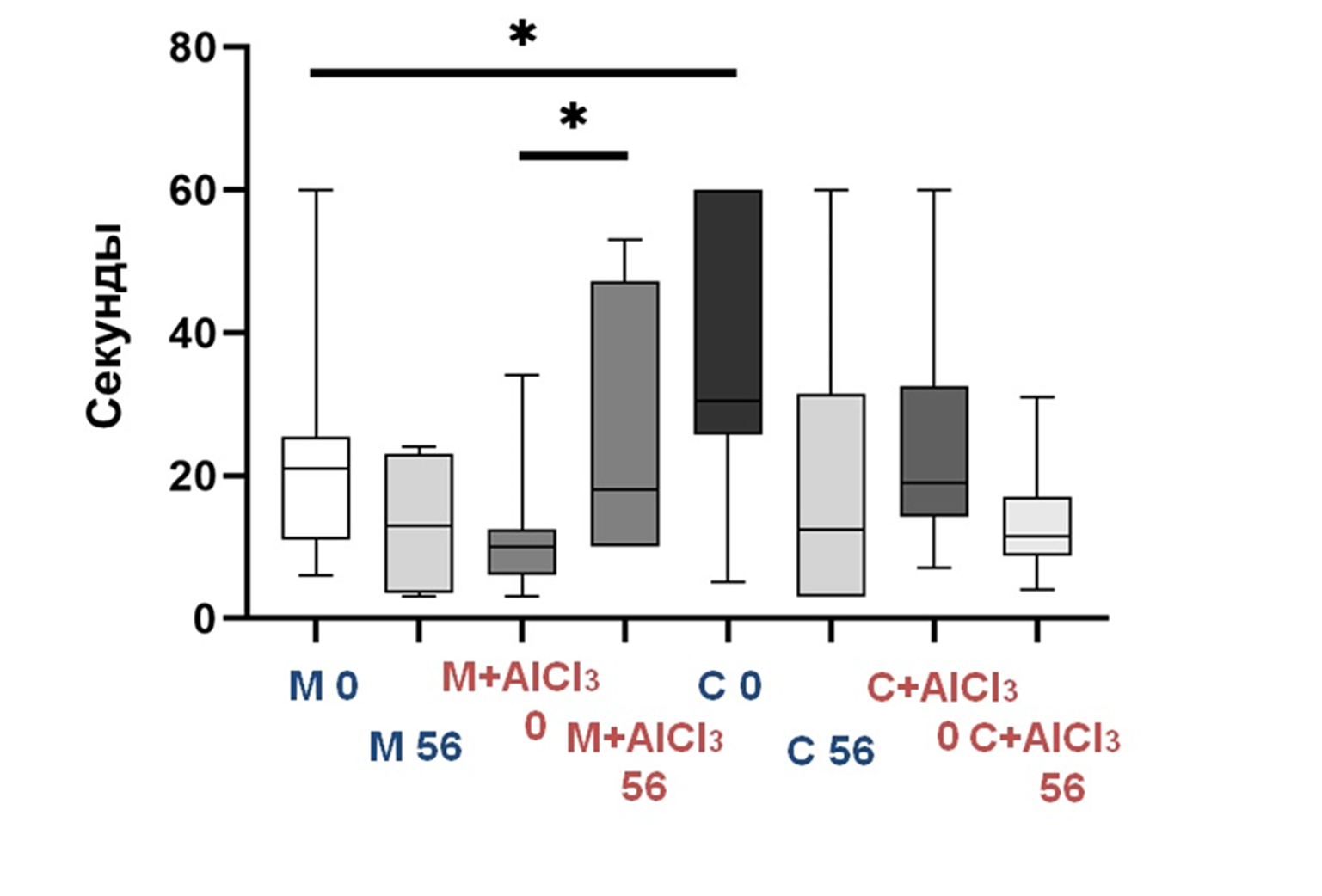
Рисунок 8. Время, необходимое для достижения платформы молодыми (М) и старыми (C) крысами Вистар контрольных и опытных (М+AlCl3 и С+AlCl3) групп на 0 и 56–57 сутки эксперимента.
р < 0,05
У старых контрольных крыс и у молодых, потреблявших хлорид алюминия, по сравнению с молодыми контрольными животными при окраске гистологических срезов головного мозга на уровне гиппокампа по методу Ниссля было обнаружено достоверно большее относительное количество видоизмененных гиперхромных нейронов в зоне СА1, тогда как в зоне СА3 и зубчатой извилине их стало больше у старых крыс, которым давали хлорид алюминия, по сравнению с молодой опытной группой.
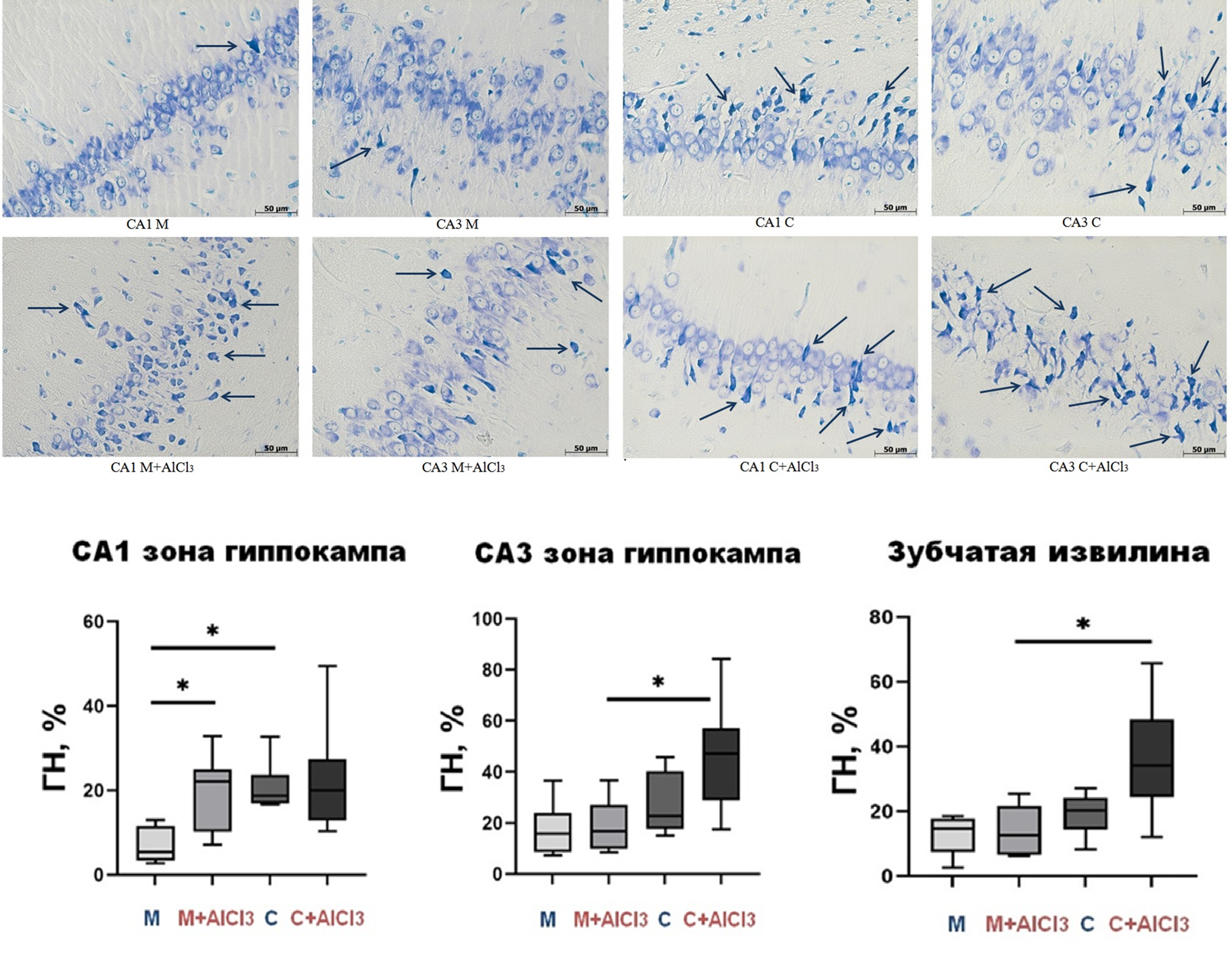
Рисунок 9. Гиперхромные нейроны в СА1 и СА3 зонах гиппокампа при окраске по методу Ниссля и относительное количество гиперхромных нейронов в зонах СА1, СА3 и зубчатой извилине гиппокампа у молодых и старых крыс Вистар контрольных и опытных групп.
ГН — гиперхромные нейроны.
р < 0,05
Данная окраска специфична для нейронов и используется для их морфологической оценки: темные сморщенные клетки полигональной формы либо уже погибли, либо находятся в состоянии гибернации, поддерживая базовый внутриклеточный метаболизм и ожидая, пока неблагоприятные внешние условия сменятся благоприятными. В таком состоянии свои основные функции — взаимодействие с другими нейронами — они выполнять не могут. Разное распределение этих дисфункциональных нейронов у молодых и старых животных может объяснять результаты исследования когнитивных функций и объясняться различной активностью и функциями исследованных зон. Регион гиппокампа CA1 отвечает за ассоциативные связи с нейронами височной коры и первичное формирование кратковременной памяти, тогда как CA3 в основном регулируют процессы пространственной и контекстуальной памяти [23]. Это требует более высоких затрат энергии нейронами СА1, а значит, они более чувствительны к ее дефициту. Но если при прекращении воздействия алюминия у нейронов молодых крыс еще был бы шанс восстановиться, то у старых скорее нет, ведь у них неблагоприятные условия вызваны инфламэйджингом, который только усиливается с возрастом. Что же касается результатов поведенческого теста, по-видимому, старение влияет на популяцию крыс и людей схожим образом, т. е. весьма неоднородно, вследствие чего наблюдалась высокая вариабельность результатов как между тренировочными сессиями, так и внутри одной сессии обучения у всех протестированных животных, как сообщалось и ранее [24]. Статистический анализ и интерпретация подобных результатов — достаточно сложная задача. Многоступенчатые и тесно взаимосвязанные процессы, происходящие в разных структурах мозга, с возрастом перестраиваются, чтобы поддержать функционирование памяти на необходимом для выживания уровне [25]. Как и у людей, в популяции крыс когнитивные способности высоко гетерогенны, и у некоторых животных возрастная адаптивная перестройка этих процессов происходит более эффективно, чем у других.
При визуализации микроглии с помощью метода иммуногистохимии было выявлено, что подавляющее большинство микроглиальных клеток в префронтальной коре молодых крыс и контрольной, и экспериментальной групп имели размер в пределах референсных значений (около 15–30 мкм) и тонкие, умеренно разветвленные отростки, что является признаками функционального состояния покоя. У старых контрольных животных размер клеток микроглии превышал 30 мкм, их отростки были гипертрофированы, удлинены, избыточно разветвлены, имели извилистую форму и шаровидные выпячивания клеточной стенки. Эти клетки уже длительное время находились в состоянии активации, но их ресурсы пока еще не истощены. У старых крыс, потреблявших хлорид алюминия, клетки микроглии также были крупными (> 30 мкм) с удлиненными извилистыми отростками и выбуханиями, однако их отростки были истончены и фрагментированы, что указывает на дистрофию. Отростки нужны микроглии (как и другим макрофагам) для передвижения в зону куда зовет бэт-сигнал воспаления и осуществления фагоцитоза, но если они ломаются, выполнять свои функции эти стражи порядка будут больше не способны.
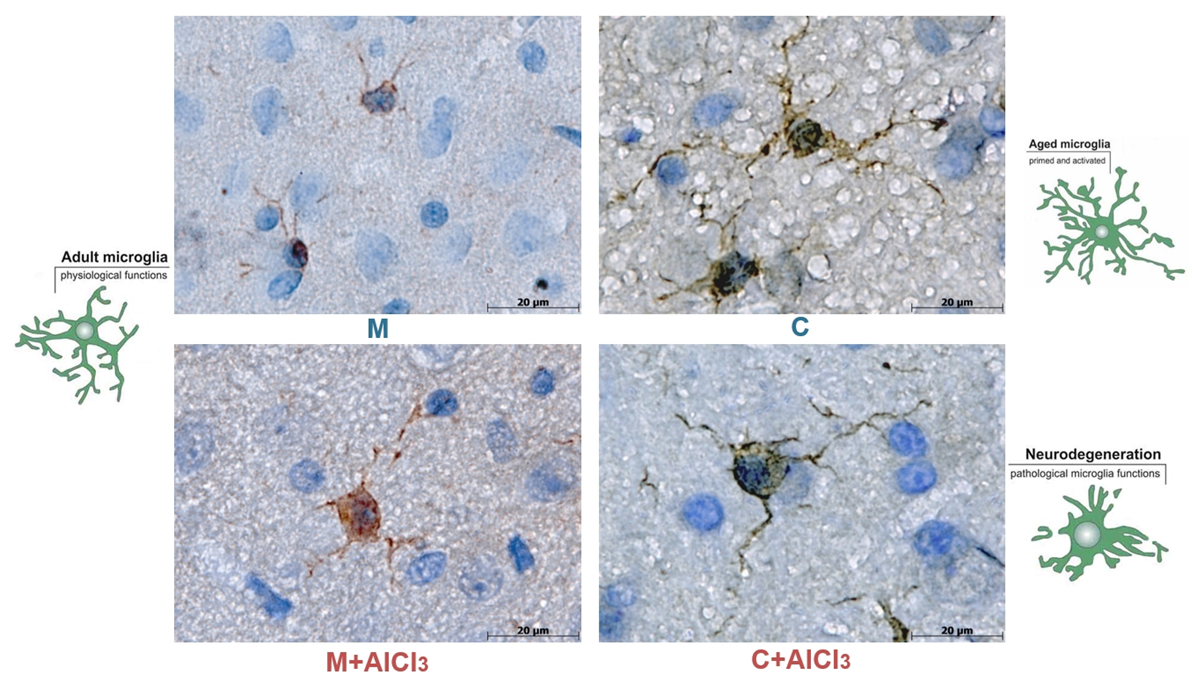
Рисунок 10. Морфологическая характеристика клеток микроглии с тонкими и короткими отростками в группах молодых крыс контрольной (М) и опытной группы (М+AlCl3); микроглия увеличенных размеров со сфероидальным набуханием гипертрофированных извитых отростков у старых крыс контрольной группы (C); микроглия увеличенного размера с бусинами, извилистыми и фрагментированными, но не утолщенными отростками у старых крыс, потреблявших хлорид алюминия (С+AlCl3). Иммуногистохимическое окрашивание с использованием антител к микроглиальному маркеру Iba-1.
По данным ПЦР в режиме реального времени уровень экспрессии мРНК провоспалительного цитокина интерлейкина-18 (IL-18) у старых крыс обеих групп был значительно выше, чем у контрольных и опытных групп молодых животных, а вот экспрессия провоспалительного маркера Tnf-α усилилась только у старых контрольных крыс относительно молодых контрольных. Экспрессия маркеров противоспалительных демонстрировала обратную тенденцию — значительное снижение; при этом уровень интерлейкина-10 (IL-10) у обеих групп старых крыс был даже ниже порога определения. Это не только прямые признаки присутствия инфламэйджинга у старых животных, но и отражение функциональной активности микроглии, ведь именно эти клетки являются основным источником этих цитокинов в ЦНС, и клетки микроглии у старых крыс, потреблявших хлорид алюминия, синтезируют меньше этих веществ, чем микроглия старых крыс, не подвергавшихся внешнему негативному воздействию.
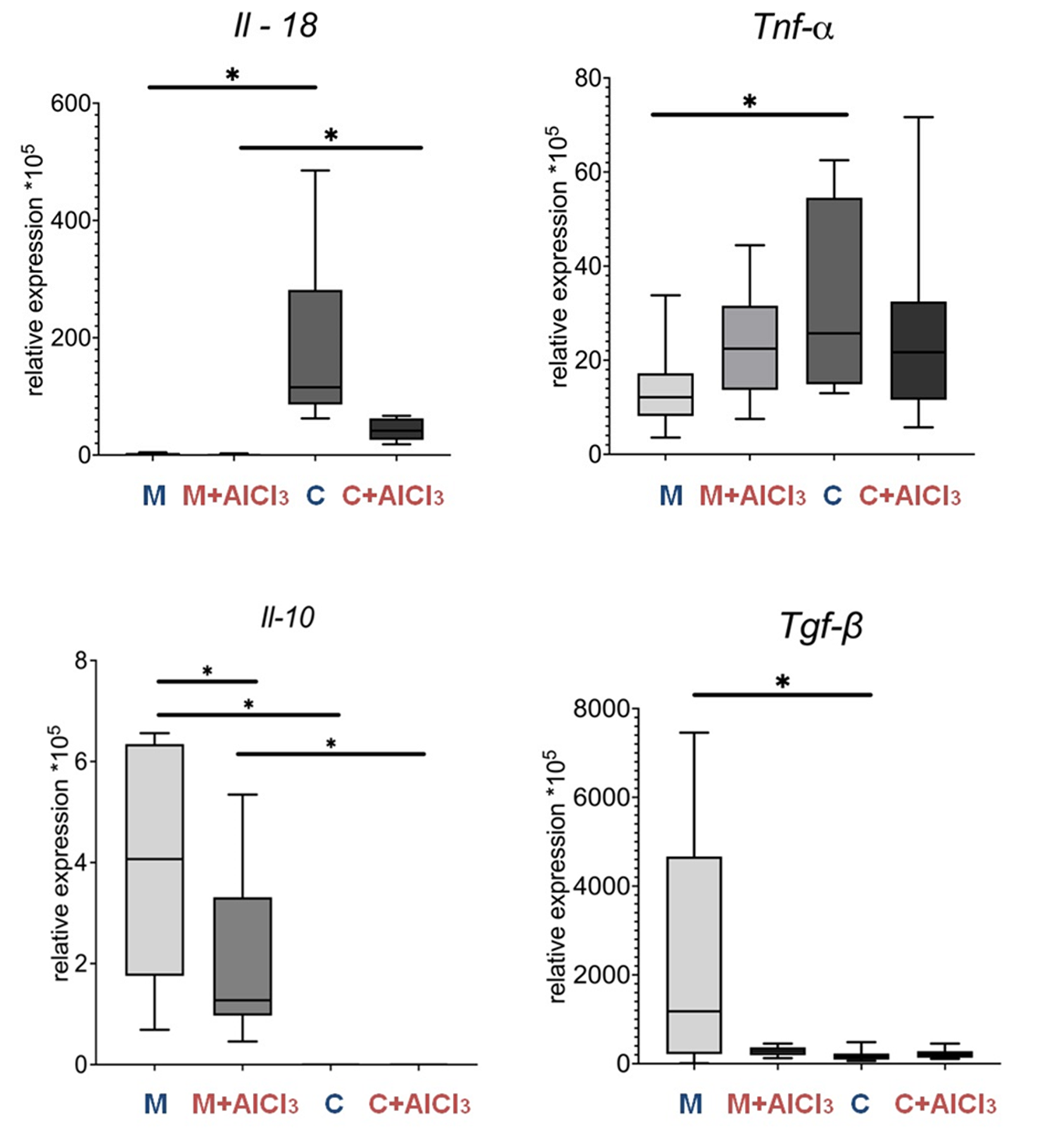
Рисунок 11. Уровни экспрессии мРНК провоспалительных цитокинов IL-18 и Tnf-α и противовоспалительных цитокинов IL-10 и Tgf-β в префронтальной коре головного мозга у половозрелых и старых крыс Вистар контрольных и опытных групп.
p < 0,05
А что там с активацией микроглии? Преимущественно эти резидентные макрофаги ЦНС находятся в состоянии функционального покоя. Это не значит, что они сидят на месте и ничего не делают. Просто работы у них немного и осуществляется она в спокойном темпе. Чтобы активировать микроглию, нужен бэт-сигнал раздражитель, взаимодействующий с их рецепторами: это могут быть экзогенные вещества, например, компоненты стенок бактерий, или те самые АФК, про- и противовоспалительные цитокины или хемокины. Соответственно, активация микроглии, как и других макрофагов, может идти двумя путями: макрофаги с провоспалительным фенотипом, или М1, активно секретируют еще больше провоспалительных факторов, чтобы побыстрее избавиться от причины, вызвавшей воспаление; когда же угроза устранена, в дело вступают макрофаги с противоспалительным фенотипом, или М2, помогая восстановить целостность неизбежно поврежденных воспалением тканей. На самом деле это одни и те же клетки, которые меняют свой фенотип в зависимости от условий микроокружения, и состояния М1—М2 не дихотомичны, а находятся в широком спектре. Тем не менее, существуют маркеры, позволяющие с определенной долей уверенности отнести микроглиальные клетки к активированным скорее по М1 или М2 пути. В качестве М1 маркера мы выбрали индуцированную синтазу оксида азота (iNos), а для М2 фенотипа — Cd163. Эти белки для оценки данных состояний используются наиболее часто. У старых крыс обеих групп оказалось больше и тех, и других, по сравнению с молодыми, но у контрольной группы преобладали все же клетки с провоспалительным фенотипом. Почему? Потому что инфламэйджинг. А вот у их собратьев, потреблявших хлорид алюминия, соотношение М1 к М2 активированным клеткам микроглии было примерно одинаковым, и это не потому, что у них М2 клеток стало больше, скорее меньше М1 вследствие дезадаптации к внешнему неблагоприятному воздействию в условиях недостатка ресурсов и нарушения функций. Признаков активации микроглии у молодых крыс, потреблявших алюминий, по-прежнему нет.
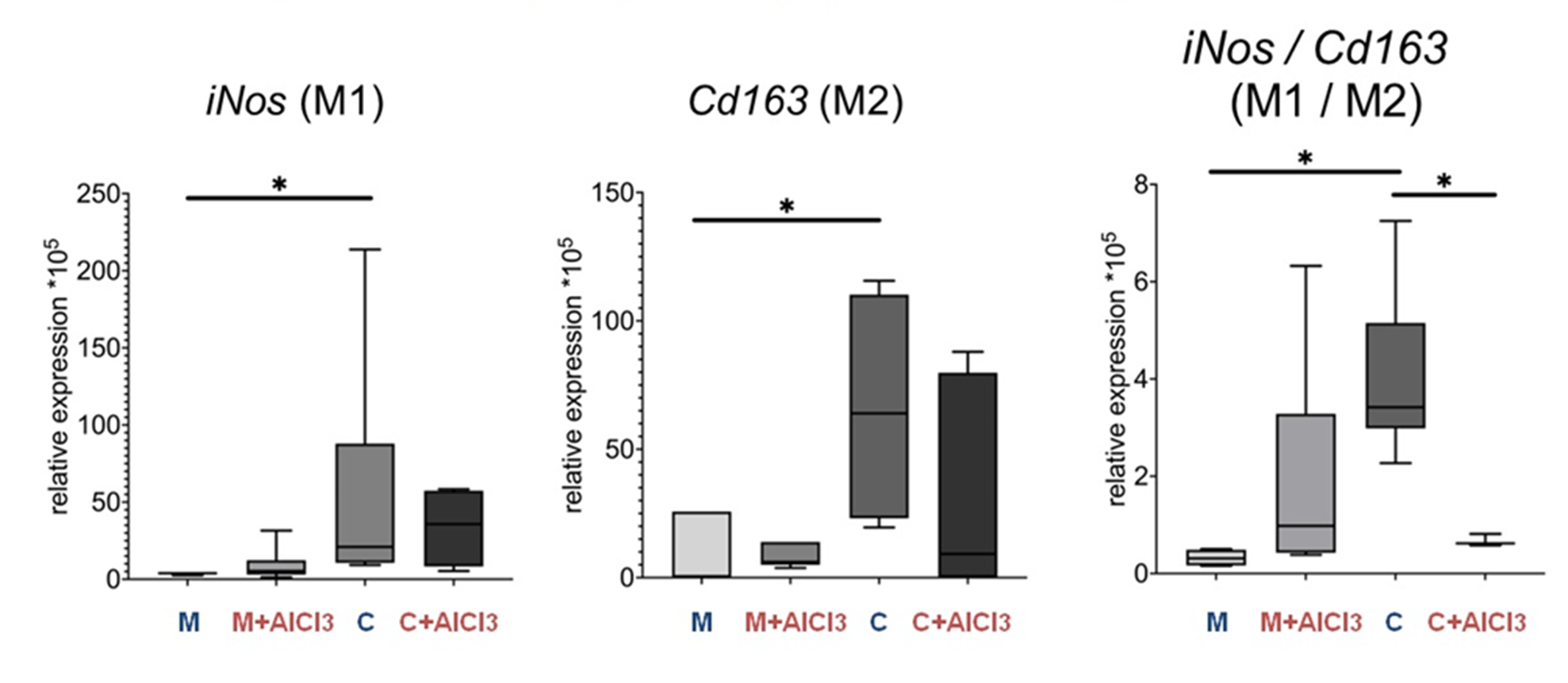
Рисунок 12. Уровни экспрессии мРНК iNos, Cd163 и индекс отношения уровня экспрессии iNos к Cd163 (индекс активации M1/M2 фенотипов микроглии) в префронтальной коре головного мозга у половозрелых и старых крыс Вистар контрольных и опытных групп.
p < 0,05
При моделировании нейродегенерации, чаще связанной с БА, чем с другими патологиями, нельзя обойтись без оценки маркеров, вовлеченных в образование отложений β-амилоида. Как упоминалось ранее, белок-предшественник амилоида (АРР) последовательно разрезается сначала α-секретазой, а после γ-секретазой с образованием растворимых фрагментов. Если же вместо α-секретазы в дело вступает β-секретаза (ВАСЕ1), расщепление происходит на другом уровне, и уже эти фрагменты постепенно слипаются, как снежный ком, в итоге откладываясь в межклеточном веществе мозга амилоидной бляшкой [26].
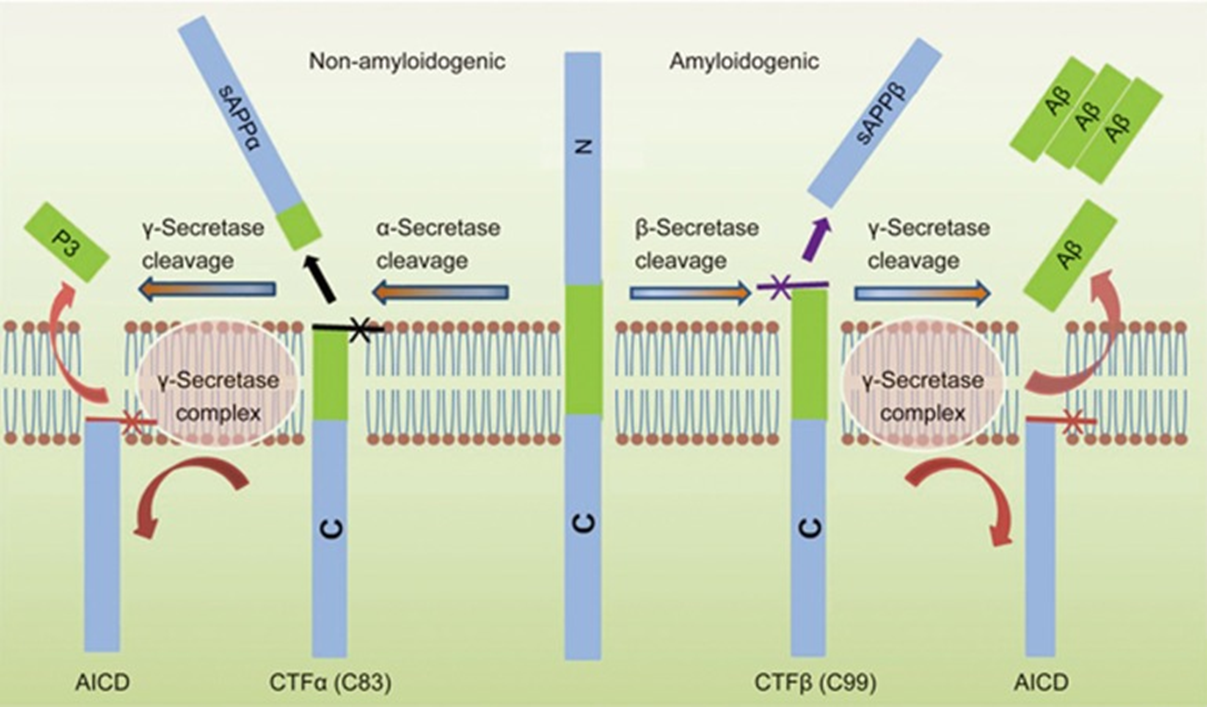
Рисунок 13. Неамилоидогенный и амилоидогенный пути метаболизма АРР.
Разумеется, были попытки создать препарат-ингибитор ВАСЕ1 и решить глобальную мировую проблему одной таблеткой — но почему-то пока не получилось [27]. Оказалось, что секретаза ВАСЕ1 не только вредная и делает плохой амилоид, но и хорошая, и выполняет много разных важных функций: участвует в процессах нейропластичности, везикулярном транспорте при синаптической передаче и долговременной потенциации, что крайне необходимо для процессов обучения и запоминания [28]. АРР, кстати, тоже не просто так. Это интегральный белок, который присутствует во многих клетках организма, а в мозге он играет важную роль также в нейропластичности — формировании новых синаптических контактов и нормальном функционировании уже существующих. При оценке экспрессии данных маркеров оказалось, что уровни экспрессии и АРР, и ВАСЕ1 у старых контрольных крыс такие же, как у молодых. А вот у старых животных, потребляющих хлорид алюминия, значительно снизились оба параметра. Как же так? Возможно, причинами являются увеличение процента нефункционирующих нейронов, тех самых темных и сморщенных на фотографиях в начале, и дисфункция микроглии, которая своевременную очистку синапсов больше не осуществляет.
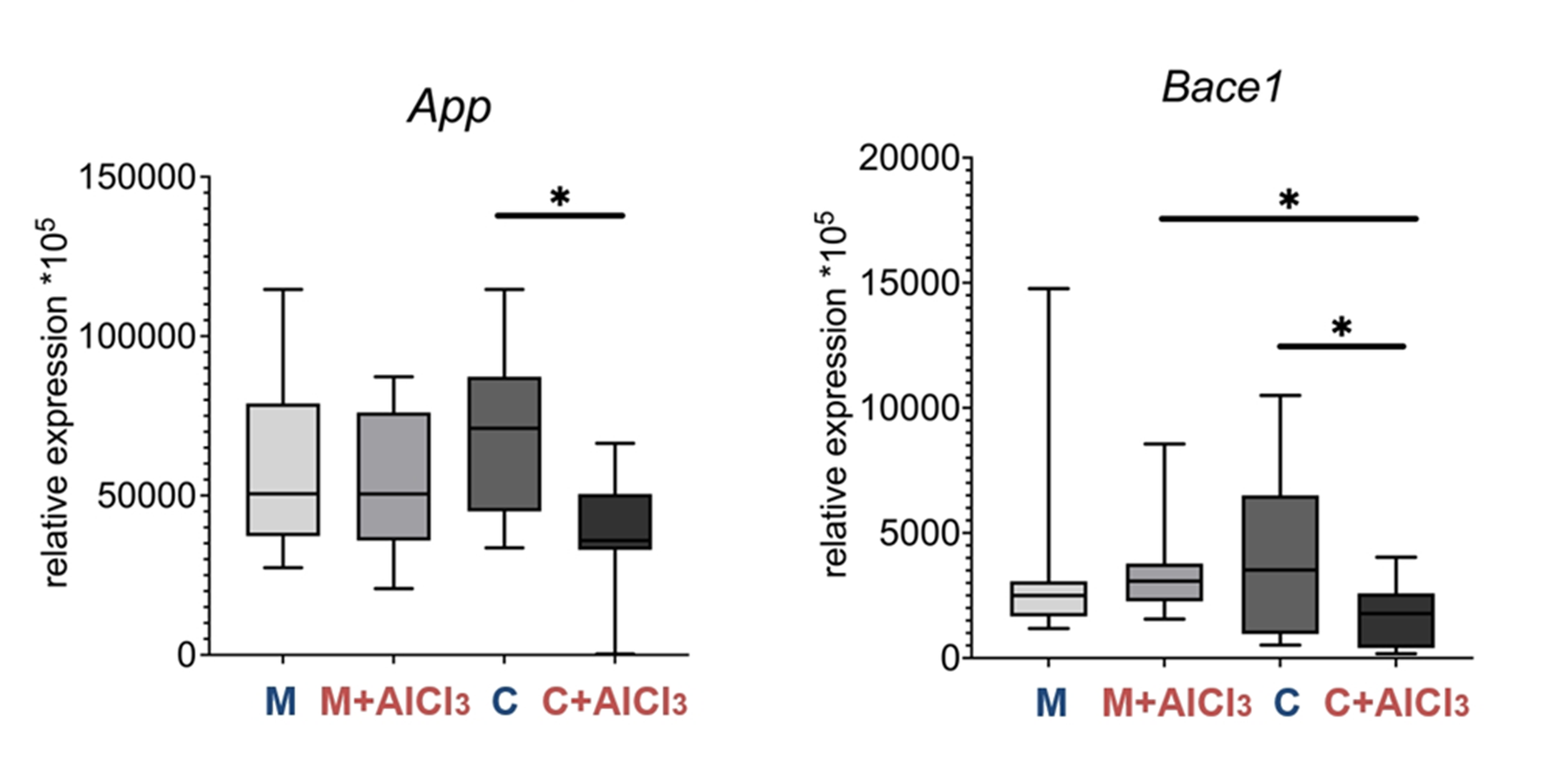
Рисунок 14. Уровни экспрессии мРНК Арр и Васе1 в префронтальной коре головного мозга у половозрелых и старых крыс Вистар контрольной и опытной групп.
p < 0,05
Что же по итогу? Несмотря на то, что само по себе старение — не болезнь, а просто иное физиологическое состояние, морфофункциональных различий у молодых и старых животных немало. При попытке вызвать нейродегенерацию у молодых животных наблюдалось снижение когнитивных функций, а также реакция, похожая на слабые проявления инфламэйджинга. В то же время, у старых животных морфологические признаки нейродегенерации были выражены гораздо заметнее, как и дисфункция клеток микроглии, которая в поддержании нормального функционирования нейронов играет роль очень важную. Поскольку эксперимент проведен в лабораторных условиях на крысах одной линии без каких-либо заболеваний, характерных для людей, и в контролируемых (насколько возможно) условиях, основной фактор, различающийся у этих животных, — возраст.
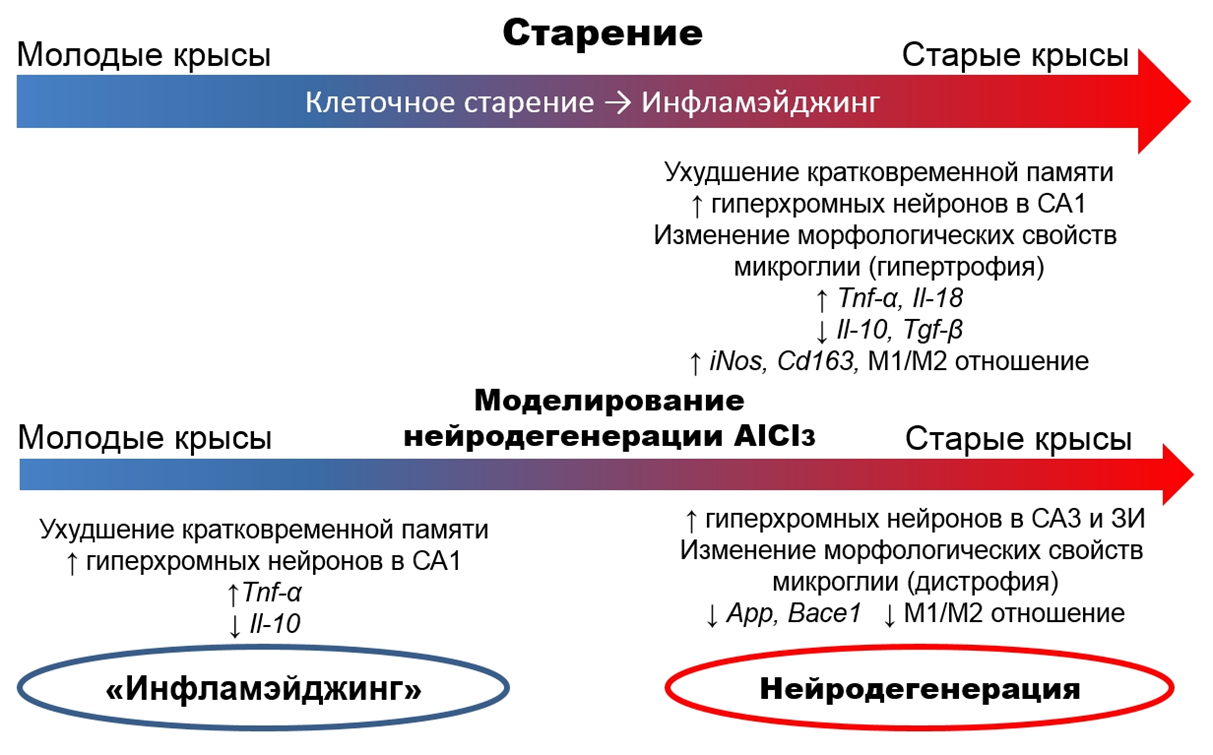
Рисунок 15. Морфофункциональные изменения в головном мозге и периферической крови у половозрелых и старых крыс Вистар при старении и AlCl3-индуцированной нейродегенерации.
ЗИ — зубчатая извилина, M1/M2 — индекс соотношения уровня экспрессии мРНК маркеров активации микроглии по М1 и М2 типу.
Вечное сияние чистого разума: чистого? сияние? вечное?
Отвечают ли полученные нами данные на вопрос, будет ли однажды изобретена условная волшебная таблетка от деменции? Да. Ответ: мы не знаем.
Человек устроен так, что ему всегда хочется всего, сразу — и желательно бесплатно. Или, по крайней мере, чтобы для достижения результата пришлось прикладывать как можно меньше усилий. Потому что так устроен наш мозг. Однако даже для лечения более понятных с точки зрения патогенеза возраст-зависимых заболеваний — атеросклероза, артериальной гипертензии, диабета и других — одной таблетки нет. Есть много разных, воздействующих на разные механизмы, которые нужно подбирать индивидуально и по мере прогрессии болезней приходится менять и хитро комбинировать. И ожидать появления чего-то универсального, эффективного и широкодоступного для лечения столь сложной патологии не приходится. Пока. Наука и медицина продолжат стремительно развиваться, и, возможно, однажды Двухсотлетний человек станет не андроидом из научной фантастики, а средним жителем Земли или какой-то другой планеты, и в свои двести лет будет оставаться в здравом уме и твердой памяти. Но чтобы это однажды стало реальностью, нужно движение в правильном направлении. Можно делать маленькие шаги, топтаться на месте или повернуть не в ту сторону. Но дорогу осилит идущий.
Благодарность: Косыревой Анне Михайловне, д.б.н., заведующей лабораторией нейроморфологии НИИ морфологии человека им. акад. А. П. Авцына ФГБНУ РНЦХ им. акад. Б. В. Петровского, руководительнице этого проекта, за создание благоприятной среды для личного и профессионального роста.
Литература
- Aleksey V. Belikov. (2019). Age-related diseases as vicious cycles. Ageing Research Reviews. 49, 11-26;
- Aubrey D.N.J de Grey. (2007). Life Span Extension Research and Public Debate: Societal Considerations. Studies in Ethics, Law, and Technology. 1;
- Pragya Girotra, Tapan Behl, Aayush Sehgal, Sukhbir Singh, Simona Bungau. (2022). Investigation of the Molecular Role of Brain-Derived Neurotrophic Factor in Alzheimer’s Disease. J Mol Neurosci. 72, 173-186;
- Charles Piller. (2022). Blots on a field?. Science. 377, 358-363;
- Wolfgang J. Streit, Heiko Braak, Kelly Del Tredici, Judith Leyh, Julia Lier, et. al.. (2018). Microglial activation occurs late during preclinical Alzheimer's disease. Glia. 66, 2550-2562;
- Christopher H. van Dyck, Chad J. Swanson, Paul Aisen, Randall J. Bateman, Christopher Chen, et. al.. (2023). Lecanemab in Early Alzheimer’s Disease. N Engl J Med. 388, 9-21;
- Anna Kosyreva, Alexandra Sentyabreva, Ivan Tsvetkov, Olga Makarova. (2022). Alzheimer’s Disease and Inflammaging. Brain Sciences. 12, 1237;
- C. Franceschi, J. Campisi. (2014). Chronic Inflammation (Inflammaging) and Its Potential Contribution to Age-Associated Diseases. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 69, S4-S9;
- Forugh S. Dafsari, Frank Jessen. (2020). Depression—an underrecognized target for prevention of dementia in Alzheimer’s disease. Transl Psychiatry. 10;
- Augusto Bleve, Francesca Motta, Barbara Durante, Chiara Pandolfo, Carlo Selmi, Antonio Sica. (2022). Immunosenescence, Inflammaging, and Frailty: Role of Myeloid Cells in Age-Related Diseases. Clinic Rev Allerg Immunol. 64, 123-144;
- Dennis J Selkoe, John Hardy. (2016). The amyloid hypothesis of Alzheimer's disease at 25 years. EMBO Mol Med. 8, 595-608;
- . (2022). 2022 Alzheimer's disease facts and figures. Alzheimer's & Dementia. 18, 700-789;
- Sulagna Dutta, Pallav Sengupta. (2016). Men and mice: Relating their ages. Life Sciences. 152, 244-248;
- Heiko Braak, Kelly Del Tredici. (2011). The pathological process underlying Alzheimer’s disease in individuals under thirty. Acta Neuropathol. 121, 171-181;
- Natalia Stefanova, Oyuna Kozhevnikova, Anton Vitovtov, Kseniya Maksimova, Sergey Logvinov, et. al.. (2014). Senescence-accelerated OXYS rats: A model of age-related cognitive decline with relevance to abnormalities in Alzheimer disease. Cell Cycle. 13, 898-909;
- Трансляционная психиатрия — как моделировать психические расстройства на животных?;
- Maria Teresa Colomina, Fiona Peris-Sampedro. (2017). Aluminum and Alzheimer’s Disease. Advances in Neurobiology. 183-197;
- Calvin C. Willhite, Nataliya A. Karyakina, Robert A. Yokel, Nagarajkumar Yenugadhati, Thomas M. Wisniewski, et. al.. (2014). Systematic review of potential health risks posed by pharmaceutical, occupational and consumer exposures to metallic and nanoscale aluminum, aluminum oxides, aluminum hydroxide and its soluble salts. Critical Reviews in Toxicology. 44, 1-80;
- Dymkowska D. (2016). Oxidative damage of the vascular endothelium in type 2 diabetes — the role of mitochondria and NAD(P)H oxidase. Postepy biochemii. 62, 116–126;
- Francisco José Sánchez-Muniz, Adrián Macho-González, Alba Garcimartín, Jorge Arturo Santos-López, Juana Benedí, et. al.. (2019). The Nutritional Components of Beer and Its Relationship with Neurodegeneration and Alzheimer’s Disease. Nutrients. 11, 1558;
- Zeba Firdaus, Devendra Kumar, Sushil Kumar Singh, Tryambak Deo Singh. (2022). Centella asiatica Alleviates AlCl3-induced Cognitive Impairment, Oxidative Stress, and Neurodegeneration by Modulating Cholinergic Activity and Oxidative Burden in Rat Brain. Biol Trace Elem Res. 200, 5115-5126;
- Alexandra Vladislavovna Sentyabreva, Ekaterina Alexandrovna Miroshnichenko, Ekaterina Andreevna Melnikova, Ivan Sergeevich Tsvetkov, Anna Mikhailovna Kosyreva. (2023). Morphofunctional Changes in Brain and Peripheral Blood in Adult and Aged Wistar Rats with AlCl3-Induced Neurodegeneration. Biomedicines. 11, 2336;
- Daniele Lana, Filippo Ugolini, Maria G. Giovannini. (2020). An Overview on the Differential Interplay Among Neurons–Astrocytes–Microglia in CA1 and CA3 Hippocampus in Hypoxia/Ischemia. Front. Cell. Neurosci.. 14;
- Eliud Enrique Villarreal-Silva, Alejandro Rafael González-Navarro, Rodolfo Amador Salazar-Ybarra, Oscar Quiroga-García, Miguel Angel de Jesús Cruz-Elizondo, et. al.. (2022). Aged rats learn Morris Water maze using non-spatial search strategies evidenced by a parameter-based algorithm. Translational Neuroscience. 13, 134-144;
- Joana Gil-Mohapel, Patricia S. Brocardo, Will Choquette, Russ Gothard, Jessica M. Simpson, Brian R. Christie. (2013). Hippocampal Neurogenesis Levels Predict WATERMAZE Search Strategies in the Aging Brain. PLoS ONE. 8, e75125;
- Guo-fang Chen, Ting-hai Xu, Yan Yan, Yu-ren Zhou, Yi Jiang, et. al.. (2017). Amyloid beta: structure, biology and structure-based therapeutic development. Acta Pharmacol Sin. 38, 1205-1235;
- R. Vassar. (2019). IMPLICATIONS FOR BACE1 INHIBITOR CLINICAL TRIALS: ADULT CONDITIONAL BACE1 KNOCKOUT MICE EXHIBIT AXONAL ORGANIZATION DEFECTS IN THE HIPPOCAMPUS. J Prev Alz Dis. 1-7;
- Brati Das, Neeraj Singh, Annie Y. Yao, John Zhou, Wanxia He, et. al.. (2021). BACE1 controls synaptic function through modulating release of synaptic vesicles. Mol Psychiatry. 26, 6394-6410.







