
Трансляционная психиатрия — как моделировать психические расстройства на животных?
21 октября 2021
Трансляционная психиатрия — как моделировать психические расстройства на животных?
- 1687
- 0
- 6
Рисунок в полном размере.
иллюстрация Софии Смоленской
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Трансляционная психиатрия — раздел нейробиологии, изучающий механизмы психических заболеваний и подходы к их лечению с использованием моделей на животных. Как смоделировать шизофрению на крысах? Как понять, что эмоциональное состояние мыши отражает клиническую картину депрессии? Как рыбки и черви помогают изучать наркотические зависимости и разрабатывать новые противотревожные препараты? Эти и другие детали трансляционных исследований подробно описаны в статье.

Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое трансляционные исследования?
Трансляционными исследованиями называют использование других видов животных для изучения болезней и расстройств человека, однако не все эксперименты на животных являются трансляционными исследованиями. Другая большая группа — фундаментальные исследования — также использует животных, но изучает базовые биологические закономерности, а не механизмы патогенеза заболеваний. Но часто модели патологий оказываются полезными для фундаментальных исследований, а фундаментальные исследования обнаруживают потенциальные пути лечения заболеваний, так что разделить эти две группы иногда сложно.
Трансляция (т.е. перенос информации с одного объекта на другой) идет в две стороны:
- From bedside to bench (от кровати больного к лабораторному столу) — воспроизведение симптомов болезни на модельных животных;
- From bench to bedside (от лабораторного стола к кровати больного) — испытания новых лекарственных препаратов на модельных животных, а затем на людях.
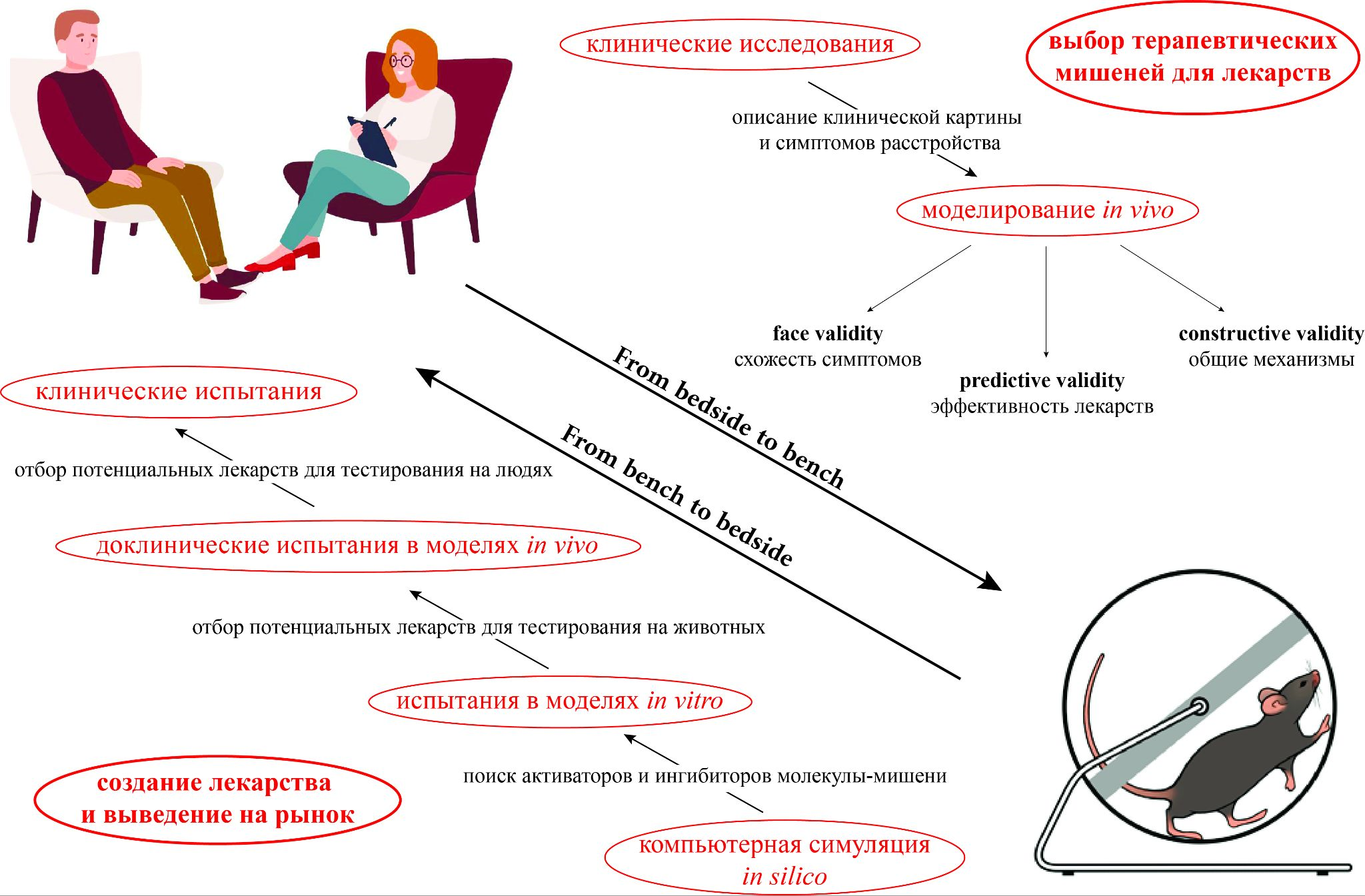
Рисунок 1. Общая схема трансляционного биомедицинского исследования.
иллюстрация автора
Рассмотрим основные этапы обеих сторон трансляционных исследований (см. схему).
From bedside to bench
Перед тем, как начинать бороться с любым заболеванием, надо собрать о нем максимум информации и как можно подробнее описать его клиническую картину. Поэтому первый этап трансляционной биомедицины — это клинические исследования. Врачи и ученые в деталях описывают психиатрические и неврологические симптомы, отклонение показателей биохимических маркеров в крови, анатомические изменения органов и тканей, то есть все возможные признаки заболевания.
После того, как мы достаточно детально понимаем, что из себя представляет изучаемое расстройство (в психиатрии стараются использовать этот термин вместо более стигматизирующего слова «заболевание»), можно начать воспроизводить его клиническую картину на модельных животных. Таким образом, второй этап трансляции — from bedside to bench — это моделирование in vivo. На этом этапе путем различных манипуляций с модельными животными (об этом ниже) ученые стараются максимально близко воспроизвести клиническую картину болезни или расстройства. Если получилось успешно транслировать нарушение с человека на животное, модель можно использовать для более глубокого понимания механизмов болезни, а затем и для разработки и тестирования новых лекарственных препаратов. Ведь те молекулярные механизмы, поломка которых приводит к развитию болезни, и есть потенциальные мишени для лекарств: чтобы «починить» организм, надо сначала понять, где именно он «сломался». В большинстве случаев терапевтические мишени — это разнообразные рецепторы, ионные каналы и транспортеры на поверхности или внутри клеток, реже ферменты, факторы транскрипции и другие регуляторные белки.
From bench to bedside
Что ж, теперь мы докопались до механизмов (разумеется, не всех, а лишь некоторых), лежащих в основе заболевания, и можем начинать трансляцию в обратную сторону, то есть пытаться создать лекарство, действующее на найденные молекулы-мишени. Большинство болезней (кроме редких моногенных) вызывается (или сопровождается — проблема курицы и яйца) довольно широким спектром молекулярных нарушений. Часто они сгруппированы вокруг определенной функциональной системы или анатомической структуры: эпилепсия связана с нарушением баланса возбуждения (глутамат) и торможения (гамма-аминомасляная кислота) в мозге; депрессия, шизофрения, СДВГ — со снижением или усилением активности моноаминовых структур. Для многих психических расстройств (шизофрения, обсессивно-компульсивное — ОКР, биполярное расстройство и расстройства аутистического спектра — РАС) наше понимание нейрофизиологических механизмов пока достаточно поверхностное, что мешает разработке новых более эффективных препаратов.
Представим: мы выбрали какую-то молекулярную мишень и начинаем поиски путей химического воздействия на нее. Первый этап трансляции — from bench to bedside — компьютерная симуляция in silico («в кремнии»). Специальные компьютерные программы перебирают миллионы возможных химических соединений и выбирают из них те, которые потенциально могут связаться с молекулой-мишенью, активировать, подавить или как-то изменить ее работу. Далее перспективные кандидаты, отобранные компьютерным моделированием, синтезируются химическим путем (или выделяются, если оказалось, что естественные молекулы справляются лучше) для начала испытаний на биологических моделях [1]. Следующий этап на пути к работающему лекарству — испытания в моделях in vitro, то есть на клеточных культурах и срезах тканей. В трансляционной психиатрии и неврологии это культуры нейронов и различных глиальных клеток или переживающие (то есть сохраняющие физиологическую активность) срезы разных структур головного мозга. Например, методами электрофизиологической регистрации можно оценивать влияние препаратов на ионные токи через каналы и рецепторы, биохимическими методами — активацию различных внутриклеточных сигнальных путей [2].
Если на клетках и переживающих срезах кандидатный препарат показал хорошие результаты, он переходит на третий этап — доклинические испытания в моделях in vivo. На экспериментальных животных моделируют исследуемое расстройство (это мы научились делать еще на стадии трансляции from bedside to bench), а затем пытаются вылечить испытываемым препаратом. Стоит уточнить, что не все эксперименты с лечением модельных животных являются доклиническими испытаниями. На самом деле, это строго регламентированный и тщательно документируемый процесс (вот, например, регламент FDA), который начинают только после того, как кандидатный препарат показывает свою эффективность в предварительных экспериментах. В доклинических испытаниях модельным животным вводят испытываемый препарат и оценивают его терапевтический эффект в зависимости от дозы и способа введения (перорально, внутрибрюшинно, внутривенно, внутримышечно, подкожно) [3].
Наконец, если доклинические испытания показали одновременно эффективность и безопасность потенциального лекарства, можно начинать клинические испытания на людях. Они состоят из нескольких фаз: 1 фазы (здоровые добровольцы — оценка безопасности), 2 фазы (небольшая группа пациентов), 3 фаза (большая группа пациентов — оценка эффективности), 4 фазы (сбор информации о побочных эффектах после выхода препарата на рынок) [4], [5].
Изучением механизмов психических расстройств на животных и испытанием психиатрических препаратов занимается трансляционная психиатрия. Именно о моделировании психических нарушений пойдет речь ниже.
Как доказать, что мы моделируем именно исследуемое расстройство?
Перед тем как переходить к подробному рассказу о методах моделирования, стоит ответить на важный вопрос — как понять, что состояние животного соответствует клинической картине человеческой патологии? Все же человек и модельные животные разделены десятками, а то и сотнями миллионов лет независимой эволюции, поэтому любая модель будет лишь приблизительно воспроизводить симптомы болезни. Для относительно объективной оценки валидности (т.е. правдоподобности) модели психического расстройства Поль Уилнер в 1984 году предложил три критерия, которые известны теперь как «критерии Уилнера» [6], [7]:
Face validity. В первом приближении состояние модельного животного должно воспроизводить клиническую картину расстройства, наблюдаемую у пациентов. В случае моделирования психических расстройств речь идет о внешних психологических симптомах. Модели тревожных расстройств должны сопровождаться усилением тревожного поведения; депрессии — подобием депрессивного поведения; модели СДВГ и маниакальной фазы биполярного расстройства — возбужденным поведением и двигательной гиперактивностью; модели ОКР — повторяющимися ритуалами; модели шизофрении и РАС — снижением коммуникации. Ниже мы ответим на вопрос, а как же мы можем понять, что те или иные поведенческие паттерны животного соответствуют человеческим симптомам.
Но внешнего сходства с клинической картиной нам недостаточно — чтобы лечить болезнь на животной модели, гораздо важнее воспроизвести известный нам патогенез болезни. И первое, что мы тут можем сделать, это проверить, работают ли в модели те лекарства, которые в той или иной степени помогают пациентам. Поэтому второй критерий трансляционной модели — predictive validity. Если мы считаем, что патогенез модели соответствует патогенезу моделируемого расстройства, то имеющиеся в нашем арсенале лекарства (пусть с низкой эффективностью или тяжелыми побочными эффектами) должны работать и в модели. Так, анксиолитики должны работать в моделях тревожных расстройств [8], антидепрессанты — в моделях депрессии и ОКР [9], а нейролептики — в моделях шизофрении [10]. Однако для лечения РАС не существует специфических препаратов, поэтому данный критерий не работает для валидизации их моделей.
Наконец, кроме действия препаратов, схожие механизмы патогенеза расстройства и его модели должны отражаться также на различных физиологических, морфологических и биохимических показателях пациента и модельного животного. Этот критерий называется constructive validity, т.е. воспроизведение известной нам молекулярно-клеточной природы патологии. Модели депрессии должны сопровождаться повышением содержания в крови глюкокортикоидов, а многие другие модели — факторов воспаления, в первую очередь интерлейкинов-1 и 6, фактора некроза опухолей (TNFα), С-реактивного белка [11]. Если мы знаем мутации, которые связаны с развитием заболевания, то такие мутации у животных (вызванные экспериментально) должны приводить к соответствующим симптомам. Нейрохимические и морфологические изменения в мозге также должны соответствовать клинической картине. Моделирование депрессии должно сопровождаться снижением моноаминовой синаптической передачи и нарушенным торможением системы «гипоталамус — аденогипофиз — кора надпочечников»; моделирование шизофрении — гиперактивацией глутаматных и дофаминовых нейрональных сетей. Кроме того, должны воспроизводиться причинно-следственные связи с известными факторами риска. Очевидно, тревожные и депрессивные расстройства должны вызываться действием стресса, а многие расстройства нейроразвития (neurodevelopmental disorders), такие как РАС и шизофрения — стрессом, интоксикацией или инфекциями во время беременности.
На каких животных изучают психические расстройства?
На первый взгляд, далеко не праздный вопрос — как среди всего биологического разнообразия животных выбрать подходящих для трансляционных исследований? На самом деле, выбор модельных организмов не слишком велик: большая их часть относится к грызунам.

Рисунок 2. Домовая мышь (Mus musculus).
сайт Jackson Labs
Домовая мышь (Mus musculus) — главный объект трансляционной биомедицины. Согласно годовым отчетам профильных министерств за 2019 год, мыши использовались в 68% исследований в Германии и 61% исследований — в Великобритании.
Главные преимущества мышей перед другими лабораторными животными, включая крыс — это низкая цена (меньше размер и быстрее размножение) и возможность генетической модификации (об этом ниже).

Рисунок 3. Серая крыса (Rattus norvegicus).
сайт Janvier Labs
Серая крыса (Rattus norvegicus) долгое время делила с домовой мышью звание главного модельного животного, пока появление генно-инженерных методов не позволило мышам вырваться далеко вперед [12]. Основное преимущество крыс перед мышами — гораздо более высокие интеллектуальные способности, что особенно важно в нейробиологии. Другое удобство крыс — больший размер, что, конечно, делает их дороже, зато значительно упрощает многие экспериментальные манипуляции. Например, перинатальные гипоксически-ишемические поражения (нарушения кровоснабжения мозга в результате перевязки мозговых артерий) смоделировать на новорожденных крысятах при должной сноровке вполне по силам, но вот на крошечных мышатах — нереально. А такие модели невероятно важны для разработки методов лечения церебрального паралича и других гипоксических энцефалопатий [13].

Рисунок 4. Прерийная полевка (Microtus ochrogaster).
Полевки (род Microtus) ворвались в нейробиологию начале 1990-х годов, когда друг за другом в самых престижных научных журналах вышли две статьи лаборатории Томаса Инсела. В них была показана ключевая роль сначала окситоцина [14], а затем и вазопрессина [15] в образовании родительских пар у моногамных (прерийная и сосновая) и полигамных (горная и луговая) видов полевок. Далее последовало множество работ, посвященных социальному, родительскому и половому поведению полевок и его нейрогуморальным механизмам [16]. Добрались до полевок и исследователи депрессии — вот свежая работа, посвященная нейроиммуным изменениям в мозге прерийных полевок при потере постоянного партнера [17].
Другие виды грызунов почти не используются в трансляционной нейробиологии.
Морские свинки упоминались в большом сравнительном анализе вомероназального органа у млекопитающих, но в основном встречаются в трансляционной кардиологии и дерматологии [18]. Джунгарские хомячки благодаря своей сезонной активности являются хорошей моделью для изучения роли эпифиза и супрахиазматического ядра гипоталамуса в регуляции суточных и сезонных ритмов [19].

Рисунок 5. Зебрафиш (Danio rerio).
сайт BrainFacts
Зебрафиш (Danio rerio) — маленькая аквариумная рыбка, стремительно набирающая популярность в нейробиологических исследованиях [20]. Конечно, мозг и поведение рыб устроены несопоставимо проще, чем у человека, приматов и грызунов, однако дешевизна и простота в работе делают данио-рерио незаменимым объектом для первичного скрининга потенциальных лекарств. На сегодняшний день для этих рыбок разработаны модели депрессии и тревожности, РАС и СДВГ [21–24].

Рисунок 6. Плодовая мушка (Drosophila melanogaster).
сайт Benchfly
Насекомые тоже используются в трансляционных исследованиях. Плодовая мушка, или Дрозофила фруктовая (Drosophila melanogaster) — главное действующее лицо генетики со времен автора хромосомной теории Томаса Моргана. В нейробиологии они тоже используются в основном для изучения молекулярно-генетических механизмов поведения и психических расстройств. У дрозофил можно оценить тревожное поведение по стремлению держаться вблизи стенки ящика. Также у них можно четко отличить агрессивное поведение, что позволяет, например, изучать роль серотонина путем фармакологических и генетических манипуляций [25].

Рисунок 7. Медоносная пчела (Apis mellifera).
сайт Grainews
Медоносная пчела (Apis mellifera) активно используется в исследованиях механизмов принятия решений и мотивационного поведения, связанного с наградой или наказанием. В этих процессах у них также важную роль играют биогенные амины, родственники серотонина и дофамина [26], [27].
Рисунок 8. Нематода (Caenorhabditis elegans).
Нематода (Caenorhabditis elegans) — свободноживущий круглый червь длиной около 1 мм. Любимый объект эмбриологов: он всегда состоит из 959 клеток, в том числе из 302 нейронов. Несмотря на предельную простоту организации нервной системы, C. elegans использует такие же электрические импульсы и те же нейромедиаторы, что позволяет легко изучать молекулярные механизмы его поведения, в том числе с помощью генетических манипуляций. Различные формы поведения делают C. elegans удобной моделью для исследований алкогольной, никотиновой и наркотических зависимостей, обучения и памяти, сна и пищевого поведения [28].

Рисунок 9. Макак-резус (Macaca mulatta).
Приматы, разумеется, эволюционно наиболее близки человеку, поэтому строение и работа их мозга максимально похоже на человека [29]. При этом исследования на них чрезвычайно дороги — обезьяны медленно размножаются, питаются фруктами, требуют больших специально оборудованных помещений для жизни, ветеринарное сопровождение и беспощадное множество бюрократических процедур. Поэтому приматов используют или для изучения высших психических функций в фундаментальных исследованиях, или для финального тестирования лекарств перед клиническими испытаниями на людях. Самый распространенный вид приматов в нейрофизиологических исследованиях — макаки-резусы (Macaca mulatta). Также используются другие нечеловекообразные обезьяны — зеленые мартышки (Chlorocebus sabaeus), мармозетки (Callithrix jacchus), беличьи саймири (Saimiri sciureus). На них исследуют наркотическое действие опиоидов [30], механизмы депрессии [31] и шизофрении [32], нарушения социального поведения [33] — и даже симптомы сезонного аффективного расстройства [34]. И лишь в самых сложных психофизиологических экспериментах используют шимпанзе и орангутанов, но это в основном фундаментальные исследования, а не разработка лекарственных препаратов. Зоозащитные организации по всему миру требуют прекращения опытов на приматах; ученые стараются к ним прислушиваться и снижают их использования в исследованиях до критически необходимого уровня.
В следующих разделах речь пойдет только об исследованиях на грызунах — мышах и крысах (и немного полевках) [35].
Что делать с животными, чтобы воспроизвести у них симптомы расстройства?
Все модели психических расстройств можно классифицировать по типу воздействия, которое мы оказываем на животное для воспроизведения симптомов. Модели удобно объединить в три группы — физические, химические и генетические.
1. Физические модели
Физические модели — это в основном стрессорные модели тревожно-депрессивных расстройств. Результаты недавнего исследования позволяют предположить, что модели острого физического стресса лучше подходят для моделирования тревожных расстройств и ПТСР, а более мягкие модели психологического стресса — для моделирования депрессии [36].

Рисунок 10. Водно-иммерсионный стресс / Тест вынужденного плавания Порсолта.
Модели острого стресса
В качестве фактора острого стресса используется хищник (например, питон съедает одну крысу на глазах у сородичей), обездвиживание в цилиндрическом пенале или помещение в воду без возможности выбраться.
Модели хронического стресса
В клинической практике ключевыми факторами развития депрессии являются повседневный стресс (работа, семья, общество) и ощущение одиночества (несчастная любовь, отсутствие друзей, неуважение коллег). Эти факторы воспроизводятся в двух наиболее распространенных моделях депрессии — хроническом непредсказуемом мягком стрессе и социальной изоляции. Хронический непредсказуемый мягкий стресс вызывается постоянно меняющимися травмирующими событиями: громкая музыка, яркий свет или обращенный световой день, лишение воды или пищи, перемешивание животных из разных клеток, мокрая подстилка и тому подобное. Животное, привыкшее к однообразному распорядку дня, от такой непредсказуемой жизни впадает в депрессию [37]. Социальная изоляция достигается помещением животного в одиночную клетку на несколько недель, что для социальных мышей и крыс является сильным стрессом. Во время пандемии коронавируса 2020–2021 годов человечество по полной программе ощутило на себе силу социальной изоляции, что ожидаемо привело к росту частоты депрессии [38].

Рисунок 11. Модель социального поражения.
сайт Tufts University
Третья модель, применимая, правда, только на самцах — социальное поражение. Животное ежедневно помещается в клетку с более крупным и агрессивным сородичем, который раз за разом одерживает победу в драке. Отчаяние от невозможности одолеть соперника или избежать конфликта тоже приводит поверженного в депрессивноподобное состояние [39].
Кроме стрессорных моделей тревожности и депрессии, грызуны используются для исследования механизмов суточных ритмов, сна и его нарушений. Для этого можно использовать депривацию сна или изменение светового дня.
2. Химические модели
Химические модели используют различные вещества для провоцирования симптомов моделируемого расстройства.
Фармакологические модели
Это основная масса химических моделей. На сегодняшний день человечество очень далеко продвинулось в понимании молекулярных механизмов огромного количества психических расстройств. А если мы знаем, что ломается при развитии данного расстройства, мы можем направлено сломать его у модельного животного и воспроизвести у него патологию. К примеру, мы много знаем о том, какую роль в патогенезе шизофрении, СДВГ и маниакальной фазы биполярного расстройства играет дофаминовая система мозга. Поэтому, активировав ее амфетамином, мы получаем гипервозбудимое животное с симптомами этих расстройств [40]. Наиболее распространенная модель РАС — введение беременной самке вальпроевой кислоты (распространенного противоэпилептического препарата) — была получена обратным путем: в ходе токсикологических исследований препарата обнаружились побочные эффекты у потомства, которые и были обращены в специфичную модель [41]. Впоследствии выяснилось, что один из эффектов вальпроата на мозг плода — нарушение созревания серотониновой системы, что является одним из факторов патогенеза РАС. На основании этого открытия были получены другие модели РАС с повышением пренатального уровня серотонина [42].
Понимание ведущей роли моноаминовой системы в патогенезе не только депрессии, но и ОКР, позволило разработать химические модели ОКР с использованием агониста 5-HT1A серотониновых рецепторов 8-OHDPAT и агониста D2/D3 дофаминовых рецепторов квинпирола [43].
Наркотические модели

Рисунок 12. Экспериментальная установка для самостоятельного введения наркотического препарата.
сайт InstechLabs
Очевидно, что химические зависимости можно изучать только путем введения соответствующих веществ модельным животным. Таким образом ученые изучают механизмы формирования наркотической, никотиновой и алкогольной зависимостей и ищут новые методики их фармакологической терапии [44–46]. Самый распространенный метод — самостоятельное введение изучаемого препарата при нажатии на рычаг. Так у животного формируется мотивация и оно запоминает, что надо сделать, чтобы стало хорошо [47]. И крыса будет жать на рычаг ради новой «дозы», пока не умрет от голода и жажды.
Иммунные модели
О важнейшей роли процессов нейровоспаления все больше говорят в контексте самых разных психических расстройств. В патогенезе шизофрении (а вероятно, и других расстройств нейроразвития) важную роль играют воспалительные процессы во время внутриутробного развития. Поэтому материнская иммунная активация (введение беременной самке интерферона или бактериального липополисахарида) широко используется как наиболее распространенная модель шизофрении не только на грызунах, но и на макаках-резусах [48], [49].
3. Генетические модели
Генетические модели — генетическое изменение модельных животных, приводящее к врожденным симптомам расстройства, увеличению или снижению предрасположенности развития симптомов при действии известных факторов риска.
Селекция
Задолго до появления методов генной инженерии люди научились путем длительного отбора выводить породы и линии животных с самыми разнообразными характеристиками, в том числе связанными с поведением. Классические крысы Крушинского—Молодкиной со склонностью к судорогам под действием громкого звука сыграли огромную роль в понимании механизмов эпилепсии [50]. Много ценных российских работ про механизмы депрессии и тревоги сделаны на линиях крыс с активной (реакция fight-or-flight, она же «бей—беги») и пассивной (реакция затаивания) стратегией адаптации к стрессовой ситуации [51].
Мутантные мыши
Первые успехи генной инженерии позволили избирательно «ломать» определенные гены, которые, по нашим представлениям, играют важную роль в патогенезе того или иного расстройства. Это вообще любимый метод ученых — чтобы понять функцию какого-то белка в организме, надежнее всего выключить его синтез и посмотреть, что будет. Такие животные называются «нокаутами по соответствующему гену». Так, нокауты по различным белкам дофаминовой системы служат моделями шизофрении [52] и СДВГ [53], а нокауты по окситоцину — моделями РАС [54], причем в 2019 году появились первые нокаутные по окситоцину полевки [55]. Подавляющее большинство мутантных моделей сделано на мышах — генетически модифицировать крыс по-прежнему сложно и дорого. Но некоторые трансгенные линии крыс все же используются для изучения стресса [56] и ряда нейродегенеративных заболеваний [57–59].
Однако каждый ген выполняет огромное количество функций, да еще и различающихся в разных клетках и тканях. Поэтому, если выключить эти гены во всем организме, эффектов будет слишком много, в том числе летальных. К примеру, нейротрофический фактор BDNF необходим для функционирования всех нейрональных структур, в том числе спинного мозга и периферических нервов, поэтому тотальный нокаут по BDNF летален. Можно либо выключить только одну копию гена (роль нейротрофического фактора BDNF в депрессии часто изучают на гетерозиготах), либо локализовать мутацию в пространстве и времени [60]. Так, можно выключить экспрессию гена только в головном мозге или только при в интересующем нас возрасте (экспрессия подавляется при добавлении в пищу тамоксифена) [61], [62].
Как оценить психические нарушения и их коррекцию тестируемым лекарством?
Теперь, когда мы познакомились со столь широким спектром трансляционных моделей различных психических расстройств, посмотрим на них через призму критериев Уилнера, чтобы убедиться, что они действительно отражают заявленные патологии. По каким параметрам это можно оценить? В моделях психических расстройств на первый план, конечно, выходят нарушения поведения — их оценивают в специальных поведенческих тестах. Тесты подтверждаются критерием predictive validity, т.е. действием известных препаратов.
Модели тревожных расстройств

Рисунок 13. Приподнятый крестообразный лабиринт.
сайт AnimaLab
Мыши и крысы — норные животные, избегающие открытых пространств. Поэтому в приподнятом крестообразном лабиринте мотивация страха будет заставлять их сидеть в темном рукаве, а мотивация любопытства — выходить в открытый. Соотношение времени в открытых и закрытых рукавах увеличивается под действием анксиолитиков, позволяет использовать его как меру оценки уровня тревожности животного [63].
Модели депрессии
Рисунок 14. Тест подвешивания за хвост.
сайт Bioseb
Не все клинические проявления депрессии можно перенести с человека на лабораторных животных, но некоторые удается. Ангедонию (снижение мотивации получать удовольствие) можно оценить в сахарозном тесте. Из двух бутылок с обычной и сладкой водой здоровая крыса предпочитает вкусненькую, а депрессивная пьет из обеих поровну, потому что ей без разницы: «Мир тлен. Жизнь боль. Какой смысл пить сладкую воду, если я все равно умру?». Другой важный симптом депрессии — отчаяние и снижение веры в свои силы — воспроизводится в тестах вынужденного плавания и подвешивания за хвост. В них отчаявшиеся животные перестают карабкаться по стенке сосуда с водой или подтягиваться на хвосте в попытках выбраться. Тесты активно используются для оценки эффективности антидепрессантов [64].
Модели синдрома дефицита внимания и гиперактивности

Рисунок 15. Открытое поле.
Оценить гиперактивность задача элементарная — запускаем животное в ограниченное пространство (классический тест «открытое поле») и измеряем, сколько оно пробежит за 5 минут [65]. Оценить внимание сложнее — крысе нужно фокусироваться на выполнении задачи и не отвлекаться на посторонние стимулы. Это можно организовать в задачах на инструментальное обучение (нажать на рычаг при определенной последовательности сигналов, отвлекся — нажал неправильно). При моделировании СДВГ важно также оценить импульсивность, то есть склонность совершать поступки по первому эмоциональному импульсу, не дождавшись рассудочного решения. В похожих парадигмах инструментального обучения можно дать крысе выбор — получить менее ценную награду сейчас или более ценную потом, прямо как делали в известном эксперименте с детьми и зефирками. Поведенческие симптомы валидизируют клиническую картину модели (face validity), а эффекты известных из клиники мутаций — constructive validity [53]. Фармакологические препараты, работающие в помогающие пациентам с СДВГ, также снижают соответствующие симптомы в животных моделях (predictive validity).
Модели обсессивно-компульсивного расстройства

Рисунок 16. Тест закапывания шаров.
Основной симптом ОКР — повторяющиеся действия, призванные снизить тревогу (мытье рук, проверка выключенных приборов). Напрямую перенести их на животных нельзя, но интенсивные повторяющиеся действия можно расценивать как аналоги компульсивных ритуалов у людей. Классический метод — тест закапывания шаров (marble burying test), в котором здоровые грызуны закапывают часть шаров и успокаиваются, а животные в модели ОКР не могут остановиться, пока не закопают все до последнего [67], [68].
Модели расстройств аутистического спектра

Рисунок 17. Тест социального предпочтения.
В многогранной клинической картине РАС наиболее ярко выделяются два симптома — избегание социальных контактов (тактильных и вербальных) и следование повторяющимся ритуалам [69]. Ритуальные действия оцениваются в том же тесте закапывания шаров, что и в моделях РАС. Для оценки коммуникативного поведения есть ряд социальных тестов. Простейший вариант — просто посадить двух незнакомых животных в клетку и оценивать коммуникацию, агрессию и другие формы взаимодействия [70], [71]. Более интересный вариант — тест социального предпочтения (social approach), в котором здоровое животное предпочитает знакомиться с новым сородичем, а животное в модели РАС с большей охотой изучает новый предмет [72]. Увы, у нас до сих пор нет ни специфических препаратов, ни четкого понимания молекулярных механизмов РАС, поэтому моделировать приходится «наощупь», то есть по схожести симптомов (face validity) [54].
Модели шизофрении

Рисунок 18. Радиальный 8-лучевой лабиринт.
сайт O'HARA & CO
Шизофрения представляет собой крайне сложное расстройство с широким спектром разнообразных симптомов, из которых у конкретного пациента может проявляться лишь какая-то часть. Эти симптомы объединяют в три группы: позитивные (галлюцинации и бред), негативные (социальное избегание) и когнитивные (нарушения памяти и внимания) [73]. Воспроизвести все симптомы в одной модели обычно не получается из-за сложных и во многом неясных механизмов, лежащих в их основе, поэтому разные модели шизофрении фокусируются на разных симптомах [74]. Очевидно, мы не можем воспроизвести у животных галлюцинации и бред, но общая двигательная гиперактивность вызывается психостимуляторами и подавляется нейролептиками, что позволяет считать ее отражением позитивных симптомов у пациентов (predictive validity) [75]. Негативные социальные симптомы оцениваются в описанных выше тестах на коммуникацию. Для оценки памяти используются различные лабиринты (пространственная память), обучение с положительным (сладкая пища) или отрицательным (удар током) подкреплением (ассоциативная память) или тест распознавания новых объектов (образная память). Когнитивные тесты на различные формы памяти также используются в исследованиях множества других психических расстройств — депрессии, СДВГ, РАС.
Модели биполярного расстройства
Биполярное расстройство по-прежнему представляет собой одну из самых больших загадок психиатрии. Мы по-прежнему знаем крайне мало как про факторы смены маниакальной и депрессивной фаз, так и про роль конкретных генов в патогенезе биполярного расстройства (хотя близнецовый анализ оценивает вклад генотипа в 80%) [76], [77]. Для терапии используются, в первую очередь, стабилизаторы настроения, такие как литий, однако механизм их действия пока непонятен. В таких условиях создать работающую модель биполярного расстройства не получается, поэтому в трансляционных исследованиях можно изучать только две фазы по отдельности, что никак не приближает нас к пониманию их взаимосвязи [78].
Заключение
Трансляционные модели психических расстройств, несомненно, внесли огромный вклад в наше понимание их механизмов и разработку психофармакологических препаратов самого широкого профиля. Кроме накопления колоссального массива новых знаний, важную роль в развитии трансляционной психиатрии играют достижения технического прогресса и новые методики исследований.
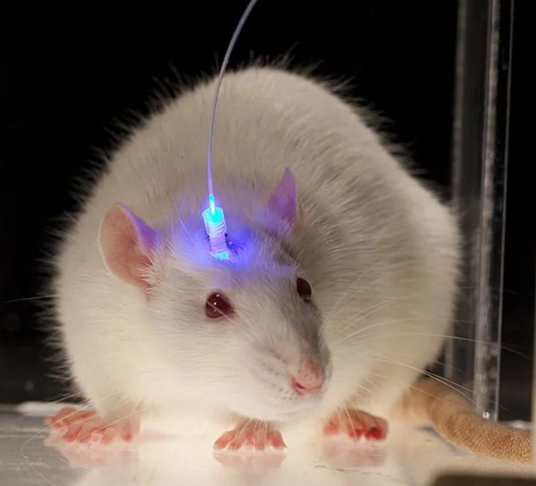
Рисунок 19. Трансгенная мышь со световодом в голове.
Сильный толчок нашему пониманию молекулярных механизмов психических расстройств сделало появление сначала генетически модифицированных модельных животных, а потом — оптогенетики. В этом невероятно популярном в наше время методе с помощью генной инженерии можно вставить в мембраны нейронов светочувствительные ионные каналы, позаимствованные у бактерий [79]. Подводя тонкий световод к определенной структуре, можно светом активировать и тормозить в ней различные типы нейронов (по используемому нейромедиатору). Так ученые могут, к примеру, изучать роль кортиколиберин-ергических нейронов миндалины в тревожном поведении или дофаминергических нейронов прилежащего ядра в мотивационном поведении и формировании наркотических зависимостей. Только представьте себе — пускаем в мозг световой сигнал, и крыса замирает от страха или начинает активнее жать на рычаг — это реальные современные исследования [80]. Есть и противоположная методика кальциевого имаджинга — генно-инженерное введение внутриклеточных сенсоров ионов кальция позволяет в микроскоп увидеть активацию отдельных нейронов у свободно движущейся мыши. Так мы можем увидеть, какие нейроны связаны с тревожностью, какие с половым поведением, а какие — с агрессией. Хочется надеяться, что новые генетические модели и технические методы позволят нам, наконец, найти эффективные методы лечения шизофрении, обсессивно-компульсивного, биполярного и других психических расстройств.
Литература
- В поисках новых лекарств: математическое моделирование поведения живой клетки;
- Поиск лекарственных мишеней;
- Три поколения лекарств;
- Клинические исследования: рыночный вопрос;
- С миру по нитке: как соединились компоненты клинического исследования;
- Paul Willner. (1984). The validity of animal models of depression. Psychopharmacology. 83, 1-16;
- Catherine Belzung, Maël Lemoine. (2011). Criteria of validity for animal models of psychiatric disorders: focus on anxiety disorders and depression. Biol Mood Anxiety Disord. 1;
- Спокоен как GABA;
- Краткая история антидепрессантов;
- Как генетика и пол влияют на эффект нейролептиков;
- Andrew H. Miller, Charles L. Raison. (2016). The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nat Rev Immunol. 16, 22-34;
- Грызун особого назначения;
- Nancy Hamdy, Sarah Eide, Hong-Shuo Sun, Zhong-Ping Feng. (2020). Animal models for neonatal brain injury induced by hypoxic ischemic conditions in rodents. Experimental Neurology. 334, 113457;
- T. R. Insel, L. E. Shapiro. (1992). Oxytocin receptor distribution reflects social organization in monogamous and polygamous voles.. Proceedings of the National Academy of Sciences. 89, 5981-5985;
- James T. Winslow, Nick Hastings, C. Sue Carter, Carroll R. Harbaugh, Thomas R. Insel. (1993). A role for central vasopressin in pair bonding in monogamous prairie voles. Nature. 365, 545-548;
- Heather E. Ross, Larry J. Young. (2009). Oxytocin and the neural mechanisms regulating social cognition and affiliative behavior. Frontiers in Neuroendocrinology. 30, 534-547;
- Tobias T. Pohl, Oona Jung, Barbara Di Benedetto, Larry J. Young, Oliver J. Bosch. (2021). Microglia react to partner loss in a sex- and brain site-specific manner in prairie voles. Brain, Behavior, and Immunity. 96, 168-186;
- M Halpern. (2003). Structure and function of the vomeronasal system: an update. Progress in Neurobiology. 70, 245-318;
- Prapimpun Wongchitrat, Marie-Paule Felder-Schmittbuhl, Pansiri Phansuwan-Pujito, Paul Pévet, Valérie Simonneaux. (2009). Endogenous rhythmicity ofBmal1andRev-erbα in the hamster pineal gland is not driven by norepinephrine. European Journal of Neuroscience. 29, 2009-2016;
- Модельные организмы: данио рерио;
- Murilo S. de Abreu, Ashton J. Friend, Konstantin A. Demin, Tamara G. Amstislavskaya, Wandong Bao, Allan V. Kalueff. (2018). Zebrafish models: do we have valid paradigms for depression?. Journal of Pharmacological and Toxicological Methods. 94, 16-22;
- Caio Maximino, Thiago Marques de Brito, Annanda Waneza da Silva Batista, Anderson Manoel Herculano, Silvio Morato, Amauri Gouveia. (2010). Measuring anxiety in zebrafish: A critical review. Behavioural Brain Research. 214, 157-171;
- Adam Michael Stewart, Michael Nguyen, Keith Wong, Manoj K. Poudel, Allan V. Kalueff. (2014). Developing zebrafish models of autism spectrum disorder (ASD). Progress in Neuro-Psychopharmacology and Biological Psychiatry. 50, 27-36;
- Barbara D. Fontana, Francini Franscescon, Denis B. Rosemberg, William H.J. Norton, Allan V. Kalueff, Matthew O. Parker. (2019). Zebrafish models for attention deficit hyperactivity disorder (ADHD). Neuroscience & Biobehavioral Reviews. 100, 9-18;
- Caio Maximino, Rhayra Xavier do Carmo Silva, Suéllen de Nazaré Santos da Silva, Laís do Socorro dos Santos Rodrigues, Hellen Barbosa, et. al.. (2015). Non-mammalian models in behavioral neuroscience: consequences for biological psychiatry. Front. Behav. Neurosci.. 9;
- Серотониновые сети;
- Дофаминовые болезни;
- T Burne, E Scott, B van Swinderen, M Hilliard, J Reinhard, et. al.. (2011). Big ideas for small brains: what can psychiatry learn from worms, flies, bees and fish?. Mol Psychiatry. 16, 7-16;
- Модельные организмы: приматы;
- Huiping Ding, Mei-Chuan Ko. (2021). Translational value of non-human primates in opioid research. Experimental Neurology. 338, 113602;
- Michael B. Hennessy, Katie Chun, John P. Capitanio. (2017). Depressive-like behavior, its sensitization, social buffering, and altered cytokine responses in rhesus macaques moved from outdoor social groups to indoor housing. Social Neuroscience. 12, 65-75;
- R. Gil-da-Costa, G. R. Stoner, R. Fung, T. D. Albright. (2013). Nonhuman primate model of schizophrenia using a noninvasive EEG method. Proceedings of the National Academy of Sciences. 110, 15425-15430;
- M. J. Sabatini, P. Ebert, D. A. Lewis, P. Levitt, J. L. Cameron, K. Mirnics. (2007). Amygdala Gene Expression Correlates of Social Behavior in Monkeys Experiencing Maternal Separation. Journal of Neuroscience. 27, 3295-3304;
- Dongdong Qin, Xunxun Chu, Xiaoli Feng, Zhifei Li, Shangchuan Yang, et. al.. (2015). The first observation of seasonal affective disorder symptoms in Rhesus macaque. Behavioural Brain Research. 292, 463-469;
- Модельные организмы: грызуны;
- Andrea Du Preez, Thomas Law, Diletta Onorato, Yau M. Lim, Paola Eiben, et. al.. (2020). The type of stress matters: repeated injection and permanent social isolation stress in male mice have a differential effect on anxiety- and depressive-like behaviours, and associated biological alterations. Transl Psychiatry. 10;
- Paul Willner. (2017). The chronic mild stress (CMS) model of depression: History, evaluation and usage. Neurobiology of Stress. 6, 78-93;
- Yena Lee, Leanna M.W. Lui, David Chen-Li, Yuhua Liao, Rodrigo B. Mansur, et. al.. (2021). Government response moderates the mental health impact of COVID-19: A systematic review and meta-analysis of depression outcomes across countries. Journal of Affective Disorders. 290, 364-377;
- Robert J Blanchard, Christina R McKittrick, D.Caroline Blanchard. (2001). Animal models of social stress: effects on behavior and brain neurochemical systems. Physiology & Behavior. 73, 261-271;
- R.E. Featherstone, S. Kapur, P.J. Fletcher. (2007). The amphetamine-induced sensitized state as a model of schizophrenia. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 31, 1556-1571;
- George C. Wagner, Kenneth R. Reuhl, Michelle Cheh, Paulette McRae, Alycia K. Halladay. (2006). A New Neurobehavioral Model of Autism in Mice: Pre- and Postnatal Exposure to Sodium Valproate. J Autism Dev Disord. 36, 779-793;
- Patricia M. Whitaker-Azmitia. (2001). Serotonin and brain development: role in human developmental diseases. Brain Research Bulletin. 56, 479-485;
- Noa Albelda, Daphna Joel. (2012). Animal models of obsessive-compulsive disorder: Exploring pharmacology and neural substrates. Neuroscience & Biobehavioral Reviews. 36, 47-63;
- Не хотим никотин, или кратко и емко о курении;
- Кто придумал употреблять алкоголь? Испорченное общество или «традиция» длиною в миллионы лет;
- Действие алкоголя на мозг: найден сайт связывания молекул спиртов;
- Eoin C. O’Connor, Kathryn Chapman, Paul Butler, Andy N. Mead. (2011). The predictive validity of the rat self-administration model for abuse liability. Neuroscience & Biobehavioral Reviews. 35, 912-938;
- Flavia S. Mueller, Joseph Scarborough, Sina M. Schalbetter, Juliet Richetto, Eugene Kim, et. al.. (2021). Behavioral, neuroanatomical, and molecular correlates of resilience and susceptibility to maternal immune activation. Mol Psychiatry. 26, 396-410;
- Melissa D. Bauman, Ana-Maria Iosif, Stephen E.P. Smith, Catherine Bregere, David G. Amaral, Paul H. Patterson. (2014). Activation of the Maternal Immune System During Pregnancy Alters Behavioral Development of Rhesus Monkey Offspring. Biological Psychiatry. 75, 332-341;
- I.I. Poletaeva, N.M. Surina, Z.A. Kostina, O.V. Perepelkina, I.B. Fedotova. (2017). The Krushinsky-Molodkina rat strain: The study of audiogenic epilepsy for 65 years. Epilepsy & Behavior. 71, 130-141;
- Galeeva A.Iu., Zhukov D.A. (1997). The effect of emotional stress on the behavioral and endocrine indices of rats selected for their contrasting capacities for active avoidance. Zh Vyssh Nerv Deiat Im I P Pavlova. 46, 929–936;
- CA Jones, DJG Watson, KCF Fone. (2011). Animal models of schizophrenia. British Journal of Pharmacology. 164, 1162-1194;
- Terje Sagvolden, Vivienne A. Russell, Heidi Aase, Espen Borgå Johansen, Mehdi Farshbaf. (2005). Rodent Models of Attention-Deficit/Hyperactivity Disorder. Biological Psychiatry. 57, 1239-1247;
- Jill L. Silverman, Mu Yang, Catherine Lord, Jacqueline N. Crawley. (2010). Behavioural phenotyping assays for mouse models of autism. Nat Rev Neurosci. 11, 490-502;
- Kengo Horie, Kiyoshi Inoue, Shingo Suzuki, Saki Adachi, Saori Yada, et. al.. (2019). Oxytocin receptor knockout prairie voles generated by CRISPR/Cas9 editing show reduced preference for social novelty and exaggerated repetitive behaviors. Hormones and Behavior. 111, 60-69;
- A. Thorsell, M. Michalkiewicz, Y. Dumont, R. Quirion, L. Caberlotto, et. al.. (2000). Behavioral insensitivity to restraint stress, absent fear suppression of behavior and impaired spatial learning in transgenic rats with hippocampal neuropeptide Y overexpression. Proceedings of the National Academy of Sciences. 97, 12852-12857;
- C. Lo Bianco, J.-L. Ridet, B. L. Schneider, N. Deglon, P. Aebischer. (2002). -Synucleinopathy and selective dopaminergic neuron loss in a rat lentiviral-based model of Parkinson's disease. Proceedings of the National Academy of Sciences. 99, 10813-10818;
- S. von Horsten, I. Schmitt, H. P. Nguyen, C. Holzmann, T. Schmidt, et. al.. (2003). Transgenic rat model of Huntington's disease. Human Molecular Genetics. 12, 617-624;
- D. S. Howland, J. Liu, Y. She, B. Goad, N. J. Maragakis, et. al.. (2002). Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS). Proceedings of the National Academy of Sciences. 99, 1604-1609;
- Catharine H. Duman, Lee Schlesinger, Masafumi Kodama, David S. Russell, Ronald S. Duman. (2007). A Role for MAP Kinase Signaling in Behavioral Models of Depression and Antidepressant Treatment. Biological Psychiatry. 61, 661-670;
- Lisa M. Monteggia, Bryan Luikart, Michel Barrot, David Theobold, Irena Malkovska, et. al.. (2007). Brain-Derived Neurotrophic Factor Conditional Knockouts Show Gender Differences in Depression-Related Behaviors. Biological Psychiatry. 61, 187-197;
- Valérie Turcotte-Cardin, Faranak Vahid-Ansari, Christine Luckhart, Mireille Daigle, Sean D. Geddes, et. al.. (2019). Loss of Adult 5-HT1A Autoreceptors Results in a Paradoxical Anxiogenic Response to Antidepressant Treatment. J. Neurosci.. 39, 1334-1346;
- . (2015). Animal models for screening anxiolytic-like drugs: a perspective. Dialogues Clin Neurosci. 17, 295-303;
- Vincent Castagné, Paul Moser, Sylvain Roux, Roger D. Porsolt. (2010). Rodent Models of Depression: Forced Swim and Tail Suspension Behavioral Despair Tests in Rats and Mice. Current Protocols in Pharmacology. 49;
- René Bernard, Mustafa Balkaya, André Rex. (2016). Behavioral Testing in Rodent Models of Stroke, Part I. Neuromethods. 199-223;
- Damiana Leo, Raul R. Gainetdinov. (2013). Transgenic mouse models for ADHD. Cell Tissue Res. 354, 259-271;
- Robert M.J. Deacon. (2009). Digging in Mice: Marble Burying, Burrowing, and Direct Observation Reveal Changes in Mouse Behavior. Mood and Anxiety Related Phenotypes in Mice. 37-45;
- Henry Szechtman, Susanne E. Ahmari, Richard J. Beninger, David Eilam, Brian H. Harvey, et. al.. (2017). Obsessive-compulsive disorder: Insights from animal models. Neuroscience & Biobehavioral Reviews. 76, 254-279;
- Расстройство аутистического спектра: «дети дождя»;
- Роль миндалевидного тела в социальном поведении;
- Страх и ненависть в миндалине: как возникает агрессия?;
- Stacey J. Sukoff Rizzo, Jacqueline N. Crawley. (2017). Behavioral Phenotyping Assays for Genetic Mouse Models of Neurodevelopmental, Neurodegenerative, and Psychiatric Disorders. Annu. Rev. Anim. Biosci.. 5, 371-389;
- Болезнь потерянных связей;
- Joanna C. Neill, Samuel Barnes, Samantha Cook, Ben Grayson, Nagi F. Idris, et. al.. (2010). Animal models of cognitive dysfunction and negative symptoms of schizophrenia: Focus on NMDA receptor antagonism. Pharmacology & Therapeutics. 128, 419-432;
- M. van den Buuse. (2010). Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36, 246-270;
- Jared W. Young, Davide Dulcis. (2015). Investigating the mechanism(s) underlying switching between states in bipolar disorder. European Journal of Pharmacology. 759, 151-162;
- Dietrich van Calker, Tsvetan Serchov. (2021). The “missing heritability”—Problem in psychiatry: Is the interaction of genetics, epigenetics and transposable elements a potential solution?. Neuroscience & Biobehavioral Reviews. 126, 23-42;
- Dominik K. E. Beyer, Nadja Freund. (2017). Animal models for bipolar disorder: from bedside to the cage. Int J Bipolar Disord. 5;
- Свет, камера, … нервный импульс!;
- Светлая голова.





