Почему именно семь, или Загадка микроцина C
07 мая 2019
Почему именно семь, или Загадка микроцина C
- 849
- 0
- 2
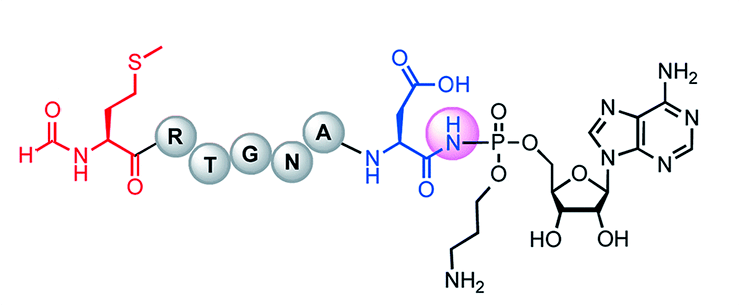
Химическая структура микроцина C
-
Автор
-
Редактор
Жизнь в бактериальном мире — это жестокая и безжалостная конкуренция за ресурсы и пространство, необходимые для существования. Чтобы выжить, многие бактерии обзаводятся плазмидами, которые кодируют токсины пептидной природы, убивающие соседние клетки, зачастую и своего вида. К числу таких токсинов относится микроцин C, вырабатываемый кишечной палочкой (Escherichia coli). Этот токсин образуется в виде пептида-предшественника, который приобретает губительные для клеток свойства после особых посттрансляционных модификаций. Хотя пептиды, подобные микроцину C, производятся многими неродственными видами бактерий и имеют совершенно разный аминокислотный состав, практически все они длиной ровно семь аминокислотных остатков. Но почему именно семь? Ответом на этот вопрос задались исследователи из Института биологии гена, Сколковского института науки и технологий, Университета Иллинойса (США) и Биомедицинского центра Уппсалы (Швеция), и результаты их исследований появились в свежем номере журнала mBio Американского микробиологического общества. Попробуем и мы разобраться в «знаке семи» микроцина C.
Для борьбы с клетками-конкурентами многие микроорганизмы не гнушаются использовать специальные «безобидные» молекулы, которые они подсовывают соседям в виде своеобразных троянских коней, — бактериоцины. Когда поглощенную молекулу начинают обрабатывать внутриклеточные ферменты, высвобождается токсин, убивающий клетку. К числу таких токсинов относится и микроцин C, вырабатываемый E. coli. За его синтез отвечает оперон mcc, содержащий пять генов и расположенный на плазмиде (рис. 1) [1]. Ген mccA кодирует пептид-предшественник из семи аминокислотных остатков (метионин—аргинин—тирозин—глицин—аспарагин—аланин—аспарагин). Продукт гена mccB, фермент MccB, с затратой АТФ навешивает на C-конец пептида-предшественника остаток аденозина, превращая при этом аспарагин в аспартат [2], причем аденозин крепится к пептиду через негидролизуемую связь между атомами азота и фосфора (рис. 2). Далее ферменты MccD и MccE присоединяют к получившемуся продукту аминопропильную группу (—C3H6NH2).
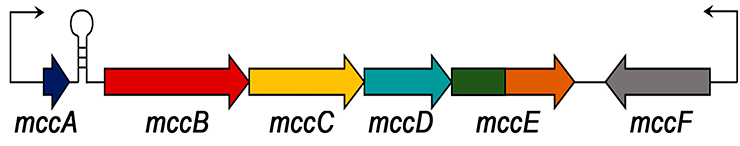
Рисунок 1. Строение оперона mcc. Тонкие стрелки обозначают промоторы и указывают направление транскрипции генов. Шпилька между mccA и mccB — терминатор транскрипции.
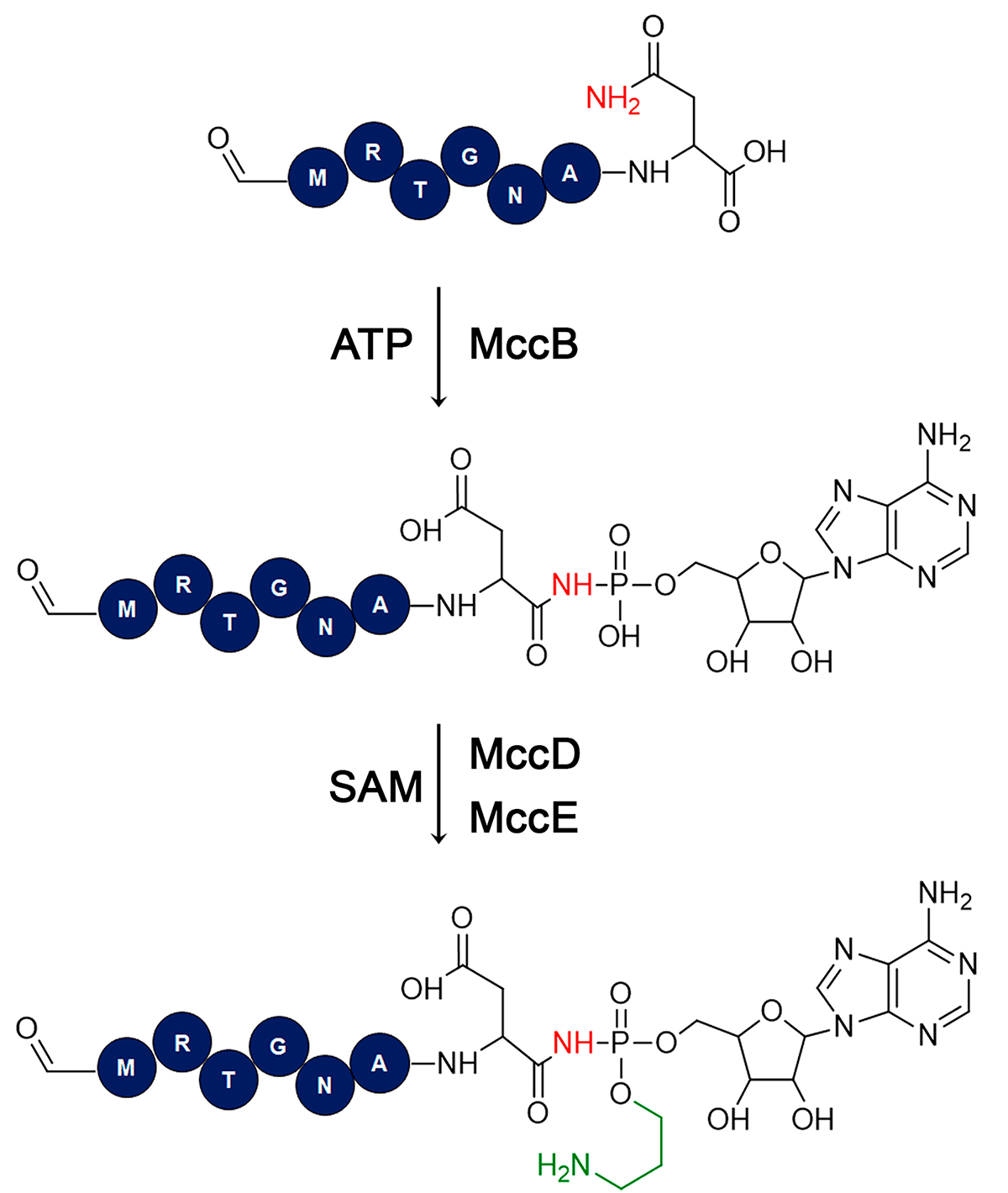
Рисунок 2. Схема биосинтеза микроцина C. Шесть N-концевых аминокислот обозначены кружочками. C-концевой аспартат показан в виде структурной формулы. Условные обозначения: AMP — аденозинмонофосфат (АМФ); SAM — S-аденозилметионин.
MccE — бифункциональный фермент: совместно с белком MccF он обеспечивает защиту от микроцина C той клетки, которая его произвела, нейтрализуя бактериоцин в цитоплазме. Белок MccC представляет собой мембранный насос, выкачивающий зрелый микроцин C наружу, откуда он через транспортер YejABEF проникает в соседние клетки [1]. Под действием их аминопептидаз, удаляющих шесть N-концевых аминокислот пока еще неактивной молекулы, микроцин C превращается в негидролизуемый аденилированный аспартамид (аспартамидаденилат), структурно очень похожий на аспартиладенилат — промежуточный продукт работы аспартил-тРНК-синтетазы (рис. 3) [2], [3]. Аспартамидаденилат ингибирует работу этого фермента, необходимого для трансляции, не давая ему работать со своим природным субстратом и синтезировать полноценные аминоацилированные тРНК. Таким образом, микроцин C нарушает синтез белка в клетке и в конце концов приводит к ее гибели [1].
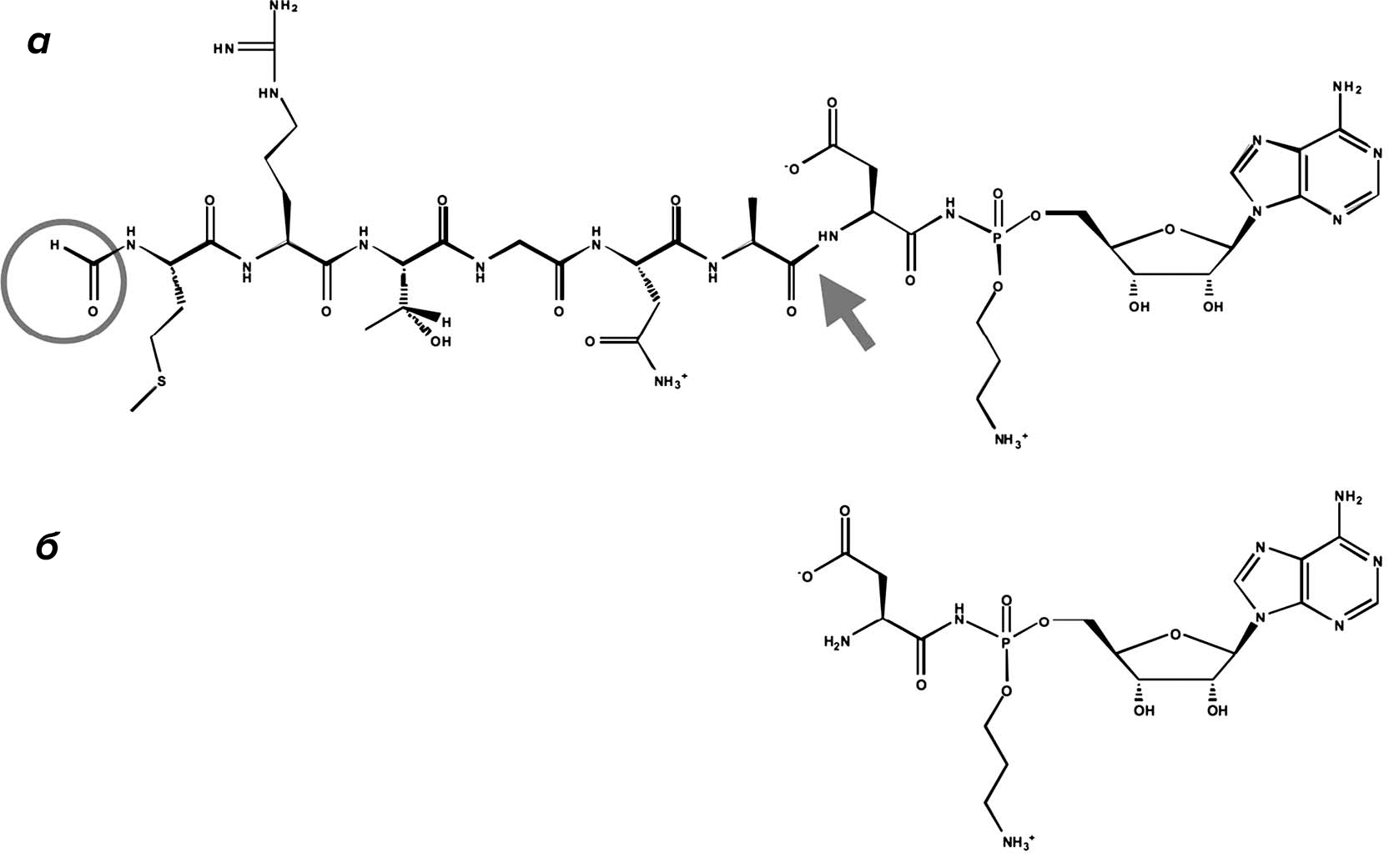
Рисунок 3. Зрелый (а) и деградированный (б) микроцин С. Кружком обведена N-концевая формильная группа. Стрелкой показана точка, где прекращают работу аминопептидазы.
Хотя аминопропильная группа усиливает токсичные свойства микроцина C, аденилированный пептид и сам по себе может подавлять рост бактериальных клеток. По сути, для синтеза работающего микроцина C в действительности необходимы только три гена — кодирующие пептид-предшественник (MccA), аденилирующий фермент (MccB) и насос, выкачивающий микроцин C из клетки, в которой он образовался (MccC) . Биоинформатический анализ показал, что белки, родственные MccB и MccA, обнаруживаются у множества видов бактерий, и, что наиболее удивительно, в абсолютном большинстве случаев MccA состоит ровно из семи аминокислотных остатков. Последним из них всегда является аспарагин, так как именно к нему пришивается аденозин, а первым — метионин [1].
«Биомолекула» уже писала о подробностях биосинтеза другого микроцина — микроцина B17 — «Микробиологические войны: чем бактерии воюют друг с другом» [4].
Для ответа на вопрос «Почему пептид-предшественник микроцина C всегда состоит ровно из семи аминокислот?» исследователи сконструировали плазмиды, кодирующие немного удлиненные версии пептида-предшественника микроцина C: из 11 и 15 аминокислот. Оказалось, что среда, в которой росли бактерии, производящие более длинные версии пептида-предшественника, обладала меньшей антибиотической активностью, чем среда от бактерий, синтезирующих нормальный микроцин C. Причем, как выяснили исследователи, удлиненные версии микроцина C не удерживались внутри производящих их клеток, что можно было бы связать с низкой антимикробной активностью среды, а просто синтезировались в гораздо меньшем количестве. Однако транскрипция mccA оказалась не связанной с длиной пептида: мРНК и длинных версий, и обычного семиаминокислотного микроцина C транскрибировались одинаково хорошо. А вот на уровне трансляции возникали существенные проблемы. Дело в том, что, как показали предыдущие исследования, короткие рамки считывания, содержащие от двух до восьми кодонов, могут транслироваться рибосомой несколько раз без диссоциации ее от мРНК в конце очередного раунда трансляции [5]. Возможность такого непрерывного синтеза обеспечивает интенсивную наработку пептида. Удлиненные версии микроцина C в силу своей величины не могут транслироваться по нескольку раз без диссоциации рибосомы, поэтому синтезируются в существенно меньшем количестве, чем нормальный микроцин C.
Оказалось также, что важнейшую роль в активности семиаминокислотного токсина играет наличие формильной группы (—CHO) на его N-концевом метионине, однако аналогичная модификация удлиненного токсина активирует его значительно меньше или вовсе ингибирует. Дело в том, что формилирование N-конца пептида-предшественника из семи аминокислот стимулирует его аденилирование, обеспечивая лучшее взаимодействие с аденилирующим ферментом MccB. В то же время формилирование 11-аминокислотного предшественника не активирует его аденилирование в той же степени, как в случае семиаминокислотного предшественника, а формилирование 15-аминокислотного предшественника даже подавляет процесс, хотя и не полностью. Кроме того, формилированные токсины эффективнее переносятся в клетки-мишени транспортером YejABEF, который, как показали ранее, лучше распознает таким образом модифицированные субстраты. Любопытно, что увеличение длины пептида-предшественника до некоторой степени увеличивает активность токсина, однако этот эффект полностью нивелируется преимуществами формилирования короткого семиаминокислотного предшественника [1].
Но почему бы не пойти в другую сторону и не попробовать сократить длину токсина? Может ли укороченный токсин быть эффективнее? Как показали экспериментально еще в 2015 году, укорочение микроцина C всего на один аминокислотный остаток приводит к нарушениям его транспорта в клетки чувствительных бактерий белком YejABEF [6].
Таким образом, похоже, магическое число «семь» — это оптимум для токсинов, подобных микроцину C, который в результате конвергентной эволюции проявился даже у неродственных бактерий.
Литература
- Inna Zukher, Michael Pavlov, Darya Tsibulskaya, Alexey Kulikovsky, Tatyana Zyubko, et. al.. (2019). Reiterative Synthesis by the Ribosome and Recognition of the N-Terminal Formyl Group by Biosynthetic Machinery Contribute to Evolutionary Conservation of the Length of Antibiotic Microcin C Peptide Precursor. mBio. 10;
- T. Kazakov, G. H. Vondenhoff, K. A. Datsenko, M. Novikova, A. Metlitskaya, et. al.. (2008). Escherichia coli Peptidase A, B, or N Can Process Translation Inhibitor Microcin C. Journal of Bacteriology. 190, 2607-2610;
- Anastasia Metlitskaya, Teymur Kazakov, Aigar Kommer, Olga Pavlova, Mette Praetorius-Ibba, et. al.. (2006). Aspartyl-tRNA Synthetase Is the Target of Peptide Nucleotide Antibiotic Microcin C. J. Biol. Chem.. 281, 18033-18042;
- Микробиологические войны: чем бактерии воюют друг с другом;
- Vildan Dinçbas, Valérie Heurgué-Hamard, Richard H Buckingham, Reza Karimi, Måns Ehrenberg. (1999). Shutdown in protein synthesis due to the expression of mini-genes in bacteria. Journal of Molecular Biology. 291, 745-759;
- G. H. M. Vondenhoff, B. Blanchaert, S. Geboers, T. Kazakov, K. A. Datsenko, et. al.. (2011). Characterization of Peptide Chain Length and Constituency Requirements for YejABEF-Mediated Uptake of Microcin C Analogues. Journal of Bacteriology. 193, 3618-3623.