
Микробиологические войны: чем бактерии воюют друг с другом
22 января 2019
Микробиологические войны: чем бактерии воюют друг с другом
- 1624
- 0
- 10
В популяциях бактерий кипит ожесточенная борьба, на которой, как и на войне, все средства хороши — даже узкоспецифичные антибиотики, убивающие клеток-сородичей
рисунок предоставлен авторами статьи в Molecular Cell
-
Автор
-
Редакторы
Повсеместно распространенная устойчивость бактерий к большинству антибиотиков, применяемых в современной медицине, грозит скорым ренессансом смертоносных бактериальных инфекций и потому вызывает большое беспокойство в кругах медиков и биологов. Поэтому одно из направлений, привлекающее внимание многих исследователей, — антимикробные пептиды, которые сами же бактерии и продуцируют для борьбы с конкурентами — другими бактериальными клетками. Зачастую эти пептиды содержат причудливые химические модификации, придающие им токсические свойства. Какие бактериальные ферменты осуществляют реакции, приводящие к таким замысловатым модификациям? Группа исследователей Центра наук о жизни Сколковского института науки и технологий совместно с исследователями из Центра Джона Иннса в Великобритании изучили ферментный комплекс, который синтезирует микроцин B17 — антибактериальный пептид, продуцируемый кишечной палочкой (Escherichia coli), и выявили химический механизм реакций, которые придают ему свойства токсина. Первый автор работы, Дмитрий Гиляров, любезно согласился прокомментировать исследование и рассказал, каковы перспективы применения бактериальных пептидов в клинической практике.
Отношения клеток бактерий одного или близких видов, населяющих одну и ту же нишу, весьма непросты. Как говорится, в большой семье клювом не щелкай, поэтому каждая клетка вынуждена вести борьбу со своими сородичами, чтобы завоевать место под солнцем в виде необходимых для жизнедеятельности ресурсов. По этой причине некоторые бактериальные клетки выделяют наружу химически модифицированные пептиды, которые токсичны для других бактерий и потому помогают сдерживать рост клеток-соседей.
Один из таких пептидов — выделяемый E. coli микроцин B17 (MccB17), который ингибирует жизненно необходимый для бактерий фермент ДНК-гиразу, регулирующую пространственную структуру ДНК. Подобно широко используемым антибиотикам из группы фторхинолонов (например, ципрофлоксацину), он заставляет гиразу расщеплять клеточную ДНК, превращая ее в «яд» для клетки. За синтез микроцина отвечает оперон mcbABCDEFG, который находится на плазмиде [7].
Образование полностью функционального антибиотика протекает в несколько этапов. Сначала по матрице мРНК гена mcbA синтезируется в ходе обычной трансляции на рибосоме пептид из 69 аминокислотных остатков. Далее комплекс белков, кодируемых генами mcbBCD, превращает несколько остатков серина и цистеина в пептиде McbA в гетероциклические соединения группы оксазолов (в случае серина) или тиазолов (в случае цистеина). Комплекс McbBCD распознает пептид McbA по его N-концевому лидерному пептиду из первых 26 аминокислот. На заключительном этапе синтеза лидерный пептид отщепляет протеаза TldD/E (которая, кстати, кодируется бактериальным геномом, а не плазмидой), и функциональный микроцин экспортируется наружу (рис. 1).
Здесь у внимательного читателя может возникнуть вопрос: а почему же микроцин не убивает ту самую бактерию, которая его и синтезировала? Дело в том, что в одном опероне с генами синтеза микроцина находится ген mcbG, продукт которого защищает клетку от микроцина.
Еще в 1996 году установили, что гетероциклические группы появляются в составе микроцина под действием белкового комплекса, состоящего из продуктов генов mcbBCD, который при этом затрачивает энергию в виде АТФ. Однако как именно устроен этот комплекс и каков химический механизм образования гетероциклических групп, долгое время известно не было.
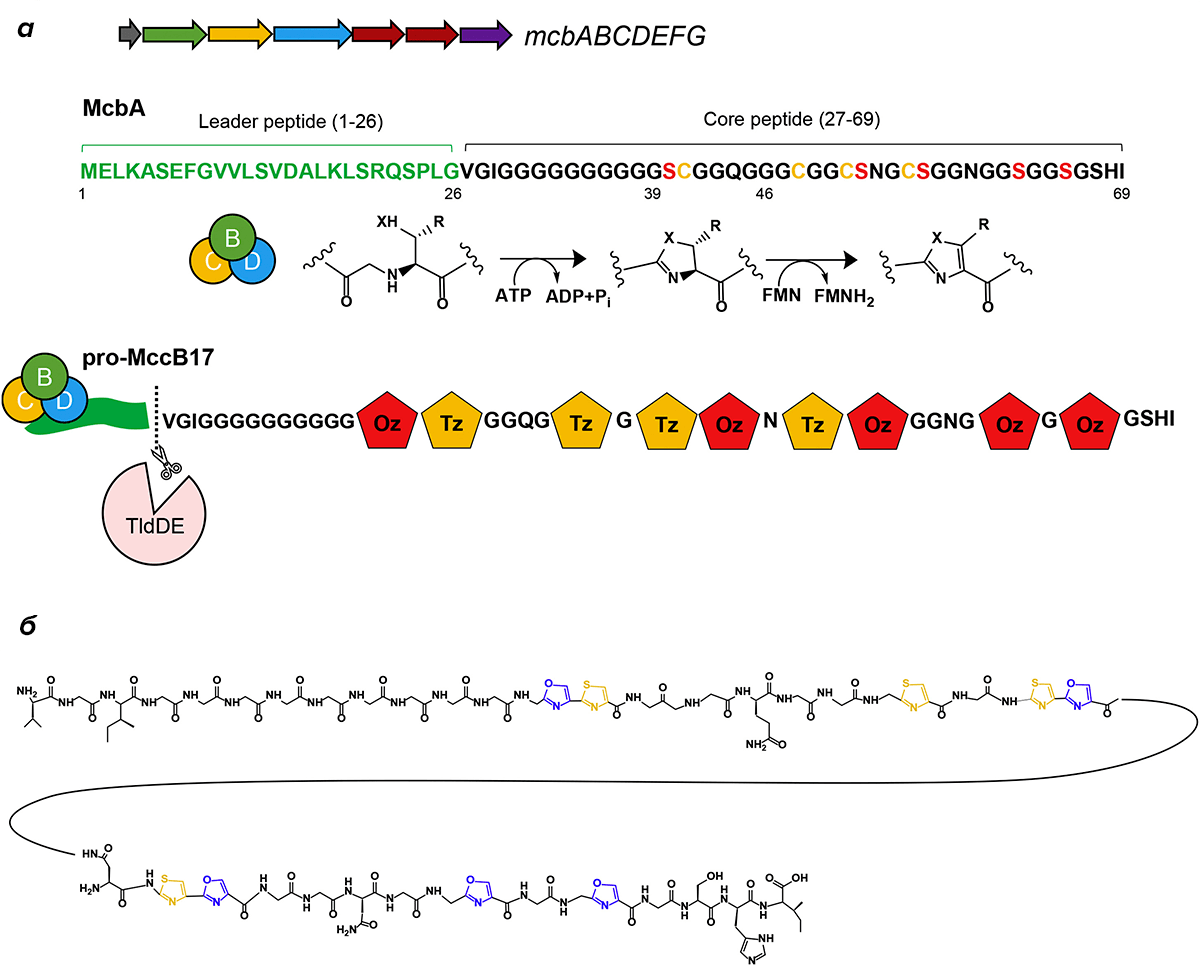
Рисунок 1. Структура микроцина и общая схема его биосинтеза. а — Схема оперона mcbABCDEFG, последовательность McbA и функционального микроцина, а также общие схемы реакций образования гетероциклов. Субъединицы McbB, McbC, McbD отмечены зеленым, желтым и голубым кружками соответственно. Лидерный пептид выделен зеленым; остатки McbA, преобразующиеся в гетероциклы, выделены красным и желтым. Желтые и красные пятиугольники — тиазолы и оксазолы соответственно. б — Химическая структура зрелого микроцина.
Группе ученых Сколтеха (во главе с Константином Севериновым) совместно с британскими исследователями удалось разобраться в тонкостях процесса синтеза микроцина [8]. Они смогли не только выделить комплекс McbBCD в рабочем состоянии (в связанном с McbA виде), но и получить его кристаллические структуры с модифицированным пептидом и без него, благодаря которым установили последовательность химических превращений, осуществляемых комплексом.
Оказалось, что комплекс McbBCD состоит из двух асимметричных субъединиц, каждая из которых включает две копии белка McbB и по одной копии белков McbC и McbD. Копии McbB в составе синтетазного комплекса неидентичны и различаются положением в пространстве одного из доменов. Они принимают участие в распознавании лидерного пептида McbA, который «заякоривает» пептид на ферментном комплексе. Каталитической активностью обладают субъединицы McbC и McbD, которые и превращают остатки серина и цистеина в гетероциклы. McbD осуществляет гетероциклизацию с затратой АТФ, причем ученые смогли разобраться в химическом механизме реакции образования гетероциклов. McbC завершает формирование гетероциклических групп, действуя как дегидрогеназа, для работы которой необходим флавинмононуклеотид.
Общий механизм работы синтетазного комплекса таков. Гетероциклы формируются в McbA последовательно, в направлении от N- к C-концу. Вероятно, McbA, «схваченный» за лидерный пептид субъединицами McbB, постоянно «перескакивает» от гетероциклазы McbD к дегидрогеназе McbC и обратно. Причем по мере формирования гетероциклов McbA «распутывается», благодаря чему становится возможным химическая модификация остатков серина и цистеина, располагающихся ближе к C-концу. В конце концов протеаза TldD/E удаляет лидерный пептид, и функциональный микроцин выделяется клеткой наружу (рис. 2).
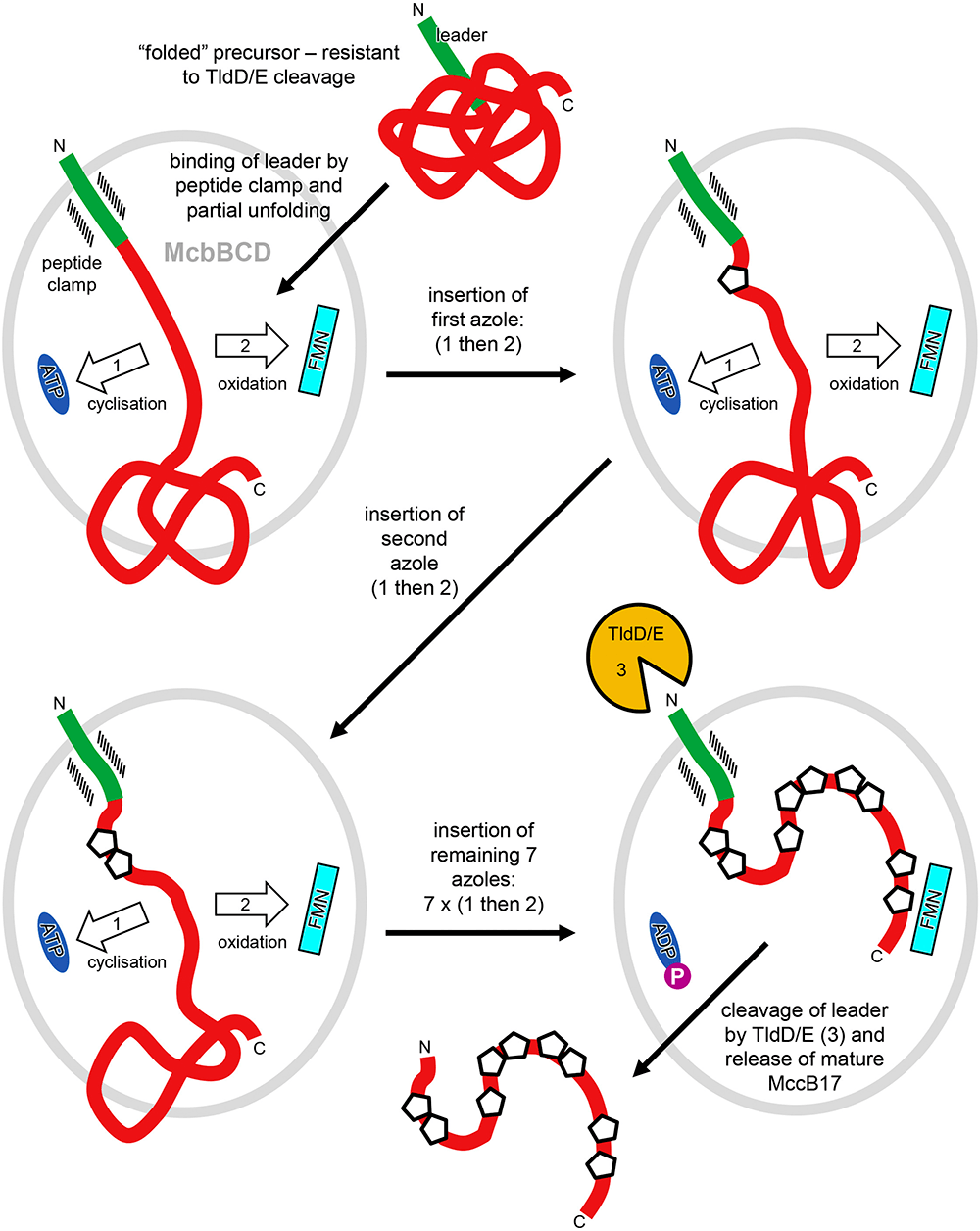
Рисунок 2. Схема работы комплекса McbBCD
Стоит отметить, что микроцин B17 — далеко не единственный в своем роде.
«Тиазолоксазолсодержащих природных продуктов, подобных микроцину, тысячи, — рассказывает Дмитрий Гиляров, первый автор публикации [8]. — Поиск генов, кодирующих родственные биосинтетические белки, позволяет ученым находить другие модифицированные пептиды, многие из которых обладают еще более сложным химическим строением и разнообразными биологическими активностями. Например, анализ генома условно-патогенной бактерии Klebsiella pneumoniae позволил ученым из Санкт-Петербургского Политеха и Сколтеха совместно с коллегами из других лабораторий выделить и описать антибиотик клебсазолицин [9], [10], ингибирующий бактериальную рибосому. Удивительно, но клебсазолицин, также синтезирующийся комплексом BCD, обладает дополнительной модификацией — амидиновым циклом. Структуры биосинтетических белков помогают исследователям понять, как один и тот же фермент может вводить разные модификации, узнавая различные аминокислотные остатки в пептидах».
Если микроцин и близкие к нему антимикробные пептиды смогут найти применение в медицине, благодаря знаниям о строении и работе комплекса McbBCD появится возможность в контролируемых условиях биотехнологически синтезировать B17 и другие тиазолоксазолсодержащие биологически активные пептиды с заданными свойствами.
Каковы же перспективы использования микроцина и подобных ему пептидов в медицине? Дмитрий отмечает, что «большая часть классов антимикробных пептидов, содержащих оксазольные и тиазольные группы, нам полностью неизвестна (мы просто видим биосинтетические гены в геномах, но возможности биоинформатики намного превосходят возможности по клонированию, синтезу и анализу продуктов этих кластеров). То есть мы совершенно не знаем свойств этих веществ и, возможно, какие-то из них будут действительно хорошими антибиотиками сами по себе. Но в целом природные продукты — плохие лекарства: они очень хорошо подходят для уничтожения конкурентов в природных местообитаниях своих продуцентов, но совсем не приспособлены для демонстрации в клинических исследованиях свойств, привлекательных для фармкомпаний. Кроме того, обычно они токсичны, плохо растворимы, вызывают иммунный ответ, к ним быстро возникает устойчивость. И кроме того, они очень узкоспецифичны (что для “классических” антибиотиков рассматривалось как плохое свойство, так как всегда хотелось иметь одну таблетку от всего сразу).
В случае с пенициллинами, стрептомицином, аминогликозидами и подобными антибиотиками проблема решалась с помощью синтетической химии — путем создания химических библиотек на основе природного скелета антибиотика и их последующего тестирования. Это позволило значительно продлить “век” антибиотиков в клинической практике и расширить сферу их применения. Поэтому, я думаю, скорее можно ожидать каких-то веществ на основе этих природных скелетов, использующих те же мишени и механизмы действия.
Например, антибиотик низин широко применяется в пищевой промышленности, и в пробиотических штаммах микроорганизмов, синтезирующих низин для нормализации микрофлоры или контроля молочного производства, уже нет ничего фантастического. То же самое относится к сельскому хозяйству: мы должны просто обеспечить синтез нужных нам микроцинов какими-то фитопротекторными штаммами, чтобы они могли эффективно вытеснять патогенные. Опять же, сейчас это все может звучать как фантастика, но эта область очень быстро развивается, и я думаю, что за этим будущее».
Дмитрий также отметил, что, возможно, в будущем трансплантация фекалий и другие методики управления нашим микробиомом приобретут большое значениe для лечения кишечных инфекций, возбудители которых обладают резистентностью практически ко всем антибиотикам, применяемым в современной клинической практике.
Подробнее о проблемах и перспективах трансплантации фекалий можно прочесть в статье [11].
Литература
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Один в поле не воин: природная антимикробная система эффективнее антибиотика;
- Бактериоцины — ноухау биомедицины;
- Антибиотики прямо под нашим носом;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Dmitry Ghilarov, Clare E.M. Stevenson, Dmitrii Y. Travin, Julia Piskunova, Marina Serebryakova, et. al.. (2019). Architecture of Microcin B17 Synthetase: An Octameric Protein Complex Converting a Ribosomally Synthesized Peptide into a DNA Gyrase Poison. Molecular Cell;
- Mikhail Metelev, Ilya A Osterman, Dmitry Ghilarov, Nelli F Khabibullina, Alexander Yakimov, et. al.. (2017). Klebsazolicin inhibits 70S ribosome by obstructing the peptide exit tunnel. Nat Chem Biol. 13, 1129-1136;
- Dmitrii Y. Travin, Mikhail Metelev, Marina Serebryakova, Ekaterina S. Komarova, Ilya A. Osterman, et. al.. (2018). Biosynthesis of Translation Inhibitor Klebsazolicin Proceeds through Heterocyclization and N-Terminal Amidine Formation Catalyzed by a Single YcaO Enzyme. J. Am. Chem. Soc.. 140, 5625-5633;
- Микробы из глубинки. Стоит ли нам трансплантировать себе фекалии дикарей, чтобы вернуть былое здоровье.






