
Почему прячут ДНК от Стинга?
13 ноября 2019
Почему прячут ДНК от Стинга?
- 891
- 0
- 6
-
Автор
-
Редакторы
Темы
Комикс на конкурс «био/мол/текст»: Казалось бы, чем наша же собственная ДНК может не угодить нашему иммунитету? Да всем — когда оказывается в цитоплазме. Потому что организму известно: генетический материал хранится внутри органелл, а цитозольная ДНК будет принадлежать бактерии, вирусу, паразиту... кому угодно, но не нам. Следовательно, ее жизненно необходимо распознать и вовремя уничтожить. Для раковых клеток вытекшая в цитоплазму ДНК — дело распространенное. Но последнее, в чем они заинтересованы, — быть замеченными иммунной системой. В этой статье пойдет речь о том, как работает внутриклеточный сенсор cGAS—STING и какую роль он играет в развитии рака.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Немного про иммунитет

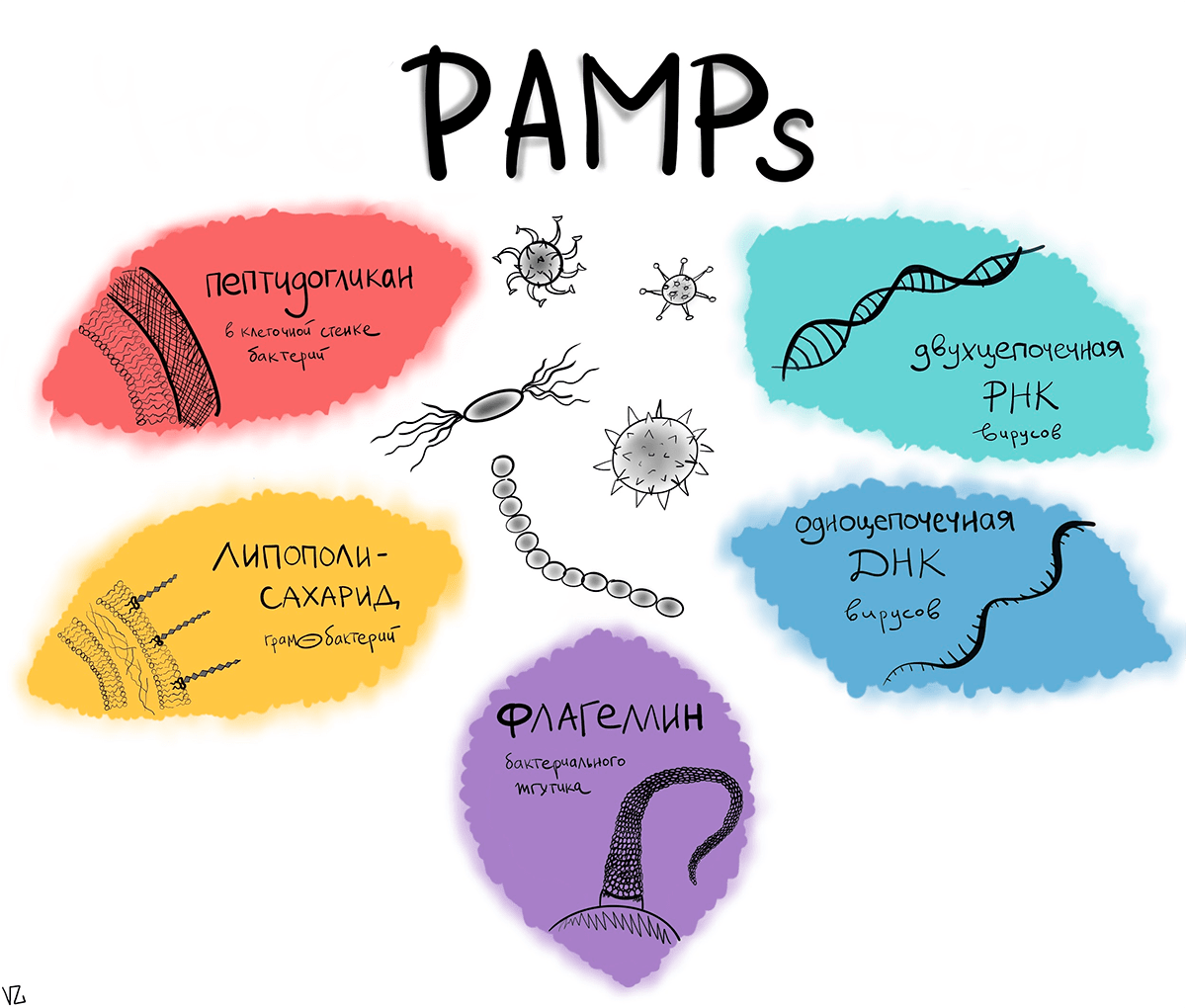
Когда чужак проникает на «территорию» нашего организма, у него не так уж много шансов остаться незамеченным. Бактерии и вирусы всячески пытаются спрятаться от иммунитета, но в ходе эволюции иммунная система запоминала наиболее часто встречающиеся патогенные структуры и теперь при встрече с ними умеет распознавать их и сразу бить тревогу. Эти структуры, которые выдают патоген нашей иммунной системе с потрохами, называются патоген-ассоциированными молекулярными образами (pathogen-associated molecular patterns, PAMPs). Для них у иммунных клеток есть специальные рецепторы, такие как Toll-like (TLR) и Nod-like (NLR), после связывания с которыми в ход пускается первая линия неспецифической обороны — врожденный иммунитет. Особенностью врожденного иммунитета является способность реагировать на патоген вне зависимости от того, встречался ли с ним организм до этого или нет. Его задача ослабить врага и помешать его распространению, в то время как нарабатываются основные силы — антитела [1].
Замкнутый образ жизни ДНК
Однако не только инородные агенты могут провоцировать иммунную реакцию. Наша собственная ДНК может стать причиной для тревоги. В норме генетический материал надежно спрятан в ядре и митохондриях и поводом для его выхода наружу может послужить лишь процесс деления клетки — когда ядерная мембрана разрушается и хромосомы расходятся к клеточным полюсам. За исключением этого события в жизни клетки наша ДНК предпочитает не высовываться из укрытия, и на то у нее есть весомые причины.

Пока ДНК упрятана в своей органелле, ее всячески лелеют и защищают, но как только она вышла наружу — завяли помидоры! Теперь наша же ДНК — цель для ликвидации как нечто аномальное и потенциально опасное. Ведь двухцепочечная ДНК есть не только у нас, но и у бактерий и некоторых вирусов (например, простого вируса герпеса) — тут уж сложно отличить, где чья. Спровоцировать утечку ДНК из прячущей ее органеллы могут различные повреждения клетки, в частности окислительный стресс, но сказать, каким именно образом и почему она периодически выходит наружу даже из здоровой клетки — сложно. На этот случай у клетки есть ферменты, разрушающие двухцепочечную ДНК в цитоплазме до того, как запустится защитная реакция — TREX1 и ДНКаза II.
Хрупкий дом забытой хромосомы
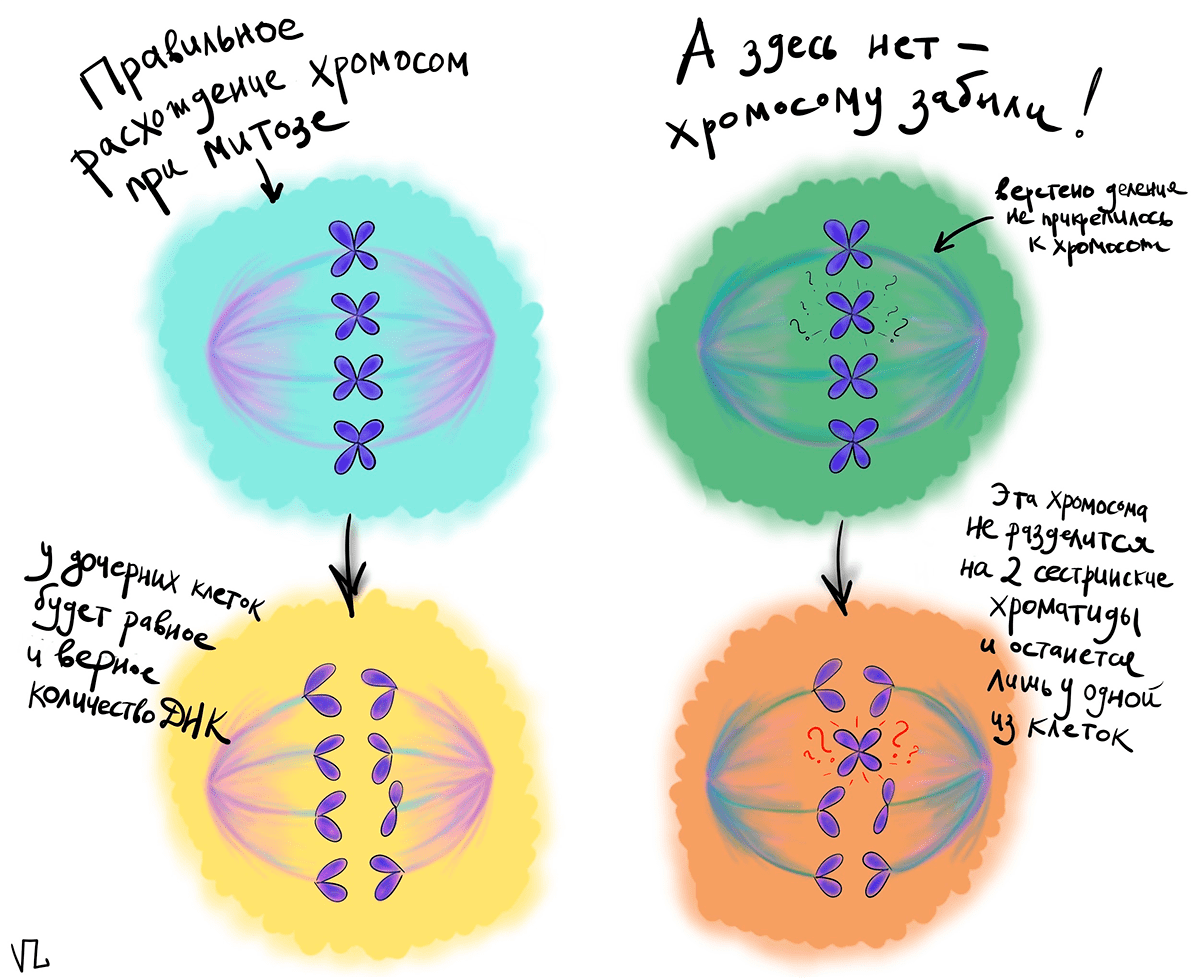
ДНК в цитоплазме часто встречается у раковых клеток. Одной из их ключевых характеристик является генетическая нестабильность [3], то есть повышенная вероятность появления точечных мутаций и различных хромосомных перестроек. Если мутации затронут гены, ответственные за сборку веретена деления и расхождения хромосом при митозе, то может получиться так, что какую-нибудь хромосому не «прихватят» с собой в полюс клетки, и та останется не у дел. Но долго горевать брошенная хромосома не будет и организует свое собственное, хоть и маленькое, ядро — микроядро. В результате поделившиеся раковые клетки будут иметь неполный набор хромосом, что, очевидно, не способствует поддержанию генетической стабильности, а способствует прогрессированию злокачественности. При этом ДНК в микроядре будет продолжать жить независимой от главного ядра жизнью. В целом, для многих типов раковых клеток свойственно наличие микроядер. Они тоже окружены мембраной, но не такой прочной, как у настоящего ядра. Ее довольно легко продырявить, и тогда ДНК вытекает в цитоплазму. И вот тут мы переходим к главным героям этой статьи.
Стинг и его команда
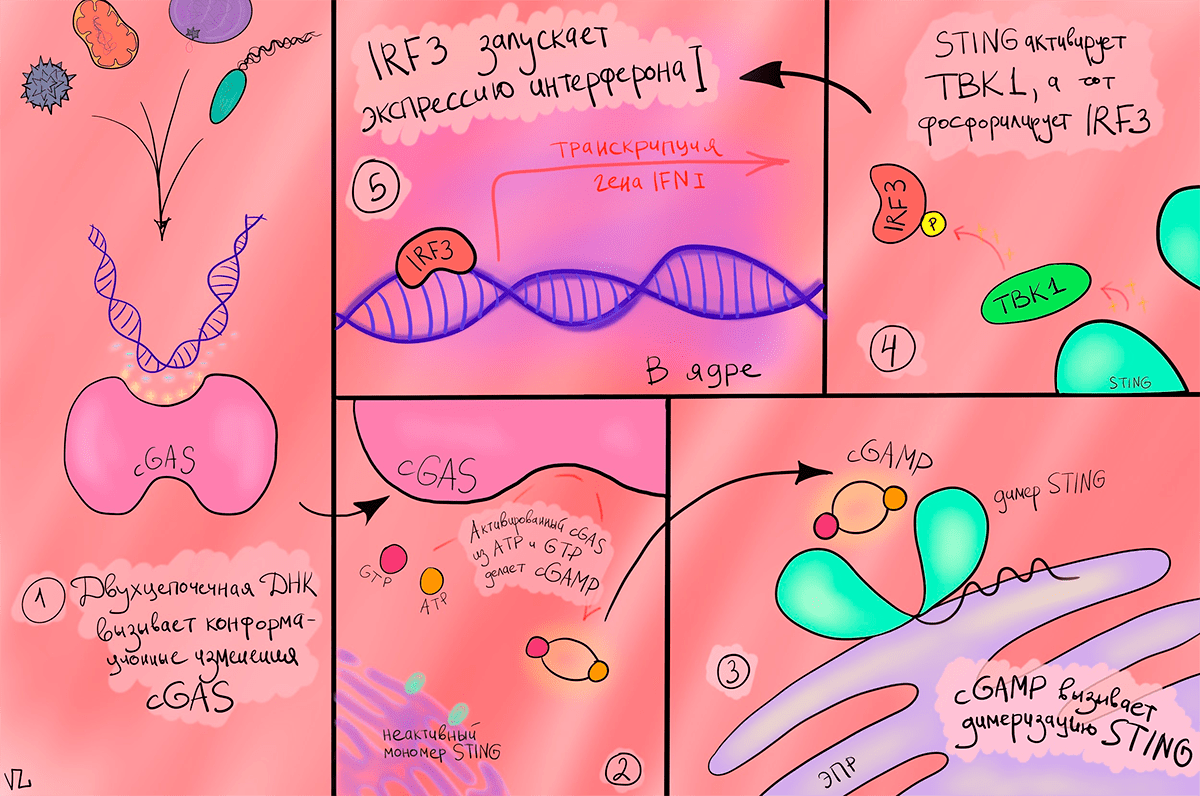
Как только ДНК, наша или чужеродная, оказывается в цитоплазме, просыпается белок cGAS. У него есть участок из положительно заряженных аминокислот, который взаимодействует с отрицательно заряженным сахарофосфатным остовом ДНК. Это взаимодействие вызывает димеризацию cGAS, и тот начинает превращать ATP и GTP в циклический динуклеотид cGAMP. cGAMP идет к эндоплазматическому ретикулуму, на котором его уже поджидает STING. Но название это возникло не в честь известного музыканта, а как аббревиатура от STimulator of INterferon Genes. STING меняет свою конформацию после взаимодействия с cGAMP и приобретает способность связывается с TBK1, который, в свою очередь, фосфорилирует регуляторный фактор интерферона 3 (IRF3). А он активирует транскрипцию интерферона 1. Здесь наконец-то появился тот, кто будет разбираться с непрошенной ДНК в цитоплазме — интерферон [4].
Снова про иммунитет и еще про интерферон
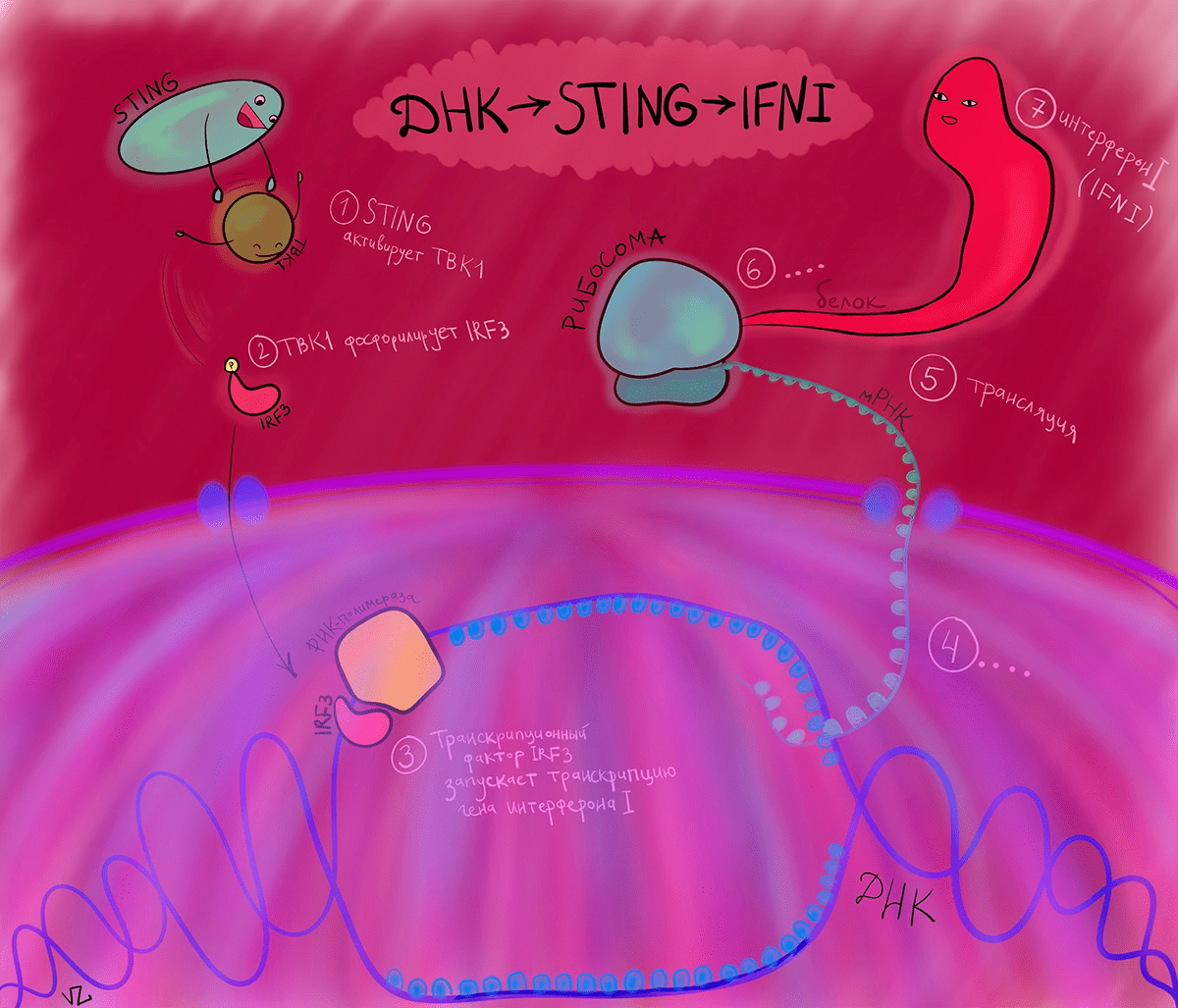
Интерфероны — группа белков, вырабатываемых клетками организма при попадании в него вирусов или бактерий. Основная их задача — предотвратить распространение врага в другие клетки и защитить окружение от уже зараженных клеток. Интерфероны млекопитающих разделяют на два типа, но в контексте cGAS—STING стоит подробнее остановиться на интерфероне 1 типа. Интерферон 1 (IFN1) связывается со своим рецептором IFNAR и запускает каскад, ведущий к активации транскрипции различных генов, которые помогают клеткам бороться с непрошенными гостями.
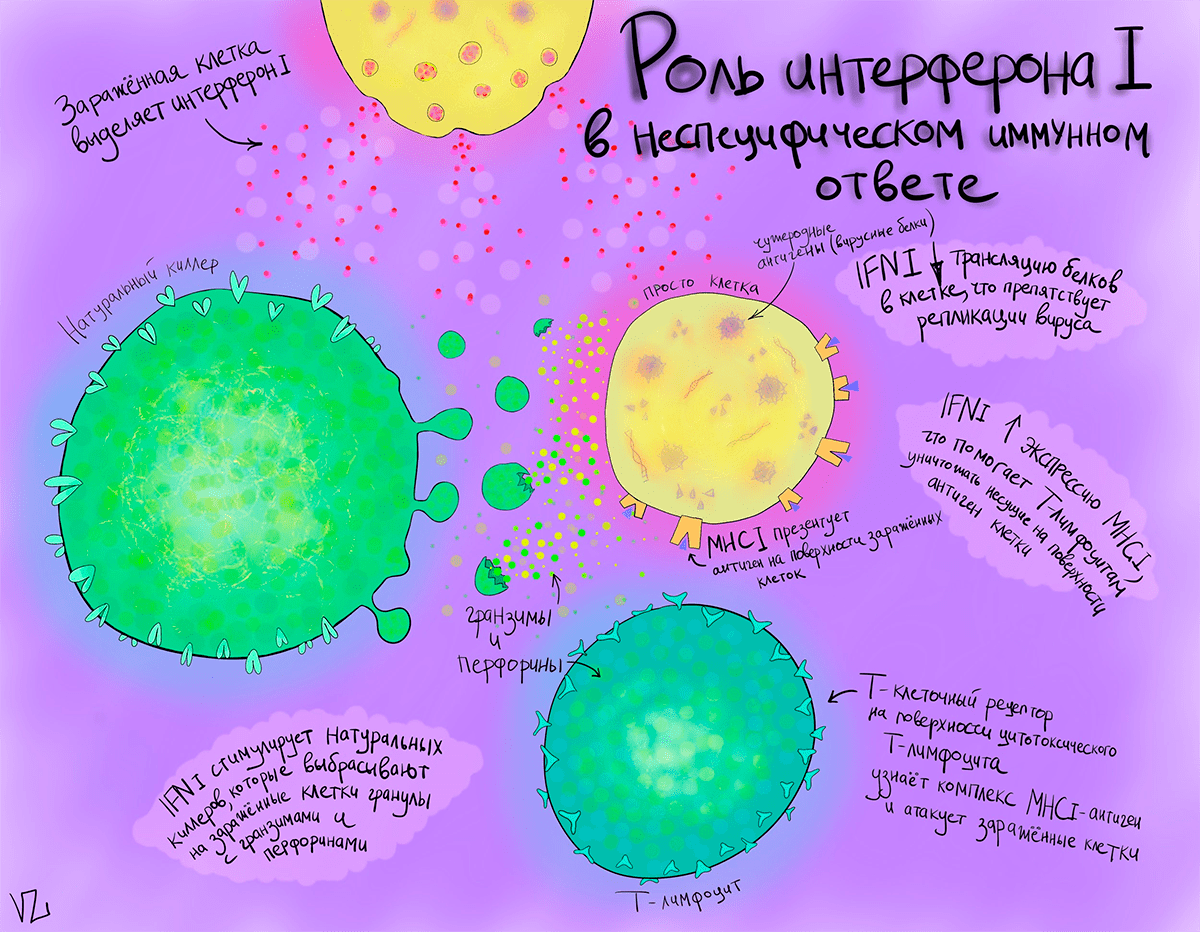
Интерферон 1 важен в первичной защите, приостанавливая репликацию вируса, чтобы дать организму время наработать более смертоносное оружие — специфические к данному вирусу антитела. А пока антитела производятся, интерферон 1 стимулирует неспецифические защитные силы организма, прямо или косвенно воздействуя на клетки иммунной системы.
Два лица интерферона 1
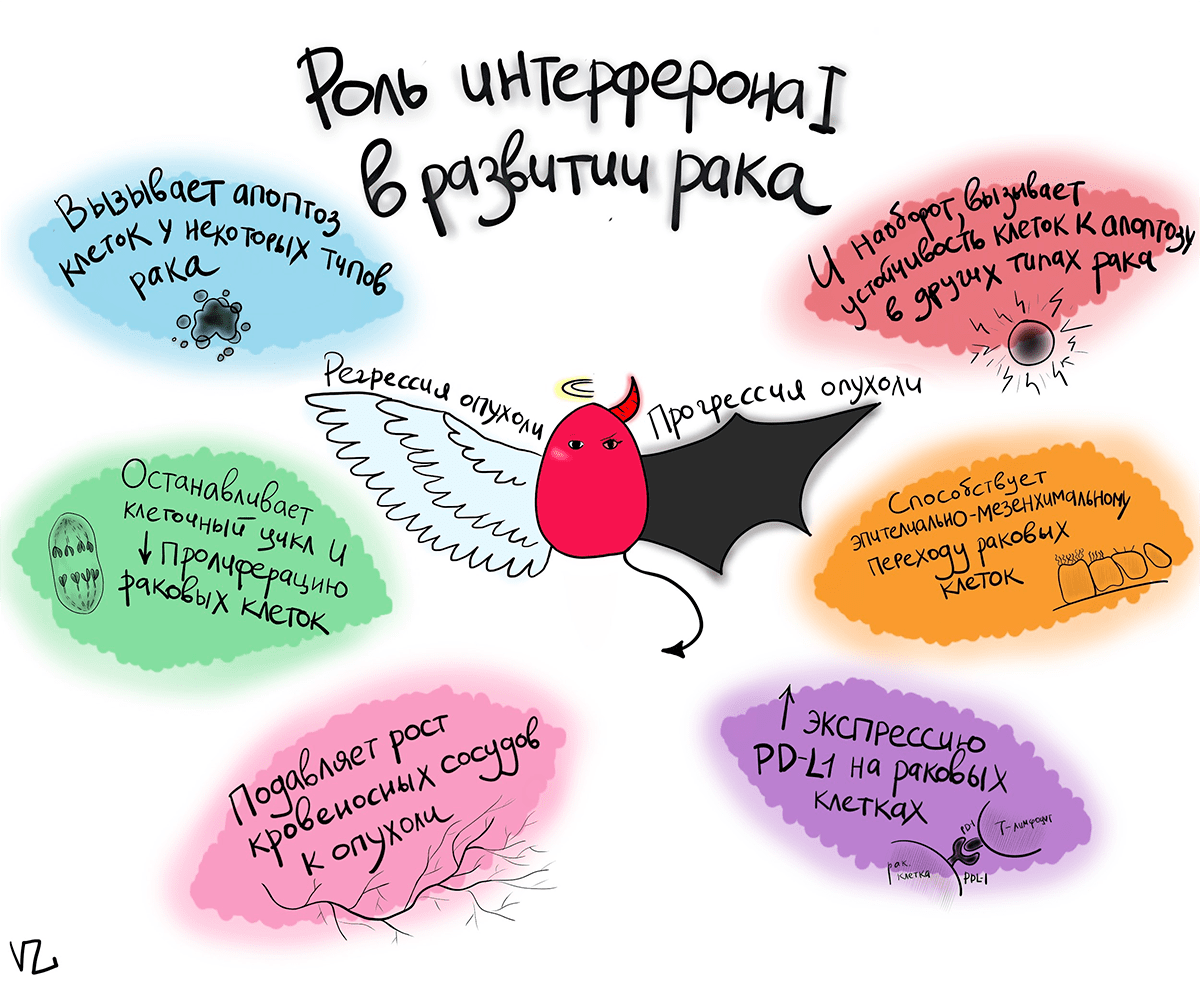
Но помимо воспаления и борьбы с инфекцией, интерферон 1 может влиять на развитие рака. Здесь все становится совсем запутанным. Казалось бы, интерферон 1 играет ключевую роль в неспецифическом иммунитете, и, разумеется, должен быть верным помощником в уничтожении раковых клеток.
Но на самом деле все не так радужно. В зависимости от типа опухоли, ее стадии развития и других факторов, интерферон 1, наоборот, может способствовать ее росту [6].
Несмотря на неоднозначное влияние интерферона 1 на развитие рака, cGAS—STING-путь является основным сенсором цитозольной ДНК, которая, как уже было сказано выше, служит косвенным признаком генетической нестабильности и хромосомных поломок, а значит — и рака. Предполагается, что cGAS—STING обнаружит вытекшую ДНК и запустит клеточную смерть, опосредованную интерфероном. Но злокачественным клеткам эта идея не по вкусу. Они усыпляют cGAS—STING, чтобы иммунная система их не видела [7].
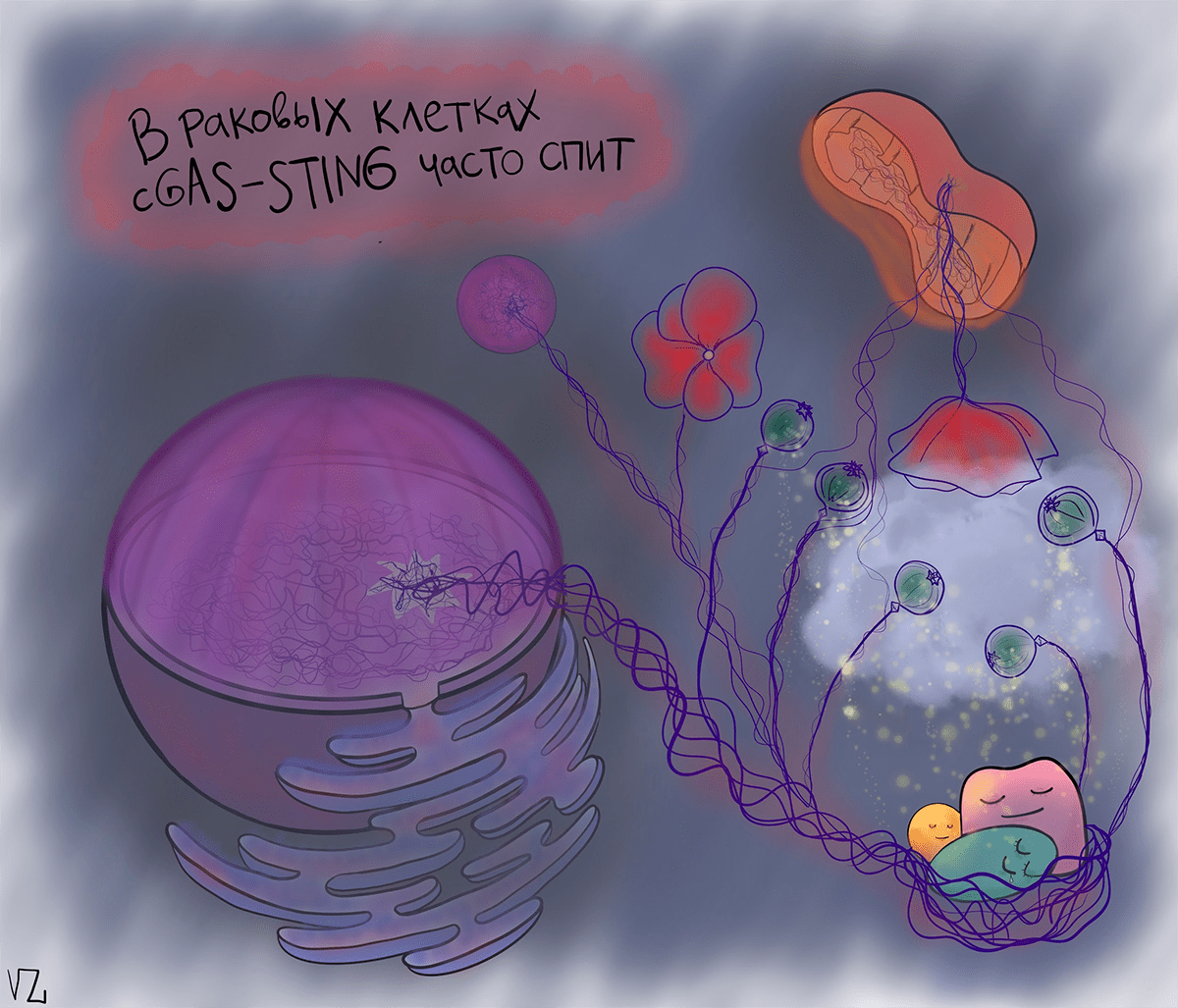
Вывод такой: при борьбе с некоторыми типами рака активировать cGAS—STING — верная идея. Ведь ДНК в цитоплазме может служить еще одной отличительной особенностью злокачественной клетки. Сейчас cGAS-STING активно изучается, и до клинических испытаний его активаторов дело еще не дошло, но полагают, что в комбинации с иммунотерапией это может быть новым перспективным шагом в терапии рака — наш иммунитет сам сможет распознавать и специфически атаковать раковые клетки, как бы те ни старались себя спрятать [8].
Литература
- Ruslan Medzhitov, Charles A Janeway. (1997). Innate Immunity: The Virtues of a Nonclonal System of Recognition. Cell. 91, 295-298;
- Daxing Gao, Tuo Li, Xiao-Dong Li, Xiang Chen, Quan-Zhen Li, et. al.. (2015). Activation of cyclic GMP-AMP synthase by self-DNA causes autoimmune diseases. Proc Natl Acad Sci USA. 112, E5699-E5705;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Lorenzo Galluzzi, Claire Vanpouille-Box, Samuel F. Bakhoum, Sandra Demaria. (2018). SnapShot: CGAS-STING Signaling. Cell. 173, 276-276.e1;
- Søren R. Paludan, Andrew G. Bowie. (2013). Immune Sensing of DNA. Immunity. 38, 870-880;
- Martina Musella, Gwenola Manic, Ruggero De Maria, Ilio Vitale, Antonella Sistigu. (2017). Type-I-interferons in infection and cancer: Unanticipated dynamics with therapeutic implications. OncoImmunology. 6, e1314424;
- Kevin W. Ng, Erin A. Marshall, John C. Bell, Wan L. Lam. (2018). cGAS–STING and Cancer: Dichotomous Roles in Tumor Immunity and Development. Trends in Immunology. 39, 44-54;
- Anping Li, Ming Yi, Shuang Qin, Yongping Song, Qian Chu, Kongming Wu. (2019). Activating cGAS-STING pathway for the optimal effect of cancer immunotherapy. J Hematol Oncol. 12.







