Почему женщины живут дольше
13 января 2021
Почему женщины живут дольше
- 2381
- 3
- 6
коллаж Вероники Пачиной
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В любой стране мира — вне зависимости от культуры, традиций, уровня жизни и качества медицины — женщины живут дольше мужчин. В этом обзоре мы отправимся в путешествие, в котором как кусочки пазла будем собирать различные гипотезы возникновения полового неравенства в продолжительности жизни. Посетим холодные воды Тихого океана и разберемся в том, как особенности внутривидового отбора способствуют долголетию косаток-бабушек. Вместе с первыми французскими колонизаторами прибудем в Канаду XVII века и расследуем эволюционные истоки генетического «проклятия матери», а также на примере генеалогических записей о продолжительности жизни евнухов из XVI века подумаем, можно ли радикально изменить механизмы старения у мужчин.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Благодаря прогрессу, достигнутому в XX веке и начале XXI-го, люди в среднем стали жить гораздо дольше. Доля пожилого населения Земли за последние полвека почти удвоилась и продолжает расти. И если сейчас каждый десятый житель Земли старше 65 лет [2], то, по прогнозам ООН, к 2050 году это будет уже каждый шестой [3]. Этот тренд вызывает значительное беспокойство, поскольку старение является лидирующим фактором риска целого ряда наиболее смертельных заболеваний, включая сердечную недостаточность, инфаркт миокарда, хроническую обструктивную болезнь легких, инсульт, деменцию, диабет и рак [1]. Поэтому не удивительно, что тема старения и увеличения продолжительности здоровой жизни приобретает всё большую популярность среди исследователей в области медицины и биотехнологий. Например, за последние десять лет, в наиболее крупной базе биомедицинской литературы — Pubmed, ежегодная доля статей с упоминанием слова aging (старение ) увеличилась почти на 60% (рис. 1).
Если вас интересует тема старения, советуем прочесть книгу Полины Лосевой «Против часовой стрелки: что такое старение и как с ним бороться». Специально для «Биомолекулы» Анна Петренко написала рецензию на эту книгу. — Ред.
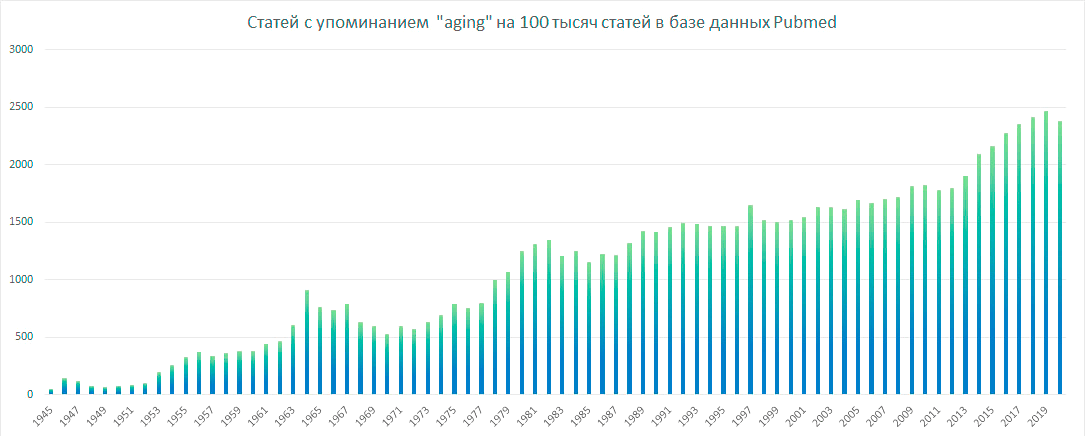
Рисунок 1. Количество статей с упоминанием запроса aging на 100 тысяч статей в базе данных Pubmed
Pubmed, диаграмма построена с помощью сервиса Pubmed by year
И тем не менее один из немногих действительно универсальных факторов, влияющих на продолжительность жизни человека — принадлежность к мужскому или женскому полу, до сих пор остается довольно слабо изучен [4].
Слабый пол
Подавляющее большинство видов животных имеют два пола, наиболее ярко выраженная разница в продолжительности жизни полов наблюдается среди млекопитающих — по имеющимся данным, самцы в среднем живут на 17,5% меньше самок [5], но у некоторых видов, как например львов, благородных оленей и зубатых китов, этот разрыв намного больше. Например, ожидаемая продолжительность жизни самок косаток может быть более чем в два раза выше — 50,7 лет против 23,3 (рис. 2) [6].
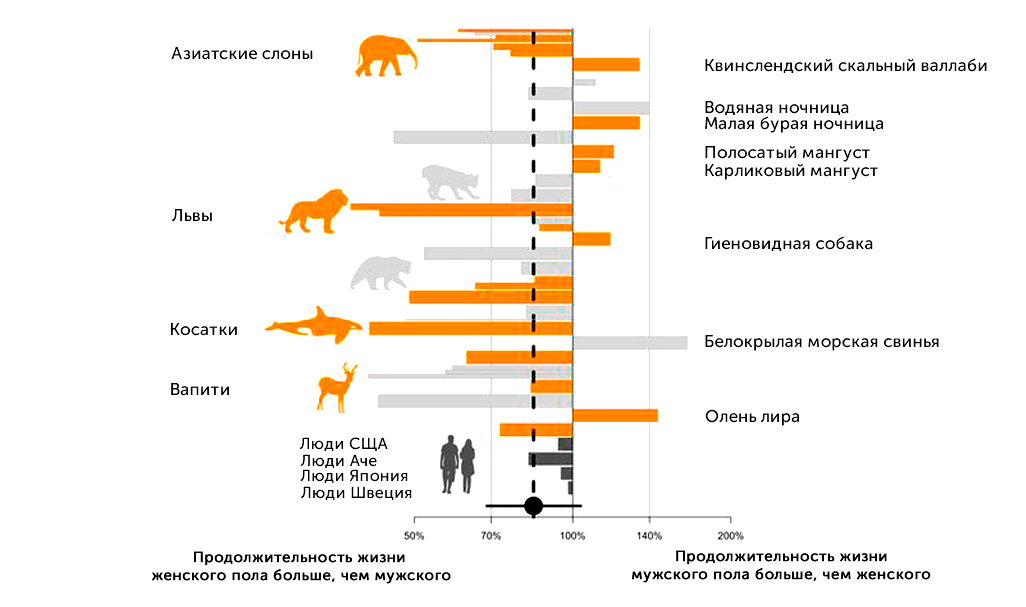
Рисунок 2. Половые различия в продолжительности взрослой жизни млекопитающих. Длина линии соответствует логарифму отношения (Продолжительность жизни взрослых самцов) / (Продолжительность жизни взрослых самок). Полосы по левую сторону от значения «100%» соответствуют видам с большей продолжительностью жизни самок. Полосы по правую сторону от значения «100%» — видам с большей продолжительностью жизни самцов. Оранжевые полосы соответствуют так называемым продольным данным, полученным в результате длительного наблюдения за одними и теми же животными в популяциях с целью измерения их фактической продолжительности жизни с последующим усреднением. Серые полосы соответствуют поперечным данным, полученным в результате единовременного измерения возрастов животных в популяции, в данном случае возраст самых старых животных считается максимумом продолжительности жизни. Самые темные полосы соответствуют продольным данным в различных популяциях людей. Черной точкой обозначена средняя разница в продолжительности жизни полов для млекопитающих, кроме человека.
[6], изображение адаптировано
Данные о продолжительности жизни у людей [7] показывают похожую картину — в среднем по миру мужчины живут почти на 7% меньше, чем женщины, в половине стран этот показатель колеблется от 4,8% до 8,2% (рис. 3). Если повнимательнее посмотреть на распределение, то можно увидеть, что такое гендерное неравенство:
- во всех странах имеет не нулевое значение, что делает преимущество женщин в продолжительности жизни одним из самых стабильных признаков человеческой популяции;
- почти не зависит от средней продолжительности жизни в стране;
- скорее всего, слабо связано с культурными традициями, поскольку на большей части распределения рядом часто оказываются страны с очень разными культурными традициями и уровнем жизни, например, Ямайка и Бельгия или Того (западная Африка) и Швеция.
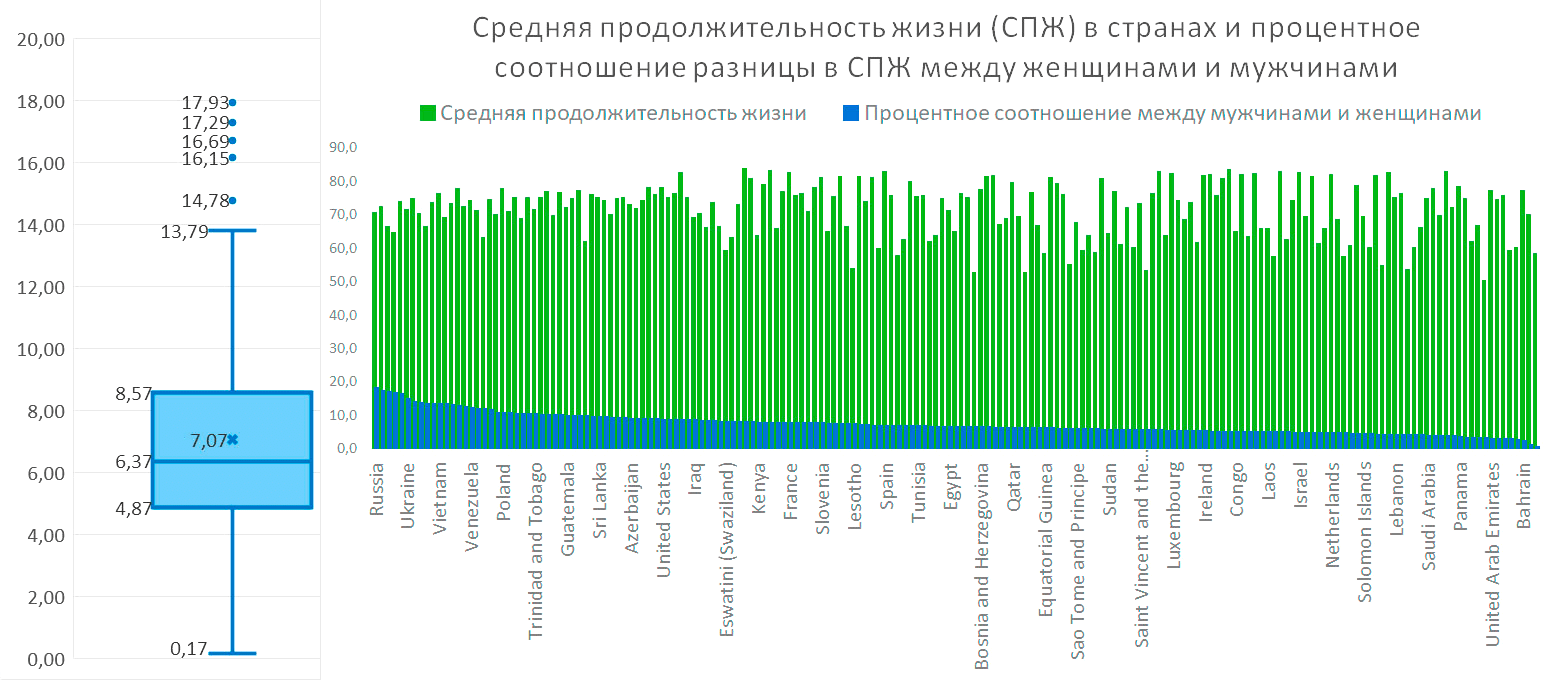
Рисунок 3. Слева: Диаграмма «ящик с усами», показывающая, как распределяются значения процентного соотношения разницы в средней продолжительности жизни между женщинами и мужчинами по 183 странам. Пять точек вверху — это страны с самым большим отрывом, в порядке убывания: Россия, где женщины живут на 17,93% дольше, чем мужчины, Беларусь — на 17,29%, Руанда — на 16,75%, Сирия — на 16,69%, Литва — на 16,15%. «Усы» — Т-образные линии сверху и снизу, соответствуют четверти самых маленьких и четверти самых больших значений. Справа: Детализация средней продолжительности жизни по странам. Зеленый столбик — общая средняя продолжительность жизни; синий столбик — разница в процентах между мужчинами и женщинами.
Темная сторона силы
Почему женщины живут дольше мужчин? Разница в продолжительности жизни полов может быть связана с особенностями отбора внутри вида. Иными словами, во всем виновата эволюция.
Один из способов оценки эволюционной успешности — это подсчет количества потомства, которому особь смогла передать свои гены. Самцы здесь преуспевают. Они, как правило, тратят гораздо меньше ресурсов на производство потомства, а их стратегия успеха состоит в большом числе спариваний в короткий промежуток времени.
Чтобы максимизировать количество спариваний, самцам приходится расходовать свои ресурсы на поддержание вторичных половых признаков, таких как яркая раскраска или крупные рога, а также сражаться за самок на турнирах, демонстрируя физическое превосходство. Все это сопровождается большими издержками и повышенными рисками смерти самцов, а такую эволюционную стратегию можно назвать: «Размножайся быстро, умри молодым» (рис. 4а).
Женский пол у млекопитающих обычно тратит гораздо больше сил на вынашивание и развитие потомства, чем мужской, и не может получать такую же репродуктивную выгоду от увеличения количества спариваний на единицу времени.
Исходя из этого, можно предположить, что естественный отбор будет по-разному влиять на оба пола, поскольку больше своих генов смогут передать с одной стороны — самые быстрые и сильные самцы, способные выиграть конкуренцию за самку, а с другой стороны — более долгоживущие самки, способные выносить большее количество потомства (рис. 4б) [9].
А поскольку долголетие самцов находится не под таким жестким давлением отбора, то у них способны закрепляться гены, дающие преимущество при конкуренции за самок, но негативно влияющие на продолжительность жизни. И кандидатами на такие неоднозначные, плейотропные гены (от греч. πλείων — «больше» и τρέπειν — «поворачивать, превращать»), могут быть гены половых гормонов самцов.
В подтверждение этой идеи можно привести результаты исследования на птицах, в котором была показана обратная связь между уровнем мужского полового гормона — тестостерона (отвечающего за формирование вторичных половых признаков) и уровнем иммунного ответа, а также устойчивостью к окислительному стрессу.
На четыре недели сорока двум самцам зебровых амадин (Taeniopygia guttata) под кожу помещали импланты, которые высвобождали в кровоток, в зависимости от группы, либо тестостерон, либо фтуламид (антагонист андрогенового рецептора); контрольная группа получала пустой имплант. Результаты показали заметное увеличение устойчивости эритроцитов к оксидативному стрессу, а также более высокий уровень Т-клеточного иммунного ответа в группе, получавшей антиандроген. Проще говоря, птицы, которые получали меньше тестостерона, лучше могли справляться с инфекциями и меньше страдали от вредного воздействия активных форм кислорода (рис. 6) [11].
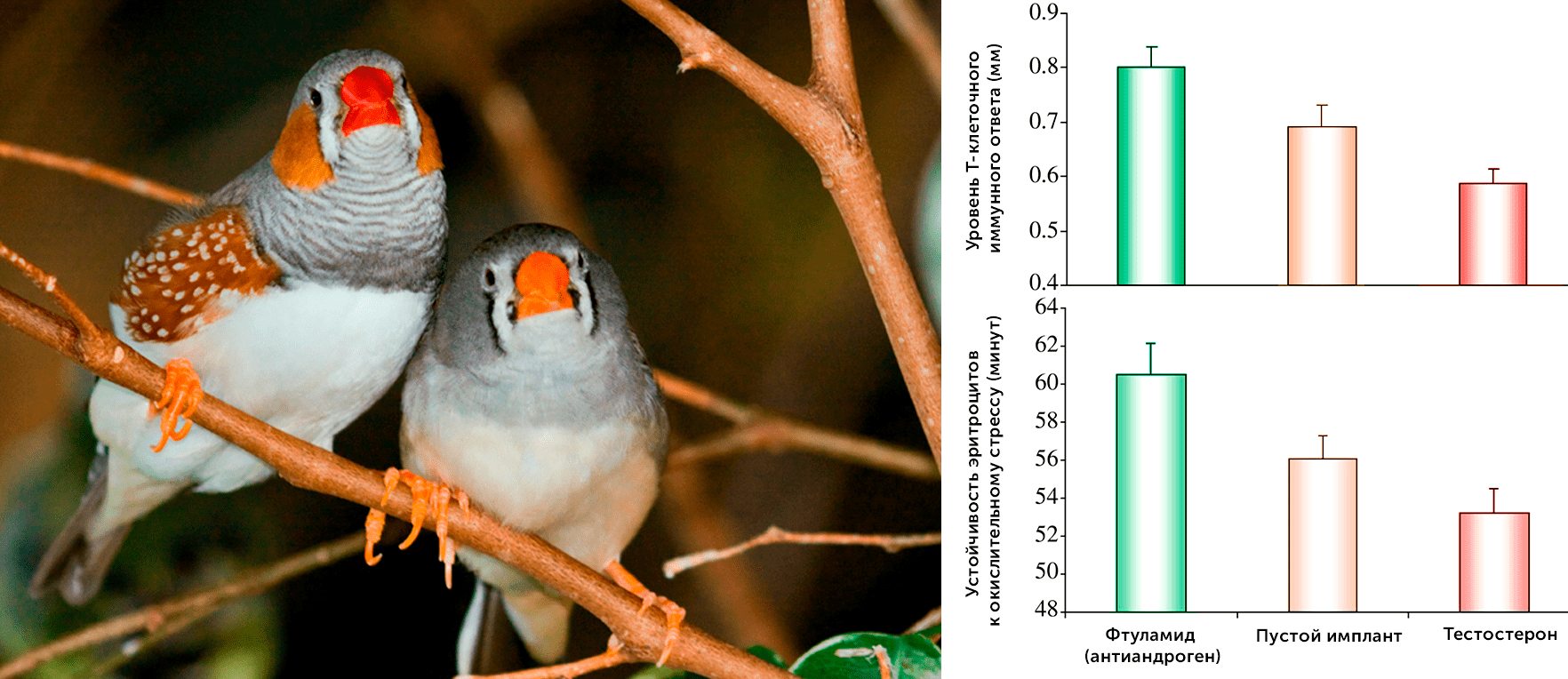
Рисунок 6. Слева: Пара зебровых амадин (Taeniopygia guttata), самец (слева) различимо выделяется более яркой окраской клюва и оперения, обусловленной действием мужских половых гормонов. Справа: Уровень иммунного ответа и устойчивость эритроцитов к оксидативному стрессу в зависимости от типа используемого импланта у подопытных зебровых амадин.
В качестве свидетельства в поддержку гипотезы «темной стороны» репродуктивного успеха у людей можно привести данные наблюдательного ретроспективного исследования о продолжительности жизни евнухов — мужчин, испытывающих на протяжении жизни недостаток тестостерона в результате кастрации. По генеалогическим записям исследователи изучили продолжительность жизни 81 евнуха, живших в Корее в XVI–XIX-х веках, и сравнили с продолжительностью жизни мужчин, принадлежащих к привилегированным семействам того же периода, но не подвергавшихся кастрации. Сопоставив данные, ученые подсчитали, что в среднем евнухи жили на 15–20 лет дольше (рис. 7) [12].
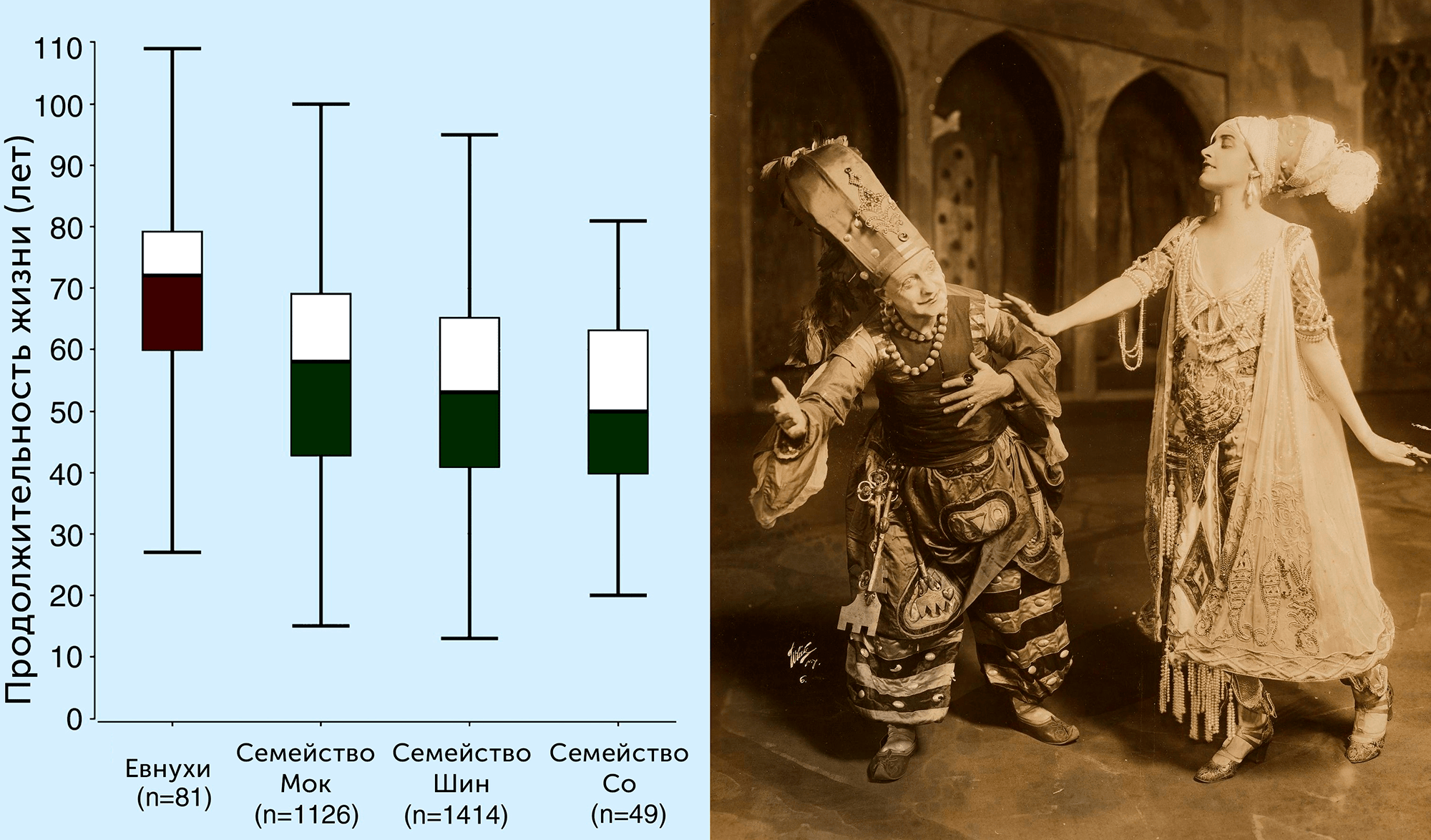
Рисунок 7. Слева: Сравнение продолжительности жизни корейских евнухов и представителей трех привилегированных семейств, по результатам анализа данных генеалогических записей с 1547 по 1861 годы. Справа: Актерский дуэт Энрико Чекетти и Флор Ревалес в ролях Евнуха и Забейды в постановке «Шехеразада».
C другой стороны, женские половые гормоны — эстрогены, — наоборот, способствуют снижению воспаления за счет того, что сокращают время, затрачиваемое макрофагами на воспалительный статус [13]. Было описано много эффектов положительного влияния эстрогенов на продолжительность жизни и снижение риска сердечно-сосудистых заболеваний [14]. Также было показано, что обработка клеточных культур эстрогенами in vitro снижала уровень клеточной гибели, вызванной окислительным стрессом [15].
Парадокс смертности-заболеваемости
Описанное выше плейотропное (множественное) действие половых гормонов может дать зацепку к объяснению так называемого парадокса смертности-заболеваемости. Наблюдаемый эффект состоит в том, что женщины, хоть и живут дольше мужчин, но в более позднем возрасте больше страдают различными заболеваниями, чаще обращаются к врачам и оценивают свое здоровье хуже, чем мужчины соответствующего возраста [16].
Но, если взглянуть на разницу в смертности между мужчинами и женщинами в четырех странах Европы (Дания, Норвегия, Швеция и Финляндия) за 1950–2005 годы в шести возрастных группах, можно заметить, что различие в смертности между мужчинами и женщинами достигает своих максимумов в репродуктивном возрасте, когда действие половых гормонов выражено наиболее ярко, а затем снова спадает к 65–84 годам (рис. 8) [16].
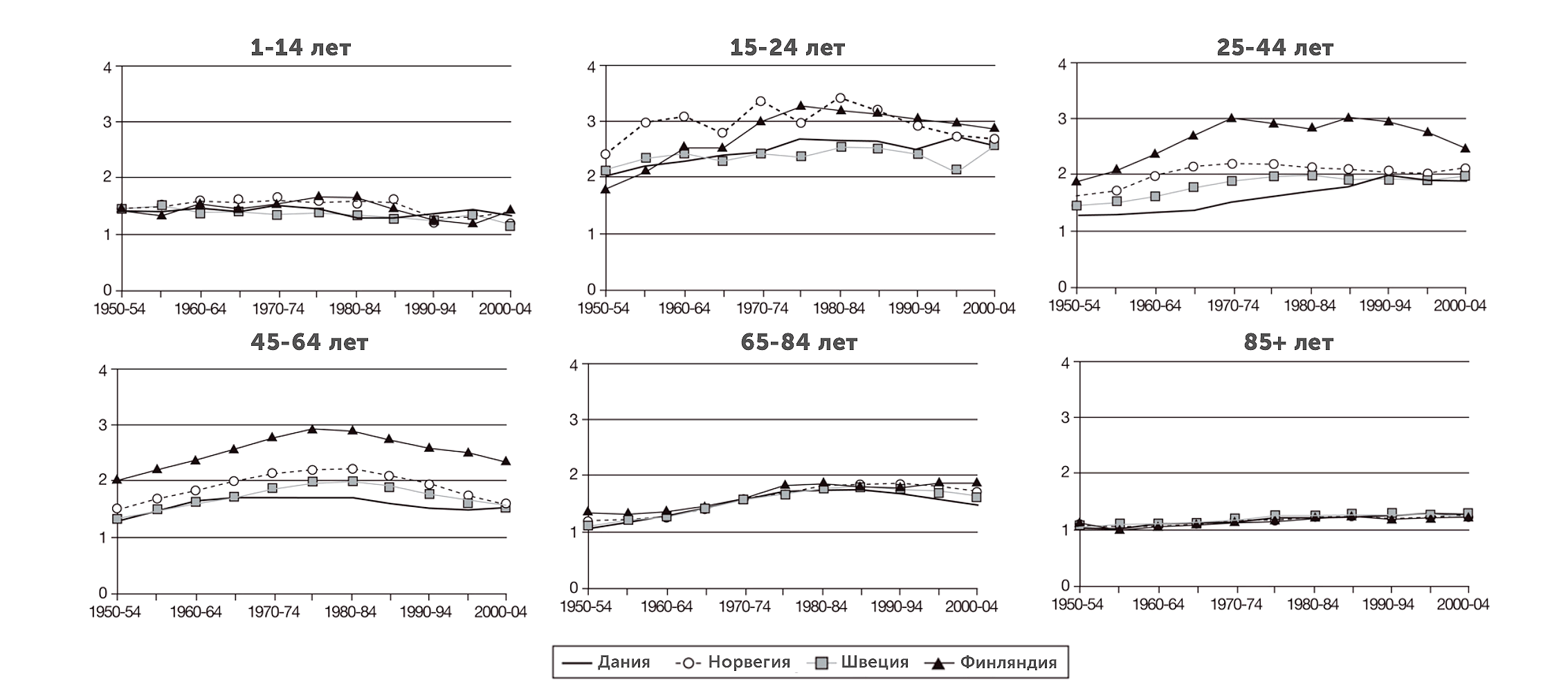
Рисунок 8. Разница в смертности между мужчинами и женщинами в различных возрастных группах в Дании, Норвегии, Швеции и Финляндии за 1950–2005 годы. Единица по вертикали соответствует одинаковой смертности у мужчин и женщин, а значение «2» означает в два раза бóльшую смертность среди мужчин в указанный период.
В эти данные вполне вписываются наблюдения средних уровней половых гормонов на протяжении жизни мужчин и женщин [17]. На рисунке 9 можно видеть, что мужчины подвергаются воздействию практически стабильного уровня тестостерона на протяжении всей жизни, в то время как у женщин, напротив, к наступлению менопаузы достаточно резко падает уровень эстрадиола, что может объяснять ухудшение самочувствия за счет снижения защитного эффекта от воспаления и окислительного стресса.
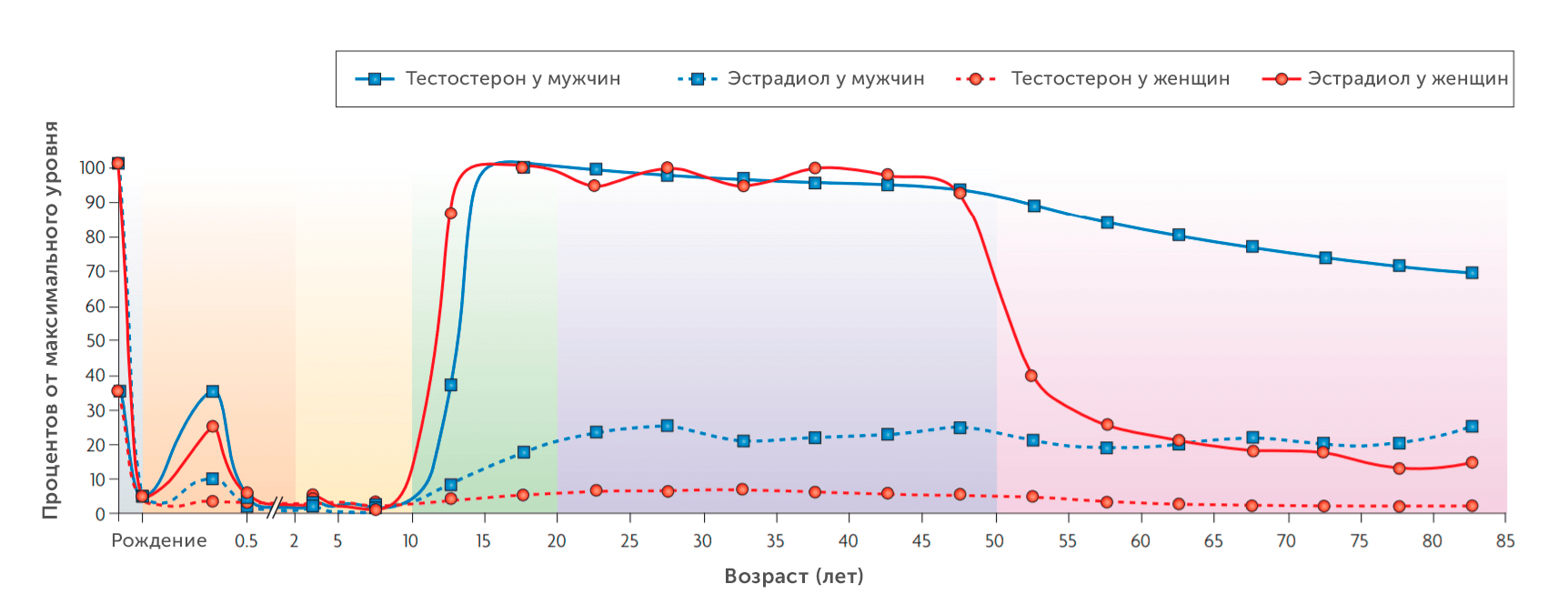
Рисунок 9. Приблизительные средние уровни половых стероидов в плазме у мужчин и женщин на протяжении жизни
«Эффект бабушки» и групповой отбор
Интересно, что само существование менопаузы как признака достоверно подтверждено у людей и еще только у нескольких видов млекопитающих. И это подводит нас к рассмотрению очень странного, с эволюционной точки зрения, феномена — пострепродуктивной продолжительности жизни .
На этот счет есть и альтернативное мнение, говорящее о том, что пострепродуктивная продолжительность жизни — это общая черта всех млекопитающих [18]. Однако, если брать не абсолютные показатели, а среднюю долю пострепродуктивных лет, прожитых особями в популяции, статистически значимые результаты до сих пор получали лишь для нескольких видов [20].
Как правило, большинство животных в диких условиях сохраняют возможность производить потомство на продолжении всей жизни, но женщины и самки нескольких видов зубатых китов [18] достаточно большую часть жизни проживают уже после потери репродуктивной функции. По этому показателю люди — абсолютные чемпионы, доля так называемых пострепродуктивных лет у женщин в среднем составляет не менее 30% [20].
Исследование, опубликованное в январе 2018 в журнале Ecology and evolution, обобщает данные о продолжительности жизни 52 видов плацентарных млекопитающих, измеряя отношение среднего количества лет жизни самок после завершения репродуктивного периода к их общей продолжительности жизни. Распределение получилось действительно неожиданным, с большим отрывом лидировали три вида: люди, косатки и короткоплавниковые гринды (млекопитающее из семейства дельфиновых). Доля пострепродуктивных лет жизни у всех трех видов составила более четверти от общих лет жизни, тогда как у всех остальных она мало отличалась от нуля (рис. 10) [21].
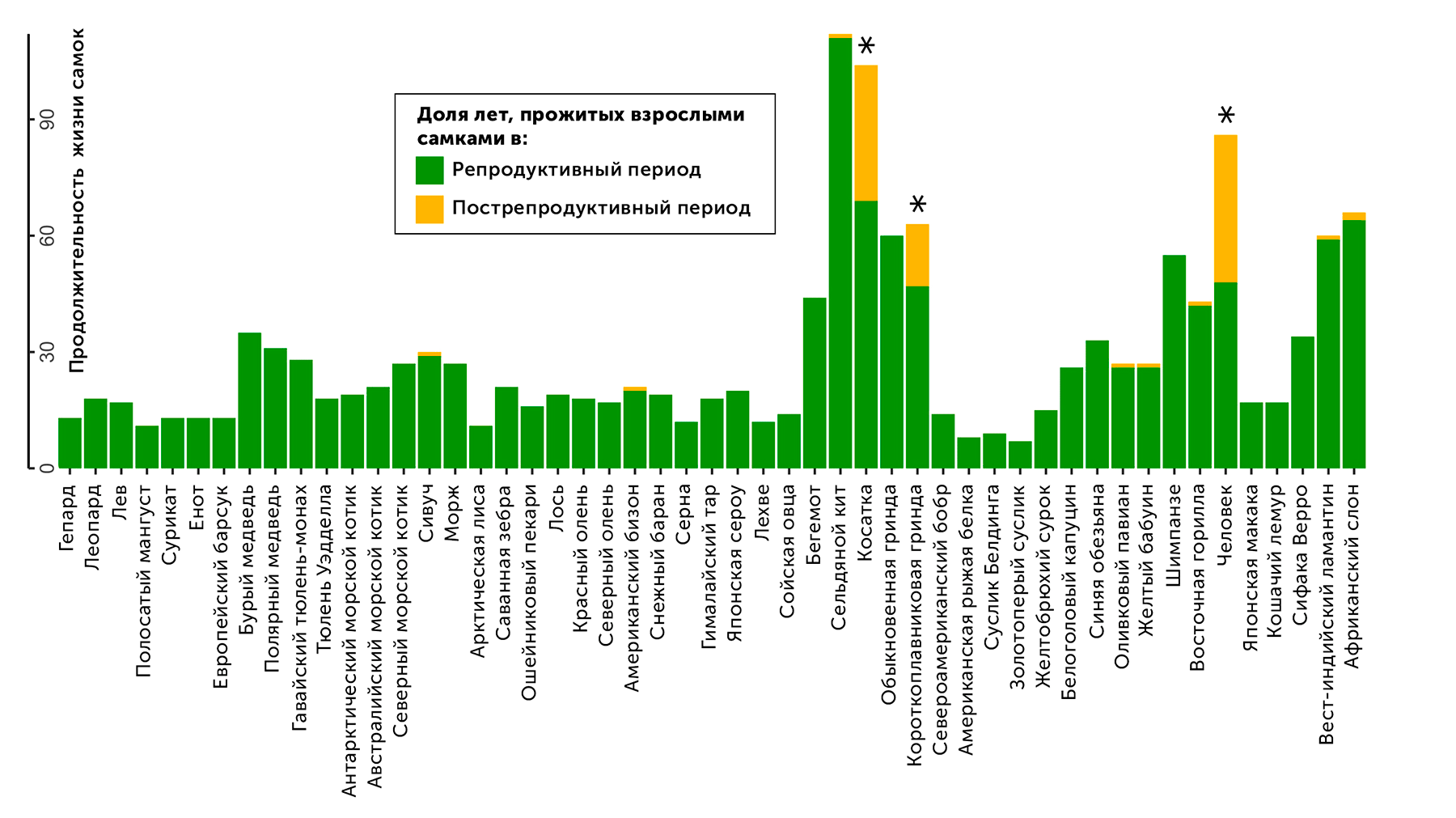
Рисунок 10. Доля пострепродуктивных лет жизни различных видов млекопитающих. Высота столбиков диаграммы — максимальная продолжительность жизни самок разных видов, желтая часть столбиков — доля пострепродуктивной продолжительности жизни.
Если оценивать успешность особи по количеству потомства, то может показаться странным, что в популяциях закрепляются гены, способствующие прекращению репродуктивной функции животных задолго до их смерти, ведь особи, обладающие такими генами, будут оставлять меньше детей.
Для объяснения этого парадокса была предложена гипотеза «эффекта бабушки», согласно которой самки старшего поколения в социальных видах, живущих группами, могут увеличивать количество копий своих генов в популяции, не размножаясь сами, а способствуя размножению и выживаемости своих потомков, например, помогая выкармливать внуков [22].
В 2019 году были опубликованы данные о наблюдении за 379 косатками в период с 1979 по 2015 годы, которые довольно убедительно свидетельствуют в пользу этой гипотезы. Похоже, что пожилые пострепродуктивные самки косаток вносят серьезный вклад в выживаемость родственников, поскольку риск смерти внуков в результате гибели бабушек у этих китов увеличивался до 4,5 раз (рис. 11) [23].
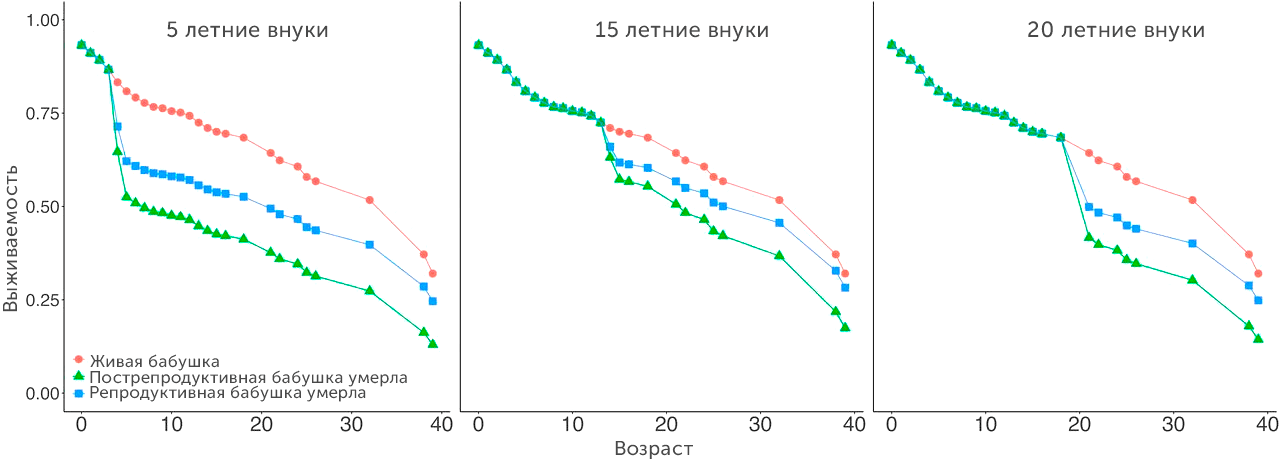
Рисунок 11. Сравнение выживаемости (по вертикали) косаток в трех возрастных когортах: 5, 15 и 20 лет. Каждая когорта разделена на три группы: косатки с живыми бабушками (красные точки), косатки, у которых погибла репродуктивная бабушка (синие квадраты), и косатки, у которых погибла пострепродуктивная бабушка (зеленые треугольники).
Но если выгода от существования не размножающихся бабушек так велика, то почему тогда пострепродуктивная продолжительность жизни не распространена среди всех социальных видов?
Чтобы ответить на этот вопрос, необходимо вспомнить одно из главных правил родственного отбора — правило Гамильтона. Оно гласит, что любое альтруистическое поведение среди животных возможно, когда доля их общих генов превышает коэффициент риска непередачи собственных генов для того животного, которое совершает акт «альтруизма». Например, помощь в спасении внука будет оправдана, если она связана с не более чем 50% риском смерти собственных детей, поскольку каждый внук имеет 25% генов бабушки.
Исходя из правила Гамильтона, можно предположить, что, если со временем родство между пожилыми самками и самцами в группе будет возрастать, то пожилым самкам станет невыгодно вкладывать свои ресурсы в конкуренцию за самцов с молодыми самками [27]. В таком случае пожилые самки смогут эффективнее увеличивать долю своих генов в популяции, выкармливая и ухаживая внучатое потомство и тем самым положительно влияя на его выживаемость. Похоже, что такие процессы развивались у косаток и людей двумя разными путями, но привели к одинаковому результату.
У людей за увеличение родства женщин с мужчинами внутри своей группы, судя по всему, отвечает асимметрия в расселении, происходящем преимущественно за счет женского пола. По достижении зрелости женщина покидает свою родную группу и присоединяется к группе мужчины, с которым производит потомство, что в социальной антропологии называется патрилокальностью (рис. 13).
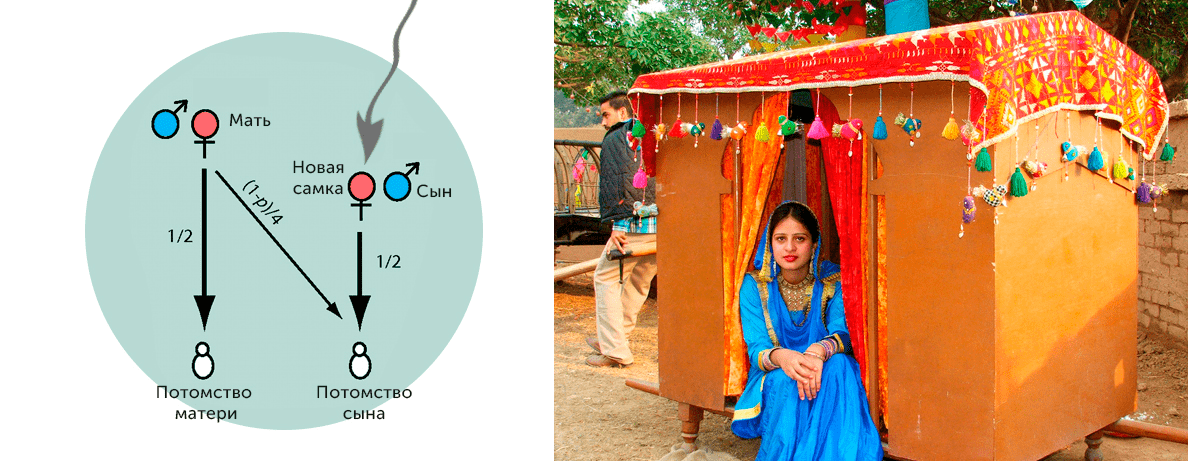
Рисунок 13. Слева: Схематичное изображение принципа репродуктивного конфликта в патрилокальном сообществе. Если старшая самка имеет сыновей, живущих в одной с ней группе, то ее родство с потомством от любой новой самки будет равно (1–p)/4, где p — вероятность того, что отцом был не ее сын. Если родившиеся в группе самки будут покидать ее по достижению репродуктивного возраста, то доля общих генов с самцами группы для старшей самки будет только увеличиваться, что с увеличением возраста самки делает конкуренцию все менее выгодной, более эволюционно выгодным для нее становится уход за потомством сыновей. Справа: Традиционная деревянная повозка (доли), в которой невесту везут в дом ее мужа. Чандигарха, Индия, 2005 год.
Даже сейчас в большинстве современных культур жены гораздо чаще проживают на территории родственников жениха, чем наоборот [28], что находит свое отражение также и в языковых нормах некоторых европейских стран. Например, в русском сохраняются свидетельства такого неравенства в виде фраз, обозначающих вступление в брак для женщины — «выйти замуж», а для мужчины — «взять в жены», аналогичные конструкции присутствуют в польском и венгерском языках.
Патрилокальность у людей подтверждается также и данными генетических исследований, показывающих, что географическая вариабельность Y-хромосомы, наследуемой от отцов, значительно меньше, чем разнообразие митохондриальной ДНК, получаемой только от матери [29], [30].
Косатки, в отличие от людей, не уходят жить в другую группу, у них возрастание родства обеспечивается за счет внегруппового спаривания. Самцы косаток практически всегда спариваются вне своей группы, поэтому родство среди самок группы сохраняется стабильно высоким, ведь дочери всегда живут с матерями, а родство самок с самцами группы увеличивается за счет рождающихся в группе самцов. Данные, полученные в результате наблюдения за популяцией из 200 косаток, показали, что максимум родства с мужскими особями в группе у самок примерно совпадает с возрастом 39 лет, когда 95% косаток прекращают воспроизводство (рис. 14) [32].
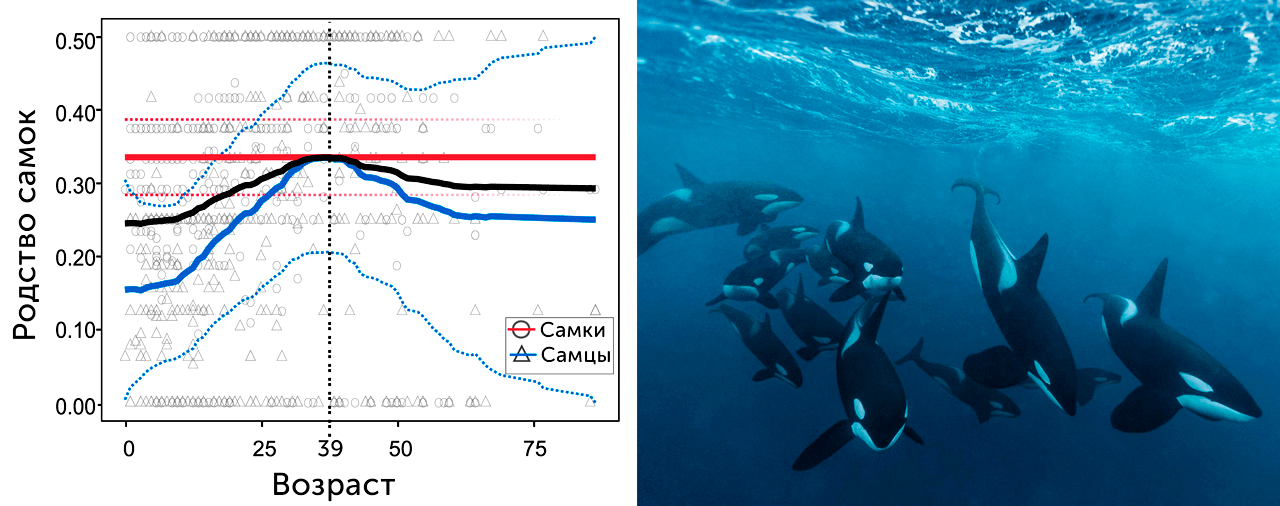
Рисунок 14. Слева: Степень родства самок, полученная из результатов наблюдения за группами косаток. Справа: Группа косаток, охотящихся на сельдь в норвежском Анд-фьорде.
«Проклятие матери» и два генома в одной клетке
Помимо неравенства родства внутри групп, действующего только для некоторых социальных видов, существует и гораздо более универсальная асимметрия, которая может вносить вклад в разницу в продолжительности жизни полов. Это разница в наследовании части генома — митохондриальной ДНК.
По современным представлениям, ядерные клетки животных появились в результате симбиоза архей и поселившихся внутри них протеобактерий, которые в результате совместной эволюции превратились в митохондрии — органеллы, отвечающие за выработку энергии в виде молекул АТФ [33].
В то же время митохондрии не полностью утратили независимость, сохранив часть собственного генетического материала. Примерно 37 из 1000 необходимых для работы митохондрии генов по-прежнему находятся внутри самих митохондрий в виде характерной для бактерий кольцевой хромосомы. По этой причине критически важная часть метаболизма клетки всецело зависит от того, насколько слаженно работают вместе два генома: ядерный и митохондриальный (рис. 15) [34].
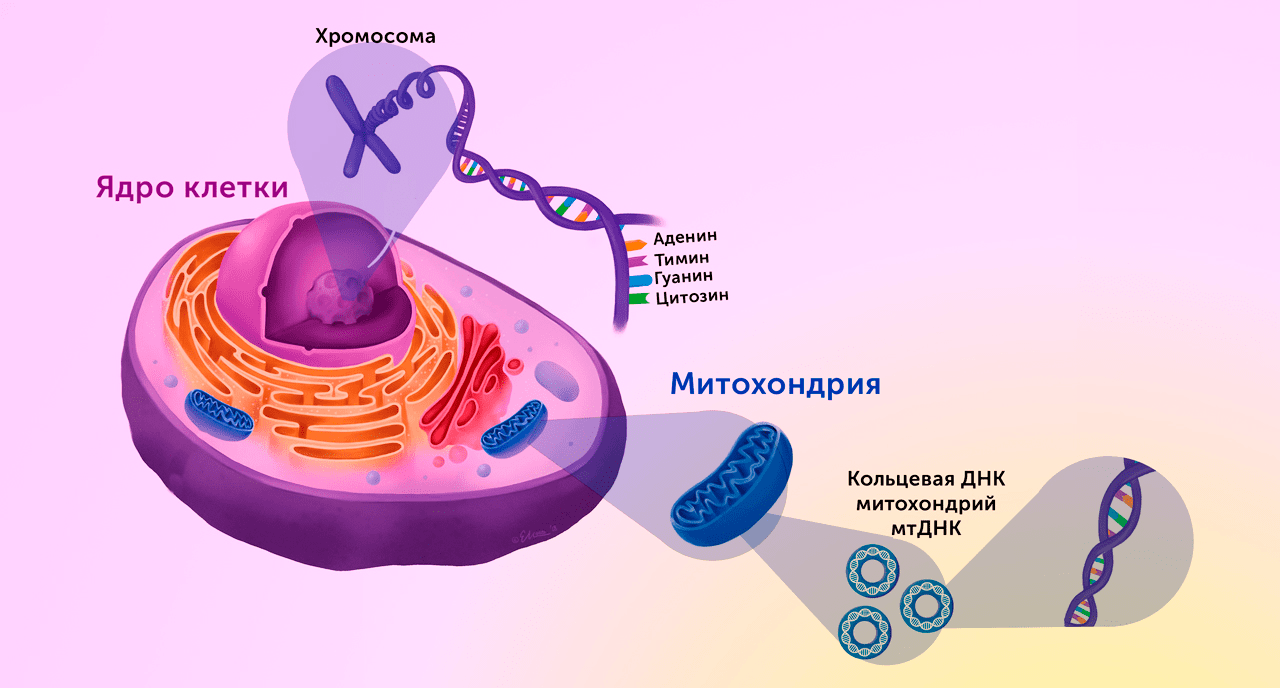
Рисунок 15. Схематические различия между ДНК, находящейся в ядре клетки (верхняя левая часть рисунка), и митохондриальной ДНК (нижняя правая часть рисунка). Пропорции не соответствуют реальным.
Elizabeth Moss, рисунок адаптирован
Но поскольку у подавляющего большинства животных после оплодотворения митохондрии мужской половой клетки подвергаются уничтожению [35], наследование митохондриального генома происходит только по материнской линии. Этот факт привел исследователей к гипотезе, согласно которой мутации в митохондриальной ДНК, ответственные за плохую совместную работу с геномом мужчин, но не женщин, не могут эффективно удаляться естественным отбором и передаются сыновьям от своих здоровых матерей, благодаря чему этот эффект и получил название «Проклятие матери» [36].
В работе 2017 года, опубликованной в журнале Nature, исследователи из Канады и Франции проанализировали подробные генеалогические записи о жизни колонизаторов Квебека (Канада) и восстановили цепочку такого «проклятия» до первой носительницы, прибывшей в Канаду во второй половине XVII века в составе так называемых Filles du Roy .
Filles du Roy в переводе с французского означает «дочери короля». Это девушки, призванные для переселения из Франции в новую канадскую колонию по социальной программе, утвержденной королем Людовиком XIV и финансирующей переселение и оплату приданного для иммигранток из государственной казны.
Само проклятие состояло в наследовании особой мутации митохондриальной ДНК — T14484C, вызывающей оптическую нейропатию Лебера и потерю зрения. Мутация эта передавалась преимущественно по женской линии. При этом мужчины были носителями этой мутации в 8 раз чаще, чем женщины, а смертность мальчиков, родившихся с этим отклонением, была в два раза выше, чем у девочек (рис. 16) [37].
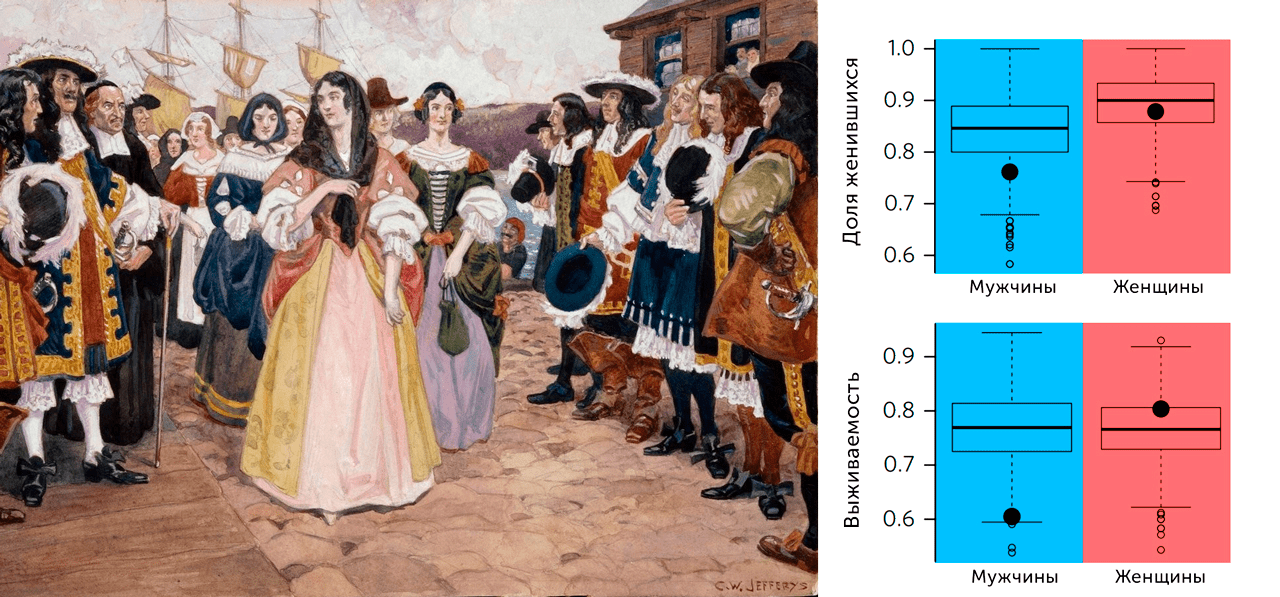
Рисунок 16. Слева: Картина, иллюстрирующая прибытие в 1667 году в Квебек Filles du Roy. Справа: Результаты анализа генеалогических записей, благодаря которым было установлено, что первой носительницей мутации T14484C, ответственной за возникновение около 89% случаев наследственной оптической нейропатии Лебера среди населения Квебека, была одна из Fille du Roy. Также было продемонстрировано, что данная мутация получила возможность сохраняться в популяции, поскольку была гораздо менее вредна для женского пола, чем для мужского.
Незащищенная X. Потерянная и токсичная Y
Как правило, половые различия на уровне архитектуры генома состоят в том, что у одного из полов одна из хромосомных пар, отвечающая за половое развитие, состоит из двух разных (негомологичных) хромосом.
Например, если у женщин все 23 пары хромосом имеют примерно одинаковый состав и строение, то у мужчин одна хромосома в 23 паре имеет существенные отличия (рис. 17). Поэтому у женщин 23 пара обозначается «XX», а у мужчин — «XY», то есть мужской пол является гетерогаметным (от греч. ἕτερος — «иной, различный»).
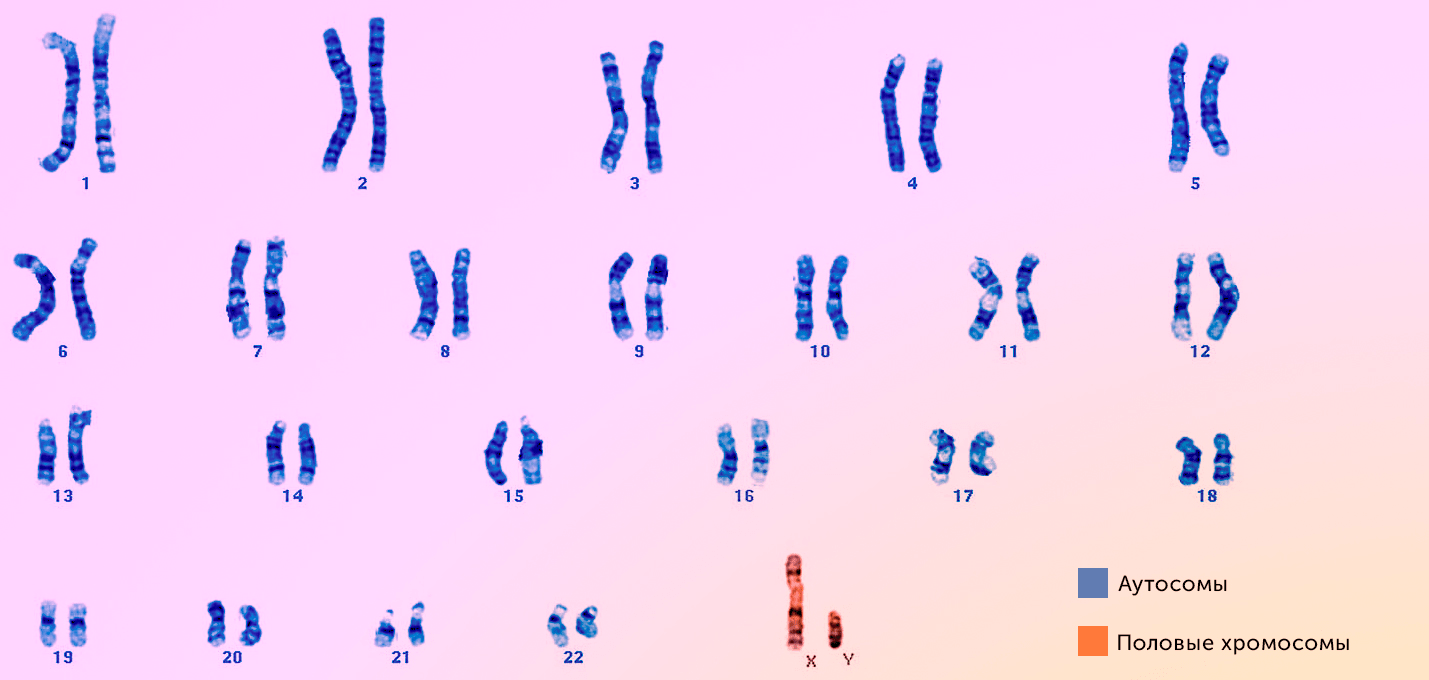
Рисунок 17. Полученная методом окрашивания G-banding микрофотография 23 пар хромосом, составляющих кариотип человека. Присутствие в последней паре Y-хромосомы указывает на соответствие кариотипа мужскому полу.
Departments of Laboratory Medicine and Pathology, рисунок адаптирован
Как мы знаем из курса школьной биологии, при формировании половых клеток хромосомы в них попадают не парами, а исключительно по одиночке. Такие одинарные хромосомы представляют собой смесь из аналогичных фрагментов двух гомологичных хромосом родительской диплоидной клетки. Этот процесс смешивания, называемый кроссинговером, можно сравнить с тем, как если бы два человека отдавали части своего гардероба, чтобы одеть третьего. Например, от одного человека достается шапка и шарф, от другого — куртка и ботинки, благодаря этому у эволюции появляется возможность проверить, как эти детали гардероба (гены) смотрятся вне своих комплектов, ведь они могут составить новую, более удачную комбинацию.
Тогда хромосомы в паре XY можно сравнить с очень по-разному одетыми людьми, например, с космонавтом и балериной, элементы гардероба которых практически не подходят друг другу, за исключением очень небольших деталей. Поэтому в кроссинговере участвует не более 3% от общей генетической информации, содержащейся в X- и Y-хромосомах. Следовательно, в половые клетки мужчин попадает практически не «перемешанная» либо X-, либо Y-хромосома. А значит, если рождается мальчик, то его Y-хромосома является исключительно наследством от папы. Наследование Y-хромосомы только по мужской линии имеет свои плюсы. Благодаря этому Y-хромосома может быть удобным местом для закрепления генов, полезных для мужского пола, в противовес эффекту «Проклятия матерей» [38].
В то же время, гетерогаметность можно назвать «ахиллесовой пятой» мужчин сразу по нескольким причинам (рис. 19). Во-первых, если женский пол при наличии вредной мутации в одной из копий Х-хромосомы может взять нормально функционирующий вариант гена (аллель) из второй копии, то у гетерогаметного пола такая защита от вредных мутаций отсутствует, поэтому целый ряд заболеваний, связанных с генами, находящимися на Х-хромосоме (дальтонизм, гемофилия и др.), гораздо более распространены у мужчин, чем у женщин [40].
Еще одна не самая лучшая сторона Y-хромосомы человека состоит в том, что она содержит примерно в пять раз больше специфических для человека транспозонов — генетических мобильных элементов, многие из которых подобно безбилетникам встраивались в нашу ДНК на протяжении эволюции [41]. Эти вирусоподобные ДНК в норме не активны и выключены с помощью плотной упаковки на специальных белковых молекулах — гистонах. Но транспозоны могут вносить свой вклад в старение организма, со временем освобождаясь от метильных меток и перескакивая в другие участки генома [42], что может нарушать работу генов и становится причиной мутаций, различных заболеваний и повышенного риска развития рака у мужчин [43].
Третья Y-беда — это возрастная потеря Y-хромосомы в клетках организма, которая распространена у пожилых мужчин и до недавнего времени считалась «здоровым» механизмом старения. Но исследование 2017 года, опубликованное в журнале Nature genetics, показало, что потеря Y-хромосомы в клетках крови у 1153 пожилых мужчин была ассоциирована с почти в два раза более высоким риском смерти и снижением продолжительности жизни в среднем на 5,5 лет [44].
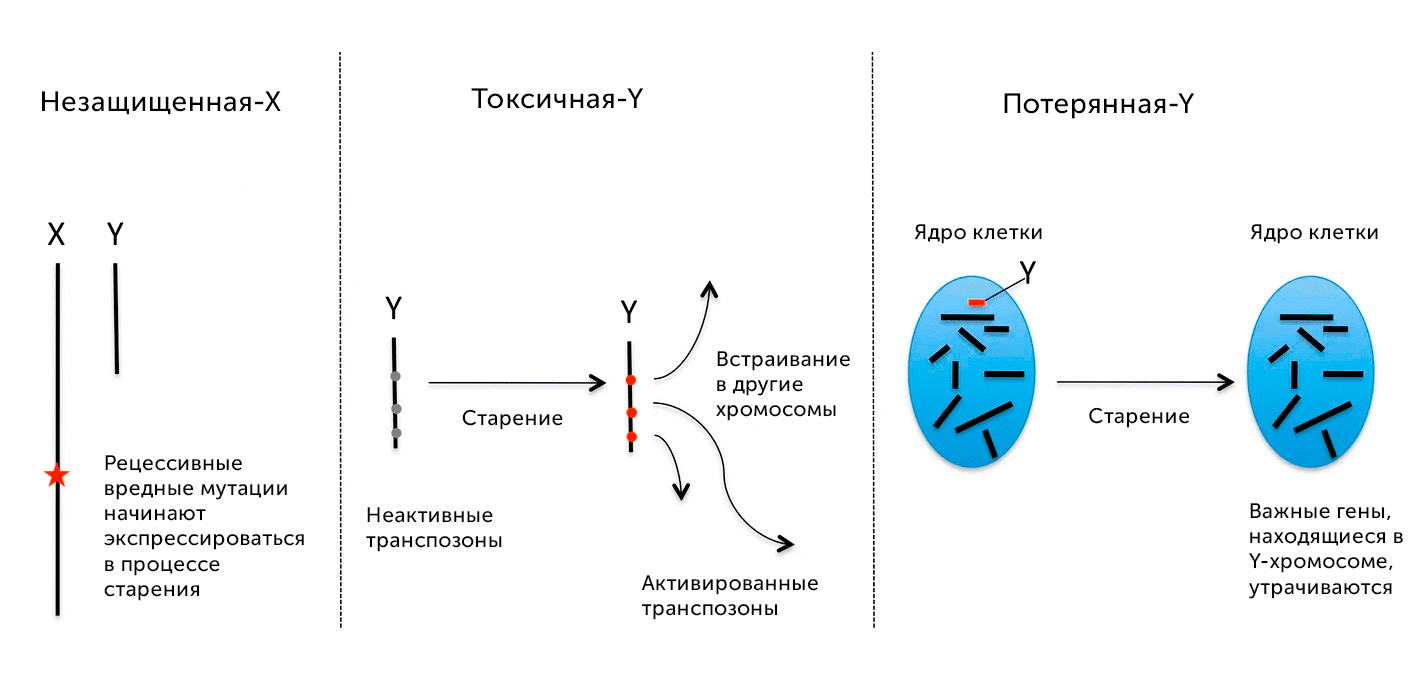
Рисунок 19. Три основных гипотезы, связанные с вредным влиянием Y-хромосомы, проявляющимся в процессе старения
В марте 2020-го исследователи из университета Нового Южного Уэльса представили довольно убедительные данные в пользу гипотезы о вкладе гетерогаметности в разницу в продолжительности жизни между полами. Анализ информации о продолжительности жизни самцов и самок 229 видов из 99 семейств и 38 отрядов показал, что гомогаметный пол в среднем живет на 17,6% дольше [46].
Важно отметить, что далеко не всегда самцы — это гетерогаметный пол. У некоторых видов гетерогаметны самки. Интересно, что в этих случаях самцы хоть и имеют преимущество в продолжительности жизни, но в среднем оно значительно меньше, чем в случае с гомогаметностью самок — 7,1% против 20,9%, что продемонстрировано на графике ниже (рис. 20).
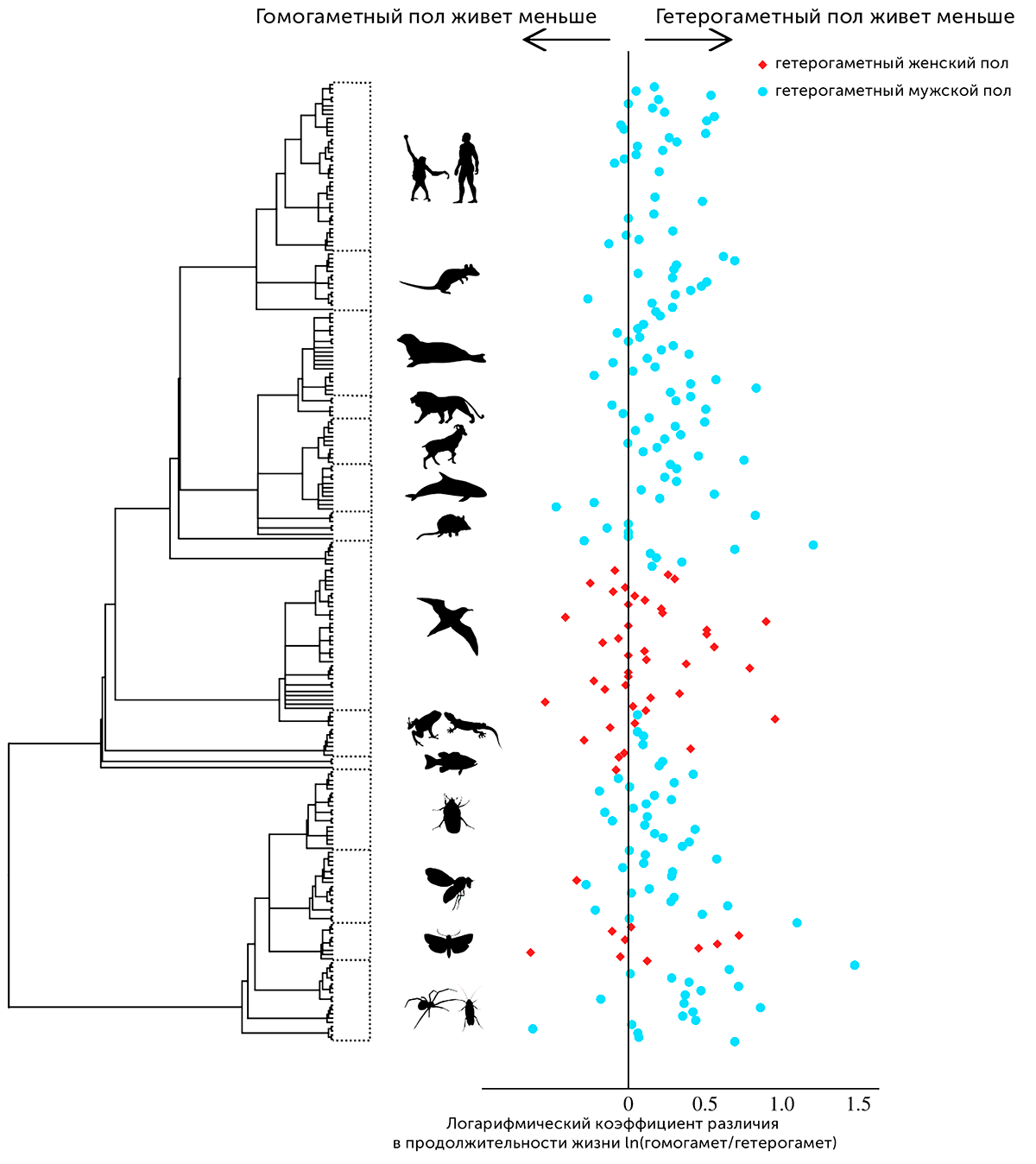
Рисунок 20. Результат обработки данных, демонстрирующий разницу в продолжительности жизни между гетерогаметным и гомогаметным полом у различных видов. Синие кружочки — гетерогаметный мужской пол, красные ромбы — гетерогаметный женский пол.
Заключение
На половые различия в продолжительности жизни влияют сразу несколько факторов, включая особенности группового и полового отборов, наличие плейотропных генов и строение генома каждого вида. Определение вклада каждого из этих факторов представляется очень интересной и непростой исследовательской задачей.
Хорошие новости в том, что люди как вид состоят в небольшом клубе вместе с еще всего несколькими социальными млекопитающими, сумевшими избавиться от естественных хищников и попавшими в условия, при которых стало возможным увеличение количества копий генов в популяции с увеличением возраста. Благодаря этому естественный отбор получил возможность эффективнее очищать вредные мутации, проявляющиеся у нас в старости.
И хотя мы стоим на правильной эволюционной дорожке, хочется верить, что человечеству с помощью его интеллекта удастся распутать хитросплетения механизмов, вызывающих старение, окончательно обойдя в этом вопросе другие виды. Возможно, мы уже сейчас стоим на пороге открытия, способного значительно увеличить продолжительность жизни человека.
Литература
- Aleksandr Zenin, Yakov Tsepilov, Sodbo Sharapov, Evgeny Getmantsev, L. I. Menshikov, et. al.. (2019). Identification of 12 genetic loci associated with human healthspan. Commun Biol. 2;
- Population ages 65 and above (% of total population). (2019). World Bank;
- Ageing. (2019). United Nations;
- Steven N. Austad, Kathleen E. Fischer. (2016). Sex Differences in Lifespan. Cell Metabolism. 23, 1022-1033;
- Gabriel A.B. Marais, Jean-Michel Gaillard, Cristina Vieira, Ingrid Plotton, Damien Sanlaville, et. al.. (2018). Sex gap in aging and longevity: can sex chromosomes play a role?. Biol Sex Differ. 9;
- Jean-François Lemaître, Victor Ronget, Morgane Tidière, Dominique Allainé, Vérane Berger, et. al.. (2020). Sex differences in adult lifespan and aging rates of mortality across wild mammals. Proc Natl Acad Sci USA. 117, 8546-8553;
- World Health Statistics 2016: Monitoring health for the SDGs. (2016). WHO;
- Maria João Fernandes Martins, T. Markham Puckett, Rowan Lockwood, John P. Swaddle, Gene Hunt. (2018). High male sexual investment as a driver of extinction in fossil ostracods. Nature. 556, 366-369;
- R. Bonduriansky, A. Maklakov, F. Zajitschek, R. Brooks. (2008). Sexual selection, sexual conflict and the evolution of ageing and life span. Functional Ecology. 22, 443-453;
- A. M. Bronikowski, J. Altmann, D. K. Brockman, M. Cords, L. M. Fedigan, et. al.. (2011). Aging in the Natural World: Comparative Data Reveal Similar Mortality Patterns Across Primates. Science. 331, 1325-1328;
- Carlos Alonso-Alvarez, Sophie Bertrand, Bruno Faivre, Olivier Chastel, Gabriele Sorci. (2007). Testosterone and oxidative stress: the oxidation handicap hypothesis. Proc. R. Soc. B.. 274, 819-825;
- Kyung-Jin Min, Cheol-Koo Lee, Han-Nam Park. (2012). The lifespan of Korean eunuchs. Current Biology. 22, R792-R793;
- Alessandro Villa, Nicoletta Rizzi, Elisabetta Vegeto, Paolo Ciana, Adriana Maggi. (2015). Estrogen accelerates the resolution of inflammation in macrophagic cells. Sci Rep. 5;
- James P Stice, Jennifer S Lee, Angela S Pechenino, Anne A Knowlton. (2009). Estrogen, aging and the cardiovascular system. Future Cardiology. 5, 93-103;
- Val Mann, Christene Huber, Giolanta Kogianni, Frances Collins, Brendon Noble. (2007). The antioxidant effect of estrogen and Selective Estrogen Receptor Modulators in the inhibition of osteocyte apoptosis in vitro. Bone. 40, 674-684;
- Anna Oksuzyan, Knud Juel, James W. Vaupel, Kaare Christensen. (2008). Men: good health and high mortality. Sex differences in health and aging. Aging Clin Exp Res. 20, 91-102;
- Carole Ober, Dagan A. Loisel, Yoav Gilad. (2008). Sex-specific genetic architecture of human disease. Nat Rev Genet. 9, 911-922;
- Alan A. Cohen. (2004). Female post-reproductive lifespan: a general mammalian trait. Biol. Rev.. 79, 733;
- Samuel Ellis, Daniel W. Franks, Stuart Nattrass, Thomas E. Currie, Michael A. Cant, et. al.. (2018). Analyses of ovarian activity reveal repeated evolution of post-reproductive lifespans in toothed whales. Sci Rep. 8;
- Daniel A Levitis, Laurie Bingaman Lackey. (2011). A measure for describing and comparing postreproductive life span as a population trait. Methods in Ecology and Evolution. 2, 446-453;
- Samuel Ellis, Daniel W. Franks, Stuart Nattrass, Michael A. Cant, Destiny L. Bradley, et. al.. (2018). Postreproductive lifespans are rare in mammals. Ecol Evol. 8, 2482-2494;
- Peter J. Lachmann. (2011). The Grandmother Effect. Gerontology. 57, 375-377;
- Stuart Nattrass, Darren P. Croft, Samuel Ellis, Michael A. Cant, Michael N. Weiss, et. al.. (2019). Postreproductive killer whale grandmothers improve the survival of their grandoffspring. Proc Natl Acad Sci USA. 116, 26669-26673;
- Norihiro Yagi, Eisuke Hasegawa. (2012). A halictid bee with sympatric solitary and eusocial nests offers evidence for Hamilton's rule. Nat Commun. 3;
- Changcao Wang, Xin Lu. (2018). Hamilton's inclusive fitness maintains heritable altruism polymorphism through rb = c. Proc Natl Acad Sci USA. 115, 1860-1864;
- Jamieson C. Gorrell, Andrew G. McAdam, David W. Coltman, Murray M. Humphries, Stan Boutin. (2010). Adopting kin enhances inclusive fitness in asocial red squirrels. Nat Commun. 1;
- Rufus A. Johnstone, Michael A. Cant. (2010). The evolution of menopause in cetaceans and humans: the role of demography. Proc. R. Soc. B.. 277, 3765-3771;
- Murdock G.P. Atlas of world cultures. University of Pittsburgh Pre, 1981. — 160 p.;
- Mark T. Seielstad, Eric Minch, L. Luca Cavalli-Sforza. (1998). Genetic evidence for a higher female migration rate in humans. Nat Genet. 20, 278-280;
- Rita Rasteiro, Pierre-Antoine Bouttier, Vítor C. Sousa, Lounès Chikhi. (2012). Investigating sex-biased migration during the Neolithic transition in Europe, using an explicit spatial simulation framework. Proc. R. Soc. B.. 279, 2409-2416;
- M. A. Cant, R. A. Johnstone. (2008). Reproductive conflict and the separation of reproductive generations in humans. Proceedings of the National Academy of Sciences. 105, 5332-5336;
- Darren P. Croft, Rufus A. Johnstone, Samuel Ellis, Stuart Nattrass, Daniel W. Franks, et. al.. (2017). Reproductive Conflict and the Evolution of Menopause in Killer Whales. Current Biology. 27, 298-304;
- Purificación López-García, Laura Eme, David Moreira. (2017). Symbiosis in eukaryotic evolution. Journal of Theoretical Biology. 434, 20-33;
- Jonci N. Wolff, Neil J. Gemmell. (2013). Mitochondria, maternal inheritance, and asymmetric fitness: Why males die younger. Bioessays. 35, 93-99;
- Peter Sutovsky, Klaus Van Leyen, Tod McCauley, Billy N Day, Miriam Sutovsky. (2004). Degradation of paternal mitochondria after fertilization: implications for heteroplasmy, assisted reproductive technologies and mtDNA inheritance. Reproductive BioMedicine Online. 8, 24-33;
- Neil J. Gemmell, Victoria J. Metcalf, Fred W. Allendorf. (2004). Mother's curse: the effect of mtDNA on individual fitness and population viability. Trends in Ecology & Evolution. 19, 238-244;
- Emmanuel Milot, Claudia Moreau, Alain Gagnon, Alan A. Cohen, Bernard Brais, Damian Labuda. (2017). Mother’s curse neutralizes natural selection against a human genetic disease over three centuries. Nat Ecol Evol. 1, 1400-1406;
- J. Arvid Ågren, Manisha Munasinghe, Andrew G. Clark. (2019). Sexual conflict through mother’s curse and father’s curse. Theoretical Population Biology. 129, 9-17;
- Molly Fox, Rebecca Sear, Jan Beise, Gillian Ragsdale, Eckart Voland, Leslie A. Knapp. (2010). Grandma plays favourites: X-chromosome relatedness and sex-specific childhood mortality. Proc. R. Soc. B.. 277, 567-573;
- Barbara R. Migeon. (2020). X-linked diseases: susceptible females. Genet Med. 22, 1156-1174;
- Wanxiangfu Tang, Seyoung Mun, Aditya Joshi, Kyudong Han, Ping Liang. (2018). Mobile elements contribute to the uniqueness of human genome with 15,000 human-specific insertions and 14 Mbp sequence increase. DNA Research. 25, 521-533;
- Emily J. Brown, Alison H. Nguyen, Doris Bachtrog. (2020). The Y chromosome may contribute to sex-specific ageing in Drosophila. Nat Ecol Evol. 4, 853-862;
- Sumadi Anwar, Wahyu Wulaningsih, Ulrich Lehmann. (2017). Transposable Elements in Human Cancer: Causes and Consequences of Deregulation. IJMS. 18, 974;
- Lars A Forsberg, Chiara Rasi, Niklas Malmqvist, Hanna Davies, Saichand Pasupulati, et. al.. (2014). Mosaic loss of chromosome Y in peripheral blood is associated with shorter survival and higher risk of cancer. Nat Genet. 46, 624-628;
- Gabriel A.B. Marais, Jean-Michel Gaillard, Cristina Vieira, Ingrid Plotton, Damien Sanlaville, et. al.. (2018). Sex gap in aging and longevity: can sex chromosomes play a role?. Biol Sex Differ. 9;
- Zoe A. Xirocostas, Susan E. Everingham, Angela T. Moles. (2020). The sex with the reduced sex chromosome dies earlier: a comparison across the tree of life. Biol. Lett.. 16, 20190867.