
Поднялась температура? Ваши бактерии уже в курсе
03 декабря 2013
Поднялась температура? Ваши бактерии уже в курсе
- 1732
- 0
- 1
Менингококки и один из РНК-термосенсоров
-
Автор
-
Редакторы
Грипп и другие простудные заболевания могут сопровождаться осложнениями. Причем осложнения чаще имеют бактериальную, а не вирусную природу, и могут вызываться как патогенными, так и условно патогенными микроорганизмами, которые без исходной посторонней инфекции продолжили бы спокойно сосуществовать с человеком в составе большого и сложного микробного сообщества, обосновавшегося в нашем организме. Причин перехода отдельных бактерий от мирного сосуществования к атаке на организм может быть множество, и далеко не все они хорошо изучены. Однако недавно удалось прояснить еще один из возможных механизмов такого явления.
До 20% человеческой популяции является носителями бактерии менингококка Neisseria meningitidis, которая обитает в носоглотке и не провоцирует никаких заболеваний, хотя потенциально способна вызывать менингит — воспаление оболочек головного и спинного мозга [1]. Известно, что вспышки менингита у людей в умеренных широтах часто следуют за сезонными эпидемиями гриппа [2], что указывает на то, что вирус гриппа может как-то «перенастраивать» менингококков с мирного существования в носоглотке на оккупацию мозговых оболочек.
Менингококк в состоянии противостоять действию иммунной системы за счет способности вырабатывать полисахаридную капсулу вокруг клетки, а также синтезировать сиаловую кислоту, которая тоже включается в бактериальную оболочку. Это препятствует работе защитной системы комплемента, блокируя ее активацию и не давая белковым мембраноатакующим комплексам перфорировать бактериальные мембраны [3]. Неясно было, зачем эволюция поддержала такую агрессивную систему противодействия иммунитету у микроорганизма, который способен жить на слизистых, не вызывая воспалений и не попадая в кровь.
Сопоставить все факты и сложить картину воедино смогли коллективы ученых из Лондона, Оксфорда и Ноттингема. Оказалось, что менингококку приходится обороняться от иммунитета именно в тех случаях, когда в носоглотку проникают другие патогены, вызывая ответную реакцию организма, поскольку эта реакция затрагивает и менингококков [4]. Фактором, запускающим у бактерии синтез полисахаридной капсулы и сиаловой кислоты, оказывается температура, которая во время вирусной инфекции повышается. На повышение температуры у бактерии реагируют так называемые РНК-термосенсоры. Это последовательности в ряде матричных РНК бактерии, которые при пониженной в норме температуре носоглотки образуют шпильки, а при повышении температуры расплетаются. Находятся эти термосенсоры именно в матричных РНК генов локуса cps, ответственных за синтез оболочки. Шпилька термосенсора при нормальной для носоглотки температуре не дает мРНК связываться с рибосомой, блокируя тем самым синтез белка. При повышении температуры белки синтезируется, и запускается образование оболочки.
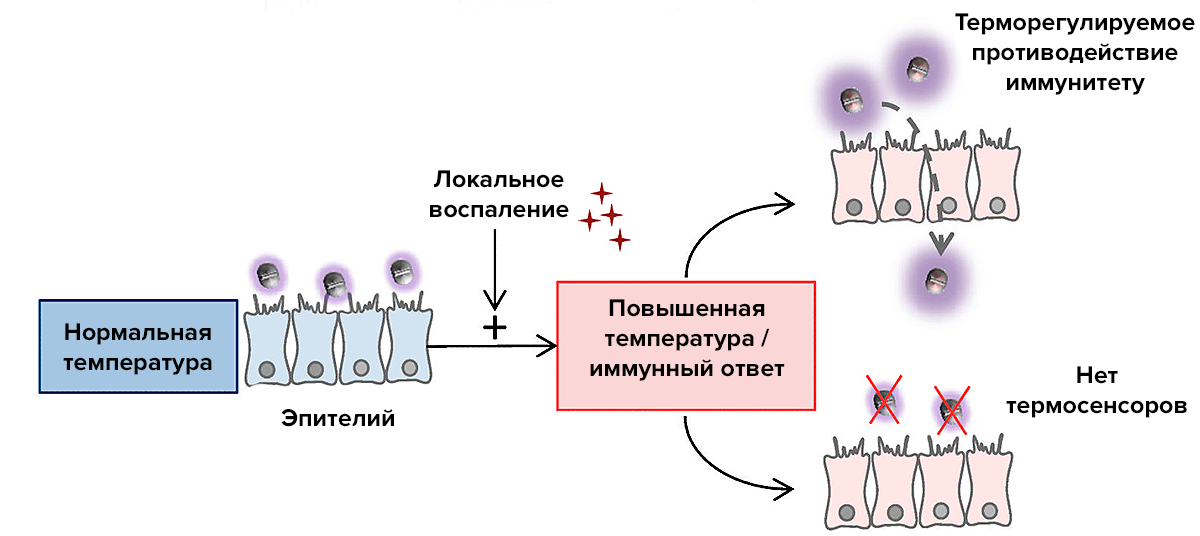
Рисунок 1. Общая схема реакции менингококков на повышение температуры при инфекции гриппа
[4], рисунок адаптирован
Воспаление и иммунный ответ на вирусную инфекцию может нарушать целостность слизистых, давая возможность бактериям проникать в ткани, находящиеся под слизистым эпителием, и в кровь. Наличие при этом у бактерий защиты от системы комплемента становится большой проблемой для организма, так как в результате может возникать сепсис, а если менингококки оказываются в оболочках спинного или головного мозга, то менингит. Такое развитие событий не является выгодным для популяции менингококков, оно лишь оказывается следствием их противодействия иммунной реакции на других патогенов.
Грипп способен провоцировать переход в патогенное состояние не только у менингококков, но и у некоторых стрептококков [5]. В этом случае участие РНК-термосенсоров не показано, однако температура также указывается авторами исследования как один из факторов, влияющих на изменение стратегии поведения и жизненного цикла стрептококков.
РНК-термосенсоры распространены у бактерий и фагов [6]. Они также встречаются у высших эукариот. Часто РНК-термосенсоры регулируют экспрессию генов белков теплового шока, а активация ими систем противодействия иммунному ответу не так хорошо описана. Обычно в состав термосенсора попадают последовательность Шайна-Дальгарно и старт-кодон гена [7].
РНК-термосенсоры привлекают внимание и с биотехнологической точки зрения. Так, недавно была предложена система, позволяющая довольно точно измерять внутриклеточную температуру бактерий при помощи генноинженерных конструкций, содержащих лактозный оперон. При низких температурах репрессор гена LacZ синтезируется, бета-галактозидаза не образуется и синего красителя в клетке нет, а при повышении температуры РНК-термосенсор, блокирующий трансляцию гена репрессора, расплетается, что в итоге приводит к образованию в клетке красителя. Такой термометр позволяет измерять внутриклеточную температуру с точностью до 0,7 °С в диапазоне 35–45 °С [8]. Это может быть важно для оценки условий роста бактерий в термически неоднородных средах. Об измерениях внутриклеточных физико-химических параметров «Биомолекула» уже писала в статье «Нано pH-метр» [9], где речь шла об измерении клеточного pH при помощи наносенсора, состоящего из трех олигонуклеотидов и флуорофоров.
РНК-термосенсоры также перспективны с точки зрения создания терморегулируемых бактериальных экспрессионных векторов. Запускать оверэкспрессию того или иного гена с целью наработки белка при помощи изменения температуры может быть дешевле и удобнее, чем при помощи химического индуцирования, которое иногда имеет побочный эффект в виде цитотоксичности. При этом свойствами РНК-термосенсоров можно легко манипулировать, заменяя отдельные нуклеотиды, регулируя тем самым температуру плавления шпильки. Разнообразие и возможные применения РНК-термосенсоров хорошо описаны в недавнем обзоре журнала Nature Reviews Microbiology [10].
Написано по материалам оригинальной статьи [4] и новости в блоге This Week in Virology [11].
Литература
- David S Stephens, Brian Greenwood, Petter Brandtzaeg. (2007). Epidemic meningitis, meningococcaemia, and Neisseria meningitidis. The Lancet. 369, 2196-2210;
- K.A.V. Cartwright, D.M. Jones, E. Kaczmarski, A.J. Smith, J.M. Stuart, S.R. Palmer. (1991). Influenza A and meningococcal disease. The Lancet. 338, 554-557;
- Muriel C. Schneider, Rachel M. Exley, Sanjay Ram, Robert B. Sim, Christoph M. Tang. (2007). Interactions between Neisseria meningitidis and the complement system. Trends in Microbiology. 15, 233-240;
- Edmund Loh, Elisabeth Kugelberg, Alexander Tracy, Qian Zhang, Bridget Gollan, et. al.. (2013). Temperature triggers immune evasion by Neisseria meningitidis. Nature. 502, 237-240;
- L. R. Marks, B. A. Davidson, P. R. Knight, A. P. Hakansson. (2013). Interkingdom Signaling Induces Streptococcus pneumoniae Biofilm Dispersion and Transition from Asymptomatic Colonization to Disease. mBio. 4;
- Shoshy Altuvia, Daniel Kornitzer, Dinah Teff, Amos B. Oppenheim. (1989). Alternative mRNA structures of the cIII gene of bacteriophage λ determine the rate of its translation initiation. Journal of Molecular Biology. 210, 265-280;
- Edmund Loh, Elisabeth Kugelberg, Alexander Tracy, Qian Zhang, Bridget Gollan, et. al.. (2013). Temperature triggers immune evasion by Neisseria meningitidis. Nature. 502, 237-240;
- K. M. McCabe, E. J. Lacherndo, I. Albino-Flores, E. Sheehan, M. Hernandez. (2011). LacI(Ts)-Regulated Expression as an In Situ Intracellular Biomolecular Thermometer. Appl. Environ. Microbiol.. 77, 2863-2868;
- Нано-pH-метр;
- Jens Kortmann, Franz Narberhaus. (2012). Bacterial RNA thermometers: molecular zippers and switches. Nat Rev Microbiol. 10, 255-265;
- Racaniello V. (2013). Virus-induced fever might change bacteria from commensal to pathogen. This Week in Virology.






