Полимеры в борьбе с антибиотикорезистентными микроорганизмами
11 октября 2019
Полимеры в борьбе с антибиотикорезистентными микроорганизмами
- 2761
- 0
- 6
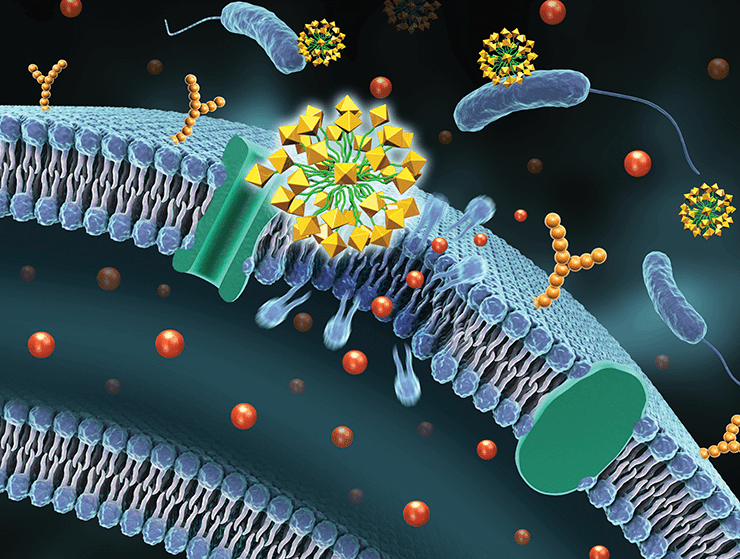
Мицеллы комплекса F127-DG атакуют внешнюю клеточную мембрану P. aeruginosa, нарушая ее целостность и увеличивая проницаемость
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Устойчивость патогенных микроорганизмов к воздействию антибиотиков — это серьезная проблема, которая грозит стать чумой XXI века. Над поиском путей ее преодоления ломают головы специалисты в областях микробиологии, биохимии и медицины со всего мира. Она приобрела такие пугающие масштабы, что побудила к действию ученых, деятельность которых, казалось бы, никак не связана с медициной, — химиков, работающих над созданием полимерных материалов. В то же время синтетические полимеры стали настолько совершенными и разнообразными, что медицинские решения с их применением были только вопросом времени.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Сколтех» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Ежегодно в мире от инфекционных заболеваний умирает 17 млн. человек: в соответствии с данными ВОЗ, такие болезни занимают 3–4 место в рейтинге причин смертности [1]. Во многом это обусловлено появлением и распространением резистентных штаммов микроорганизмов.
Устойчивость бактерий к антибиотикам делает существующие методы борьбы с ними малоэффективными. В то же время разработка нового лекарства требует не только неимоверных усилий, но и огромных денежных затрат: в 2012 году сумма, необходимая для получения регистрационного удостоверения FDA, составляла 2,6 млрд долларов! Причем инвестиции в создание антибиотиков окупаются хуже всего: помимо высокой стоимости научно-исследовательской работы, существуют также риски, связанные с возможным внесением препарата в резерв, — так осуществляется контроль за оборотом антибиотиков на государственном уровне.
Кроме того, срок действия патента на новый антибиотик составляет всего 20 лет, 10 из которых уходит на регистрацию и клинические испытания [1]. В связи с этим остро стоит не только вопрос получения новых соединений с антимикробными свойствами, но и возможного уменьшения затрат на их изучение, упрощения и ускорения процесса производства. Это позволило бы не только удешевить антибиотики, но и стимулировать ведущие фармацевтические компании спонсировать исследования в данной области.
Настоящий обзор посвящен возможностям полимерных молекул в борьбе с антибиотикорезистентностью. В нем описаны некоторые подходы, позволяющие усилить эффективность существующих препаратов при помощи синтетических полимеров или получить совершенно новые антибиотики, проявляющие эффективность в отношении бактерий с множественной лекарственной устойчивостью.
“I’m a plastic, it’s fantastic”
Что вы представляете себе, услышав слово «полимер»? Первой ассоциацией наверняка станет пластиковый цветочный горшок, капроновые чулки или резиновые уточки. Кто-то, возможно, вспомнит школьный курс биологии — упомянет целлюлозу и «вроде бы ДНК тоже полимер, но это не точно». В химии же полимерами называют макромолекулы, построенные путем присоединения большого числа повторяющихся одинаковых или разных фрагментов друг к другу [2]. Огромное число областей, в которых полимеры нашли себе применение сегодня, объясняется широкой вариативностью свойств полимерных материалов. Не обошлось без них и в медицине [3].
Полимеры биомедицинского назначения обладают рядом потрясающих особенностей: высокой химической стойкостью, биоинертностью и способностью принимать любые мыслимые формы [3]. Зачастую изделия из пластика намного дешевле и удобнее в использовании по сравнению с металлическими и стеклянными. Однако в этой статье хочется рассказать о менее очевидном, но, возможно, более важном инженерном решении с использованием макромолекул. Речь пойдет о роли полимерных молекул в борьбе с антибиотикорезистентностью.
Антибиотикорезистентность: апокалипсис начнут не зомби
Наверняка слово «апокалипсис» у многих из нас ассоциируется с ордами зомби, охочих до мозгов, или масштабными катаклизмами, тему которых так любят затрагивать в современном кинематографе. Мы, затаив дыхание, наблюдаем за гибелью человечества на экране, не осознавая, что в нашей благополучной и радостной жизни существуют реальные угрозы. Они способны если не стереть человечество с лица Земли, то очень сильно усложнить ему жизнь. И речь здесь пойдет не о ядерном оружии, которое, хоть и представляет большую опасность, всё же поддается контролю. У нас есть другой, гораздо более хитрый и изворотливый враг, особенно опасный своей непредсказуемостью и незаметностью. Имя ему — антибиотикорезистентность!
Под антибиотикорезистентностью [4] понимается невосприимчивость патогенных микроорганизмов к действию веществ, направленных на борьбу с ними, — антибиотиков [5]. Казалось бы, в чем проблема? Перестал действовать один антибиотик — ученые придумают новый, а затем еще один. Человек же гораздо умнее бактерии, неужели в XXI веке нам нужно бояться не ядерной войны, а какой-то доядерной клетки?
Однако бактерии имеют эволюционное преимущество: они гораздо старше человека и намного лучше приспособлены к изменяющимся условиям окружающей среды. На их стороне — большая скорость воспроизведения себе подобных, быстрая изменчивость и закрепление необходимых мутаций в популяции, а также наличие такого инструмента как горизонтальный перенос генов. Этот механизм позволяет передавать приобретенные признаки не только собственным потомкам, но даже представителям других видов! Бактерии смогли превратить свои особенности в мощное оружие, которое позволяет им бороться с воздействием антибиотиков, тем самым делая излечение многих болезней сложным и не всегда эффективным.
Что делать?
На вопрос «Что же делать в сложившейся ситуации?» ответ однозначный: не опускать руки и продолжать научный поиск. В том числе в области синтеза полимеров. Но для начала нужно разобраться, какие сложности могут возникнуть при таком подходе.
Высокомолекулярные соединения отличаются от прочих веществ не только большим размером и внушительной массой молекул. Как мы знаем, строение полимера почти никогда нельзя описать строгой формулой, так как вещество состоит из макромолекул различной длины и молекулярной массы, микроструктура которых может сильно варьировать [2]. Это не критично для корпуса автомобиля, то совершенно недопустимо для лекарственного препарата.
Для медицинских целей очень важно получить не просто сверхчистый полимер. Необходимо, чтобы все его молекулы имели одинаковую длину, структуру и положение функциональных групп, так как всего одна лишняя гидроксильная группа или двойная связь могут кардинальным образом изменить биологическую активность макромолекулы. С этим затруднением призван справиться макромолекулярный дизайн [6], который позволяет контролировать структуру полимеров на стадии синтеза и получать именно те молекулы, которые нам нужны. Во многом благодаря ему полимеры сегодня всё более широко применяются в медицинских целях, в том числе в качестве лекарственных препаратов.
Далее мы поговорим о том:
- как воскресить «старые» антибиотики;
- можно ли придумать что-то новое, когда уже всё придумано до нас;
- обязательно ли пить таблетки, если даже стены лечат;
- можно ли победить инфекции при помощи носков.
«Стой! Куда? Нет у нас пути обратного!» — «Пошли, я покажу!»*
Для борьбы с устойчивостью микроорганизмов к антибактериальным препаратам рассматривают две возможные стратегии.
Первая заключается в создании новых веществ с антимикробной активностью, что является крайне сложной и запредельно дорогой задачей. Кроме того, такой подход требует колоссальных затрат времени, что сильно отодвигает момент введения их в клиническую практику, и, следовательно, ставит под угрозу возможность излечения сотен и тысяч людей.
Второй подход, который сегодня кажется более перспективным, — продление жизни уже существующих препаратов, повышение их терапевтической эффективности и биодоступности, преодоление защитных механизмов бактерий при помощи наукоемких решений. Этой проблемой занимается область науки, которую называют фармацевтической нанотехнологией [7].
В начале 60-х годов прошлого столетия на небосклоне бактерий с множественной лекарственной устойчивостью (МЛУ) взошла новая звезда — метициллинрезистентный золотистый стафилококк [8] (MRSA), одиозная фигура и возбудитель большого числа внутрибольничных и бытовых инфекций. Он возглавил мощное и массовое движение против β-лактамных антибиотиков (определения этого и последующих терминов даны в словарике в конце тексте).
На протяжении долгого времени данный класс препаратов широко применялся в клинической практике для лечения большого числа инфекционных заболеваний. Однако у бактерий было свое мнение на этот счет: не желая уступать человеку первенство в борьбе за существование, грамотрицательные, а за ними и грамположительные бактерии приступили к реализации плана «β-лактамаза» [9]. Довольно быстро было сформировано порядка 200 различных видов фермента, отличающихся специфичностью действия и направленных на борьбу с β-лактамными антибиотиками.
Следует отметить, что, приобретая устойчивость к одному из антибиотиков группы, бактерия зачастую ограждала себя от воздействия его собратьев по оружию. Все дело в механизме инактивации лекарства ферментом: молекула β-лактамазы связывается с антибиотиком, разрушая β-лактамный цикл, присутствующий в составе всех антибиотиков группы и обусловливающий их антимикробную активность. В результате препарат становится совершенно бесполезным [10]. Что в таком случае делать с некогда эффективными и надежными препаратами? Неужели просто оставить на задворках истории и искать новые методы воздействия на коварные микроорганизмы?
Помощь пришла, откуда не ждали: на защиту антибиотиков встали уже знакомые нам полимеры. Оказалось, что некоторые металлоорганические соединения, которые ранее удавалось использовать в качестве противоопухолевых препаратов, способны дать β-лактамным антибиотикам вторую жизнь! Они нейтрализуют β-лактамазу, позволяя антибиотикам делать свою работу.
Могут быть «спасены» пенициллин-G, амоксициллин, ампициллин и цефазолин путем взаимодействия с кобальтоценсодержащими металлополимерами [11]!
Сама по себе металлоорганика весьма токсична, однако, в составе металлополимера такое вещество, как кобальтоцен, проявляет хорошие бактерицидные свойства без ущерба для макроорганизма. Такой металлополимер хорошо растворим в воде, а за счет способности кобальтоцена образовывать связь с карбоксилат-анионом полимер надежно связывается с различными β-лактамными антибиотиками (рис. 1). В результате такого взаимодействия генерируется стабильный конъюгат, который проявляет синергические антибактериальные свойства антибиотика и полимера. За счет ионной связи между антибиотиком и металлополимером блокируется электростатическое закрепление β-лактамазы на поверхности молекулы антибиотика, что предотвращает его ферментативную деактивацию.
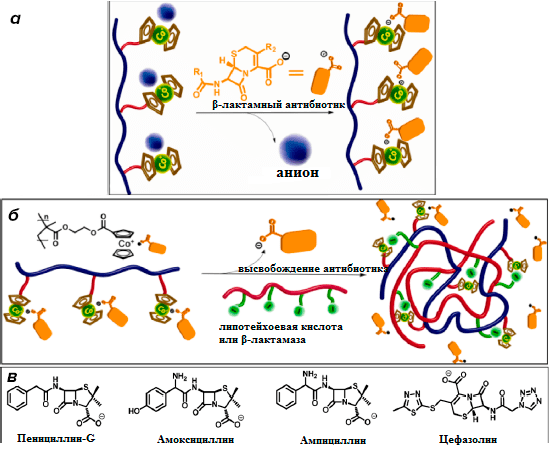
Рисунок 1. Металлополимер и β-лактамный антибиотик. а — Формирование ионной пары между β-лактамным антибиотиком и кобальтоценсодержащим полимером. б — Высвобождение антибиотика из комплекса с металлополимером после взаимодействия с компонентами клеточной стенки или β-лактамазой. в — Структурные формулы β-лактамных антибиотиков, использованных в исследовании.
Высвобождение антибиотика происходит после ионного обмена между полимером и компонентами клеточной стенки бактерии: он может связаться как с липотейхоевой кислотой (компонентом клеточной стенки грамположительных бактерий), так и с β-лактамазой, выделяемой микроорганизмом. Комплексное воздействие на бактериальную клетку осуществляется путем лизиса клеточной мембраны и дезактивации β-лактамазы. Исследование [11] показало, что совместное действие антибиотика и кобальтоценового полимера намного более эффективно, чем индивидуальная активность каждого из веществ.
В комплексном препарате металлополимер не только ингибирует β-лактамазу, но и проявляет самостоятельную бактерицидную активность за счет связывания с клеточной стенкой бактерии и ее последующего разрушения (рис. 2). Кроме того, препарат проявляет высокую селективность воздействия на бактериальные клетки. Комплекс эффективен в отношении MRSA с множественной лекарственной устойчивостью, но при этом не разрушает мембраны эритроцитов и оказывает минимальное токсическое воздействие на эукариотические клетки как в опытах in vitro, так и in vivo.
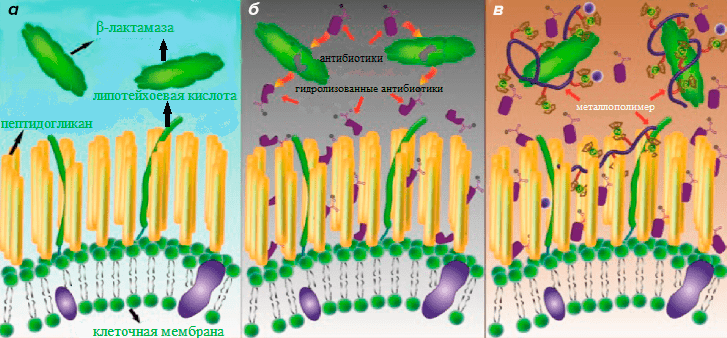
Рисунок 2. Ключевые пути взаимодействия β-лактамного антибиотика и β-лактамазы. а — Клеточная мембрана MRSA, продуцирующая β-лактамазу. б — Гидролиз β-лактамного антибиотика, подошедшего к наружной мембране бактерии, β-лактамазой. в — Предполагаемый способ взаимодействия полимерного комплекса с клеточной стенкой бактерии: комплекс полимер—антибиотик связывается с β-лактамазой, нейтрализуя ее; β-лактамный антибиотик высвобождается и получает возможность взаимодействовать с клеточной стенкой бактерии, что приводит к гибели последней.
Новая разработка может стать ключом к решению проблемы МЛУ и дать антибиотикам вторую жизнь.
Поликарбонат — не только крыша
Как мы уже отмечали, разработка новых лекарственных препаратов — это сложно и дорого [1]. Но не стоит забывать, что антибиотики, широко используемые современной медициной, были и остаются весьма «тяжелыми» препаратами. Убивая бактерии, ставшие причиной инфекционного заболевания, они часто наносят ощутимый ущерб органам и тканям человеческого организма.
Антибиотики не самым благоприятным образом воздействуют на печень и почки, осуществляющие выведение продуктов жизнедеятельности из организма, а также на нервную систему [12]. Кроме того, антимикробные средства поражают как болезнетворные бактерии, так и естественную микрофлору, часто становясь причиной кишечного дисбактериоза и кандидоза.
Именно поэтому создание новых препаратов с антибактериальной активностью было и остается актуальным. Современные технологии позволяют контролировать токсические свойства получаемых веществ, снижая негативное воздействие на клетки человека. И вот один из подобных случаев.
Может показаться, что поликарбонат (а именно из него сделаны теплицы и зеленые крыши автобусных остановок) не имеет ничего общего с лекарственными препаратами. Однако ученым из Университета биоинженерии и нанотехнологии в Сингапуре (Institute of Bioengineering and Nanotechnology) удалось связать молекулы поликарбоната с гуанидином и получить совершенно новый антибиотик!
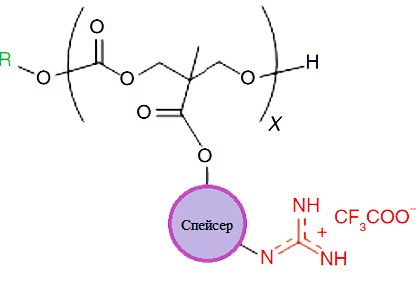
Рисунок 3. Структура молекулы поликарбоната (черный цвет), функционализированного гуанидином (красный цвет) — pEt-20. Обозначения: Х = 20; спейсер — С2Н4.
Он совмещает в себе бактерицидную и фунгицидную активность гуанидина (всем известный хлоргексидин является его производным) со способностью модифицированного поликарбоната взаимодействовать с бактериальными клетками [13]. Важным элементом строения макромолекул стали так называемые спейсеры — алифатические или ароматические группировки, привитые к полимерной цепи и придающие ее поверхности гидрофобные свойства (рис. 3). Механизм действия такого комбинированного препарата довольно прост:
- На первом этапе катионный участок полимера связывается с отрицательно заряженной клеточной мембраной бактерии за счет сил электростатического взаимодействия.
- Затем гидрофобные полимерные субъединицы аккуратно встраиваются в липопротеидный слой, не вызывая разрушения мембраны бактерии.
- В случае комбинированной терапии с участием гуанидина после встраивания поликарбоната в мембрану гуанидин получает непосредственный контакт с цитоплазмой клетки, вызывая денатурацию белковых молекул и гибель бактерии.
Стоит отметить, что токсичность гуанидина снижается при объединении в комплекс с поликарбонатом, вследствие чего он не оказывает отравляющего воздействия на организм млекопитающего [13]. Его высвобождение происходит уже после проникновения поликарбоната в клеточную стенку бактерии.
Уникальный механизм действия обеспечивает не только невероятно высокую эффективность препарата, но и его колоссальную избирательность в отношении болезнетворных бактерий. Полученный комплекс гуанидин—поликарбонат эффективен в отношении широкого спектра патогенов, таких как Acinetobacter baumannii (грамотрицательная бактерия, относится к ESCAPE-патогенам), Eschirichia coli и Klebsiella Pneumoniae с МЛУ. При этом он намного менее токсичен для организма, чем привычные антибиотики, — полимиксин-В, имипинем и ванкомицин, — хотя и превосходит их по эффективности [13]. Это во многом обусловлено чрезвычайно низкими концентрациями полимера, необходимыми для полной гибели колонии бактерий.
Кроме того, полимерный комплекс водорастворим, биоразлагаем и отличается гораздо более коротким временем воздействия на патогены. Сокращение времени терапии позволит ускорить выздоровление пациента и снизить риск побочных эффектов, связанных с накоплением антибиотика в организме.
Из-за крайне высокой скорости воздействия на бактерии, комплекс поликарбоната и гуанидина позволит быстро справиться с инфекцией, например, при сепсисе, избежав накопления бактериальных токсинов, ответственных за септический шок. Это может стать спасением при перитонитах различного генеза. Предполагают, что полная деградация полимера наступает через три дня после введения в организм, вследствие чего он не оказывает гепато- и нефротоксического воздействия, в отличие от традиционных антибиотиков.
Что особенно важно, устойчивость бактерий к полимерному антибиотику не вырабатывается даже после многократной обработки колонии сублетальными дозами препарата. Это также происходит благодаря самобытному механизму действия полимерного комплекса. Таким образом, создание подобного полимера открывает широкие перспективы в профилактике и лечении мультирезистентных системных инфекций [13].
К сожалению, результаты пока получены лишь в исследованиях in vitro на клеточных культурах, однако они столь многообещающи, что исследование in vivo вряд ли заставит себя долго ждать.
Инженерное решение для пептидов
В научных изданиях неоднократно сообщалось о возможности применения природных биополимеров — полипептидов [14], [15] — для борьбы с антибиотикорезистентностью. Эти вещества проявляют поистине уникальную активность в отношении патогенных микроорганизмов. Более того, при помощи полипептидов удается пробиться даже сквозь бактериальные пленки.
Тем не менее применение полипептидов для разрушения биопленок имеет серьезный недостаток: эффективные дозы препаратов на их основе весьма токсичны и негативно воздействуют как на возбудителя инфекции, так и на клетки организма млекопитающего. Но решение было найдено! Оказалось, что необходимые свойства природных пептидов можно воссоздать в синтетических полимерах [16]. Благодаря тонкому контролю процесса синтеза удается с высокой точностью задавать структуру макромолекул. Это позволяет скопировать необходимые свойства полипептидов и значительно снизить их токсичность.
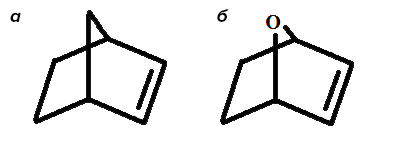
Рисунок 4. Норборнен (а) и оксанорборнен (б)
Исследователи из Университета штата Массачусетс (University of Massachusetts Amherst) сделали смелое предположение, что лечебное воздействие и токсичность катионных полимеров, представляющих собой синтетический аналог полипептидов, можно регулировать, изменяя структуру гидрофобных фрагментов. Такие фрагменты эквивалентны химическим группам, присутствующим в активных центрах антимикробных полипептидов [16]. Речь пойдет о полимерах норборнена и оксанорборнена (рис. 4).
Структура полимерных производных норборнена схожа со структурой молекул полипептидов, из-за чего полимеры на его основе обладают ярко выраженной антимикробной активностью. При этом контроль над структурой макромолекул создает колоссальное преимущество таких полимеров перед природными пептидами: синтезируя молекулу в лаборатории, можно регулировать соотношение между бактерицидными свойствами и токсичностью вещества, изменяя его структуру или вид заместителей.
Оказалось, например, что увеличение длины гидрофобного фрагмента с трех атомов углерода до одиннадцати, приводит к 1000-кратному усилению антимикробного действия препарата [8]! Объясняется это просто: полимер с длинной боковой цепью способен к самоорганизации в растворе. В результате образуются полимерные наночастицы (ПНЧ), активность которых гораздо выше, чем у одиночных молекул [16].
Такие ПНЧ полимера P5 (рис. 5) проявили активность в отношении грамотрицательных P. aeruginosa и E. cloacae с МЛУ. Против грамположительных штаммов S. аureus, включая высоковирулентный MRSA, ПНЧ Р5 также оказались эффективными. Всё это говорит о способности полимерных частиц уклоняться от общих механизмов сопротивления бактерий.
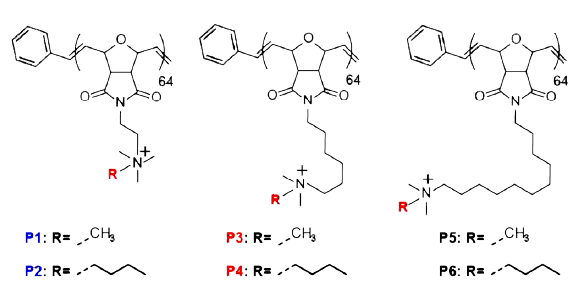
Рисунок 5. Молекулярная структура полимерных производных норборнена. Обозначения: P1–P6 — полимеры с разными гидрофобными фрагментами; R — заместители различной природы.
Катионные заряды ПНЧ связываются с клеточной стенкой бактерии, вызывая ее разрушение. Микроорганизмы гибнут при контакте с полимерными молекулами независимо от химического состава мембран и патогенности. Но и это еще не всё. ПНЧ настолько «хитры», что умеют проникать даже в бактериальные пленки, не оставляя инфекции шансов!
Учитывая механизм действия и полное разрушение мембраны бактериальной клетки, возникновение устойчивости к таким молекулам потребует кардинальных изменений в бактериальном фенотипе. Если в опытах с использованием таких антибиотиков, как ципрофлоксацин (хинолон), цефтазидим (β-лактам) и тетрациклин, устойчивость бактерий формируется буквально на глазах, то получить резистентный штамм, невосприимчивый к ПНЧ Р5, в лаборатории не удалось [16]. Остается надеяться, что препараты на основе ПНЧ Р5 совсем скоро увидят свет.
Возвращение плюроника
Как упоминалось выше, часто причиной невосприимчивости бактерий к антибиотикам становится ограниченная проницаемость клеточной стенки для препарата. В случае грамотрицательных бактерий, доставка достаточного количества антибиотика внутрь клетки становится совсем нетривиальной задачей — их клеточная стенка защищена дополнительной мембраной. Еще больше снижает проницаемость двойной клеточной стенки врожденный дефицит поринов.
Устойчивость грамотицательных микроорганизмов поражает воображение: например, P. aeruginosa способна существовать даже в дезинфицирующих растворах (фурацилин), используемых для промывания медицинских инструментов и ран в стационарах. И это уже совсем обидно.
Сейчас разработано несколько способов преодоления высокой устойчивости грамотрицательных бактерий, однако они часто сопряжены с определенными сложностями. Например, все те же катионные пептиды, на которые возлагают большие надежды, токсичны для клеток млекопитающих.
Как мы знаем, синтетические полимеры менее агрессивны в отношении эукариотических клеток. Ученые из Университета Джорджии (Department of pharmaceutical and biomedical sciences, College of pharmacy, University of Georgia) предложили использовать в качестве пермеабилизатора (вещество, изменяющее проницаемость клеточной мембраны, и новое прикольное слово в вашем лексиконе) полоксамер [17]. Полоксамер (он же плюроник) и раньше применялся в противоопухолевой терапии в составе систем доставки лекарства в раковые клетки. В связи с этим родилось предположение, что он может быть полезен и для улучшения усвоения антибиотиков грамотрицательными бактериями.
В водных растворах молекулы полоксамера собираются «стайками», формируя устойчивые надмолекулярные структуры — мицеллы. Такие агрегаты обладают потрясающей способностью поглощать и удерживать вещества с гиброфобными свойствами — солюбилизацией. В быту это свойство мицелл используется для удаления жировых загрязнений (теперь вы знаете, зачем нужны ПАВ в составе моющих средств). Но для фармацевтического и медицинского применения мицеллы могут оказаться еще более полезными [18].
За счет гидрофобности как мицеллы, так и отдельные молекулы полоксамеров, способны взаимодействовать с биологическими мембранами, образуя поры в клеточной стенке бактерии. Кроме того, они замедляют работу клеточного насоса и препятствуют выведению антибиотика из бактериальной клетки. Но сами по себе полоксамеры не способны накапливаться на поверхности бактериальной клетки в достаточном количестве. Для повышения их эффективности разработали комплексный препарат F127-DG, представляющий собой комплекс десферриоксамина-B (сидерофор, связывающий катионы Fe3+) [19] и ионов галлия, удерживаемый мицеллами плюроника F127. К слову, ионы галлия тоже обладают бактерицидными свойствами.
Механизм действия препарата разберем на примере P. aeruginosa. Во время заражения организма P. aeruginosa (синегнойная палочка) усиливает выделение рецепторов клеточной оболочки, необходимых для усвоения железа [20]. Комплекс десферриоксамин—галлий (DG) аналогичен собственному сидерофору грамотрицательной синегнойной палочки, легко распознается этими рецепторами, но, в отличие от собственного сидерофора бактерии — ферриоксамина, — блокирует поступление ионов железа в бактериальную клетку, что и становится причиной ее гибели (рис. 6).
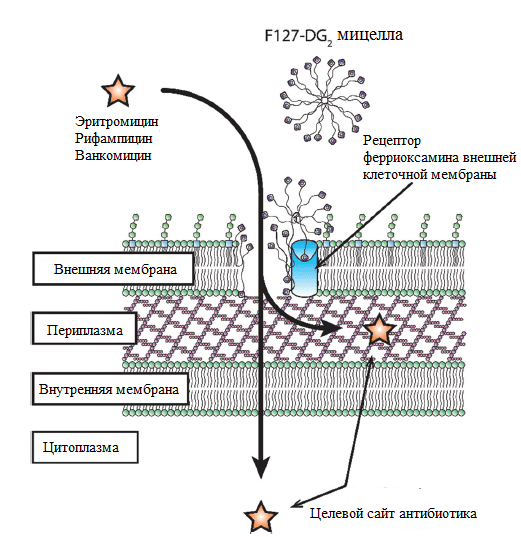
Рисунок 6. Мицеллы F127-DG атакуют рецепторы ферриоксамина, выделяемые внешней клеточной мембраной P. aeruginosa; полимер накапливается на поверхности бактериальной клетки. Высокая локальная концентрация полимерных молекул нарушает целостность внешней мембраны и увеличивает ее проницаемость.
Железо является важнейшим микроэлементом для жизнедеятельности многих бактерий. Оно действует как кофактор синтеза ДНК, РНК и многих белков. Ряд исследований подтверждает прямую взаимосвязь между концентрацией ионов железа в окружающей среде и вирулентностью бактерий. Ограничение захвата железа приводит к замедлению роста колонии и повышению чувствительности микроорганизмов к антибактериальным препаратам [20]. Кроме того, комплекс DG способствует увеличению концентрации мицелл полоксамера на поверхности бактериальной мембраны, обеспечивая разрушение внешнего липидного слоя.
Опыты на P. aeruginosa с МЛУ проводили с использованием полимера в сочетании с эритромицином, рифампицином и ванкомицином. Эти антибиотики имеют непохожие механизмы воздействия, поэтому на их примере можно проследить, будет ли усиливаться антимикробный эффект от совместного применения F127-DG и антибиотика.
Синергия лучше проявилась в опытах с ванкомицином, но оказалась не слишком впечатляющей для двух других антибиотиков. Это обусловлено различиями в целевых участках воздействия антибиотиков и механизмах сопротивления бактерий [17].
Эритромицину и рифампицину необходим не только доступ к периплазматическому веществу клетки, но и проникновение через внутреннюю мембрану в цитоплазму, так как они воздействуют через рибосомы и РНК-полимеразу. Кроме того, мицеллы, уже доставившие антибиотик к клетке, остаются на ее поверхности и создают те самые недостающие поры, способствуя увеличению проницаемости наружной мембраны. Как приток, так и отток вещества из клетки становится более интенсивным за счет естественных насосов, препятствуя накоплению антибиотика в периплазматическом веществе.
Ванкомицин же нацелен на сшивающие ферменты, ответственные за синтез бактериальной клеточной стенки. Синтез происходит как раз в периплазме грамотрицательных микроорганизмов. Пермеабилизация наружной мембраны позволяет ванкомицину достичь своей специфической мишени, чем и объясняется хороший эффект от совместного использования этого антибиотика и полимерного комплекса.
Стоит отметить, что даже в отношении бактерий, ранее не проявлявших восприимчивости к перечисленным антибиотикам, комплексный препарат оказался активен. То есть мицеллы F127-DG «работают» в обход защитных механизмов бактерий.
Важно, что в аналогичном опыте на кишечной палочке [17] никакого результата получено не было. Обусловлено это отсутствием у E. coli специфического рецептора, связывающегося с DG, что говорит о превосходной избирательности нового препарата и селективном воздействии именно на P. aeruginosa. Таким образом, можно ожидать отсутствие токсического воздействия не только на клетки млекопитающих, но и на другие штаммы микроорганизмов. Это, например, позволит сохранить нормальную бактериальную флору кишечника при лечении антибиотиками.
Однако не стоит забывать, что какими бы совершенными ни были антибиотики, существует еще один фактор, играющий едва ли не первостепенную роль в предотвращении опасных заболеваний. Профилактика! Проветривание, личная гигиена и антисептическая обработка поверхностей тоже способны помочь нам избежать возникновения и распространения опасных инфекций. О ней мы и расскажем в следующих разделах статьи.
Да будет свет!
Речь в этой главе пойдет не о кварцевании помещений, как вы могли подумать. Существует менее очевидный, но более эффективный способ борьбы с антибиотикорезистентными бактериями при помощи электромагнитного излучения — создание фотоактивируемых поверхностей. Они способны генерировать цитотоксические формы активного кислорода под действием обычного дневного света [21]! Такой подход перспективен в плане обеззараживания предметов, медицинских приборов и оборудования, с которыми соприкасаются пациенты медучреждений. Давайте поговорим о создании самоочищающихся антимикробных поверхностей.
Интерес к фотобактерицидным средствам возник не вчера. Попытки создать самоочищающиеся поверхности неоднократно предпринимались учеными по всему миру, однако способы реализации по тем или иным причинам оказывались недостаточно хороши. Наиболее подходящим для подобного применения стал композит на основе сверхчистого полиуретана . Этот полимер давно используется для изготовления частей медицинских приборов, систем эндопротезирования и даже в качестве биоклея для мгновенной стяжки открытых ран.
В медицине полиуретан получил широкое распространение из-за потрясающей биосовместимости. Изделия из него не выделяют вредных веществ и не реагируют с лекарственными препаратами. Гибкость и высокая износоустойчивость позволяет применять его в изготовлении протезов, презервативов, имплантатов и покрытий для оборудования.
В состав полиуретанового композита ввели органический краситель — кристаллический фиолетовый, который играл роль «улавливателя света», или фотосенсибилизатора. Механизм бактерицидного действия поверхностей на основе такого композита косвенный: токсическое воздействие на микроорганизмы оказывает не сам материал, а активный кислород, который вырабатывается в нем под действием света.
Свободные радикалы и синглетный кислород (рис. 7) способны окислять биологические субстраты, вызывая необратимые повреждения клеточной мембраны и дезактивацию ферментов, что приводит к гибели бактериальных клеток даже при наличии у них устойчивости к антибиотикам — против лома нет приёма (рис. 8)! Единственным недостатком такого материала стало обесцвечивание композита в процессе эксплуатации и утрата им бактерицидных свойств.
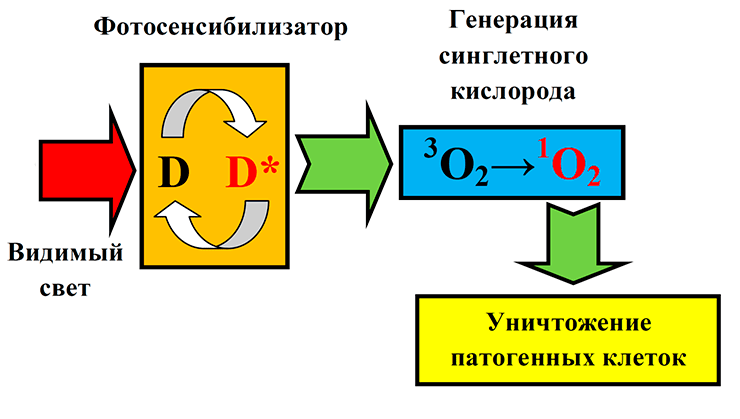
Рисунок 7. Активные формы кислорода генерируются путем фотодинамических реакций: при воздействии света с определенной длиной волны энергия фотона переводит молекулу фотосенсибилизатора в возбужденное синглетное состояние, которое является неустойчивым. Затем молекула красителя переходит в стабильное триплетное состояние, что сопровождается эмиссией электронов, которые и инициируют образование активных форм кислорода по двум путям. В первом фотоиндуцированные окислительно-восстановительные реакции приводят к образованию супероксидных и гидроксильных свободных радикалов, а во втором энергия квантового перехода инициирует преобразование молекулярного кислорода воздуха в высокоактивную синглетную форму [21]. Условные обозначения: D — фотосенсибилизатор; D* — возбужденный фотосенсибилизатор; 3O2 — кислород воздуха в триплетном состоянии; 1O2 — активный синглетный кислород.
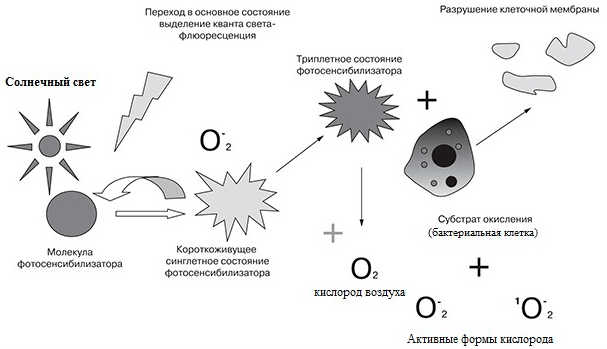
Рисунок 8. Схема фотодинамического воздействия на бактериальные клетки
Альтернативный подход предложили ученые из Великобритании [21]. Они изучили композит, в состав которого, наряду с органическим красителем, включили квантовые точки (КТ). КТ представляют собой мельчайшие частицы вещества с проводниковыми или полупроводниковыми свойствами. Они способны поглощать свет с почти любой длиной волны, в том числе видимого спектра. Пропадает необходимость использования вспомогательного оборудования для облучения материала. Кроме того, композиты с использованием КТ дольше не подвергаются фотообесцвечиванию.
Для медицинского полимера было решено применить КТ на основе индия, так как обычные квантовые точки, содержащие кадмий, выделяют токсичные ионы Cd2+ в процессе квантовых переходов. В ходе исследования [21] также установили, что наилучший результат достигается при одновременном введении в композит КТ и красителя (кристаллического фиолетового), которые формируют наночастицы (рис. 9).

Рисунок 9. Изображение наночастиц «КТ — кристаллический фиолетовый» в составе полиуретана, полученное методом просвечивающей электронной микроскопии высокого разрешения
Эффективность композита была проверена на штаммах MRSA и кишечной палочки с МЛУ — грамположительных и грамотрицательных микроорганизмах. Результаты оказались просто невероятными! Модифицированный таким образом полиуретан, соприкасаясь с колониями бактерий, вызвал практически полную гибель последних всего за четыре часа!
Учитывая высокую антибактериальную активность композита и отсутствие токсичности за счет применения индия, вполне возможно, что подобное покрытие скоро заменит собой традиционные пластики в медицинских учреждениях.
Нас защитит... Одежда? Бросаем камни в полиэфирную ткань!
Еще одним необычным решением в борьбе с антибиотикорезистентностью стала попытка создания нанотекстиля, который способен убивать бактерий. В этой главе мы поговорим о полипирроле. Ммм, снова приставка «поли-», звучит многообещающе и загадочно, не правда ли? Так вот, медицинские учреждения часто сталкиваются с такой проблемой, как антибактериальная обработка текстиля — а это постельное белье, одежда персонала и пациентов. Обычная стирка даже при высокой температуре не обеспечивает достаточного очищения тканевых изделий от бактериального загрязнения.
Применение наноткани в быту также может оказаться весьма полезным — он прекрасно подойдет для пошива спортивной одежды, нижнего белья и постельных принадлежностей. В данном случае биоцидные структуры в составе материала позволят избежать появления неприятного запаха и упростить процесс очистки изделий. Кроме того, нанотекстиль можно использовать для изготовления защитной спецодежды (для работы в сверхчистых помещениях), а также систем фильтрации воздуха и воды, не подверженных биообрастанию .
Проблема скопления патогенных микроорганизмов в системах кондиционирования и очистки воздуха — биообрастания фильтров, — стоит особенно остро в медицинских учреждениях. Часто именно вентиляция способствует распространению заболеваний в инфекционных отделениях, снижая эффективность лечения и подвергая риску пациентов других отделений больниц.
Несомненным плюсом является то, что наноткань выдерживает 65 циклов стирки при 75 °C, сохраняя свои антибактериальные свойства! Нет, вы только вдумайтесь!
Спасением от вездесущих микробов станет полиэфирная ткань с покрытием из полипиррола [22]. Полипиррол — синтетический электропроводящий полимер. Он обладает исключительной биосовместимостью — матрица из полипиррола подходит для электростимулированного выращивания клеток и используется для устранения дефектов нервной ткани [23], [24]! Полипиррол не оказывает токсического и канцерогенного воздействия на эукариотические клетки даже в большом количестве, не вызывает иммунного ответа в человеческом организме, а, следовательно, и аллергических реакций.
Антимикробная активность полипиррола обусловлена наличием катионных зарядов, формирующихся вдоль цепи полимера в процессе синтеза. Известно, что клеточная стенка бактерий заряжена отрицательно, — это обусловлено наличием анионных полимеров, например пептидогликана, в ее составе [25]. Полипиррол легко адсорбируется на поверхности бактериальной клетки, вызывая разрушение клеточной мембраны и гибель бактерии. При этом полимер не вызывает устойчивости микроорганизмов, воздействуя непосредственно на их клеточную стенку.
Процесс нанесения покрытия из полипиррола на поверхность полиэфирной ткани не требует присутствия токсичных растворителей и производится при помощи ультразвука. Сам метод получил забавное название — «бросание камней» [22].
Подразумевается, что наночастицы полипиррола получают заранее, а ультразвук используется только для их распространения и фиксации на поверхности волокна. При этом слой полипиррола получается однородным, что усиливает бактерицидные свойства материала.
Бактерицидную активность полипиррола оценивали в отношении E. coli и S. aureus [22]. Для сравнения взяли образцы полиэфирной ткани с разной концентрацией полипиррола и контрольный образец без покрытия. Наилучший результат был получен для образца с самым однородным и плотным покрытием (вполне ожидаемо) и концентрацией частиц полипиррола, равной 4,33 г/м2 (образец D на рисунке 10).
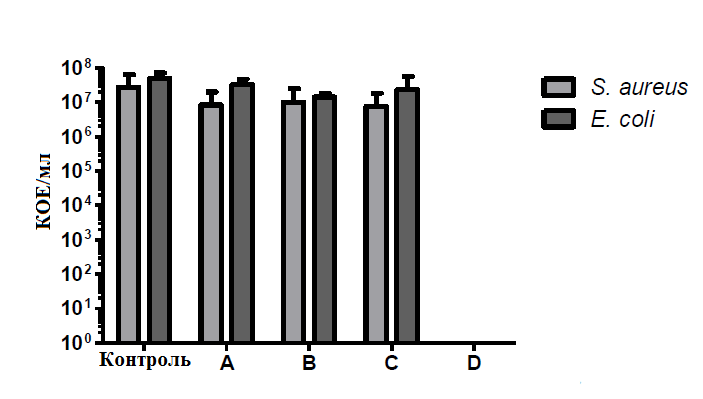
Рисунок 10. Антибактериальная активность текстиля с покрытием из полипиррола. Эффективность антибактериального действия оценена в отношении S. aureus и E. coli при разных концентрациях полипиррола в материале (увеличивается от А к D: А — 0,62 г/м2; В — 1,42 г/м2; С — 2,61 г/м2; D — 4,33 г/м2). КОЕ — количество колониеобразующих единиц микроорганизмов. Контрольный образец не содержит частиц полипиррола.
Превосходные антибактериальные свойства текстиля подтвердила полная и безоговорочная капитуляция колоний E. coli и S. aureus на его поверхности. Создание подобного текстиля — еще один шаг на пути к преодолению антибиотикорезистентности!
Выводы
Полимерные молекулы поистине удивительны! Их и без того широкие возможности стали почти безграничными с появлением такого направления органического синтеза, как макромолекулярный дизайн. Антибиотики на основе полимеров проявляют невероятную эффективность в отношении опаснейших патогенов, борьба с которыми в условиях стационаров становится всё более ожесточенной.
Главным преимуществом полимерных антибиотиков является то, что ни в одном из исследований не удалось выявить устойчивость патогенов к их воздействию. При этом уникальные свойства полимеров и механизмы взаимодействия макромолекул с клетками бактерий делают их эффективными даже в отношении микроорганизмов с множественной лекарственной устойчивостью.
Кроме того, полимеры были и остаются биосовместимыми, инертными, а иногда даже биоразлагаемыми соединениями. В отличие от привычных антибиотиков, полимеры менее токсичны, их воздействие намного более селективно — макромолекулы вызывают гибель бактериальных клеток, почти не затрагивая клетки макроорганизма.
К сожалению, все представленные в обзоре исследования пока не смогли выйти за границы лаборатории. Остается лишь надеяться, что стадия клинических испытаний и появление полимерных антибиотиков на международном рынке не заставит себя долго ждать. Однако уже сейчас мы можем смотреть в будущее с гораздо бóльшим оптимизмом — антибиотикорезистентность победят полимеры!
Словарь
- Активный центр
- участок молекулы действующего вещества, обусловливающий его активность.
- Бактериальные пленки
- конгломерат бактерий, клетки которых объединены между собой. Они часто формируются на поверхности медицинских имплантатов и постоянных устройств, таких как катетеры и протезы. Подобное явление носит название «биообрастание». Инфекционные биопленки образуются на слизистых оболочках, коже, на поверхности внутренних органов. Бактериальные пленки непроницаемы для молекул большинства антибиотиков и часто становятся причиной рецидивирующих заболеваний, сложно поддающихся лечению.
- Клеточный (эффлюксный) насос
- помпа, позволяющая «выкачать» антибиотик, попавший в клетку, назад во внеклеточную среду. Помпы могут быть настолько эффективны, что антибиотик не способен достигнуть необходимой концентрации внутри бактериальной клетки.
- Мицеллы
- это агрегаты ПАВ, состоящие из большого количества амфифильных молекул.
- Поверхностно-активное вещество (ПАВ)
- амфифильное вещество, молекулы которого способны снижать поверхностное натяжение, концентрируясь на границе раздела термодинамических фаз.
- Полимерные наночастицы (ПНЧ)
- коллоидные частицы твердых полимеров, имеющие размеры от 50 до нескольких сотен нанометров.
- Полоксамеры
- ряд сополимеров полиоксиэтилена и полиоксипропилена. За счет различного отношения к воде полиоксиэтилена (гидрофилен) и полиоксипропилена (гидрофобен) проявляют свойства ПАВ.
- Порообразующие белки (порины)
- белки клеточной стенки бактерий, выполняющие транспортную функцию. Они образуют заполненные водой поры (каналы) и способствуют неспецифическому прохождению через внешнюю мембрану веществ с относительно невысокой молекулярной массой.
- Сидерофоры
- низкомолекулярные вещества, продуцируемые клеточной стенкой некоторых бактерий и способные эффективно связывать ионы железа для усвоения их микроорганизмами.
- Сублетальная доза
- доза препарата, вызывающая серьезные нарушения жизнедеятельности микроорганизма, но не приводящая к его гибели.
- Бета-лактамные антибиотики
- группа антибиотиков, которые объединяет наличие в структуре β-лактамного кольца. Мишенью действия β-лактамных антибиотиков в микробной клетке являются ферменты (пенициллинсвязывающие белки), участвующие в синтезе основного компонента наружной мембраны как грамположительных, так и грамотрицательных микроорганизмов, — пептидогликана. Связывание β-лактамных антибиотиков с ферментами ведет к инактивации последних, прекращению роста и последующей гибели микробной клетки.
Литература
- Зубов П.В. (2015). Разработка новых антибактериальных препаратов — проблемы и перспективы. «Современные проблемы науки и образования». 5;
- Оудиан Дж. Основы химии полимеров. М.: «Мир», 1974. — 614 с.;
- Марычев С.Н. Полимеры в медицине. Владимир: ВлГУ, 2001. — 68 с.;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Anja S. Goldmann, Nathan R. B. Boase, Lukas Michalek, James P. Blinco, Alexander Welle, Christopher Barner‐Kowollik. (2019). Adaptable and Reprogrammable Surfaces. Adv. Mater.. 31, 1902665;
- A.N. Generalova, V.P. Zubov. (2018). Design of polymer particle dispersions (latexes) in the course of radical heterophase polymerization for biomedical applications. Colloids and Surfaces B: Biointerfaces. 166, 303-322;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Leyla S. Namazova-Baranova, Alexander A. Baranov. (2017). Antibiotic Resistance in Modern World. Pediatr. farmakol.. 14, 341-354;
- Аляутдин Р.Н. Фармакология (2-е изд.). М.: «Гэотар-Мед», 2004. — 592 с.;
- Jiuyang Zhang, Yung Pin Chen, Kristen P. Miller, Mitra S. Ganewatta, Marpe Bam, et. al.. (2014). Antimicrobial Metallopolymers and Their Bioconjugates with Conventional Antibiotics against Multidrug-Resistant Bacteria. J. Am. Chem. Soc.. 136, 4873-4876;
- Чурина О.С. и Шукиль Л.В. (2012). Характеристика побочных действий антибактериальных препаратов. «Омский научный вестник». 2, 86–89;
- Willy Chin, Guansheng Zhong, Qinqin Pu, Chuan Yang, Weiyang Lou, et. al.. (2018). A macromolecular approach to eradicate multidrug resistant bacterial infections while mitigating drug resistance onset. Nat Commun. 9;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Бактериоцины — ноухау биомедицины;
- Akash Gupta, Ryan F. Landis, Cheng-Hsuan Li, Martin Schnurr, Riddha Das, et. al.. (2018). Engineered Polymer Nanoparticles with Unprecedented Antimicrobial Efficacy and Therapeutic Indices against Multidrug-Resistant Bacteria and Biofilms. J. Am. Chem. Soc.. 140, 12137-12143;
- Max Purro, Jing Qiao, Zhi Liu, Morgan Ashcraft, May P. Xiong. (2018). Desferrioxamine:gallium-pluronic micelles increase outer membrane permeability and potentiate antibiotic activity against Pseudomonas aeruginosa. Chem. Commun.. 54, 13929-13932;
- Воробьев С.И. (2009). Биологические и физико-химические свойства неионогенных поверхностно-активных веществ. «Российский биотерапевтический журнал». 3, 3–8;
- Леонов В.В., Миронов А.Ю., Ананьина И.В., Рубальская Е.Е., Сентюрова Л.Г. (2016). Микробные сидерофоры: строение, свойства и функции. «Астраханский медицинский журнал». 4, 24–37;
- А.Е. Abaturov, Т.А. Kryuchko. (2018). Drug limitation of the availability of iron ions for pathogenic bacteria (part 1). CH. 13, 416-424;
- Ethel G. A. Owusu, Alexander J. MacRobert, Imad Naasani, Ivan P. Parkin, Elaine Allan, Elnaz Yaghini. (2019). Photoactivable Polymers Embedded with Cadmium-Free Quantum Dots and Crystal Violet: Efficient Bactericidal Activity against Clinical Strains of Antibiotic-Resistant Bacteria. ACS Appl. Mater. Interfaces. 11, 12367-12378;
- Diego Omar Sanchez Ramirez, Alessio Varesano, Riccardo Andrea Carletto, Claudia Vineis, Ilana Perelshtein, et. al.. (2019). Antibacterial properties of polypyrrole-treated fabrics by ultrasound deposition. Materials Science and Engineering: C. 102, 164-170;
- E. S. Zu, J. O. Ramirez-Fernandez, J. Morales, R. Olayo, J. R. Godinez. (2015). Growth Aligned in Primary Skeletal Muscle Cells on Poly Pyrrole Coated Surfaces by Plasma Polymerization. VI Latin American Congress on Biomedical Engineering CLAIB 2014, Paraná, Argentina 29, 30 & 31 October 2014. 211-214;
- Rossana Boni, Azam Ali, Amin Shavandi, Andrew N. Clarkson. (2018). Current and novel polymeric biomaterials for neural tissue engineering. J Biomed Sci. 25;
- Юсупова Р.И., Курмаева А.И., Потапова М.В., Кулагина Е.М., Барабанов В.П. (2013). Суспензия клеток микроорганизмов как коллоидная система. Часть 2. Поверхностный заряд и электрокинетические свойства дрожжевых и бактериальных суспензий. «Вестник Казанского технологического университета». 4, 189–191.