
Прямая атака в центр опухоли
01 ноября 2011
Прямая атака в центр опухоли
- 1568
- 2
- 2
Прямая атака в центр опухоли!
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Терапия онкологических заболеваний представляет собой огромную трудность для медицины. До сих пор нет однозначного мнения по эффективности того или иного метода терапии. Как известно, опухолевые клетки отличаются в антигенном отношении от нормальных клеток организма. Существует мнение, что раковые клетки индуцируют иммуносупрессивные образования, которые до сих пор полностью не идентифицированы. Главная задача иммунотерапии раковых заболеваний состоит в процессе стимуляции эффекторов и помощников при блокаде или торможении клеток — супрессоров.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
В 80-х годах поиск методов иммунотерапии опухолей идет в следующих направлениях:
- активная иммунизация;
- пассивная, или адоптивная (adopt — принимать), иммунизация;
- неспецифическая стимуляция [1].
В настоящее время главная задача, стоящая перед иммунологами и медициной в целом, заключается в поиске наиболее эффективного способа «векторной доставки лекарственных средств». Решение данной задачи позволит повысить эффективность лечения и уменьшить степень побочных действий за счет уменьшения дозы лекарственного средства, а также решит проблему доставки лекарственного средства непосредственно в область поражения [2]. В качестве переносчиков наиболее перспективно использовать:
- магнитные наночастицы, управляемые внешним магнитным полем;
- золотые наночастицы (самостоятельно или в комплексе);
- биологические объекты (клетки крови, ДНК, бактерии и прочие).
Золото — инертный и биологически совместимый материал. Его можно использовать в качестве составной части композита, осуществляющего векторную доставку лекарственных средств. Важная характеристика золотых наночастиц — сродство к тиоловым и дисульфидным группировкам [3].
При переходе к «наношкале» необходимо учитывать такие параметры, как:
- состав (определяет основные свойства);
- размер (модифицирует свойства);
- размерность (делает частицы неоднородными);
- упорядочение в системе (интеграция свойств в ансамбле нанообъектов) [4].
Это то, что касается технической составляющей. Что касается биологической составляющей, здесь необходимо решить следующие задачи, стоящие перед лекарственным средством:
- поиск клетки-мишени в организме;
- доставка лекарственного средства к клеткам-мишеням;
- проникновение внутрь клетки (ткани) и извлечение содержимого;
- распад на части и выход из организма [5].
В данной работе мною были проанализированы различные подходы для решения этой проблемы (лечение опухоли «изнутри»), а также предложены принципы схем лечения подобных заболеваний.
Для лечения опухолевых заболеваний было предложено много методов, и многие из них успешно применяются. Но до сих пор медицина испытывает затруднение при лечении областей, которые находятся внутри опухоли.
I. Краткий обзор публикаций
1. «Троянский конь: подарок раковым опухолям»
В работе «Троянский конь: подарок раковым опухолям» описано лечение рака груди с использованием макрофагов в качестве векторов для доставки золотых наночастиц [11].
Для решения поставленных задач наиболее привлекательным является использование в качестве «носителей» лекарства клеток самого организма, и прежде всего, клеток иммунной системы. Такие наноконструкции являются наиболее привлекательными тем, что не распознаются иммунной системой как чужеродные.
...При изучении зон некрозов в опухолях были обнаружены нормальные, не раковые, клетки. Это макрофаги... Было предложено начинить наночастицами не непосредственно опухолевые клетки, а моноциты и макрофаги, которые потом внедряются в опухоль, привлеченные остатками мертвых тканей. Взяли золотые оболочки с внутренним диаметром 60 нм, внешним 87 нм. При облучении светом определенной длины такие наночастицы разогреваются благодаря поверхностному плазмонному резонансу, вызывая фотоиндуцированную гибель клеток...

Рисунок 1. Наночастицы золота
Первое, на что следует обратить внимание — это размер (внешний диаметр 87 нм). Как известно, в процессе возникновения и развития онкологических заболеваний клетки ткани подвергаются дедифференцировке и приобретают эмбриональный тип строения. В результате этого появляются эмбриональные антигены, которые во взрослом организме отсутствуют. Данные антигены оказывают иммунизирующее действие на опухоль [1].
Наночастицы золота размером 10–100 нм (87 нм входит в их число) значительно усиливают пролиферацию (деление) эмбриональных стволовых клеток мыши [4]. А это значит, используя наночастицы диаметром 87 нм, мы стимулируем иммунную систему.
Нельзя забывать, что стимуляция всей Т-системы может активизировать и Т-супрессоры. Это отрицательно сказывается на эффективность противоопухолевого иммунитета, функции которого нарушаются при онкологических заболеваниях. Поэтому стимуляция иммунитета при онкологических заболеваниях иногда противопоказана ввиду возможного отягощения процесса [1]. Не лучше ли использовать наночастицы размером больше 100 нм, которые не оказывают влияние на стволовые клетки [4]?
Для золотых наночастиц длина волны плазмонного резонанса составляет 520 нм [6]. Как известно, раковые клетки вырабатывают повышенное содержание перекиси водорода, так как имеет место хроническое воспаление. Вследствие этого раковые клетки отмирают от недостатка кислорода и питательных веществ [7].
При воздействии света (фотоиндукция) происходит разложение перекиси водорода и образуется кислород. Поглощение света сопровождается увеличением внутренней энергии атомов или молекул вещества. Количество поглощенной молекулой энергии зависит от длины волны света. Наиболее активные — лучи фиолетового спектра (λ=400 нм, Е=71 ккал/моль — количество энергии, поглощаемой одним молем), наименее активны «красные» лучи (λ=750 нм, Е=38 ккал/моль) [8]. То есть в процессе лечения, мы активизируем процессы непосредственно в очаге поражения (λ=520 нм), не затрагивая иммунную систему в целом (λ=754 нм).
Однако данным метод нежелательно применять для лечения метастазирующих заболеваний.
2. «Нанотехнологические попутчики в крови»
...Полимерные частицы могут долго циркулировать в крови в том случае, если они присоединены к красным кровяным тельцам. На циркуляцию красных кровяных телец наночастицы не влияют. Частицы, прикрепленные к красным кровяным тельцам, избегают фагоцитоза за счет того, что тельца ускользают от фагоцитов...
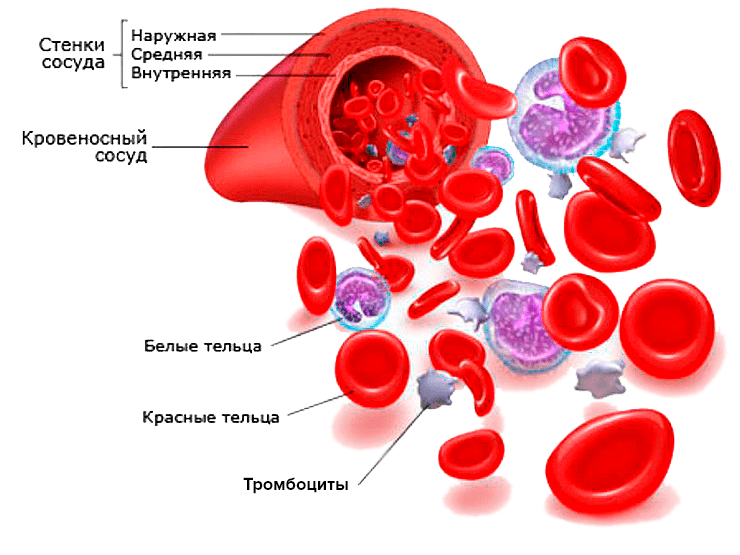
Рисунок 2. Форменные элементы крови и строение кровеносного сосуда
Не проще ли было бы заменить эритроциты липосомами размерами 0,2–0,4 мкм с иммобилизированным гемоглобином [9]? Рассмотрим эритроцит как сумму антигенных веществ эритроцита. Как известно, антигены, модифицированные различными группировками могут инициировать срыв естественной толерантности по отношению к немодифицированному аутоантигену и обеспечить развитие аутоиммунной реакции [1].
Делая вывод, необходимо заметить, что «внедриться и обмануть» иммунную систему — идея хорошая, но в данном случае всегда имеется риск возникновения аутоиммунной реакции. Это относится как к красным кровяным тельцам, так и к белкам, ДНК, то есть ко всем субстанциям, обладающим антигенными свойствами.
3. «Там, где антибиотики бессильны»
...Фототермическое разрушение клеток в настоящее время является перспективным направлением, как при терапии рака, так и в лечении инфекционных заболеваний. Суть явления такова: наночастицы золота имеют максимум поглощения в ближней инфракрасной области, и при облучении соответствующим светом сильно разогреваются. Если они при этом находятся внутри или вокруг каких-либо клеток (чего можно добиться путем конъюгации золотых частиц с антителами или другими молекулами), то эти клетки гибнут...
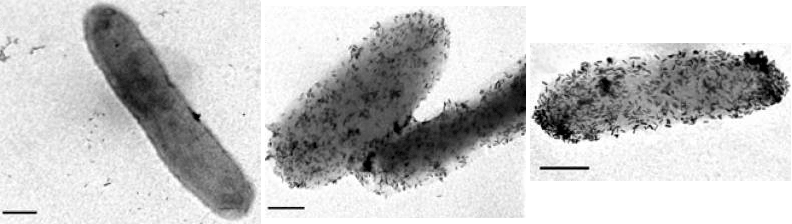
Рисунок 3. Взаимодействие конъюгированных с антителами наночастиц с клетками P. aeruginosa
В раковых и воспалительных клетках рН (водородный показатель) значительно снижен, и если даже антитело сможет «подвести» золотую частицу к пораженной области, не факт, что они смогут попасть в центр очага, так как взаимодействие антитело — антиген происходит только в среде электролитов, оптимальная концентрация которых соответствует 0,85% раствору хлорида натрия. При этом рН должен быть близок к нейтральному значению [1]. То есть мы сможем получить лечение «периферийных областей» без воздействия на центр очага.
4. «Применение функциональных наноматериалов»
...С помощью фосфолипидных везикул — липосом оказалось возможным осуществить направленный транспорт лекарственных веществ по сосудистому руслу, а в случае внедрения в них магнитных наночастиц — еще и концентрировать их в злокачественных клетках под действием внешнего магнитного поля...
Как было сказано выше, раковые клетки вырабатывают повышенное количество перекиси водорода [7]. Перекись водорода в присутствии ионов железа продуцирует гидроксильные радикалы, что инициирует перекисного окисления липидов в мембранных клетках. В результате этого липосомы увеличивают свои размеры и начинают сливаться. Перекисное окисление липидов способствует усилению антибактериальной активности липидных везикул. Избежать или хотя бы уменьшить процесс перекисного окисления липидов можно внедрение в оболочку липосом антиоксидантов.
Но вместе с тем, различные компоненты крови (липопротеиды, сывороточный альбумин, глобулины, белки системы комплемента и протромбиновый комплекс плазмы) оказывают на липосомы дестабилизирующее действие, что в ряде случаев ведет к их разрушению. В результате введения в состав бислойных липидных мембран холестерина и сфингомиелина можно повысить стабильность липосом [9].
Поэтому, учитывая тот факт, что лекарственное средство нужно доставить внутрь опухоли и единственным способом является гематогенный путь, без дополнительной модификации липосом обойтись нельзя.
5. «Противоопухолевые ДНК-вакцины»
Обсуждаются ДНК-вакцины для иммунотерапии рака. Одним из способов доставки названо использование липосом в качестве «контейнеров» для лекарственного средства. Но в данном случае снова необходимо учитывать дестабилизирующее действие компонентов крови [10].
Для придания липосомам сродства к определенным органам, тканям и клеткам макроорганизма на их поверхности иммобилизуют антитела против указанных антигенов указанных образований и различные соединения, препятствующие поглощению липидных везикул макрофагами, клетками печени и других паренхиматозных органов. Также, когда необходимо направить липосомы с лекарственным препаратом в обход печени, других паренхиматозных органов и макрофагов, используют ряд приемов, обеспечивающих блокирование ретикулоэндотелиальной системы [9]. Но в нашем случае задача усложняется тем, что внутри опухоли находятся исключительно макрофаги. Поэтому описанные выше 2 способа, не подходят.

Рисунок 4. Схематическое изображение ДНК
Необходимо решить, каким способом «заставить» макрофаги «проглотить» наноконтейнер, а также доставить его в нужное место? Как известно, для предотвращения захвата макрофагами и клетками печени липосомы покрывают сиаловыми кислотами (N — ацильными производные нейраминовой кислоты) или фиксируют на их поверхности сиалогликопротеиды, например, фетуин. Бислойные липидные везикулы, покрытые амилопектинами или маннаном, усиленно эндоцируются макрофагами и при внутривенном введении морским свинкам с повышенной эффективностью накапливаются в легких, а липосомы, покрытые полиэтиленгликолем, — в очагах воспаления макроорганизма.
II. Возможные конструкции биоконъюгатов, способные к «лечению опухоли изнутри»
Так как одной из главных причин возникновения онкологического заболевания является нарушение действия иммунной системы, то иммунотерапия такого заболевания должна проводиться с учетом всех параметров иммунитета. Поэтому необходимо учитывать не только принципы биосовместимости, но и принципы биодеграции молекул — переносчиков. Но сложность данного подхода заключается в том, что одновременно надо исключить возможность проявления аутоиммунной реакции. С появлением в печати новости, что внутри опухоли, кроме раковых клеток, находятся еще и «здоровые» макрофаги, дает ключ к разгадке эффективной иммунотерапии онкологических заболеваний. Варьируя те или иные композиции можно создать лекарство для терапии раковых заболеваний. Этот подход обеспечивает терапию «внутренних областей» опухоли, которые до недавнего времени казались «закрытыми» для действия лекарственных средств.
Способ 1. Биоконъюгат
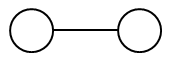
Рисунок 5. Схема биоконъюгата
Первая липосома — пустая и покрыта полиэтиленгликолем. Так как раковые заболевания сопровождаются хроническим воспалением, то бислойные липидные везикулы, покрытые полиэтиленгликолем, усиленно эндоцируются макрофагами и накапливаются в раковых областях.
Вторая липосома покрыта сиаловыми кислотами, которые предотвращают захват макрофагами и клетками печени липосом. Наноконтейнер, содержащий лекарственное средство.
Две липосомы соединены друг с другом.
Почему необходимо использовать именно биоконъюгат, а не отдельные частицы? Макрофаг, захватив первую липосому, «поведет» вторую липосому прямо к месту поражения. Этот комплекс «избегает» иммунной системы за счет того, что первая липосома находится в «макрофаге», вторая покрыта сиаловыми кислотами. Если биоконъюгат минует место поражения, то он все равно не сможет быть захвачен печенью из-за покрытия второй липосомы сиаловыми кислотами.
Плюс этого метода состоит в том, что максимально исключается «холостое хождение» липосом по организму. То есть лекарство направляется прямо в цель и практически исключена передозировка. Кроме, этого, в ответ на внутривенное введение «пустых» липосом нарушается свертываемость крови [9], а это является нежелательным.
Способ 2. Одновременная доставка комплекса липосом
Первая липосома сиалогликопротеиновая (существует защита от макрофагов, содержит лекарственное средство), вторая — содержит фермент, ферментирующий сиалогликопротеины, третья липосома — «вектор». При обработке первой липосомы ферментом ее оболочка становится растворимой. Идея: весь этот комплекс попадает внутрь опухоли. Первой освобождается липосома с ферментом (2), который ферментирует мембрану первой липосомы. Освобождается лекарственное средство.
То есть, при конструировании того или иного лекарства необходимо варьировать именно «захват/отсутствие захвата» макрофагами той или иной части биоконъюгата.
Выводы
Изучение природы онкологических заболеваний, а также методов терапии подобных заболеваний должны быть приоритетными для медицины. Задача усложняется тем, что происходит нарушение иммунитета, который является своеобразным «щитом» для организма. В своей работе я попыталась проанализировать некоторые статьи и публикации, но, учитывая тот факт, что организм является открытой системой, к теории обязательно должна быть «приложена» экспериментальная часть.
Литература
- Петров Р.В. Иммунология. М.: Медицина, 1982. — 368 с.;
- Елисеев А.А. и Лукашин А.В. Применение функциональных наноматериалов. Часть 2: Молекулярная электроника, магнитные носители информации, материалы для бионанотехнологий. Методические материалы. Нанокапсулы. М.: МГУ им. М.В. Ломоносова, факультет наук о материалах, 2007;
- Jie Bao, Wei Chen, Taotao Liu, Yulin Zhu, Peiyuan Jin, et. al.. (2007). Bifunctional Au-Fe3O4 Nanoparticles for Protein Separation. ACS Nano. 1, 293-298;
- Щербаков А. и Савенко Е. (2008). Между нанокорытом и нанокосмосом. «Нанометр»;
- Алексеева О. (2008). «Пуля» или «баркас»? — Углеродные нанотрубки против раковых заболеваний. «Перст». 3, 5–6;
- Fiona McKenzie, Karen Faulds, Duncan Graham. (2007). Sequence-Specific DNA Detection Using High-Affinity LNA-Functionalized Gold Nanoparticles. Small. 3, 1866-1868;
- Dongwon Lee, Sirajud Khaja, Juan C. Velasquez-Castano, Madhuri Dasari, Carrie Sun, et. al.. (2007). In vivo imaging of hydrogen peroxide with chemiluminescent nanoparticles. Nature Mater. 6, 765-769;
- Киреев В.А. Курс физической химии. М.: «Химия», 1975. — 776 с.;
- Ефременко В.И. Липосомы. Ставрополь: Ставропольский научно-исследовательский противочумный институт, 1999. — 238 с.;
- Shaw D.R. and Strong T.V. (2006). DNA vaccines for cancer. Front. Biosci. 11, 1189–1198;
- Mi-Ran Choi, Katie J. Stanton-Maxey, Jennifer K. Stanley, Carly S. Levin, Rizia Bardhan, et. al.. (2007). A Cellular Trojan Horse for Delivery of Therapeutic Nanoparticles into Tumors. Nano Lett.. 7, 3759-3765;
- Chambers E. and Mitragotri S. (2007). Long circulating nanoparticles via adhesion on red blood cells: mechanism and extended circulation. ExpBiol. Med. 7, 958–966;
- R. Sean Norman, John W. Stone, Anand Gole, Catherine J. Murphy, Tara L. Sabo-Attwood. (2008). Targeted Photothermal Lysis of the Pathogenic Bacteria,Pseudomonas aeruginosa, with Gold Nanorods. Nano Lett.. 8, 302-306.






