
Растения, которые делают «кусь!»
08 июня 2020
Растения, которые делают «кусь!»
- 2302
- 0
- 5
Аборигены, встретившиеся с деревом Я-Те-Вео. Рисунок из книги Джеймса Буля (James William Buel) «Земля и море» (1887 год). Рисунок в большом разрешении.
-
Автор
-
Редакторы
Хищные растения всегда привлекали внимание как широкой публики, так и ученых. Одно из первых серьезных исследований хищных растений провел еще Чарльз Дарвин. Он изучал росянку (Drosera) — как устроены ее ловчие листья, чем и как она питается, — и в письме своему другу геологу Чарльзу Лайелю отзывался о ней так: «Сейчас росянка интересует меня больше, чем происхождение всех видов в мире». Ну а широкая публика примерно в те же годы боялась человекоядных деревьев, которых выдумали неизвестные мистификаторы. Итак, кто же они такие — хищные растения — и как дошли до жизни такой?
Всем живым существам необходимы фосфор и азот; большинство растений получают их с помощью корней из растворенных в почве соединений этих элементов. Хищные (еще их называют насекомоядными, но это не совсем правильно — ведь едят они далеко не только насекомых) растения выработали приспособления для получения азота и фосфора из тел насекомых и других мелких животных. Приспособления эти включают структуры для привлечения жертв, их поимки, растворения и всасывания нужных растению соединений. Такая возможность дает этим растениям огромные преимущества для роста на почвах, бедных азотом и/или фосфором, на которых обычные растения расти не могут. Цветковых растений (а хищники встречаются только среди них) около 300 000 видов; из них, по разным оценкам, от 500 до 1000 видов хищных (рис. 1). Способность к хищничеству возникала в эволюционной истории цветковых многократно: так, две крупнейших группы хищных растений — семейства росянковых и пузырчатковых — друг другу не близкородственны.
Иронично, что, хотя хищные растения активно изучал Дарвин — основатель эволюционной биологии, — о них любят говорить креационисты, пытаясь доказать, что эволюции не существует. Такие сложно устроенные новые структуры, как листья-ловушки дарлингтонии или ловчие пузырьки пузырчатки, говорят они, не могли возникнуть иначе как путем творения — ведь никаких промежуточных форм между ними и обычными растениями нет.
Первые опровержения этому дала ботаника: выяснилось, что существуют растения, которые, хотя не являются в строгом смысле хищными, но имеют некоторые из приспособлений «хищников». Например, у них могут быть липкие волоски, с помощью которых они приманивают и ловят насекомых (как у роридулы) или ловчие листья (как у дарлингтонии), но нет ферментов, которые позволяли бы переваривать их. В этом им помогают другие существа — бактерии, как в случае дарлингтонии, или даже другие насекомые, как в случае роридулы . Либо наоборот, у растения может не быть специализированных приспособлений — насекомые просто падают в воду, накапливающуюся в листьях растений, — но есть ферменты. Такое известно у некоторых бромелиевых.
Жуки Pameridea roridulae выработали специальный механизм защиты от прилипания — их клетки выделяют на поверхность кутикулы субстанцию, которая может легко отшелушиваться, и таким образом прилипает она, а не само насекомое [2].
Правда, по мере развития методов исследования некоторые факты о таких «недохищных» растениях пересматриваются — так, до недавнего времени считалось, что у дарлингтонии есть ловушки, но нет пищеварительных ферментов, но позже их все-таки обнаружили [3]. Однако вопрос о том, насколько растение использует свои собственные ферментные системы, а насколько полагается на симбионтов, остается открытым. Это само по себе показывает, что между типичными хищными и обычными растениями есть весь спектр переходных форм.
Дело Дарвина живет и побеждает!
Развитие методов геномики позволило изучать насекомоядные растения на принципиально новом уровне. Очевидно, что столь глубокие изменения в морфологии (развитие структур-ловушек) и биохимии (пищеварительные ферменты) растения должны определяться на уровне генома.
В мае 2020 года в журнале Current Biology вышла статья Пальфалви с соавторами, в которой исследовали геномы трех хищных растений [4]. Все они принадлежат к семейству росянковых: венерина мухоловка (Dionaea muscipula) — у нее ловушки — видоизмененные листья напоминают капкан с захлопывающимися створками или челюсти; альдрованда — водное растение с похоже устроенными, но гораздо более миниатюрными ловушками; и собственно, так полюбившаяся Дарвину росянка (но другой вид) — она приманивает жертв яркими листьями с блестящими каплями, к которым они и прилипают.
Размеры геномов у этих видов сильно различаются — у росянки 323, у альдрованды — 509, а у венериной мухоловки — 3180 м.п.н. (миллионов пар нуклеотидов). А теперь внимание, вопрос: «У кого из них недавно произошла полногеномная дупликация?». Если вы ответили — у венериной мухоловки, то вы неправы! На самом деле у альдрованды, а у венериной мухоловки геном такой большой из-за того, что у нее произошло размножение мобильных элементов. Вставки мобильных элементов, особенно недавние — большая проблема для сборки геномов. Поэтому неудивительно, что второй автор статьи, биоинформатик Томас Хакл, начал работу над геномом венериной мухоловки еще в 2011 году, а статья по результатам вышла только в 2020-м.
Но, как бы ни был труден путь, он привел к успеху. Авторы, собрав геномы всех трех растений, обнаружили, что число генов у них уменьшено : 18 тысяч у росянки и 21 у венериной мухоловки (у альдрованды 25 тысяч, но это из-за дупликации). Уменьшение это обусловлено в основном тем, что теряются многокопийные гены. Однако нашлось 279 ортогрупп (то есть групп генов разных видов, соответствующих одному гену их ближайшего общего предка), в которых у хищных растений генов стало не то что не меньше, а наоборот, сильно больше, чем у обычных растений (рис. 2) [4]. И выяснилось, что среди них гораздо больше «хищных» генов — кодирующих транспортеры азотных и фосфорных соединений, сигнальные пептиды, белки, участвующие в производстве слизи, в синтезе сахаров, необходимых для привлечения жертв.
Так же как и у тоже хищной, но совершенно не родственной им генлизеи, геном которой мы с коллегами изучили в 2013 году [1].
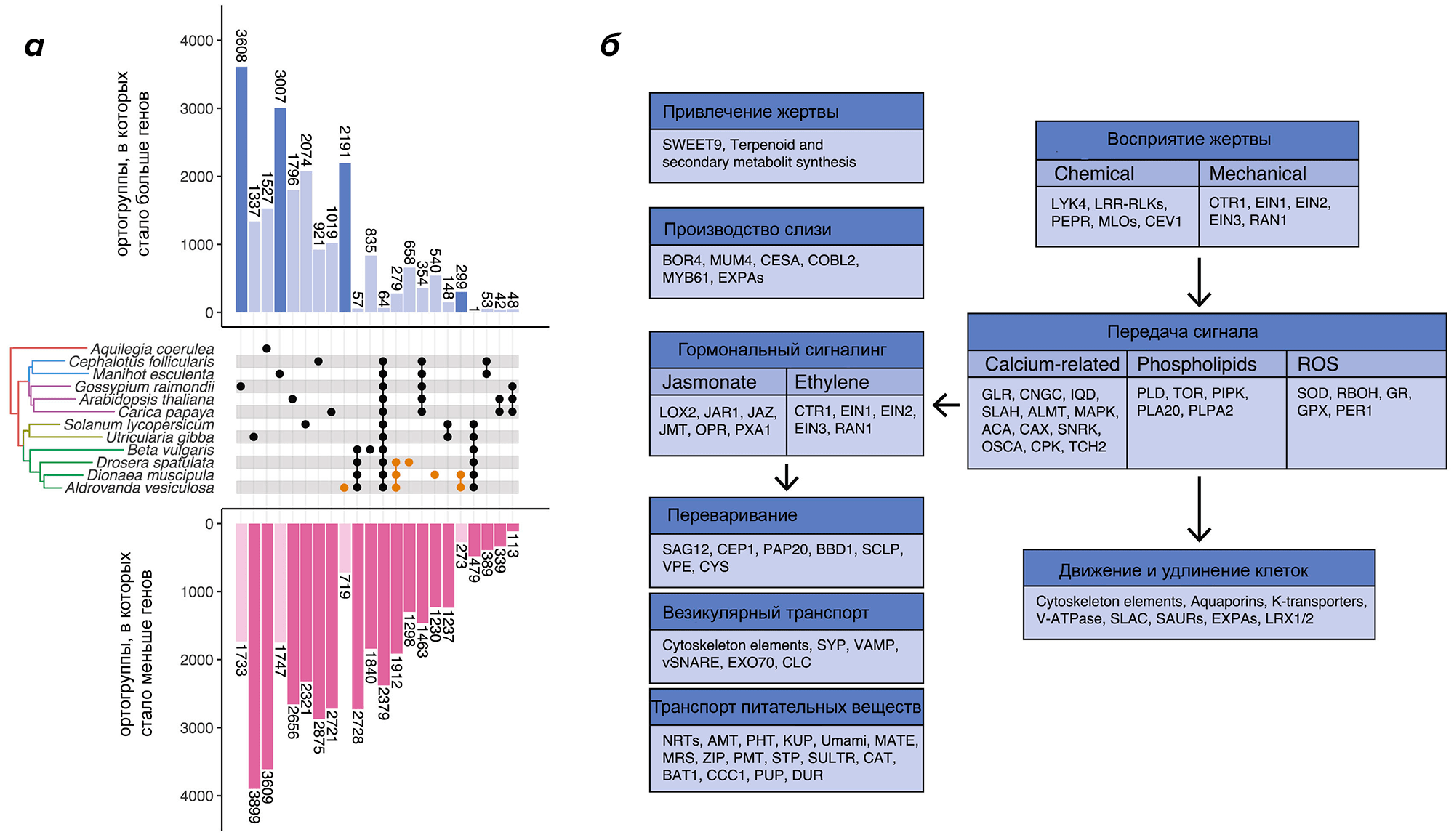
Рисунок 2. Увеличение и уменьшение семейств генов у хищных растений. а — Число ортогрупп, в которых стало больше (синий цвет) и меньше (розовый цвет) генов. Оранжевым цветом выделены случаи, когда изменение числа произошло у всех трех видов растений из семейства росянковых, у двух из трех или только у одного. б — Функциональные группы генов, входящих в число 279 семейств, увеличенных у всех росянковых, и их связь с хищным образом жизни. Стрелки указывают последовательность событий в цикле охоты растения.
Лучшая защита — это нападение
Помимо собственно наличия генов важна их активность. Пальфалви с соавторами изучили транскриптомы ловчих листьев на разных стадиях их работы — в спокойном состоянии, в момент контакта с жертвой и в момент переваривания. Первоначально это сделано было в 2016 году, еще без геномной последовательности, по результатам сборки транскриптома [5]. Авторов той работы интересовал прежде всего набор генов, активирующихся при работе ловушки, и динамика их экспрессии. Они нашли, что при контакте с жертвой повышаются экспрессия генов сигнальных путей, активируемых жасмонатом, и синтез самого жасмоната. Затем наступает следующая стадия — экпрессируются гены, продукты которых необходимы для растворения тела жертвы — хитиназы, протеазы. Также вступают в действие гены белков — транспортеров неорганических ионов.
Секвенирование генома позволило расширить и уточнить эти результаты. Сравнив тканевую специфичность генов, экспрессирующихся в ловчей части листа, авторы показали, что после поимки жертвы начинают экспрессироваться гены, ортологи которых у арабидопсиса работают в корнях [6]. Это понятно — обычные растения получают соединения азота и фосфора из почвы с помощью корней, а хищные — из растворенной добычи с помощью листьев. Наличие собранного генома позволило авторам посмотреть на промоторы генов, ассоциированных с хищностью. Выяснилось, что промоторы генов, повышенно экспрессирующиеся после активации ловушки, обогащены сайтами связывания двух транскрипционных факторов — WRKY6 и WRKY29. У обычных растений эти транскрипционные факторы участвуют в ответе на стресс — как абиотический, так и биотический (в том числе защищая от патогенов и травоядных животных). Это подтверждает точку зрения, что плотоядность у растений возникла как модификация защитных механизмов («лучшая защита — это нападение!») [5]. Интересно, что у всех росянковых находится общая и уникальная для них дупликация генов-ортологов WRKY6, а у альдрованды и у венериной мухоловки еще и общая и уникальная для них (но не для росянки) дупликация WRKY29.
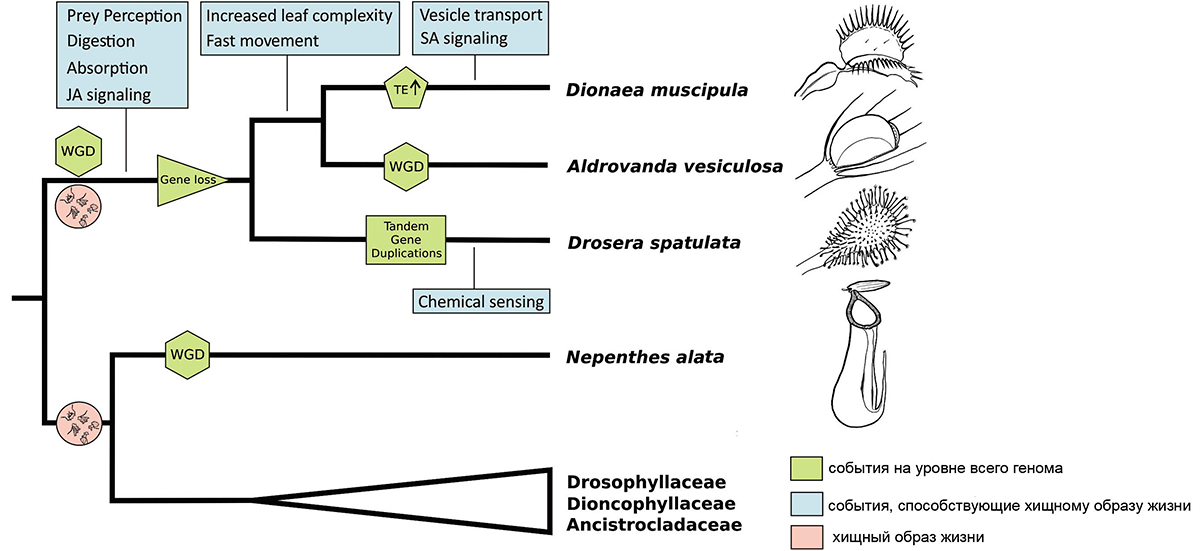
Рисунок 3. Реконструкция ключевых этапов в эволюции хищничества у росянковых. WGD — полногеномная дупликация (whole genome duplication); TE — мобильные элементы (transposable elements).
Авторы сравнили полученные ими данные по геномам росянковых с данными по секвенированию транскриптома другого хищного растения — непентеса (хорошо знакомых многим ярко-красных листьев-кувшинов) и нескольких родственных нехищных растений. Непентес принадлежит к семейству непентовых, которые вместе с еще несколькими мелкими семействами являются сестринской группой росянковых. Результаты филогенетического анализа дают основания считать, что ближайший общий предок этих двух групп уже был хищным растением [7]. Однако геномные данные говорят другое: ортогруппы, общие для росянковых и непентовых, не имеют отношения к хищничеству, а ортогруппы, связанные с хищничеством, уникальны. Из этого авторы делают вывод, что эти группы перешли к хищничеству независимо. Впрочем, с этим выводом не все согласны (реплика Виктора Альберта, специалиста по геномике растений, профессора Университета штата Нью-Йорк в Буффало) [8].
Зная то, насколько сложно и не всегда надежно установление ортологов у растений (особенно по транскриптомным данным и на фоне полногеномных дупликаций), я скорее согласна с теми, кто считает, что для вывода о двух независимых возникновениях нужно больше данных. Есть и другие вопросы, которые интересно было бы изучить — и работа Пальфалви с соавторами дает для этого прекрасную основу. Так, помимо перехода обычных растений к хищничеству в эволюции, видимо, был и обратный переход. Такие изменения, предположительно, происходили в семействе Dioncophyllaceae (принадлежат к той же группе растений, что и росянковые и непентовые, но ближе к непентовым). Из трех родов (в каждом из которых по одному виду) этого семейства один хищный — Triphyophyllum peltatum — и два нехищных. Некоторые изменения, такие как паразитический образ жизни, у растений необратимы, поскольку связаны с потерей большого количества генов, у которых нет дублирования. Хищничество, как мы теперь знаем, возникает в результате более тонких изменений, в основном на уровне регуляции генов и вариаций наборов генов в мультигенных семействах. Поэтому тут возможна большая гибкость, позволяющая переходы и от обычного образа жизни к хищному и обратно.
Литература
- Evgeny V Leushkin, Roman A Sutormin, Elena R Nabieva, Aleksey A Penin, Alexey S Kondrashov, Maria D Logacheva. (2013). The miniature genome of a carnivorous plant Genlisea aurea contains a low number of genes and short non-coding sequences. BMC Genomics. 14, 476;
- D. Voigt, S. Gorb. (2008). An insect trap as habitat: cohesion-failure mechanism prevents adhesion of Pameridea roridulae bugs to the sticky surface of the plant Roridula gorgonias. Journal of Experimental Biology. 211, 2647-2657;
- Marianne Koller-Peroutka, Stefanie Krammer, Anselm Pavlik, Manfred Edlinger, Ingeborg Lang, Wolfram Adlassnig. (2019). Endocytosis and Digestion in Carnivorous Pitcher Plants of the Family Sarraceniaceae. Plants. 8, 367;
- Gergo Palfalvi, Thomas Hackl, Niklas Terhoeven, Tomoko F. Shibata, Tomoaki Nishiyama, et. al.. (2020). Genomes of the Venus Flytrap and Close Relatives Unveil the Roots of Plant Carnivory. Current Biology;
- Felix Bemm, Dirk Becker, Christina Larisch, Ines Kreuzer, Maria Escalante-Perez, et. al.. (2016). Venus flytrap carnivorous lifestyle builds on herbivore defense strategies. Genome Res.. 26, 812-825;
- Модельные организмы: арабидопсис;
- G. Heubl, G. Bringmann, H. Meimberg. (2006). Molecular Phylogeny and Character Evolution of Carnivorous Plant Families in Caryophyllales — Revisited. Plant Biology. 8, 821-830;
- Elizabeth Pennisi. (2020). How Venus flytraps evolved their taste for meat. Science.













