
Счастливая подруга Гарольда: как изменения в геноме пенсионерки привели к утрате болевой чувствительности
09 апреля 2019
Счастливая подруга Гарольда: как изменения в геноме пенсионерки привели к утрате болевой чувствительности
- 940
- 1
- 1
Гарольд, скрывающий боль. Пенсионерка из статьи, которую мы обсуждаем, не скрывает боль. Она ее просто не чувствует.
-
Автор
-
Редакторы
Темы
Случай 66-летней жительницы Великобритании широко разошелся по новостным лентам и удивил многих. У пациентки, которая в течение жизни почти не жаловалась на боль и редко использовала обезболивающие, обнаружили мутации, нарушающие работу фермента, который разрушает эндоканнабиноиды. В результате у нее в крови циркулирует естественный анальгетик. Возможно, ученые открыли перспективное направление для разработки новых лекарств, избавляющих от боли.
Боль — это естественная реакция организма на повреждение тканей. Если мы обожжемся или порежемся, игнорировать это не так-то просто. Боль становится сигналом, сообщающим, что с организмом происходит что-то неправильное. Однако существуют люди, у которых утеряна или значительно снижена болевая чувствительность (ноцицепция). Но нечувствительность к боли (гипоалгезия) — это не суперспособность, а большая проблема для человека. Он может не замечать собственные травмы, и итогом станут значительные проблемы со здоровьем и даже смерть. Боль дана человеку не просто так.
В основе большинства случаев врожденной невозможности испытывать боль лежит патология потенциал-чувствительных натриевых каналов [1]. Из-за мутаций в генах каналов типа Nav1.9 их работа нарушается, и передача сигнала по нервному волокну не происходит должным образом. Таким образом, нарушение ноцицепции происходит в нервном волокне. Но боль — это ощущение, которое до конца формируется в центральной нервной системе. На этом уровне в процессы ноцицепции вовлечены уже не натриевые каналы, а эндоканнабиноидная система нашего организма. Подробно о ней можно прочесть в статье «Каннабиноиды в медицине: тупик или перспективное направление?» [2].
Эндоканнабиноиды — это класс веществ, которые связываются с каннабиноидными рецепторами, расположенными в разных органах нашего тела. В эту группу входят анандамид, пальмитоил- и олеоилэтаноламиды. Воздействие этих веществ на нервную систему человека уменьшает уровень тревоги и боли [3]. Похожий эффект оказывают и эндогенные опиоиды: их воздействие на специфические рецепторы способно уменьшить интенсивность боли [4].
Эндоканнабиноиды синтезируются в ходе длинной цепочки реакций, но нам сейчас важнее процесс их разложения. Ключевой фермент распада эндоканнабиноидов — гидролаза амидов жирных кислот (fatty acid amide hydrolase, FAAH). От ее работы зависит количество веществ, действующих на рецепторы клеток человеческого организма. Чем хуже работает FAAH, тем выше концентрация эндогенных каннабиноидов, и тем слабее будет болевое чувство. Например, мыши с «выключенным» геном FAAH демонстрируют снижение болевой чувствительности [5], а в их мозге отмечено повышенное содержание анандамида.
Фермент FAAH подходит на роль мишени для нового класса обезболивающих у людей. Существующие клинические данные подтверждают, что люди с нарушенной функцией FAAH испытывают менее выраженные болевые ощущения в сравнении с теми, кто обладает «полноценной» версией фермента. У 26% людей встречается вариант однонуклеотидного полиморфизма (аденин вместо цитозина в нуклеотидной последовательности гена; rs324420), который связан со снижением активности FAAH. Женщины, гомозиготные по A-аллели гена FAAH, нуждались в меньшем количестве обезболивающих после операции, проведенной из-за рака груди [6].
В недавно вышедшей статье обсуждается случай 66-летней женщины, которая демонстрировала значительно сниженную болевую чувствительность и уменьшенную потребность в обезболивающих при травмах и после операций [7]. Она страдала формой остеоартрита, которая обычно вызывает сильные боли, но у этой пациентки их не было. При сборе анамнеза выяснилось, что пациентка не раз получала порезы и ожоги, заживавшие практически без следов и при этом безболезненные. Интересная деталь: женщина не испытывала дискомфорта при поедании очень острой пищи. С обезболивающими у пожилой леди тоже были особенные отношения. Из неопиоидных анальгетиков она принимала только парацетамол, а прием морфина вызвал у нее сильную тошноту и рвоту, продлившиеся два дня.
Операцию по поводу остеоартрита проводили со стандартным обезболиванием фентанилом при седации пропофолом. Кроме этих лекарств ей вводили противорвотный препарат ондансетрон, а блокаду аксиллярного нерва проводили левобупивакаином. В послеоперационном периоде пациентка приняла всего 1 грамм парацетамола, а также получила две инъекции еще одного противорвотного — циклизина.
Низкая потребность в обезболивающих препаратах у пенсионерки заинтересовала ученых. Сбор семейного анамнеза позволил узнать, что отец пациентки также редко прибегал к приему анальгетиков, а у ее сына была понижена болевая чувствительность. Изучив ДНК женщины и ее близких, ученые обнаружили изменения в гене фермента FAAH и псевдогене FAAH-OUT, который находится возле него (табл. 1). У пациентки сочетались микроделеция в псевдогене и гетерозиготность по А-аллелю гена FAAH. У ее сына не обнаружили гетерозиготность по А-аллелю гена FAAH, но выявили микроделецию в псевдогене FAAH-OUT. У матери пациентки и ее дочери с нормальной болевой чувствительностью подобных изменений в ДНК не нашли.
| Гипоалгезивный фенотип | Микроделеция в FAAH-OUT | Гетерозиготность FAAH SNP (rs324420) | |
|---|---|---|---|
| Пациентка | Полный | + | + |
| Мать пациентки | Отсутствует | – | + |
| Сын пациентки | Частичный | + | – |
| Дочь пациентки | Отсутствует | – | + |
Оказалось, что в случае этой семьи на болевую чувствительность большее влияние оказывают изменения в псевдогене FAAH-OUT, чем в гене, кодирующем сам фермент. Микроделеция в FAAH-OUT у пациентки привела к потере его промоторной области и двух первых экзонов. Пока не очень понятно, как это способно повлиять на работу гена FAAH, поскольку данные совсем свежие. Сейчас существует два возможных объяснения.
Первое: микроРНК, возникающие на основе FAAH-OUT — это «приманки», защищающие матричные РНК гена FAAH от разрушения [8].
Второе объяснение строится на том, что белок, зашифрованный в гене FAAH-OUT, регулирует активность транскрипции гена FAAH при помощи эпигенетических механизмов.
Дальнейшие исследования помогут разобраться в этой проблеме.
Анализ концентрации эндоканнабиноидов в крови пациентки показал их повышенное содержание. Изменения в гене FAAH и псевдогене FAAH-OUT привели к увеличению уровня анандамида на 70%, а пальмитоилэтаноламида и олеоилэтаноламида на 300% по сравнению с контролем (рис. 1).
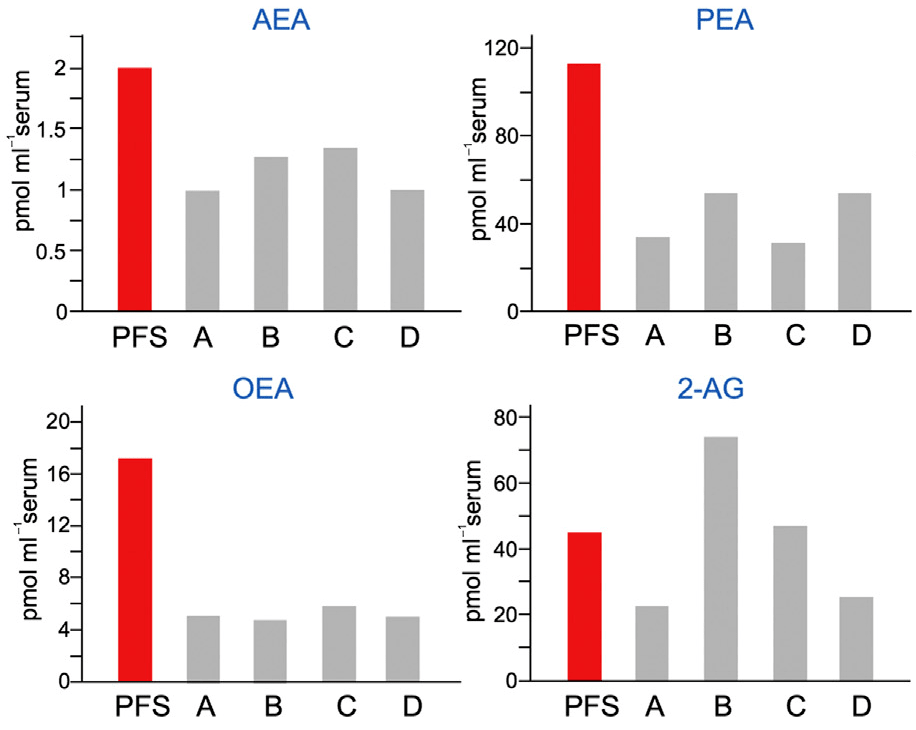
Рисунок 1. У нечувствительной к боли пациентки повышен уровень эндогенных каннабиноидов в крови. Уровни трех эндогенных каннабиноидов — анандамида (AEA), пальмитоил- и олеоилэтаноламида (PEA и OEA соответственно) — выше у пациентки (PFS), чем у остальных участников эксперимента, взятых для сравнения. Отличаются значения 2-арахноидилглицерола (2-AG), но это не расходится с существующими данными: 2-арахноидилглицерол хуже, чем остальные эндоканнабиноиды, распадается под воздействием фермента FAAH [9]. Участники A и B — гомозиготные носители А-аллеля (малофункционального) гена FAAH. Участники C и D — гетерозиготные носители этого варианта гена.
Почему так произошло, что пациентка чувствует боль не так остро, как остальные люди? Самая очевидная причина этого в свете полученных данных — повышение уровня эндоканнабиноидов из-за дефекта работы фермента FAAH. Этот клинический случай открывает пространство для поиска новых анальгетиков. К настоящему времени уже были исследованы препараты, ингибирующие FAAH и создающие препятствие к распаду анандамида и других амидов жирных кислот. Один из ингибиторов FAAH не показал эффективности выше, чем плацебо при артрите коленных суставов [10]. Вторая молекула, обратимый ингибитор FAAH, привела к ужасным результатам [11]. В пилотном исследовании лекарство принимали четыре человека, и у троих из них развились острые неврологические расстройства. Нарушения речи, зрения, снижение памяти и ряд других симптомов сопровождались очаговыми поражениями в мозге пациентов (рис. 2). В итоге один из четверых участников исследования умер.
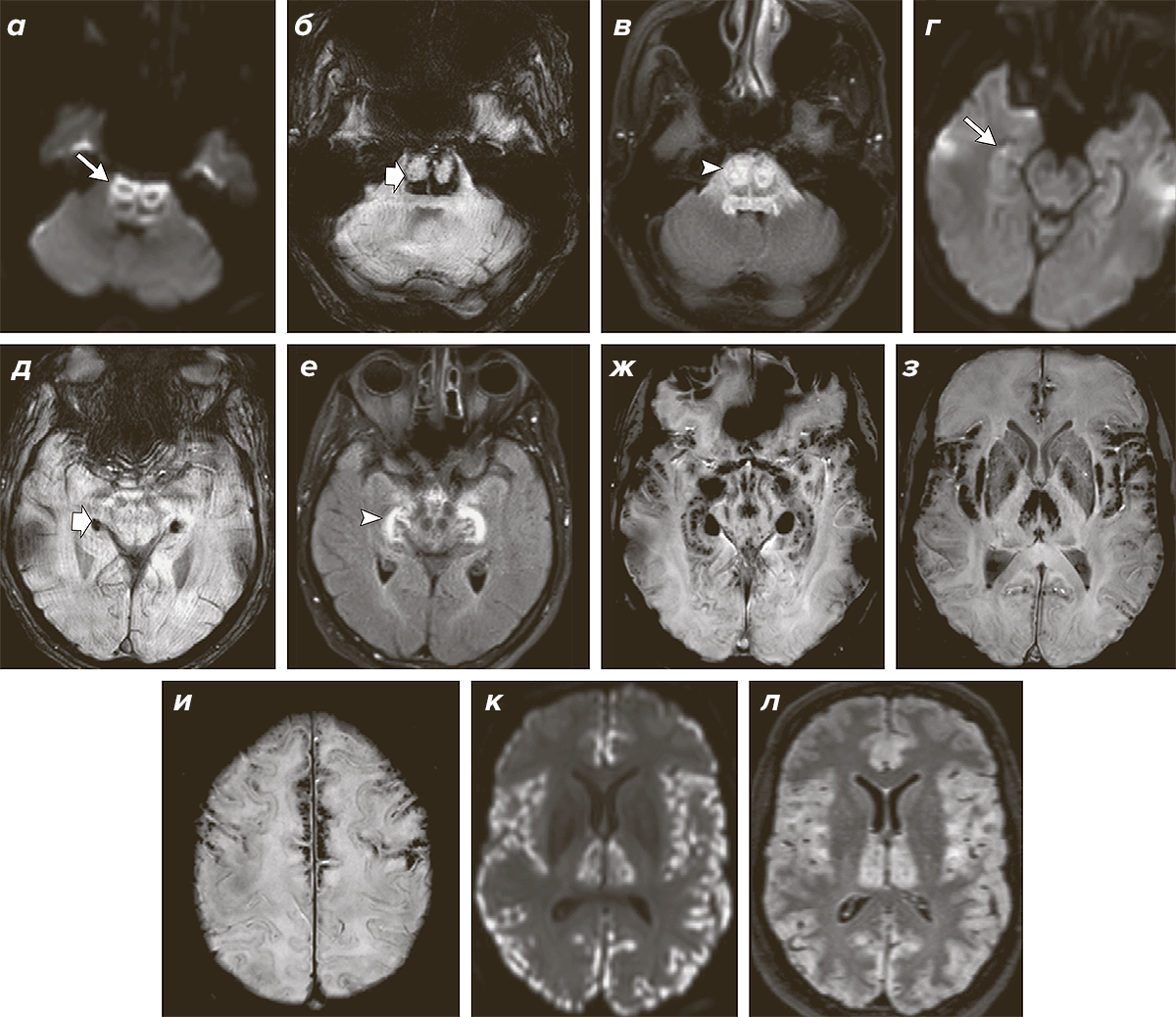
Рисунок 2. Нарушения в мозге, вызванные приемом экспериментального обезболивающего — ингибитора FAAH. На компьютерной томограмме мозга одного из пациентов, принимавшего ингибитор фермента FAAH, видны множественные очаги поражения (белые участки, показанные стрелками). Патологическим процессом оказались затронуты многие части головного мозга пациента: глубокие (а, в, е) и корковые отделы (к и л). Пока не ясно, почему возникло поражение головного мозга после приема препарата.
Несмотря на неудачи и трагические последствия испытаний уже известных молекул, свежее исследование дает новый подход к работе с ферментом FAAH как методу обезболивания. Ученые отмечают, что прямое ингибирование фермента у людей не вызывает такого же эффекта, как у животных. Значит, нам нужен более хитрый путь, косвенно вмешивающийся в работу эндоканнабиноидной системы головного мозга.
Случай британской пациентки демонстрирует, что подавление активности фермента может осуществляться через вмешательство в работу псевдогена, расположенного «по соседству». Исследуя альтернативный путь, мы можем создать новый класс анальгетиков, а люди получат еще одно лекарство в борьбе с болью. Возможно, польза будет еще и для пациентов психиатрических клиник, ведь эта женщина была поразительно жизнерадостна и почти не испытывала тревоги даже по самым опасным поводам — в противоположность герою интернет-мема Гарольду, скрывающему свою боль (именно он изображен на заглавной картинке к этой статье). Кроме телесной боли вмешательство в работу FAAH может дать лекарство и для боли душевной.
Литература
- Voraluck Phatarakijnirund, Steven Mumm, William H. McAlister, Deborah V. Novack, Deborah Wenkert, et. al.. (2016). Congenital insensitivity to pain: Fracturing without apparent skeletal pathobiology caused by an autosomal dominant, second mutation in SCN11A encoding voltage-gated sodium channel 1.9. Bone. 84, 289-298;
- Каннабиноиды в медицине: тупик или перспективное направление?;
- Raphael Mechoulam, Linda A. Parker. (2013). The Endocannabinoid System and the Brain. Annu. Rev. Psychol.. 64, 21-47;
- Yingxue Li, Mark R Lefever, Dhanasekaran Muthu, Jean M Bidlack, Edward J Bilsky, Robin Polt. (2012). Opioid glycopeptide analgesics derived from endogenous enkephalins and endorphins. Future Medicinal Chemistry. 4, 205-226;
- Aron H Lichtman, Christopher C Shelton, Tushar Advani, Benjamin F Cravatt. (2004). Mice lacking fatty acid amide hydrolase exhibit a cannabinoid receptor-mediated phenotypic hypoalgesia. Pain. 109, 319-327;
- Kristiina Cajanus, Emil J. Holmström, Maija Wessman, Verneri Anttila, Mari A. Kaunisto, Eija Kalso. (2016). Effect of endocannabinoid degradation on pain. PAIN. 157, 361-369;
- Abdella M. Habib, Andrei L. Okorokov, Matthew N. Hill, Jose T. Bras, Man-Cheung Lee, et. al.. (2019). Microdeletion in a FAAH pseudogene identified in a patient with high anandamide concentrations and pain insensitivity. British Journal of Anaesthesia;
- Margaret S. Ebert, Phillip A. Sharp. (2010). Emerging Roles for Natural MicroRNA Sponges. Current Biology. 20, R858-R861;
- Vincenzo Di Marzo, Mauro Maccarrone. (2008). FAAH and anandamide: is 2-AG really the odd one out?. Trends in Pharmacological Sciences. 29, 229-233;
- John P. Huggins, Trevor S. Smart, Stephen Langman, Louise Taylor, Tim Young. (2012). An efficient randomised, placebo-controlled clinical trial with the irreversible fatty acid amide hydrolase-1 inhibitor PF-04457845, which modulates endocannabinoids but fails to induce effective analgesia in patients with pain due to osteoarthritis of the knee. Pain. 153, 1837-1846;
- Anne Kerbrat, Jean-Christophe Ferré, Pierre Fillatre, Thomas Ronzière, Stéphane Vannier, et. al.. (2016). Acute Neurologic Disorder from an Inhibitor of Fatty Acid Amide Hydrolase. N Engl J Med. 375, 1717-1725.





