
Сегодня друг, завтра враг: какие перспективы открывают активные формы кислорода при разработке терапии против рака
20 марта 2025
Сегодня друг, завтра враг: какие перспективы открывают активные формы кислорода при разработке терапии против рака
- 273
- 0
- 5
Сегодняшний день для раковых клеток (картинка слева): активные формы кислорода «радуют» опухолевую клетку. И завтрашний день (картинка справа): те же активные формы кислорода уже являются угрозой для раковой клетки.
Рисунок в полном размере.
рисунок автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В живых организмах образуется огромное количество веществ. Одни вещества идут на постройку клеток и регуляцию процессов в них, другие являются ненужными и выбрасываются наружу, третьи представляют определенную угрозу для организма и нуждаются в немедленной нейтрализации или выделении. Но есть и такие необычные вещества, которые относятся сразу к нескольким группам. Такими веществами являются активные формы кислорода (АФК). С одной стороны, они образуются в митохондриях как побочные продукты, с другой стороны, они также необходимы в регуляции жизнедеятельности клеток. Однако у активных форм есть и темная сторона, а именно — они могут проявлять активное участие в развитии злокачественных заболеваний. В данном обзоре будет рассмотрено, насколько АФК являются «надежными друзьями» для раковых клеток, и каким образом их «помощь другу» может иметь обратный эффект.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое АФК и зачем они образуются в клетках?
С тех пор как сине-зеленые бактерии изобрели кислородный фотосинтез, мы находимся в чрезвычайно агрессивной окислительной среде [1]. Правда, сам по себе кислород не представляет особой опасности для нас, однако иногда в процессах неполного окисления кислород превращается в частично восстановленные или возбужденные формы атмосферного кислорода, то есть в активные формы кислорода, к которым относятся 1O2,OH⁻,H2O2 др [1]. И вот тогда эти молекулы поистине становятся страшными окислителями, взаимодействуя с любой органикой, встретившейся на пути: белками, жирами, углеводами, нуклеиновыми кислотами [1]. Таким образом, АФК могут разрушать молекулы ДНК, РНК, белков, что приводит к изменениям в клетке или ее гибели. Поэтому из-за своей высокой реакционноспособной природы АФК считаются токсичными веществами в клетке. Тем не менее, активные формы кислорода постоянно образуются во многих частях клетки, в особенности в митохондриях и хлоропластах вследствие биохимических процессов с участием кислорода, которые протекают в этих органеллах. Как оказалось, именно из-за стремления активных форм кислорода прореагировать со всеми веществами они способны выполнять ряд важных задач, поддерживающих нормальную жизнедеятельность как животных, так и растительных клеток. К таким задачам относятся стрессовая сигнализация для регулирования окислительно-восстановительного баланса, от которого зависят многие процессы в клетке, и для поддержания физиологических функций в клетке, а именно: деление клеток, их дифференциация, обмен веществ и так далее [2].
АФК как обоюдоострый меч в борьбе с раком
Если баланс допустимой концентрации АФК нарушается и начинается их накопление, этот процесс нередко становится началом канцерогенеза (превращение нормальных клеток в раковые). Это связано с тем, что большие количества АФК, во-первых, вызывают повреждения в ДНК, во-вторых, способствуют накоплению этих повреждений, так как активные формы кислорода препятствуют активации ферментов репарации (восстановления) ДНК, что в дальнейшем приводит к необратимым изменениям в генетической информации будущих клеток, и в конечном итоге возникают раковые клетки [3]. Несмотря на все изменения в опухолевых клетках, они по-прежнему, как и нормальные клетки, умеют получать пользу для своего развития из различных видов АФК. Высокая концентрация АФК служит хорошим стимулятором для размножения больных клеток и не доводит их до состояния умерщвления из-за подавляющих АФК механизмов в самом организме. Начиная с 1990-х годов, исследования подготовили почву для концепции, что АФК являются движущим фактором опухолеобразования [3]. Одной из важных характеристик раковых клеток является их повышенный уровень АФК по сравнению с уровнем в их здоровых клетках. При поддержании такого уровня АФК в раковых клетках обеспечивается активный рост, пролиферация и распространение больных клеток. В результате необходим также и повышенный уровень антиоксидантов для детоксикации накопленных АФК с целью восстановления окислительно-восстановительного баланса [3]. Тем не менее, раковые клетки при высокой концентрации АФК также не могут избежать своей гибели, что и является важным моментом в применении форм кислорода при разработке новой терапии лечения рака. Поэтому важно разобраться в роли АФК при развитии рака, чтобы разрабатывать новые методы терапии с применением свойств этих уникальных молекул.
Как активные формы кислорода помогают злокачественными клеткам?
Как только равновесие регуляторной системы АФК в организме нарушается, переизбыток АФК может привести к тяжелому окислительному стрессу, включающему разрушение химических связей биомолекул, изменение структурных свойств белков и ферментов, нуклеиновых кислот и липидов, и, следовательно, вызвать дисфункцию клеточного метаболизма и мутацию [3]. Раковые клетки стремятся к быстрому размножению, развитию и созданию для себя благоприятного микроокружения и оптимальных условий, поэтому из-за активного метаболизма они продуцируют гораздо большее количество активных форм кислорода, чем здоровая клетка. Таким образом, такие клетки способны быстро размножаться и поддерживать стабильность клеточных процессов даже при повышенных концентрациях АФК. Чтобы адаптироваться к этой среде повышенного окислительного стресса, опухолевые клетки усиливают свою антиоксидантную способность [3]. Такая защита от излишков активных форм кислорода осуществляется с помощью антиоксидантов, способных к расщеплению активных форм кислорода; к таким антиоксидантам относится, например, каталаза — фермент, ответственный за разложение перекиси водорода [4]. Также антиоксидантная защита происходит путем отдачи антиоксидантом своих электронов, за счет чего происходит нейтрализация заряда у активных форм кислорода, и те, в свою очередь, перестают быть активными окислителями [4]. Так опухолевые клетки регулируют количество активных форм кислорода, предотвращая нарушения активности клеточных процессов и налаживая оптимум и стабильность процессов, в которых участвуют АФК. Но при этом уровень АФК в них все равно остается выше, чем в обычных клетках. С одной стороны, такой уровень активных форм кислорода стимулирует не только пролиферацию клеток, но и метастазирование, так как АФК способны активировать образование различных молекул, например, MAPK (митоген-активируемая протеинкиназа), некоторые из таких выработанных молекул помогают раковым клеткам запускать пути формирования метастатических колоний, их дальнейшее попадание в кровоток и закрепление в новых здоровых тканях [3], [5]. С другой стороны, превышающие норму для раковых клеток концентрации АФК могут подавлять рост и выживание клеток, запуская запрограммированную гибель клеток [3].
Как АФК стали опасным неприятелем для раковых клеток?
Как было выше сказано, АФК включают в себя множество функций с противоположными эффектами в прогрессировании и терапии рака. Когда накопление АФК превышает точку невозврата, их роли в канцерогенезе, пролиферации и инвазии смещаются к противоопухолевым. Это происходит посредством запуска запрограммированной гибели клеток. Запрограммированная клеточная гибель включает несколько видов, в том числе апоптоз, некроптоз и аутофагию.
Апоптоз
Апоптоз — это не только естественный механизм устранения поврежденных клеток, но и желаемый результат использования противоопухолевых препаратов. Апоптоз постоянно запускается в клетках, в которых что-то пошло не так — например, повреждена ДНК или не работают необходимые белки [6]. Процесс апоптоза стимулируется специфическими цистеиновыми протеазами, которые относятся к группе ферментов, расщепляющих молекулы белка до аминокислот. К группе таких ферментов относятся каспазы [7]. Апоптоз, вызванный каспазой, завершается образованием апоптических тел, представляющие собой покрытые мембраной отдельные части клеток. В дальнейшем такие апоптические тела устраняются ближайшими фагоцитами — клетки поглощающие инородные тела [7]. Помимо этого, процессы апоптоза могут быть запущены с помощью активных форм кислорода.
Существует несколько путей запуска апоптоза посредством каспаз и АФК: внешний и внутренний.
Внешний путь апоптоза
Под действием АФК внешний путь (рис. 1) активируется вызывающими смерть лигандами, которые связывают с родственными рецепторами. К ним относятся Fas лиганды и лиганды, связанные с TNF (TRAIL-R1/2), индуцирующие апоптоз [7]. Те, в свою очередь, привлекают прокаспазу-8, прокаспазу-10 и адаптерные белки [7]. В результате связывания образуется сигнальный комплекс, вызывающий смерть, из-за чего начинается активация эффекторных каспаз и запускается апоптоз.
Внутренний путь апоптоза
Высокий уровень АФК способен контролировать запуск процессов, приводящих к апоптозу в клетке. Активные формы кислорода взаимодействуют с электронно-транспортной цепью митохондрий, вызывая высвобождение цитохрома c, являющимся белком-переносчиком электронов [7]. Высвобождение этого белка происходит путем разрыва митохондриальной мембраны и открытия каналов PTP-поры с высокой проницаемостью в митохондриях [7]. Цитохром c, работая с прокаспазой-9 и Apaf-1-фактор активации апоптотической пептидазы (белок, запускающий расщепление белков на аминокислоты) генерируют «апоптосомы», представляющие собой белковые структуры, образующиеся во время апоптоза, которые далее активируют каспазу-9 [7]. В свою очередь, каспаза-9 запускает эффекторные каспазы, расщепляющие непосредственно белки, такие как каспаза-3 и каспаза-7, что приводит к распаду белка и апоптозу [7] (рис. 1).
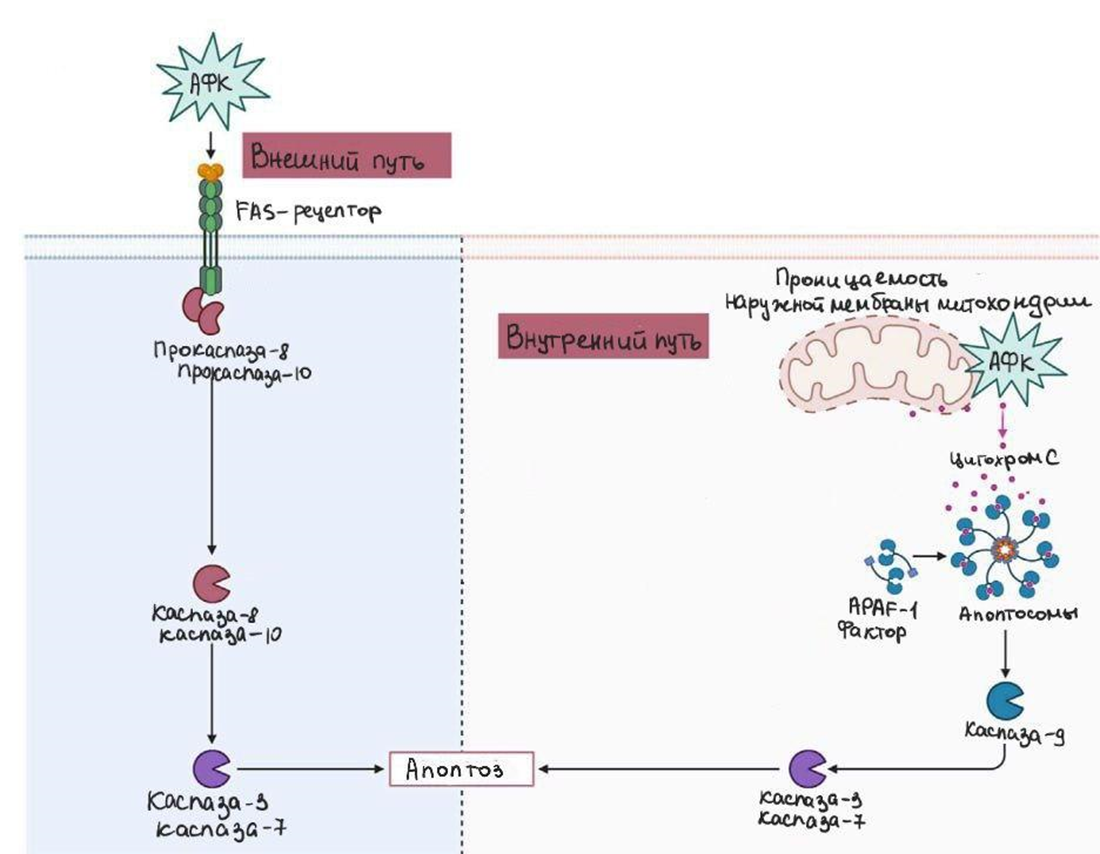
Рисунок 1. Внутренний (справа) и внешний (слева) пути апоптоза. Как может запускаться механизм апоптоза в раковых клетках с помощью АФК.
Кроме того, известно, что повреждение ДНК является ключевым сигнальным путем апоптоза, опосредованным АФК в опухолевых клетках [7]. Повреждение ДНК может быть вызвано лекарственными препаратами противораковой терапии, способными вызывать окислительный стресс [7]. Апоптоз запускается прокарбазином (противораковый препарат), который вызывает окислительное повреждение ДНК, которое не может быть восстановлено системой репарации ДНК, убирающей поврежденные азотистые основания или нуклеотиды, например, при опухолевом заболевании лимфатической системы (лимфома Ходжкина) и глиобластоме [7].
Кроме того, апоптоз может возникнуть в эндоплазматическом ретикулуме (ЭПР) при подавлении или нарушении созревания и сворачивания белков в ЭПР [8]. Поэтому разработано множество препаратов, нацеленных на усиление окислительного стресса в ЭПР раковых клеток путем увеличения АФК. Одним из таких препаратов является бортезомиб — блокатор действия протеасомы (белковые комплексы, разрушающие дефектные белки), который увеличивает количество АФК, приводящих к окислительному стрессу ЭПР в клетках плоскоклеточного рака головы и шеи [8].
Аутофагия
Аутофагия является еще одним механизмом подавления опухолей, который вызывает гибель трансформированных клеток [8]. Аутофагия — процесс самопоглощения, который разрушает старое, дефектное или ненужное содержимое клеток, используя лизосомы для поддержания метаболизма и выживания клеток [9].
Недавно аутофагия на основе АФК была предложена в качестве метода лечения [7]. Сам механизм аутофагии опосредуется многими белками, ответственными за запуск клеточной гибели. Одним из таких белков является протеаза Atg4, белок, влияющий на формирование LC3-ассоциированных аутофагосом (двумембранные структуры с клеточным содержимым, содержащие LC3-липиды) [10]. В процессе развития аутофагосом АФК могут ингибировать работу Atg4, что необходимо для протекания реакций формирования аутофагосом [11]. Так, протеаза Atg4 участвует в сращивании LC3 с образованием цитоплазматического LC3-I [11]. Затем LC3-I присоединяется к фосфатидилэтаноламину (PE) с участием протеаз Atg7 и Atg3 [11]. Липидная версия LC3 или LC3-II, прилипает к мембранам аутофагосом, что в дальнейшем облегчает процесс протекания аутофагии [11].
Недавно аутофагия на основе АФК была предложена в качестве метода лечения [7]. Сам механизм аутофагии опосредуется многими белками, ответственными за запуск клеточной гибели. Одним из таких белков является протеаза Atg4, белок, влияющий на формирование LC3-ассоциированных аутофагосом (двумембранные структуры с клеточным содержимым, содержащие LC3-липиды) [10]. В процессе развития аутофагосом АФК могут ингибировать работу Atg4, что необходимо для протекания реакций формирования аутофагосом [11]. Так, протеаза Atg4 участвует в сращивании LC3 с образованием цитоплазматического LC3-I [11]. Затем LC3-I присоединяется к фосфатидилэтаноламину (PE) с участием протеаз Atg7 и Atg3 [11]. Липидная версия LC3 или LC3-II, прилипает к мембранам аутофагосом, что в дальнейшем облегчает процесс протекания аутофагии [11].
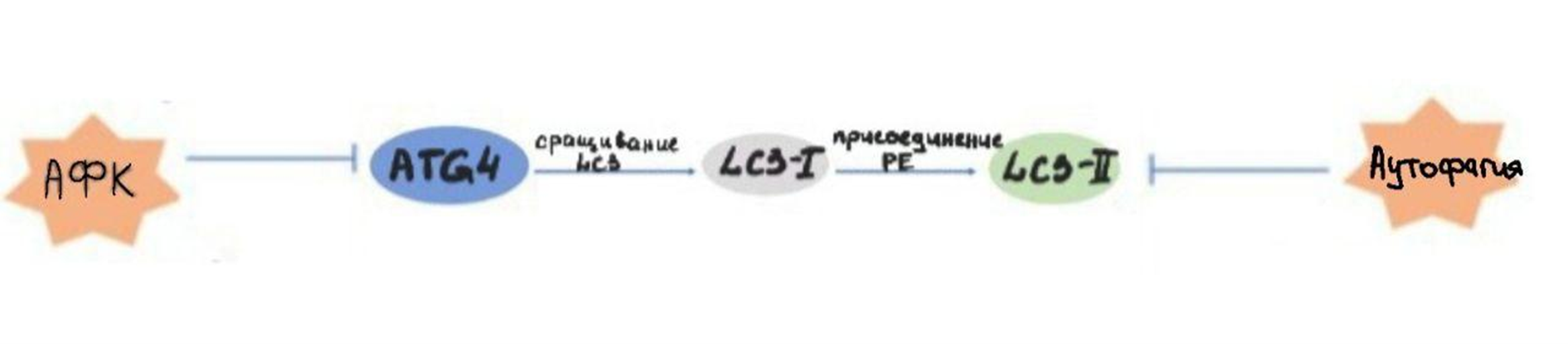
Рисунок 2. Механизм аутофагии. АФК запускает процесс аутофагии, воздействуя на ATG4, который в конце приводит к образованию липида LC3-II, необходимого для образования аутофагосом.
Некроптоз
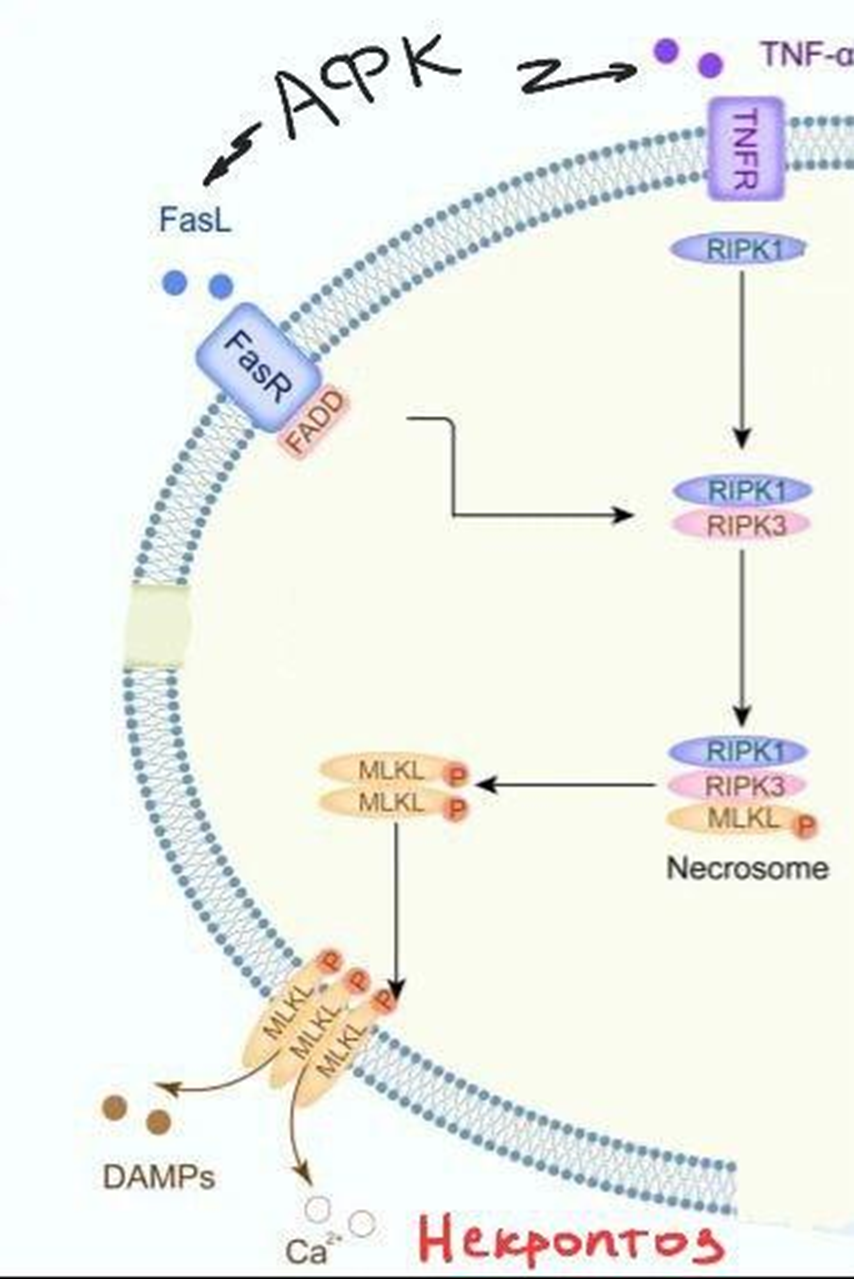
Рисунок 3. Механизм некроптоза. Воздействие АФК на рецепторы FasR и TNFR, их взаимодействие с лигандами FasL и TNF-α. Приводит к дальнейшему взаимодействию рецепторов RIPK1 и RIPK3, что приводит к фосфорилированию MLKL и формированию некросом, которые встраиваются в плазматическую мембрану. Клетка начинает набухать и теряет целостность.
Некроптоз является еще одним видом запрограммированной клеточной гибели, механизм которого может инициироваться способом, аналогичным внешнему апоптотическому пути под действием АФК, образующихся в результате повышения энергетического обмена за счет фермента NADPH-оксидазы (NOX) [12]. Запуск некроптоза осуществляется взаимодействием рецепторов гибели клеточной поверхности (FasR, TNFR) с их соответствующими лигандами [8]. Некроптоз как регулируемая форма некроза (повреждение клеток, приводящее к их гибели) зависит от фосфорилирования (присоединения остатка фосфорной кислоты) киназоподобных белков смешанного происхождения (MLKL), которое происходит с помощью взаимодействий белка RIPK 3 (рецептор протеинкиназы 3) и рецептором протеинкиназой-1 (RIPK 1) [12]. После взаимодействия рецепторов протеинкиназ 1 и 3 происходит фосфорилирование MLKL с образованием активированного комплекса «некросом», который переносится в плазматическую мембрану [12]. В конечном итоге это приводит к гибели клеток, характеризующейся проницаемостью плазматической мембраны, последующем набуханием клеток, потерей целостности клеток и органелл [12].
Подходы терапии, разработанные благодаря активным формам кислорода
Существует множество противораковых методов, создающих АФК, которые используются в терапии рака. Далее пойдет обзор, посвященный некоторым методам терапии, вошедших в клинические испытания, а именно: фотодинамическая терапия и радиотерапия, связанные с активно развивающимися нанобиотехнологиями.
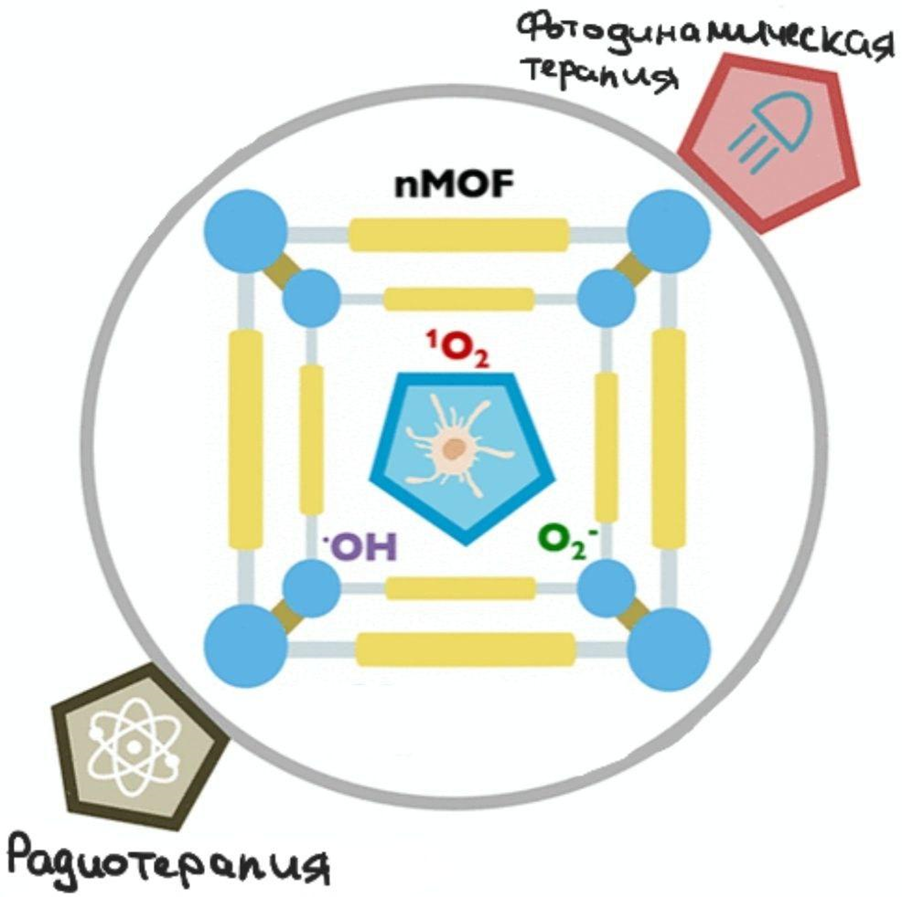
Рисунок 4. nMOF в радиотерапии и фотодинамической терапии, способствуют выработке АФК.
Фотодинамическая терапия
Фотодинамическая терапия (ФДТ) — это лечение, которое использует силу активных форм кислорода (например, 1O2), генерируемых фотосенсибилизаторами (ФС), для борьбы с опухолями [13].
Фотодинамическая терапия (ФДТ) — это лечение, которое использует силу активных форм кислорода (например, ¹O₂), генерируемых фотосенсибилизаторами (ФС), для борьбы с опухолями [13]. Фотосенсибилизаторы — соединения, способные поглощать определенные длины волн ультрафиолетового света, что приводит к образованию свободных радикалов и инициированию фотополимеризации (изменение свойств вещества под действием света). При облучении фотосенсибилизаторы активируются и передают энергию кислороду, что приводит к образованию активных форм кислорода [13]. Вызывая окислительный стресс, фотодинамическая терапия стимулирует активацию врожденных иммунных клеток и экспрессию IL-1 (интерлейкин-1- цитокин (белок) регулирует процессы воспаления и иммунитета) и IL-6 (интерлейкин-6- цитокин, создает иммунный ответ при заболеваниях) [13].
Наноразмерные металлоорганические структуры и фототерапия создают АФК
За последние 15 лет был достигнут огромный прогресс в области нанотехнологий в области рака, и несколько наночастиц достигли клинических испытаний (NCT05838729 и NCT03444714) для лечения рака [14]. Среди этих наночастиц есть наноразмерные металлоорганические каркасы (nMOF), класс органо-неорганических наноматериалов. nMOF построены из участков связывания металлов и мостиковых лигандов, которые привлекли значительное внимание своей структурной и композиционной настраиваемостью, многофункциональностью и биосовместимостью, совмещенные в единый наноматериал для терапии рака [14].
Фотодинамическая терапия обеспечивает высокоэффективную локальную терапию рака с использованием активных форм кислорода, которые генерируются из комбинации трех нетоксичных по своей сути компонентов: фотосенсибилизаторов, света и тканевого кислорода [13]. При лечении рака фотосенсибилизаторы обычно накапливаются в опухолевой ткани, а затем лазер используется для облучения места расположения опухоли для получения большого количества АФК и последующего уничтожения опухолевых клеток. Реактивные формы, образующиеся в процессе ФДТ, могут убивать раковые клетки напрямую через апоптоз, некроз или аутофагию. Локальное облучение места опухоли лазером после обогащения ФС в месте опухоли позволяет избирательно убивать опухолевую ткань и сводит к минимуму повреждение здоровой ткани. В настоящее время в ФДТ используются различные наноматериалы на основе MOF из-за их легкой диффузии АФК [14]. Тем не менее, фототерапия не лишена недостатков — так, например, при облучении ФС часть энергии может рассеиваться при прохождении через ткани человека [14].
Радиотерапия и наноразмерные металлоорганические структуры, создающие АФК
Радиотерапия является распространенным методом лечения рака, который уничтожает злокачественные опухоли как через прямые, так и через косвенные механизмы [15]. К косвенным механизмам относится образование АФК и других свободных радикалов под действием радиации, что приводит к клеточному стрессу и повреждению биомолекул [15]. За последние несколько лет материалы на основе нанобиотехнологий добились заметного прогресса в области медицины и биологии. Существует большое количество наноматериалов с уникальными АФК-регулирующими свойствами и способностью образовывать активные формы кислорода. Такие наноматериалы были использованы из-за их влияния на микросреды раковых клеток, что способствует появлению нового терапевтического метода [15].
Одной из самых заметных работ в терапии рака является разработка MOF для радиосенсибилизации (увеличение радиочувствительности в живых тканях) [16]. MOF на основе Hf, усиливающие радиацию, используются для поглощения низких доз рентгеновских лучей и последующего создания АФК, что способствует повреждению ДНК в раковых клетках и дальнейшему запуску запрограммированной клеточной гибели [16]. Это решает ключевую проблему с фототерапией, описанной выше, поскольку высокоэнергетическое излучение не испытывает такого же ослабления при прохождении через ткани человека, что обеспечивает гораздо большее проникновение в организм [16]. Hf-MOF является одной из известных MOF, которая вышла за рамки доклинической разработки и перешла в фазу 1 клинических испытаний (NCT03444714 и NCT05838729) под названием RiMO-301 [16].
Заключение
Исследования функций и роли АФК в клетке открыло множество новых идей для ученых, чтобы полностью изменить представление об этих молекулах. И то, что раньше считалось только основной причиной возникновения мутации или образования злокачественных опухолей в организме, сейчас же может быть использовано для того, чтобы противостоять разным видам рака. Если несколько ранее АФК действительно можно было назвать «близкими друзьями» раковых клеток из-за их функций, способствующих быстрому закреплению рака в организме, то на сегодняшний день активно разрабатываются противораковые терапии и открываются новые методы, где активным участником будет являться АФК благодаря тем же свойствам. Таким образом, многообещающие перспективы противораковой терапии, открывающиеся с каждым прошлым и будущим исследованием АФК, возможно, достигнет той вершины, когда человек сможет полностью довериться активным формам кислорода, способным надолго продлить людям жизнь и заставить верить в победу в нелегкой битве с этим заболеванием.
Литература
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Ron Mittler. (2017). ROS Are Good. Trends in Plant Science. 22, 11-19;
- Yawei Wang, Huan Qi, Yu Liu, Chao Duan, Xiaolong Liu, et. al.. (2021). The double-edged roles of ROS in cancer prevention and therapy. Theranostics. 11, 4839-4857;
- Sajan George, Heidi Abrahamse. (2020). Redox Potential of Antioxidants in Cancer Progression and Prevention. Antioxidants. 9, 1156;
- W Zhao, P Zhuang, Y Chen, Y Wu, M Zhong, Y Lun. (2023). “Double-Edged Sword” Effect of Reactive Oxygen Species (ROS) in Tumor Development and Carcinogenesis. Physiol Res. 72;
- Соревнуясь с раком;
- Priyanka Verma, Bhavika Rishi, Noreen Grace George, Neetu Kushwaha, Himanshu Dhandha, et. al.. (2023). Recent advances and future directions in etiopathogenesis and mechanisms of reactive oxygen species in cancer treatment. Pathol. Oncol. Res.. 29;
- Bruno Perillo, Marzia Di Donato, Antonio Pezone, Erika Di Zazzo, Pia Giovannelli, et. al.. (2020). ROS in cancer therapy: the bright side of the moon. Exp Mol Med. 52, 192-203;
- Yuanyuan Fu, Zhiying Huang, Liang Hong, Jia-Hong Lu, Du Feng, et. al.. (2019). Targeting ATG4 in Cancer Therapy. Cancers. 11, 649;
- Yunmeng Liu, Yaxin Wang, Jincheng Zhang, Qikai Peng, Xingdong Wang, et. al.. (2024). Nanotherapeutics targeting autophagy regulation for improved cancer therapy. Acta Pharmaceutica Sinica B. 14, 2447-2474;
- Pavlos Pantelis, George Theocharous, Nefeli Lagopati, Dimitris Veroutis, Dimitris-Foivos Thanos, et. al.. (2023). The Dual Role of Oxidative-Stress-Induced Autophagy in Cellular Senescence: Comprehension and Therapeutic Approaches. Antioxidants. 12, 169;
- Xuhui Tong, Rong Tang, Mingming Xiao, Jin Xu, Wei Wang, et. al.. (2022). Targeting cell death pathways for cancer therapy: recent developments in necroptosis, pyroptosis, ferroptosis, and cuproptosis research. J Hematol Oncol. 15;
- Dan Zhao, Wang Zhang, Shuang Yu, Si-Lei Xia, Ya-Nan Liu, Guan-Jun Yang. (2022). Application of MOF-based nanotherapeutics in light-mediated cancer diagnosis and therapy. J Nanobiotechnol. 20;
- Kuangda Lu, Chunbai He, Wenbin Lin. (2014). Nanoscale Metal–Organic Framework for Highly Effective Photodynamic Therapy of Resistant Head and Neck Cancer. J. Am. Chem. Soc.. 136, 16712-16715;
- Mozafari F., Rashidzadeh H., Ghaffarlou M., Salehiabar M., Ertas Y., Ramazani A. (2022). ROS-Based Cancer Radiotherapy. Springer nature. 265–309;
- Alec Wang, Madeline Walden, Romy Ettlinger, Fabian Kiessling, Jeremiah J. Gassensmith, et. al.. (2024). Biomedical Metal–Organic Framework Materials: Perspectives and Challenges. Adv Funct Materials. 34.







