
Соревнуясь с раком
12 октября 2018
Соревнуясь с раком
- 5109
- 1
- 18
Победить не берусь, перехитрить попробую (М.И. Кутузов).
иллюстрация Евгении Иноземцевой
-
Авторы
-
Редактор
Статья на конкурс «био/мол/текст»: На поиски новых способов борьбы с раком и усовершенствование существующих человечество уже потратило миллиарды долларов, а проблема всё так и остается нерешенной. Бесконечные войны с раком зачастую оканчиваются нашим поражением. Можно ли придумать волшебную пилюлю от рака и с гордостью заявить: «Всё, теперь-то мы победили»? К сожалению, ответ на этот вопрос для нас весьма неутешительный. Несмотря на то, что ученые по всему миру придумывают всё новые способы борьбы с онкологическими заболеваниями, рак тоже способен учиться: онкологическая терапия постоянно сталкивается с возникновением мультилекарственной резистентности.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Партнер номинации — медицинская компания «Инвитро».

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Раковое ралли
Рак — это собирательное название группы смертельных и крайне разнородных заболеваний [1]. Однако все раковые клетки обладают набором характерных биологических признаков [2], позволяющих нам применять общие стратегии противораковой терапии.
Одним из таких признаков является хроническая пролиферация (бесконтрольное деление) клеток. Нормальные клетки нуждаются в ростовых факторах, продуцируемых товарищами [3], в то время как раковые могут обеспечивать себя сигналом «роста» самостоятельно. Представим, что опухоль в организме — это автомобиль, несущийся по трассе. В таком случае у автомобиля постоянно работает педаль газа (рис. 1).

Рисунок 1. Ракомобиль. В сравнении со здоровыми клетками организма, раковые — гоночный автомобиль: мощный, скоростной и небезопасный.
иллюстрация Евгении Иноземцевой
С другой стороны, в регуляцию клеточного роста включаются ингибиторные сигналы. Раковые клетки научились такие сигналы игнорировать. То есть наш «ракомобиль» оказывается еще и со сломанными тормозами.
Согласитесь, такое авто на дороге просто опасно для окружающих. Обычно водитель может понять, что скорость превышена, взглянув на спидометр. У клетки роль спидометра выполняет белок р53 — ключевой сенсор повреждения ДНК, запускающий гибель раковой клетки апоптозом (одним из видов программируемой клеточной смерти). Однако многие виды рака сопряжены с потерей функции р53, в результате чего механизмы самоликвидации не запускаются.
Пробег «раковой машины» определяют теломеры (концевые участки хромосом), сокращающиеся с каждым клеточным делением. Около 90% раковых опухолей обладают белком, способным увеличивать длину теломер [4], [5]. Таким образом, «ракомобиль» всегда кажется новенькой моделью, хотя на самом деле этой старой кляче просто скрутили показания одометра.
Несущийся по шоссе автомобиль поглощает литры горючего. Так и раковым клеткам необходимы питательные вещества и кислород, поэтому опухоли стимулируют прорастание кровеносных сосудов вокруг себя — ангиогенез, что облегчает доставку «топлива» к опухолям [6].
Многие опухоли обладают инвазивностью и способностью метастазировать [7–9]. И хотя первый процесс происходит в тканях, где опухоль появилась, а второй заключается в построении колоний в других тканях, генетически и биохимически оба процесса очень похожи. Скажем, что наша машина вдруг превращается в летающую.
Клетки иммунной системы, как инспекторы на дороге, сражаются со свихнувшимися раковыми клетками — нарушителями ПДД — и восстанавливают нормальные функции организма. Однако с иммунной системой не всё так просто. Как коррумпированные полицейские, входящие в состав преступного синдиката, иммунная система иногда способствует росту опухоли [10].
Терапия и резистентность. Кто кого?
Очевидно, что физиологически здоровая клетка должна претерпеть множество изменений, прежде чем превратиться в раковую. С одной стороны, все эти характерные изменения делают нормальную клетку очень опасной раковой, а с другой — служат основными мишенями лекарственной терапии. Противоопухолевая терапия сродни стрельбе из лука: чем выше дальность (селективность и биодоступность) и точность (наименьшее количество побочных эффектов), тем больше очков мы выигрываем в борьбе с опухолью. Не зря одним из самых популярных терминов в области является «таргетная терапия» (от англ. target — «цель», «мишень»). Именно отсюда возникает такое разнообразие групп препаратов [11]. Основные мишени противоопухолевой терапии — ДНК (как основной регулятор всех внутриклеточных процессов) и белки, выполняющие специфические функции.
Многие из противоопухолевых препаратов весьма эффективны, однако к ним возникает устойчивость, в результате чего лечение ставится под угрозу. Резистентность может быть первичной (особенность конкретной опухоли) или вторичной (приобретенной, возникающей в ответ на прием препаратов). Попробуем разобраться на примере препарата «Герцептин».
«Герцептин» — высокоэффективный препарат, применяемый при раке груди [12], и механизм его действия связан с блокировкой рецептора HER2, помогающего опухолевым клеткам активно пролиферировать (выжимать педаль газа). Однако в случае, если у опухолевых клеток нет рецептора HER2, его блокировка «Герцептином», очевидно, совершенно бесполезна. Это значит, что опухоль обладает первичной резистентностью к этому препарату. Другое дело, когда в опухолевых клетках мутируют внутриклеточные каскады, связанные с рецептором HER2, и мишень теряется [13]. Так развивается вторичная резистентность (рис. 2).
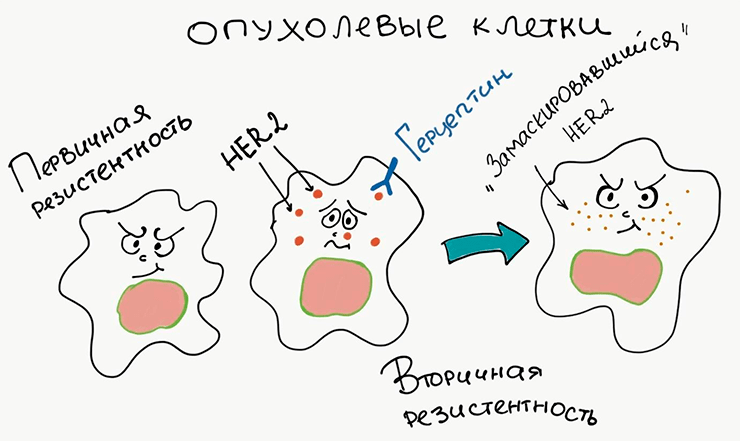
Рисунок 2. Возникновение резистентности. Первичная резистентность к лекарству характерна для клеток, у которых изначально нет его мишени. Вторичная резистентность возникает в результате изменения мишени, при котором препарат теряет способность с ней связываться.
иллюстрация Евгении Иноземцевой
Самый очевидный способ обмануть опухоль и побороть резистентность — использовать как можно больше лекарственных препаратов, отличающихся по структуре и механизму действия. Однако, как ни парадоксально, опухоли способны спонтанно развивать резистентность к различным противоопухолевым агентам одновременно. Это и называется мультилекарственной резистентностью.
Интересно, что из всей пестрой популяции раковых клеток, совсем как в эволюционной теории Дарвина, выживают наиболее приспособленные. Часть клеток, вероятно, гибнет под действием лекарства, тогда как другая часть выживает и оказывается еще более неуловимой для терапии. Поэтому у онкологов есть препараты I, II и прочих линий. Как только одно лекарство перестает работать, нужно быстро назначить пациенту другое, а когда опухоль приспособится и к нему, дать третье, и так далее. К сожалению, список лекарств не бесконечен, именно поэтому вопрос изучения механизмов мультилекарственной резистентности очень важен.
Механизмы развития резистентности
Каким образом раковые клетки способны приобретать устойчивость? Как ученые могут эту устойчивость обойти? Борьбу с резистентностью можно сравнить с партией в шахматы. На каждый наш ход — новое противораковое лекарство — клетки опухоли придумывают маневр для ухода. Рассмотрим несколько таких ответных ходов: поговорим о мембранных переносчиках, особенностях метаболизма, мутации терапевтической мишени, клеточной гибели и о том, как раковые клетки придумали скрываться от «иммунных полицейских».
Ход 1. Шах от мембранных переносчиков
Как проникнуть внутрь клетки?
Все клетки нашего организма окружены мембраной — двойным слоем липидов, основная задача которого — поддерживать целостность и постоянство внутриклеточного содержимого [14]. Большинство молекул, необходимых для жизнедеятельности клетки, водорастворимы, а значит, через липидную мембрану они не проходят. Именно поэтому клеточная мембрана содержит сотни различных белков-переносчиков [15]. Вернемся к нашему примеру с «раковым автомобилем», нуждающимся в топливе: для закачки бензина необходим бензобак, им-то как раз и служат мембранные переносчики. Увеличение количества мембранных переносчиков, таких как селективный переносчик глюкозы GLUT1, отмечают в различных типах опухолей (рис. 3).
Глюкоза — лучшее «топливо» для клеток, а ее переносчик довольно хорошо изучен. Казалось бы, почему нельзя просто взять и заблокировать этот переносчик, ведь ни одна машина без бензина не поедет? Дело в том, что абсолютно идентичные переносчики работают и на мембранах здоровых клеток, которые нам еще пригодятся. Поэтому в терапии преобладает другой подход — ученые постоянно ищут способы, как можно использовать некоторые переносчики в своих целях. Например, доставить лекарство в клетку вместе с естественными для организма молекулами. Почему так сложно? Дело в том, что не всякое лекарство сможет проникнуть через липидную мембрану. Если это заряженная или водорастворимая молекула, то попасть в клетку она сможет только с помощью переносчика. К примеру, белок OCT1, находящийся в клеточной мембране лейкоцитов, переносит через нее противоопухолевый препарат иматиниб [16]. Этот переносчик не только повышает эффективность терапии хронического миелоидного лейкоза, но и позволяет врачам подбирать оптимальную эффективную дозу для пациентов [17].
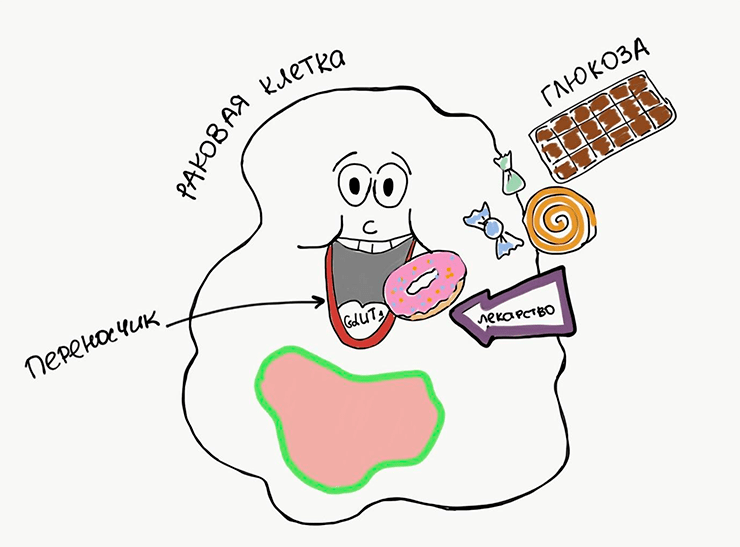
Рисунок 3. Мембранные переносчики нужны для транспорта питательных веществ в клетку. Например, глюкоза поступает через переносчик GLUT1. Вместе с питательными веществами переносчики иногда могут транспортировать и молекулы лекарств.
иллюстрация Евгении Иноземцевой
Краеугольный камень мультилекарственной резистентности — это совсем другая группа мембранных транспортеров. В отличие от предыдущих переносчиков, они, наоборот, выкачивают из клетки всё ей ненужное. В первую очередь, конечно же, противоопухолевые препараты, которые мы с таким трудом в клетку доставили. Это семейство переносчиков со скромным названием «ABC» [18] в разы усложняет работу ученых и несет ответственность за возникновение резистентности к большей части лекарственных препаратов [19]. Главой семейства ABC-переносчиков можно назвать белок P-gp (P-гликопротеин, он же — MDR1, белок множественной лекарственной устойчивости 1) [20]. Каждый день он буквально спасает нас от смерти, выкачивая из клеток организма попавшие туда чужеродные и токсичные вещества.
Однако P-гликопротеин — двуликий Янус! Противоопухолевые препараты, которые назначают пациенту, он принимает за вражеских агентов и спешит поскорее избавить от них раковую клетку (рис. 4). Важно отметить, что все представители семейства ABC-транспортеров — переносчики неспецифические, которые переносят многие (главным образом, гидрофобные) молекулы, не различая их. Поэтому, увеличивая количество хотя бы одного белка-переносчика в мембране, раковая клетка автоматически приобретает навык выкачивать разные лекарства. Таким образом, рак сразу вычеркивает из нашего списка лекарств значительную их часть.

Рисунок 4. ABC-переносчики удаляют продукты жизнедеятельности и токсины из клетки. Такие переносчики (например, P-gp) неселективны, то есть удаляют из клетки всё подряд, в том числе лекарства.
иллюстрация Евгении Иноземцевой
Ход 2. Метаболический
Основная сложность противоопухолевой терапии состоит в том, что раковые клетки, пусть и немного свихнувшиеся, но всё же родственники здоровых клеток организма. А те в процессе эволюции разработали десятки защитных механизмов, спасающих их от чужеродных токсинов. Что в общем-то хорошо, ведь мы не хотим, чтобы лекарство блуждало по нашему организму целую вечность. Некоторые препараты обладают довольно высокой токсичностью, и их необходимо удалить как можно быстрее — ну, только после достижения эффекта. Однако раковые клетки научились менять метаболизм лекарства, что тоже приводит к резистентности.
Вместе с P-гликопротеином в команду резистентности попадает еще один белок — цитохром P450 (сокращенно его называют ЦИП. Не путать с цыплятами!). Этот белок — будем называть его для простоты P450 — является основным ферментом метаболизма лекарств. Если задуматься, это удивительно: как один белок может влиять на эффективность практически всех лекарств?
Попадая в организм, противоопухолевые препараты претерпевают изменения. Как мы помним, организм стремится поскорее избавиться от всего чужеродного, поэтому он меняет структуру противоопухолевого препарата так, чтобы тот не мог задерживаться в тканях и скорее выводился. Этой нелегкой работой как раз и занимается P450 (рис. 5a). И опять: как и все белки-защитники, P450 работает со всеми веществами подряд. Интересно, что цитохромы могут реагировать на сигнал от некоторых лекарств, активирующих или угнетающих их работу.
Пытаясь использовать деятельность P450 на благо человечества, ученые разработали пролекарства — молекулы, которые P450 не лишает, а наделяет лекарственной активностью (рис. 5б). То есть в таблетке находится «спящая» молекула, а после «обработки» цитохромом она начинает работать: становится токсичной для опухоли. Однако в случае потери или снижения активности P450 такие противоопухолевые препараты остаются неактивными. Поэтому принимающим их пациентам советуют не пить грейпфрутовый сок — известный ингибитор P450 [21].
Казалось бы, вот они — пути борьбы с мультилекарственной резистентностью. Но стόит признаться, что тут рак поставил человечеству шах, от которого оно не может ускользнуть. Мы уже упоминали, что такие белки-защитники, как Р450 или P-gp, работают неселективно: помимо выкачивания противоопухолевых препаратов, Р-gp защищает наш мозг от попадания токсичных веществ, а цитохром Р450 окисляет эндогенные гормоны и метаболиты. Вмешиваясь в деятельность Р450 или P-gp, мы рискуем лишить организм естественной защиты и регуляции, что приводит к появлению токсинов.
Ход 3. Рокировка мишени
Помимо того, что наш организм и так усиленно пытается всеми возможными путями избавиться от противоопухолевых препаратов (ход 2), опухолевые клетки всегда начеку и в случае эффективности препарата стараются избавиться от его мишени (рис. 6). Как такое возможно? В условиях бесконтрольности раковые клетки накапливают мутации (изменения в ДНК), служащие резервным механизмом выживания клеток. Хитрость хода раковых клеток впечатляет: вместо того, чтобы пытаться всеми правдами и неправдами избавиться от лекарства, они в одну секунду делают препарат неактивным, избавляясь от его мишени. В случае с тем же «Герцептином», например, клетки просто теряют рецептор HER2, на который направлено действие препарата.
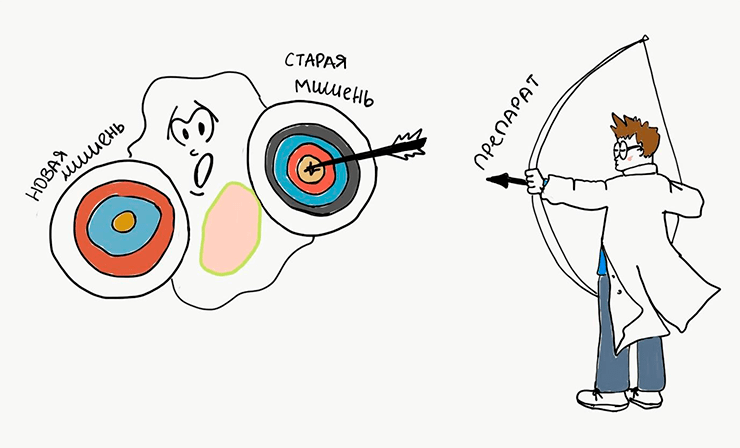
Рисунок 6. Как только опухолевая клетка изменит мишень лекарства, препарат сразу перестанет действовать. Тогда ученым нужно будет придумывать лекарство, бьющее по новой мишени.
иллюстрация Евгении Иноземцевой
Ход 4. Клеточный гамбит
Апоптоз (вид программируемой клеточной гибели) — это не только естественный механизм устранения опухолевых клеток, но и желаемый результат использования противоопухолевых препаратов. Апоптоз постоянно запускается в клетках, в которых что-то пошло не так — например, повреждена ДНК или не работают необходимые белки (рис. 7). Он проходит тихо, и клетка, умирая, оставляет после себя только безвредные ошмётки, легко удаляемые соседями. Должно быть, читателю уже стало понятно, что апоптоз — один из ключевых пунктов, против которого будет бороться раковая клетка. Здоровые физиологически клетки имеют много механизмов, запускающих апоптоз, и белков — регуляторов апоптоза, что позволяет клетке-герою надежно отличить опасную для всего организма ситуацию и пожертвовать собой, тихонечко скончавшись. Это умение, конечно, достается по наследству и раковым клеткам, однако они быстро учатся справляться с апоптозом.

Рисунок 7. Один из механизмов программируемой клеточной гибели — апоптоз — работает в многоклеточном организме постоянно. Отслужившие клетки тихонечко самоликвидируются, оставляя после себя лишь безвредные крохотные тельца.
иллюстрация Евгении Иноземцевой
Апоптоз может инициироваться целым рядом противоопухолевых препаратов, повреждающих ДНК. Однако опухолевые клетки научились противостоять нашим атакам. Дефекты апоптотических каскадов дают им преимущество выживать даже тогда, когда в нормальных условиях клетки бы уже давно почили (рис. 8). Несмотря на то, что в этом противостоянии опухолевые клетки пока что одерживают победу, ученые не опускают руки. Разветвленность апоптотических путей позволяет нам разрабатывать всё новые препараты, облегчающие ход уже запущенного апоптоза [22]. Так действует, например, новая группа лекарственных средств — миметики проапототических белков [23].
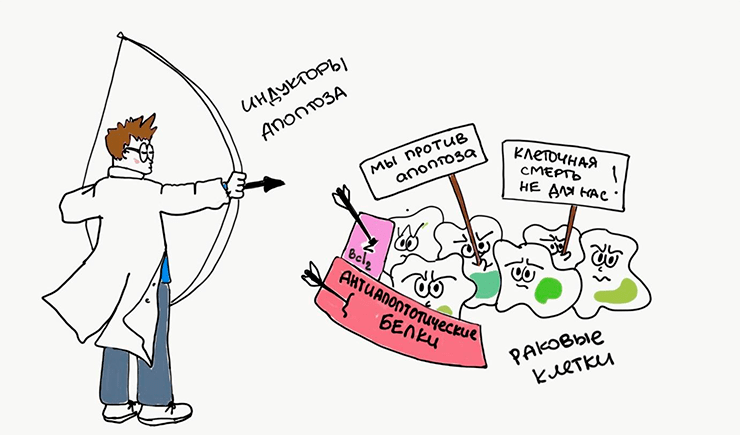
Рисунок 8. Раковые клетки стремятся избежать апоптоза. Они усиливают работу антиапоптотических белков, а ученые, наоборот, пытаются апоптоз индуцировать.
иллюстрация Евгении Иноземцевой
Ход 5. Микропешки
Клетки никогда не находятся в одиночестве, они образуют «коммуну» — объединяются в ткани и активно взаимодействуют с клетками других тканей. Кроме того, клетки должны прочно закрепиться на одном месте, а не болтаться по организму. А вот раковые клетки иногда, как мы уже упоминали, игнорируют это правило и образуют метастазы, когда «теряют сцепление» с окружающей их средой. Также для опухоли очень важно иметь вокруг себя кровеносные сосуды, через которые она получает питательные вещества. Если опухоль большого размера, она может сдавливать кровеносные сосуды. Но не нужно радоваться слишком рано: такое сдавление усложняет доставку и противоопухолевых препаратов к центру опухоли. Ее периферические клетки лекарство победит, а вот находящиеся в самом сердце опухоли выживут, мутируют, и всё начнется сначала.
Помимо того, что одна популяция раковых клеток может стать резистентной к лекарству, она может обучить другую популяцию, спасая таким образом чувствительные к лекарству опухолевые клетки от смерти и сводя на нет все усилия врача. Информация о том, как сопротивляться лекарству, зашифрована в виде микро-нуклеиновых кислот. Обычно это регуляторные микроРНК, упакованные в очень маленькие пузырьки — микровезикулы (рис. 9). Всё это «мимимикро» — очень коварный ход со стороны рака. МикроРНК регулируют экспрессию генов устойчивости. А микровезикулы защищают «ценную» информацию от разрушителей РНК (РНКаз) [24]. Микровезикулы могут передаваться от одних клеток к другим, высвобождать микроРНК. Бороться с таким транспортом ученые пока не научились.

Рисунок 9. Микровезикулы переносят от одной раковой клетки к другой микроРНК, регулирующие экспрессию генов устойчивости. Таким образом гетерогенная группа клеток становится устойчивой к терапии.
иллюстрация Евгении Иноземцевой
Ход 6. Иммунный ферзь
Иммунная система — хранитель благополучия организма. И раковые клетки, разумеется, всеми возможными путями пытаются скрыться от грозных стражей, снующих по организму. «Раковая машина» скрывает свои настоящие водительские права — антигены (молекулы, способные вызвать иммунный ответ), которые позволяют «инспекторам» различать свои и чужеродные клетки.
Иммунная система в научной среде сейчас по-настоящему в тренде. И конечно, фармацевтические компании не могут обойти эту тему стороной. В онкотерапии истинный бум вызвали две новые группы препаратов — моноклональные антитела и перепрограммированные модифицированные Т-клетки (CAR T-клетки) [25]. Про модифицированные Т-клетки «Биомолекула» уже не раз писала [26], [27], как и про идею моноклональных антител [28], [29]. Мы же в очередной раз хотим обратить внимание на конкретную группу лекарств — чек-поинт ингибиторы [30], [31], за которые Джеймс Эллисон (James Allison) и Тасуку Хоньо (Tasuku Honjo) получили Нобелевскую премию по физиологии или медицине 1 октября этого года. [32] Подробнее об этом событии читайте в нашем специальном выпуске! [33]
Началось всё с открытия белка PD-L1 на поверхности раковой клетки, что, на самом деле, никого не впечатлило. Открыли какой-то там белок — молодцы! Ну и что? А вот когда обнаружили его рецептор PD-1 на поверхности Т-клеток, началось самое интересное. Расшифровываются эти аббревиатуры как programmed death ligand 1 и programmed cell death protein 1. То есть удалось обнаружить настоящих вестников смерти раковых клеток! PD-L1 есть и у здоровых клеток иммунной системы. В норме при взаимодействии этих молекул — рецептора и лиганда — посылается ингибиторный сигнал Т-клеткам, которые должны распознавать чужеродные фрагменты и уничтожать их. Получая ингибиторный сигнал, Т-клетки понимают, что эту конкретную клетку убивать не нужно. Эта проверка (чек-поинт) позволяет сохранять нормальные, здоровые клетки. Как уже, вероятно, догадался читатель, хитрые раковые клетки научились экспрессировать на своей поверхности PD-L1, вводя в заблуждение иммунных полицейских. Ингибиторы такого взаимодействия — новое слово в борьбе против рака (рис. 10).

Рисунок 10. Раковые клетки научились обманывать иммунный надзор: они показывают PD-L1, который обычно есть у нормальных иммунных клеток. PD-L1 (мячик) связывается с рецептором PD-1 на Т-клетках (щенок на страже), в этом случае иммунные клетки принимают раковые «за своих» и не атакуют. Препараты — ингибиторы PD1-PDL1-взаимодействия (косточка) позволяют иммунным клеткам обойти обманный маневр врагов.
иллюстрация Евгении Иноземцевой
Шах и мат?
Борьба с возникновением мультилекарственной резистентности сродни игре в шахматы. Каждый раз ученые придумывают новые способы терапии, к которым рано или поздно раковые клетки вырабатывают резистентность. Возможно, эта партия будет длиться до бесконечности, пока мы не узнаем чего-то принципиально нового о механизмах развития онкологических заболеваний [34]. Современная онкотерапия постоянно дополняется рекомендациями, часто авторитет и интуиция врача играют большую роль. К сожалению, у онкологов не всегда есть время для раздумий над следующим ходом. Но не унывай, читатель! Каждый раз, когда ученые открывают очередную маленькую молекулу на поверхности раковой клетки или придумывают, как обойти тот или иной механизм возникновения лекарственной резистентности, человечество делает еще один шаг к победе над раком.
Литература
- Рак. (2018). Сайт ВОЗ;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Теломеры и новые мишени протоонкогенной терапии;
- Страшней клешней на свете нет...;
- Во власти опухоли: почему метастазы так сложно остановить?;
- Метастазирование опухолей;
- Тернистый путь метастазов: через гипоксию в печень;
- Lisa M. Coussens, Zena Werb. (2002). Inflammation and cancer. Nature. 420, 860-867;
- Hiba Zahreddine, Katherine L. B. Borden. (2013). Mechanisms and insights into drug resistance in cancer. Front. Pharmacol.. 4;
- Рак молочной железы с семейной историей;
- Maria Luque-Cabal, Paula García-Teijido, Yolanda Fernández-Pérez, Luisa Sánchez-Lorenzo, Isabel Palacio-Vázquez. (2016). Mechanisms behind the Resistance to Trastuzumab in HER2-Amplified Breast Cancer and Strategies to Overcome It. Clin Med Insights Oncol. 10s1, CMO.S34537;
- Липидный фундамент жизни;
- Lawrence Lin, Sook Wah Yee, Richard B. Kim, Kathleen M. Giacomini. (2015). SLC transporters as therapeutic targets: emerging opportunities. Nat Rev Drug Discov. 14, 543-560;
- J. Thomas. (2004). Active transport of imatinib into and out of cells: implications for drug resistance. Blood. 104, 3739-3745;
- H. Burger, R. H. J. Mathijssen, A. Sparreboom, E. A. C. Wiemer. (2013). Can "specific" OCT1 inhibitors be used to determine OCT1 transporter activity toward imatinib?. Blood. 121, 4965-4966;
- P. M. Jones, A. M. George. (2004). The ABC transporter structure and mechanism: perspectives on recent research. Cellular and Molecular Life Sciences (CMLS). 61, 682-699;
- A. Levchenko, B. M. Mehta, X. Niu, G. Kang, L. Villafania, et. al.. (2005). Intercellular transfer of P-glycoprotein mediates acquired multidrug resistance in tumor cells. Proceedings of the National Academy of Sciences. 102, 1933-1938;
- Michael M. Gottesman. (2002). Mechanisms of Cancer Drug Resistance. Annu. Rev. Med.. 53, 615-627;
- J HUKKANEN, P JACOBIII, N BENOWITZ. (2006). Effect of grapefruit juice on cytochrome P450 2A6 and nicotine renal clearance. Clinical Pharmacology & Therapeutics. 80, 522-530;
- Rebecca SY Wong. (2011). Apoptosis in cancer: from pathogenesis to treatment. J Exp Clin Cancer Res. 30, 87;
- A R D Delbridge, A Strasser. (2015). The BCL-2 protein family, BH3-mimetics and cancer therapy. Cell Death Differ. 22, 1071-1080;
- Elke Pogge von Strandmann, Rolf Müller. (2016). Shipping Drug Resistance: Extracellular Vesicles in Ovarian Cancer. Trends in Molecular Medicine. 22, 741-743;
- От слов к делу: технологию CRISPR-Cas впервые применили для лечения онкозаболеваний;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак;
- CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?;
- Моноклональные антитела;
- Краткая история открытия и применения антител;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Пресс-релиз Нобелевского комитета. (2018). Сайт Нобелевского комитета;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Нерешаемые проблемы биологии: нельзя создать два одинаковых организма, нельзя победить рак, нельзя картировать организм на геном.









