
Серотониновые сети
13 марта 2015
Серотониновые сети
- 25022
- 1
- 38
3-(β-аминоэтил)-5-гидроксииндол, он же серотонин, он же 5-гидрокситриптамин, он же... плевать — главное, что уважаем даже производителями бижутерии.
Рисунок в полном размере.
фото с сайта store.madewithmolecules.com
-
Автор
-
Редактор
Нейромедиаторы осуществляют передачу сигналов между клетками в нервной системе. Разные группы нейронов объединяются в целые функциональные системы, которые «работают» на определенном веществе. В психиатрии и нейробиологии особое внимание уделяется серотонину — нейромедиатору, о котором и пойдет речь.
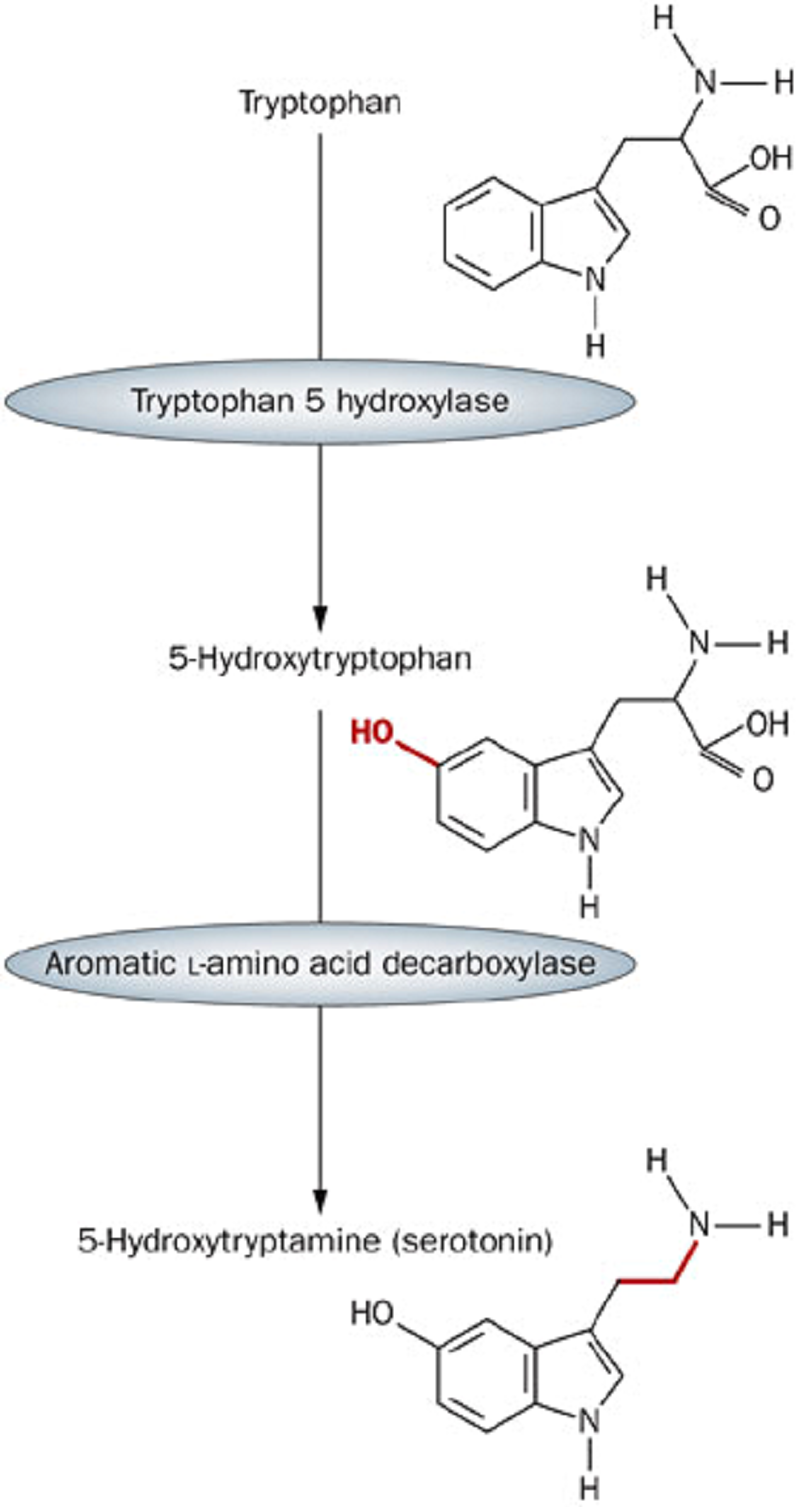
Рисунок 1. Две стадии синтеза серотонина из триптофана. Сначала к аминокислоте прикрепляется OH-группа, а затем отсоединяется карбоксильный радикал.
Сырное настроение
Ранее я уже писал о том, чем занимается дофамин в нашем мозге [1]. Сейчас речь пойдет о другом нейромедиаторе — серотонине. Как и в случае с дофамином, предшественником серотонина является аминокислота — триптофан. В состав триптофана входит ароматическое ядро индола, а само соединение синтезируется довольно сложным путем. Серотонин (5-гидрокситриптамин, 5-НТ) получается из триптофана всего за две реакции: сначала к индоловой части присоединяется гидроксильный радикал, а затем от получившейся молекулы отщепляется карбоксильная группа (рис. 1).
Схема распространения отростков серотониновых нейронов напоминает дофаминовую систему. Из глубоких отделов мозга — из комплекса скоплений нейронов, называемых ядра шва — сигналы разбегаются почти по всему органу (рис. 2). Уже на месте серотонин взаимодействует с рецепторами на постсинаптической мембране, осуществляя свои психофизиологические эффекты. Существует семь основных типов серотониновых рецепторов и множество их подтипов [2], но подробное описание их роли займет слишком много места.
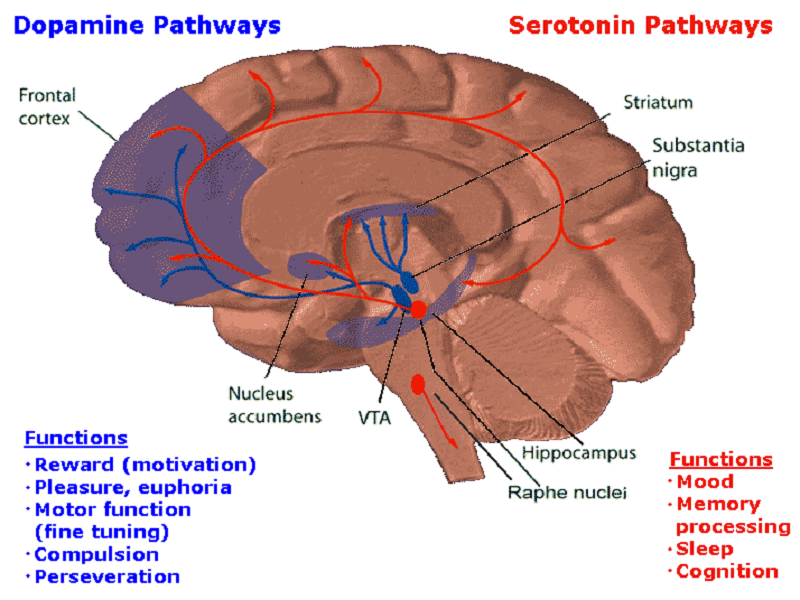
Рисунок 2. Серотониновые и дофаминовые пути в головном мозге человека. Дофаминовые волокна из глубоких отделов мозга распространяются в подкорковые отделы и в лобную долю. Отростки серотониновых нейронов распространяются шире и влияют на большее количество функций.
Лучше обратить внимание на то, как содержание триптофана, предшественника серотонина, может повлиять на наше поведение. Логично предположить, что повышение количества триптофана в пище приведет к тому, что увеличится и уровень серотонина. При депрессии содержание серотонина в центральной нервной системе снижается. Можно представить такой эксперимент: из рациона человека исключается триптофан. Вследствие этого страдает синтез серотонина, и мы наблюдаем снижение настроения — типичный симптом депрессии. На практике это работает немного по-другому. При уменьшении поступления триптофана с пищей снижение настроения отмечается только у тех людей, которые раньше болели депрессией [3]. Отказ от триптофана не оказывал значимого влияния на испытуемых без депрессивных эпизодов в прошлом. По всей видимости, это связано с изменёнными путями метаболизма серотонина у пациентов с депрессивными расстройствами, которых нет у здоровых людей.
Интересно, что если уровень триптофана в пище будет высоким, это может привести к щедрости. В исследовании голландских психологов [4] была выявлена именно такая связь. Испытуемые, принявшие большую дозу триптофана, жертвовали больше денег, чем те участники эксперимента, которые ее не получили. Сами исследователи объясняют повышенную щедрость связью между серотониновой и окситоциновой системами в головном мозге. Неспецифическое повышение интенсивности сигнала в серотониновой системе приводит к увеличению активности всех связанных с ней структур. Окситоциновые нейроны не становятся исключением, и в мозге появляется больше окситоцина. Такое повышение приводит к тому, что мозг человека становится более предрасположенным к выбору в пользу других людей. Кстати, лидером по содержанию триптофана среди пищевых продуктов является сыр, и было бы интересно проследить взаимосвязь между потреблением сыра и щедростью у разных народов.
Нейромедиатор контроля
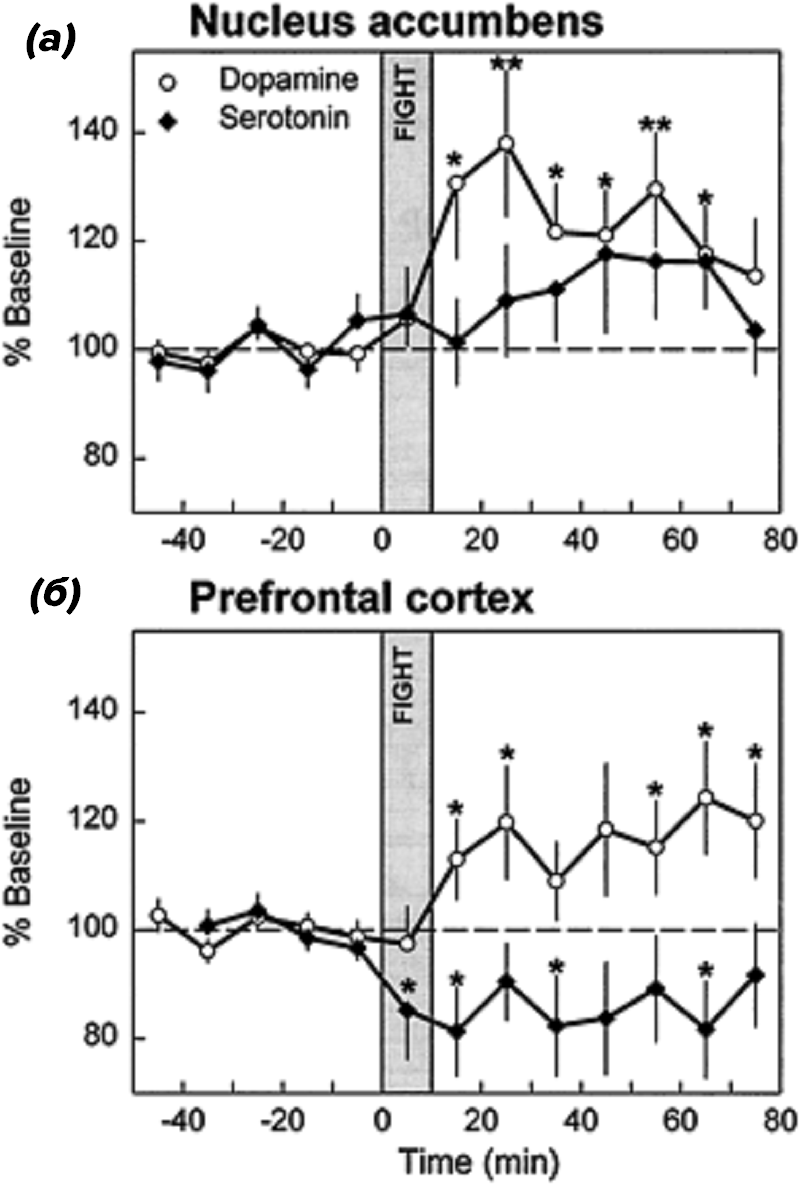
Рисунок 3. Изменение содержания нейромедиаторов у крыс в состоянии агрессии. Во время драки (серая вертикальная полоса) и после неё повышается содержание дофамина в добавочном ядре (а), регулирующем поведение и мотивацию, и снижается высвобождение серотонина в лобных отделах коры (б). Звездочки указывают на существенные различия с базовыми уровнями нейромедиаторов.
Как уже говорилось, серотонин распространяется из продолговатого мозга, из ядер шва. Существенная разница с дофаминовой системой заключается в более широком охвате структур головного мозга серотониновыми волокнами. Такой охват позволяет серотонину влиять на процессы памяти и когнитивные способности: темп и качество мышления. При депрессии снижение интенсивности серотониновой передачи приводит к ухудшению сообразительности и замедлению мышления.
Кроме влияния на интеллект серотонин оказывает серьезное воздействие на агрессивное поведение. Например, у крыс сравнивалось содержание дофамина и серотонина в подкорковых структурах и лобной доле при драках [5]. Ученые выяснили, что агрессивное поведение животных связано со снижением уровня серотонина в лобных отделах коры, отвечающих за планирование и контроль поведения (рис. 3). У людей также показана связь между пониженным уровнем серотонина в лобных отделах коры и агрессивным поведением, но только импульсивным, возникающим внезапно [6].
Серотонин снижает активность нейронов префронтальной коры не прямым воздействием на них, а через тормозные нейроны, выделяющие гамма-аминомасляную кислоту (ГАМК). Нейромедиатор попадает на рецепторы, расположенные на теле и отростках ГАМК-ергических нейронов, блокируя или запуская передачу сигнала [7]. Примечательно, что при уменьшении активности отдельных нейронов под воздействием серотонина увеличивается упорядоченная активность нейронных систем, то есть серотонин упорядочивает совместную работу нейронов, не давая им перебивать друг друга в многоголосой беседе.
В вопросах влияния серотонина на личность стоит обратить внимание на один из генов серотониновой системы — ген белка-транспортёра серотонина (5-HTT, SERT). Существуют два варианта промоторной последовательности этого гена (serotonin transporter linked polymorphic region, 5-HTTLPR), различающиеся длиной, причем короткий вариант выполняет свою работу хуже, чем длинный. При исследовании влияния полиморфизма 5-HTTLPR на особенности социальной жизни оказалось, что обладатели короткого аллеля более склонны к тревожным реакциям при социальном взаимодействии [8]. Носители короткого варианта в гомозиготном и гетерозиготном состоянии проявляли повышенную чувствительность к эмоциональным стимулам и хуже контролировали своё поведение. В исследовании, опубликованном в 2013-м году в The Journal of Neuroscience [9], было показано, что у обладателей короткого аллеля 5-HTTLPR префронтальная кора хуже контролирует работу миндалины — центра эмоционального реагирования (рис. 4), который чувствителен и к другим «эмоциональным» аллелям, например, к полиморфизму гена моноаминоксидазы-А [10]. Выяснилось, что в течение жизни на активность 5-HTT может оказывать влияние опыт негативного взаимодействия с окружающими, например, жестокое обращение в детстве. Такие события ухудшают и без того слабую работу белка-транспортёра, приводя к нарушениям в работе головного мозга, вроде описанных выше.
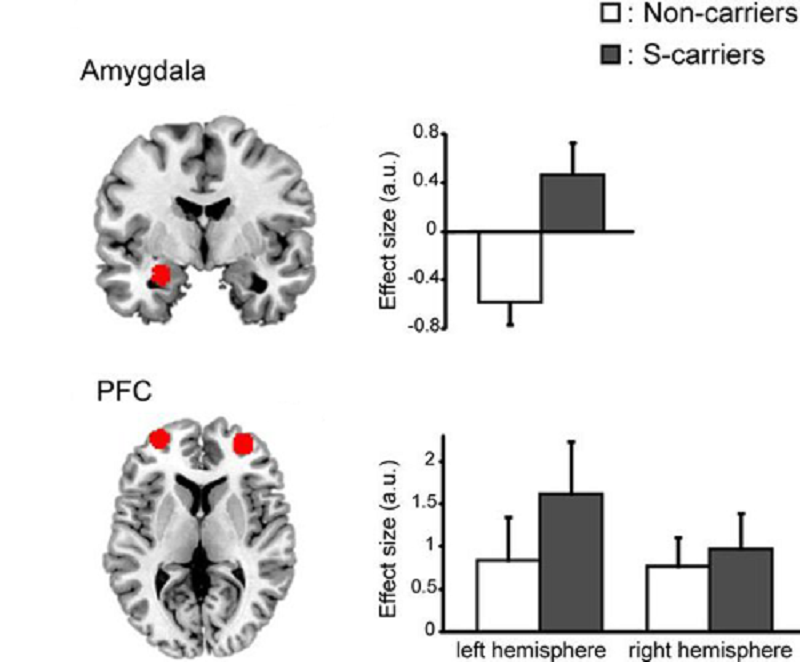
Рисунок 4. Возбудимость миндалины (сверху) и передней префронтальной коры (снизу) в зависимости от полиморфизма промотора гена транспортёра серотонина. У обладателей короткого (S-, темные столбцы) варианта 5-HTTLPR активация миндалины выше, чем у носителей длинного аллеля (белые столбцы). На нейробиологическом уровне это значит, что мозг «захлестывают» эмоции. Чтобы справиться с этим информационным потоком, наблюдаемого незначительного повышения активности префронтальной коры в левом и правом полушариях не достаточно.
Рискованные лекарства
Учитывая вовлеченность серотонина в психические процессы, ряд лекарств, которыми пользуются психиатры и психотерапевты, прицельно воздействует на серотониновые системы. Самым известным классом подобных препаратов являются антидепрессанты [11]. Среди антидепрессантов стоит отметить селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) и селективные ингибиторы обратного захвата серотонина (СИОЗС).
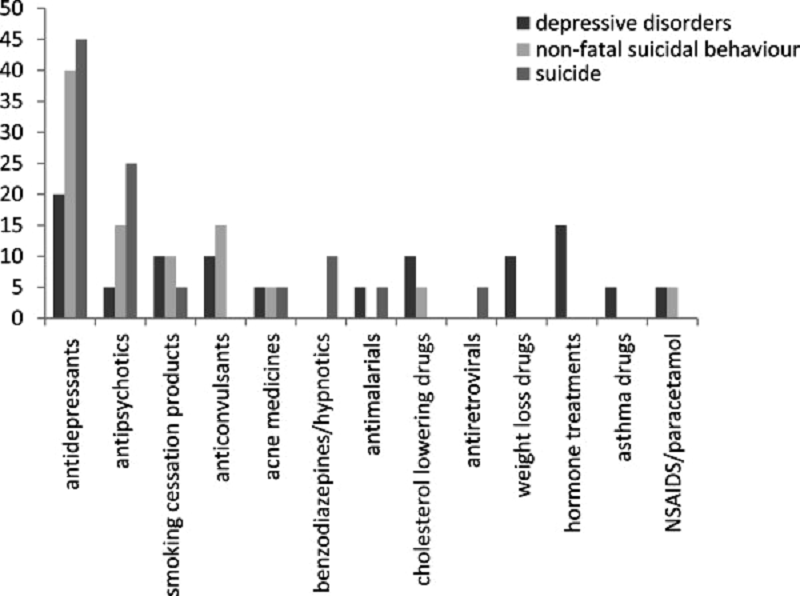
Рисунок 5. Антидепрессанты — лидеры по поведенческим побочным эффектам.
Принцип работы этих лекарств довольно прост. Под воздействием электрического сигнала из одного нейрона в синаптическую щель начинает выделяться серотонин. Связавшись с рецептором на поверхности другого нейрона, он удаляется из синапса при помощи специального фермента. При применении СИОЗС нарушение деятельности фермента, осуществляющего обратный захват серотонина, приводит к увеличению силы сигнала в серотониновой системе мозга. К классу СИОЗС относится всем известный прозак (флуоксетин). Другая группа препаратов — СИОЗСН — подавляет обратный захват как серотонина, так и норадреналина; среди них широко применяются венлафаксин и дулоксетин. На похожем принципе — подавлении обратного захвата нейромедиаторов — основана работа классического антидепрессанта амитриптилина, который «берёт еще шире»: не только тормозит захват серотонина и норадреналина, но и меняет активность транспортёров этих нейромедиаторов.
Однако с СИОЗС возник ряд проблем. В британском исследовании, которое объединило данные по нежелательным эффектам лекарств за 13 лет, эта группа антидепрессантов проявила себя не с самой лучшей стороны [12]. Среди всех препаратов, которые вызывали при приеме депрессию, пароксетин занял третье место. В случае суицидальных попыток, не приведших к смерти, чаще всего фигурировали СИОЗС пароксетин (1-е место), циталопрам (3-е место) и флуоксетин (4-е место). Если же смотреть по завершенным самоубийствам, то 2-е, 3-е и 4-е места заняли циталопрам, флуоксетин и пароксетин соответственно. Чаще всего именно антидепрессанты были связаны со всеми перечисленными нежелательными эффектами (рис. 5).
С одной стороны, эта информация выглядит пугающе и непонятно: как могут антидепрессанты провоцировать самоубийства? С другой стороны, у этого феномена могут быть два объяснения. Антидепрессанты назначаются в случае депрессии, а при депрессии часто бывают суицидальные мысли и намерения, поэтому нет ничего удивительного, что у человека с депрессией, даже принимающего препараты, может случиться суицидальный эпизод. Другое объяснение лежит в принципе действия группы СИОЗС: они напрямую вмешиваются в нейрометаболизм. Мы до сих пор не очень хорошо разбираемся в работе головного мозга и не можем выделить точные критерии для применения того или иного препарата. По этим причинам назначение СИОЗС может привести к нарушению работы головного мозга, усугублению проблем с нейромедиаторами. Но даже несмотря на это, в подавляющем большинстве случаев антидепрессанты работают должным образом, а описанные побочные эффекты остаются весьма редкими.
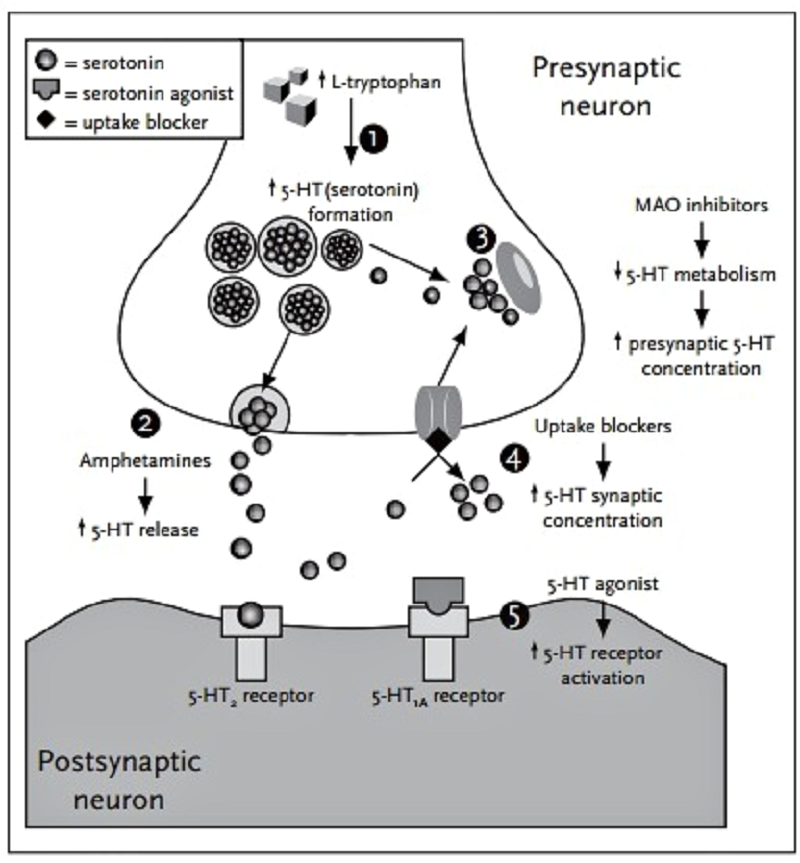
Рисунок 6. Механизм развития серотонинового синдрома. Применение СИОЗС приводит к увеличению концентрации серотонина в синаптической щели. ИМАО вызывают повышение количества этого нейромедиатора в пресинаптическом нервном окончании. Вместе эти два фактора обеспечивают избыток серотонина в нервных путях.
Другим серьезным побочным эффектом, возникающим при применении серотонинергических препаратов, является серотониновый синдром. Серотониновый синдром — это состояние организма, при котором отмечается усиленное воздействие этого нейромедиатора на организм, чрезмерная активация серотонинергических структур головного мозга. Такое происходит, например, при одновременном назначении двух типов антидепрессантов — СИОЗС и ингибитора моноаминоксидазы (ИМАО). Если СИОЗС препятствуют удалению серотонина из синаптической щели, то ИМАО подавляют разрушение серотонина в пресинаптическом окончании. Последствием этих процессов будет повышенное содержание серотонина в синапсе и увеличение интенсивности сигналов в серотонинергической системе (рис. 6).
Кроме лекарственных средств серотониновый синдром может вызываться приемом экстази. Клинически это состояние проявляется следующим набором симптомов: у пациента повышается температура, он беспокоен или находится без сознания, у него могут участиться сердцебиение и дыхание, появиться одышка. Довершают картину болезни колебания артериального давления, диарея и беспорядочные мышечные сокращения. В случае диагностированного серотонинового синдрома отменяются все серотонинергические препараты; пациенту проводится дезинтоксикация [13]. Как и в случае с суицидальным поведением, серотониновый синдром встречается крайне редко, поэтому не стоит бояться их при лечении антидепрессантами группы СИОЗС.
Исследование серотониновой системы человеческого мозга еще раз возвращает нас к тому, насколько мы зависим от биологических, а не только социальных, факторов. Количество съедаемого сыра, гены, переданные нам от родителей, назначенные лекарства — всё это меняет метаболизм в мозге, а значит, меняет и нас. Конечно, можно сказать, что есть общение с другими людьми, различия в индивидуальном опыте, то есть чисто социальные моменты, но не надо забывать, что социальная составляющая нашей личности реализуется всё теми же биологическими — и доступными для исследования — механизмами нашей психики.
Литература
- Дофаминовые болезни;
- Рецептор медиатора настроения;
- Paolo Fusar-Poli, Paul Allen, Philip McGuire, Anna Placentino, Mariachiara Cortesi, Jorge Perez. (2006). Neuroimaging and electrophysiological studies of the effects of acute tryptophan depletion: a systematic review of the literature. Psychopharmacology. 188, 131-143;
- Laura Steenbergen, Roberta Sellaro, Lorenza S. Colzato. (2014). Tryptophan promotes charitable donating. Front. Psychol.. 5;
- Annemoon M. M. van Erp, Klaus A. Miczek. (2000). Aggressive Behavior, Increased Accumbal Dopamine, and Decreased Cortical Serotonin in Rats. J. Neurosci.. 20, 9320-9325;
- Carmelo M. Vicario. (2014). Aggression Traits in Youth Psychopathy: The Key Role of Serotonin. Front. Psychiatry. 5;
- M. Victoria Puig, Allan T. Gulledge. (2011). Serotonin and Prefrontal Cortex Function: Neurons, Networks, and Circuits. Mol Neurobiol. 44, 449-464;
- Avshalom Caspi, Ahmad R Hariri, Andrew Holmes, Rudolf Uher, Terrie E. Moffitt. (2010). Genetic Sensitivity to the Environment: The Case of the Serotonin Transporter Gene and Its Implications for Studying Complex Diseases and Traits. AJP. 167, 509-527;
- Inge Volman, Lennart Verhagen, Hanneke E. M. den Ouden, Guillén Fernández, Mark Rijpkema, et. al.. (2013). Reduced Serotonin Transporter Availability Decreases Prefrontal Control of the Amygdala. J. Neurosci.. 33, 8974-8979;
- Слово о генетике поведения;
- Краткая история антидепрессантов;
- Kyla H Thomas, Richard M Martin, John Potokar, Munir Pirmohamed, David Gunnell. (2014). Reporting of drug induced depression and fatal and non-fatal suicidal behaviour in the UK from 1998 to 2011. BMC Pharmacol Toxicol. 15;
- Bijl D. (2004). The serotonin syndrome. Neth. J. Med. 62 (9), 309–313..






