Сетевая медицина в исследовании старения: от биомаркеров к механизмам возраст-зависимых заболеваний
03 марта 2025
Сетевая медицина в исследовании старения: от биомаркеров к механизмам возраст-зависимых заболеваний
- 449
- 1
- 1
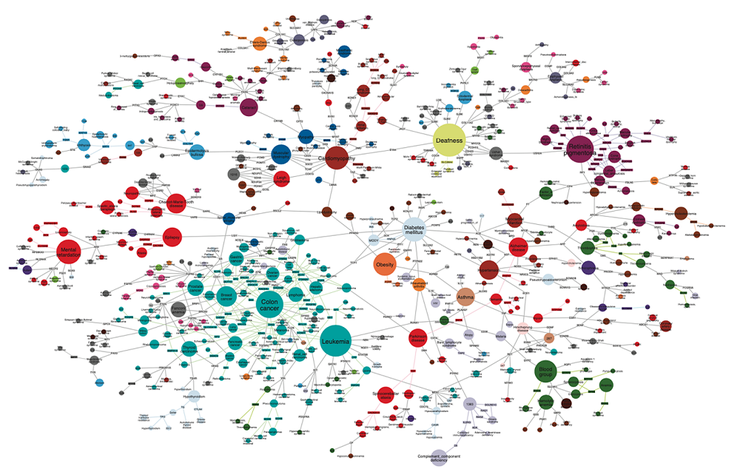
Сетевая карта взаимосвязей между заболеваниями человека — комплексный взгляд на «дизисом». На этой детальной визуализации, созданной под руководством Альберта-Ласло Барабаши, одного из основоположников науки о сетях и создателя теории безмасштабных сетей, представлена масштабная карта взаимосвязей между заболеваниями человека. Каждое заболевание изображено в виде круга, размер которого пропорционален количеству связанных с ним генов. Цветовая кодировка отражает тип заболевания: от онкологических (голубой) до неврологических (зеленый) и сердечно-сосудистых (красный). Линии между заболеваниями показывают наличие общих генетических факторов. В центре сети можно заметить крупные узлы, такие как диабет и ожирение, которые имеют множественные связи с другими заболеваниями, что отражает их комплексную природу и важную роль в развитии возрастных патологий. Эта революционная визуализация, опубликованная лабораторией Барабаши, наглядно демонстрирует один из ключевых принципов сетевой медицины: болезни не существуют изолированно, а формируют сложную взаимосвязанную сеть, понимание которой критически важно для развития современной медицины и исследования процессов старения.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Сетевая медицина — это новая парадигма в исследовании и лечении заболеваний, которая соединяет молекулярную биологию, математическое моделирование и клиническую практику. В этой статье представлены ключевые принципы сетевого анализа, позволяющие заглянуть в скрытые механизмы сложных заболеваний, от нейродегенеративных расстройств до онкологии. Читатель узнает, как сетевая медицина уже меняет наше понимание болезней: от идентификации новых мишеней для лекарств и перепрофилирования известных препаратов до диагностики и прогнозирования на основе индивидуальных молекулярных данных. Также рассмотрены перспективы персонализированной медицины и профилактики заболеваний через анализ молекулярных взаимодействий. Эта статья открывает двери в будущее, где медицина становится точной, персонализированной и проактивной, прокладывая путь к здоровому долголетию.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в спецноминации «Старение и долголетие» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение: новый взгляд на старение через призму сетей
Представьте себе современный мегаполис с высоты птичьего полета. Миллионы людей спешат по своим делам, используя сложную систему дорог, метро и автобусных маршрутов. Город живет благодаря постоянному взаимодействию множества элементов: транспортных узлов, энергетических сетей, систем водоснабжения. Стоит нарушиться работе одного крупного узла — и проблемы начинают распространяться по всей системе, затрагивая, казалось бы, не связанные районы.

Рисунок 1. Вид на ночной Нью-Йорк.
Удивительно, но похожим образом работает и наш организм. Подобно городской инфраструктуре, он представляет собой сложную сеть взаимодействующих молекул, генов и белков. И подобно тому, как мы не можем понять работу города, изучая только одну автобусную остановку, мы не можем полностью осознать механизмы старения, фокусируясь лишь на отдельных генах, белках или молекулах.
Именно поэтому последнее десятилетие ознаменовалось революцией в исследованиях старения — появлением сетевой медицины (network medicine). Этот подход позволяет увидеть целостную картину происходящих в организме изменений, объединяя данные о тысячах молекулярных взаимодействий в единую систему. Используя мощные компьютеры и алгоритмы искусственного интеллекта, ученые создают детальные карты «молекулярного города» нашего организма и отслеживают, как он меняется с возрастом.
Результаты оказались поразительными. Выяснилось, что многие возрастные заболевания, которые традиционно считались отдельными и независимыми — от болезни Альцгеймера до сердечно-сосудистых патологий — на самом деле тесно связаны между собой на молекулярном уровне. Это открытие не только изменило наше понимание природы старения, но и открыло новые перспективы для диагностики и лечения возрастных заболеваний.
Сетевая медицина позволяет ответить на вопросы, которые долгое время ставили ученых в тупик. Почему одни люди стареют быстрее других? Как различные заболевания влияют друг на друга? Можно ли предсказать, какие возрастные патологии с наибольшей вероятностью разовьются у конкретного человека? И самое главное — как использовать эти знания для продления здоровой жизни?
Как отметил нобелевский лауреат сэр Пол Нерс: «Организмы — это информационные сети». И действительно, сетевая медицина — не просто новая стратегия анализа биологических механизмов и заболеваний, а объединяющий подход, который исследует сложность биологии и болезней уникальным информативным способом для диагностических и терапевтических целей [1].
В этой статье мы отправимся в путешествие по молекулярным сетям старения. Мы узнаем, как современные технологии помогают картировать процессы старения на молекулярном уровне, какие неожиданные открытия они уже принесли и как это знание может помочь каждому из нас прожить более долгую и здоровую жизнь.
Основы сетевой медицины: как устроены биологические сети
Каждую секунду в нашем организме происходят миллиарды молекулярных взаимодействий. Белки связываются друг с другом, гены включаются и выключаются, метаболиты превращаются один в другой. Эта сложнейшая система напоминает социальную сеть, где вместо людей – молекулы, а вместо сообщений и лайков – биохимические реакции и регуляторные сигналы.
Анатомия молекулярных сетей
Любая биологическая сеть состоит из узлов (нод, от node) и связей между ними. В зависимости от типа сети, узлами могут быть различные биологические молекулы [2]:
- В сетях белок-белковых взаимодействий узлы — это белки, а связи показывают их физическое взаимодействие. Например, белок p53, известный как «страж генома», взаимодействует с десятками других белков, координируя клеточный ответ на повреждения ДНК.
- В генных сетях узлы — это гены, а связи отражают их регуляторные взаимоотношения. Когда один ген активируется, он может усиливать или подавлять работу других генов, создавая сложные регуляторные каскады.
- В метаболических сетях узлы представляют собой различные метаболиты, а связи — биохимические реакции, превращающие одни вещества в другие.
Масштаб этих взаимодействий поражает воображение: в человеческом организме около 25 000 белок-кодирующих генов, около 1000 метаболитов и неопределенное количество различных белков и функциональных РНК. В результате число клеточных компонентов, формирующих узлы интерактома (сети всех молекулярных взаимодействий), легко превышает 100 000, а количество функционально значимых взаимодействий между ними еще больше [3]. Анализ сетевых взаимодействий показал, что около половины общих белков между сетями старения и возраст-зависимых заболеваний участвуют в передаче сигналов, образуя общую сигнальную сеть, которая включает более 40% всех хабов (белков с множественными взаимодействиями) в человеческом интерактоме [4].
В биологических сетях есть важная характеристика их внутренней организации — это модульность. Каждый модуль представляет собой дискретную единицу из нескольких компонентов, которые работают вместе для выполнения определенной функции. Подобно тому, как клетку можно рассматривать как коллекцию взаимодействующих молекулярных механизмов, сеть может быть разделена на функциональные модули [5].
Ключевые принципы организации биологических сетей
Исследования показали, что биологические сети не случайны, а организованы по определенным принципам:
- Правило хабов: важную роль в процессах старения играют сигнальные хабы — белки со множественными взаимодействиями. Почти все общие белки (98%) между сетями долголетия и возрастных заболеваний взаимодействуют между собой, образуя общую сигнатурную сеть [8]. Небольшое число узлов (хабов) имеет непропорционально большое количество связей. В контексте старения такими хабами часто выступают регуляторы клеточного метаболизма, например, mTOR или AMPK. Нарушение работы хабов обычно приводит к серьезным последствиям для всей системы [3].
- Модульная организация: сети содержат группы тесно связанных между собой молекул (модули), выполняющие определенные функции [9]. Например, существуют модули, отвечающие за пролиферацию клеток, энергетический обмен или противовоспалительный ответ [10].
- Принцип малого мира: любые два узла в сети обычно связаны через небольшое число промежуточных узлов. Это объясняет, почему нарушение работы одного гена может влиять на множество, казалось бы, не связанных процессов [3].
Роль больших данных и искусственного интеллекта
Построение и анализ молекулярных сетей стали возможны благодаря трем технологическим прорывам:
- Высокопроизводительные технологии: современные методы секвенирования, протеомики и метаболомики позволяют одновременно измерять уровни тысяч молекул в организме.
- Мощные алгоритмы: искусственный интеллект помогает находить закономерности в огромных массивах данных и предсказывать новые связи между молекулами. Например, алгоритмы машинного обучения успешно предсказывают ранее неизвестные белок-белковые взаимодействия.
- Интеграция разных типов данных: современные методы позволяют объединять информацию из разных источников — от генетических исследований до клинических наблюдений — создавая многоуровневую картину биологических процессов.
Успех биологических сетевых моделей во многом обязан их математическим свойствам. Биологические сети являются «масштабно-свободными» (scale-free), где взаимодействия генов происходят не случайным образом. В таких сетях присутствует несколько высокосвязанных «хабов» — узлов, которые соединяются со множеством других узлов и, как правило, являются критически важными для поддержания целостности всей сети. Белки-хабы обычно кодируются эволюционно консервативными генами, выполняющими ключевые клеточные функции [9].
От теории к практике
Сетевая медицина предлагает множество практических решений, которые уже находят применение в клинической и исследовательской практике. Во-первых, она позволяет идентифицировать механизмы заболеваний, анализируя белково-белковые взаимодействия и выделяя ключевые «узлы» в молекулярных сетях. Это помогает понять, как развиваются такие сложные патологии, как рак или нейродегенеративные заболевания. Во-вторых, сетевая медицина значительно улучшает диагностику и прогнозирование, например, с помощью методов сетевой стратификации заболеваний, что позволяет выделять подтипы болезней и предсказывать их индивидуальное течение. В-третьих, этот подход стал важным инструментом в разработке новых лекарств и перепрофилировании существующих препаратов, когда уже одобренные лекарства находят применение для лечения других заболеваний благодаря картированию их мишеней на молекулярных сетях. В-четвертых, сетевая медицина способствует прогрессу в области персонализированной терапии, где анализ индивидуальных молекулярных данных пациента помогает подбирать наиболее эффективные и безопасные схемы лечения. И наконец, в-пятых, с ее помощью можно предотвращать заболевания: анализ динамики молекулярных сетей выявляет ранние изменения, позволяя проводить профилактические вмешательства задолго до появления клинических симптомов. Эти достижения делают сетевую медицину ключевым инструментом современной науки и клинической практики [11].
Сетевой подход открывает новую эру в медицине, где лечение основывается не на симптомах, а на понимании сложных молекулярных взаимодействий, лежащих в основе заболеваний. В следующем разделе мы рассмотрим, как эти принципы применяются конкретно к исследованию процессов старения.
Картирование процессов старения: как выглядит молекулярный портрет времени
От отдельных путей к сети старения
Долгое время исследователи старения напоминали слепцов из древней притчи, изучающих слона. Одни сосредотачивались на укорочении теломер, другие — на накоплении поврежденных белков, третьи — на нарушении работы митохондрий. Каждый видел лишь часть явления, оставаясь в неведении относительно общей картины. Сетевой подход впервые позволил взглянуть на «слона» целиком, объединив разрозненные данные в единую систему.
Исследования показали, что «сеть старения» состоит из нескольких ключевых модулей, каждый из которых отражает важные аспекты биологии клетки. Модуль пролиферации (P) управляет клеточным делением и ядерным транспортом, но с возрастом его активность снижается, указывая на снижение регенеративных способностей клеток. Модуль дифференцировки (D), напротив, усиливает свою активность, что отражает переход клеток к специализированным функциям и уменьшение их делительной активности.
Метаболизм представлен двумя модулями: окислительным (O) и восстановительным (редуктивным, R), которые демонстрируют противоположные изменения. Этот сдвиг в метаболическом балансе с возрастом сопровождается накоплением повреждений и нарушением энергетического гомеостаза клеток. Иммунный модуль (I), активность которого возрастает с возрастом, играет центральную роль в развитии хронического воспаления, характерного для стареющих тканей.
Эти модули не существуют изолированно — их взаимодействие координируется через интерфейсы, где ключевые гены-регуляторы обеспечивают баланс и стабильность системы. Однако с возрастом эта координация нарушается, что приводит к дестабилизации сети и усилению возрастных изменений.
Таким образом, сетевой подход открыл новое видение старения как комплексного процесса, в котором изменения в отдельных модулях и их взаимодействиях формируют уникальный «почерк» возраста. Это понимание прокладывает путь к новым стратегиям замедления старения и профилактики возрастных заболеваний [10].
Ключевые хабы в процессах старения
Анализ сетей помог выявить главных «дирижеров» процесса старения. Среди них:
- mTOR (мишень рапамицина млекопитающих, mechanistic target of rapamycin) — центральный регулятор клеточного роста и метаболизма. Этот белок связывает питание, рост и старение, реагируя на уровень питательных веществ и гормонов. Интересно, что снижение активности mTOR продлевает жизнь многим организмам, от дрожжей до мышей [12].
- Сиртуины — семейство белков, реагирующих на энергетический статус клетки. SIRT1, наиболее изученный представитель семейства, связывает более 200 различных белков, регулируя процессы от репарации ДНК до воспаления [13].
- AMPK (АМФ-активируемая протеинкиназа, AMP-activated protein kinase) — «энергетический сенсор» клетки, активирующийся при снижении уровня ATP. Через этот хаб проходят сигналы об энергетическом статусе клетки, что делает его ключевым регулятором метаболизма при старении [14].
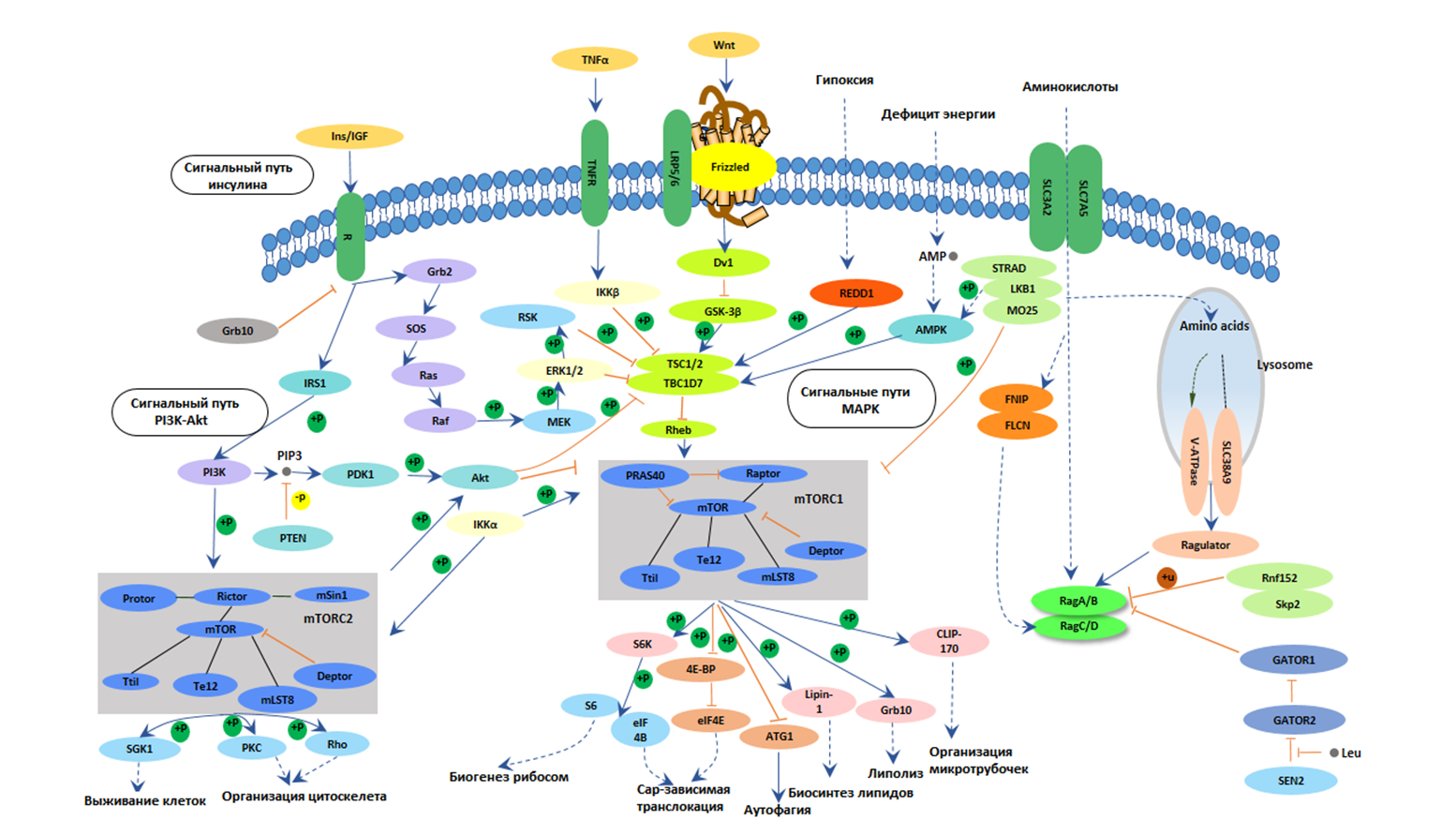
Рисунок 2. Молекулярная карта клеточных сигнальных путей, регулирующих процессы старения. На схеме представлены ключевые сигнальные каскады, включая путь инсулин/IGF, PI3K-Akt и MAPK сигналинг, а также mTOR-зависимую регуляцию. Эти пути координируют важнейшие клеточные процессы: выживание клеток, организацию цитоскелета, биогенез рибосом, трансляцию белков, аутофагию и липидный обмен. Интеграция этих сигнальных путей позволяет клетке адаптироваться к различным воздействиям, таким как гипоксия, энергетический дефицит и изменения в доступности питательных веществ, что играет критическую роль в процессах старения.
Временная динамика изменений сетей
В молодости (до 40 лет) наши клеточные «электростанции», митохондрии, работают как часы, обеспечивая энергией все процессы. Но постепенно их эффективность начинает падать. Происходит это неслучайно: накапливаются повреждения в митохондриальной ДНК, нарушается работа электрон-транспортной цепи, а уровень важнейшего кофактора NAD+ неуклонно снижается. Параллельно в тканях начинает тлеть подспудное воспаление — так называемый «инфламэйджинг», а системы контроля качества белков (особенно аутофагия) теряют свою эффективность.
К среднему возрасту (40–60 лет) ситуация усугубляется. Теперь уже страдает не только энергетический обмен — нарушается сама архитектура клеточных сетей. Появляются новые патологические связи между сигнальными путями, а старые полезные взаимодействия ослабевают. Клетки все чаще переходят в состояние сенесценции, выделяя целый коктейль воспалительных факторов (SASP). Это похоже на эффект домино: проблемы в одной системе запускают каскад нарушений в других.
После 60 лет молекулярные сети претерпевают настоящую революцию — меняется сама их архитектура. Формируются устойчивые патологические модули, нарушается работа стволовых клеток, а способность организма противостоять стрессам значительно снижается. Однако исследования последних лет показывают: многие из этих изменений можно замедлить или даже обратить вспять. Например, восстановление уровня NAD+, устранение сенесцентных клеток или активация аутофагии открывают новые перспективы в борьбе со старением [15].
Это уже не просто фундаментальная наука — на основе понимания возрастных изменений молекулярных сетей разрабатываются принципиально новые терапевтические стратегии, способные продлить здоровое долголетие.
История успеха: открытие роли сенесцентных клеток
Яркий пример эффективности сетевого подхода — исследование сенесцентных (старых) клеток. Анализ сетей показал, что эти клетки являются не просто «отработанным материалом», а активными узлами в сети старения, влияющими на окружающие ткани через секрецию различных сигнальных молекул (т.н. SASP — ассоциированный со старением секреторный фенотип, senescence-associated secretory phenotype) [16].
Построение сетевой карты взаимодействий сенесцентных клеток с окружающими тканями привело к разработке сенолитиков — препаратов, избирательно уничтожающих такие клетки. Эксперименты на мышах показали, что удаление сенесцентных клеток может значительно замедлить развитие возрастных патологий.
Понимание архитектуры и динамики сетей старения открывает новые возможности для разработки терапевтических стратегий. Вместо того, чтобы пытаться воздействовать на отдельные молекулы, мы можем разрабатывать препараты, влияющие на работу целых сетевых модулей, добиваясь более эффективного и безопасного эффекта.
От теории к практике: диагностические возможности сетевой медицины
Новый взгляд на биомаркеры старения
Традиционный подход к поиску биомаркеров старения напоминал попытку оценить состояние автомобиля по одному параметру — пробегу, расходу топлива или износу шин. Сетевая медицина предложила принципиально новый подход: оценивать не отдельные показатели, а паттерны их взаимодействий. Это позволило увидеть, что изменения в сетях взаимодействий белков, генов и метаболитов зачастую предшествуют появлению видимых симптомов старения [17].
Сетевой анализ позволил пересмотреть наше понимание роли митохондрий в процессах старения. Вместо простой модели накопления повреждений, современные исследования показывают, что митохондрии являются частью сложной регуляторной сети, где нарушения в одном компоненте могут каскадно влиять на всю систему. База данных MitoInteractome, собравшая информацию о взаимодействиях в митохондриальном протеоме, помогла построить детальную карту этих взаимосвязей. Особое внимание привлекает теория «слабых связей» в старении — согласно ей, возрастные изменения в первую очередь затрагивают низкоаффинные, временные взаимодействия в митохондриальных сетях. Эти нарушения особенно заметны в работе шаперонов — белков, которые связывают различные функциональные модули митохондрий. Перегрузка системы шаперонов может привести к нарушению координации между различными митохондриальными процессами, что, в свою очередь, ускоряет старение. Понимание этих сетевых взаимодействий открывает новые перспективы для терапевтического воздействия на процессы старения через стабилизацию митохондриальных сетей [18].
Биомаркеры старения нового поколения
В последние годы достигнут значительный прогресс в выявлении и изучении различных типов биомаркеров старения. На сегодняшний день выделяют несколько основных категорий [19]:
- Эпигенетические маркеры считаются наиболее точными предикторами биологического возраста. «Эпигенетические часы», основанные на анализе метилирования ДНК, позволяют с высокой точностью предсказывать продолжительность жизни независимо от других факторов риска. Этот тип маркеров особенно ценен тем, что отражает фундаментальные возрастные изменения на уровне регуляции генома.
- Молекулярно-генетические биомаркеры включают в себя прежде всего длину теломер — классический показатель клеточного старения, а также различные транскриптомные профили. Изменения в этих маркерах не только отражают возраст, но и тесно связаны с развитием возраст-зависимых заболеваний.
- Протеомные биомаркеры представляют собой специфические белки и их модификации в плазме крови и других биологических жидкостях. Изменения в белковом профиле могут свидетельствовать о различных аспектах старения организма, включая воспаление и окислительный стресс.
- Метаболические биомаркеры отражают возрастные изменения обмена веществ и включают профили различных метаболитов в крови и моче, а также изменения в гликозилировании белков. Они позволяют оценить функциональные изменения, происходящие в организме с возрастом.
- Иммунные биомаркеры характеризуют возрастные изменения иммунной системы, включая хроническое воспаление и иммуностарение. Они особенно важны для понимания механизмов возрастной уязвимости к различным заболеваниям.
- Комплексные биомаркеры объединяют различные показатели и позволяют получить интегральную оценку биологического возраста. Такой системный подход особенно перспективен, поскольку разные типы маркеров часто работают независимо друг от друга и отражают различные аспекты процесса старения.
Исследования показывают, что корреляции между различными типами биомаркеров обычно слабые или отсутствуют. Это может указывать на то, что разные биомаркеры отражают различные аспекты процесса старения, что подчеркивает важность комплексного подхода к его оценке.
От теории к практике: примеры успешного применения
Сетевой анализ уже привел к разработке нескольких практических диагностических инструментов:
Эпигенетические часы Хорвата
Эпигенетические часы Хорвата стали настоящим прорывом в изучении старения. Основанные на метилировании ДНК, эти часы анализируют 353 ключевых CpG-сайта, формируя точную модель, которая позволяет определять биологический возраст тканей и клеток. Подход отличается своей универсальностью, поскольку охватывает широкий спектр тканей, включая кровь, мозг, эпителий и другие.
Эти часы не ограничиваются отдельными метками старения. Вместо этого они фиксируют сложные паттерны эпигенетических изменений, отражая взаимодействие между различными механизмами регуляции. Например, они могут указывать на ускорение биологического возраста тканей (age acceleration), связанное с заболеваниями, такими как рак, или генетическими аномалиями, включая мутации TP53.
Уникальность эпигенетических часов заключается в их способности работать независимо от типа ткани, пола или состояния здоровья, что делает их универсальным инструментом для оценки возраста и прогнозирования рисков возрастных заболеваний. Они открывают новые горизонты в поиске маркеров старения и тестировании омолаживающих терапий [20].
Воспалительные часы старения (iAge)
Воспалительные часы старения (inflammatory age, iAge) представляют собой инновационный подход к оценке биологического возраста, основанный на анализе системного воспаления. В основе метода лежит применение алгоритмов глубокого обучения, которые анализируют сложные паттерны взаимодействия между различными воспалительными маркерами в организме. Особенность этого подхода заключается в способности учитывать нелинейные связи между компонентами иммунной системы.
Среди множества воспалительных маркеров особое значение приобрел хемокин CXCL9, который оказался ключевым предиктором возрастных изменений. Алгоритм iAge не просто измеряет отдельные показатели, а оценивает комплексные изменения в иммунной сети, связанные с развитием мультиморбидности, снижением иммунной функции и сердечно-сосудистыми заболеваниями. Интересно, что у долгожителей наблюдаются более низкие показатели iAge, что указывает на существование защитных механизмов, сдерживающих хроническое воспаление.
Принципиальным отличием iAge от других биомаркеров старения является его потенциальная терапевтическая значимость. Идентификация CXCL9 как ключевого компонента возрастного воспаления открывает новые возможности для разработки таргетных терапий. В экспериментальных исследованиях подавление активности CXCL9 приводило к снижению воспаления и улучшению функции сосудов, что может стать основой для разработки новых подходов к профилактике возрастных заболеваний [21].
Практическое применение сетевых биомаркеров
Персонализированный подход к анализу биомаркеров позволяет не только идентифицировать значимые молекулярные маркеры, но и оценивать их индивидуальную прогностическую ценность для конкретного пациента. Недавние исследования в области сетевой медицины показали, что анализ «локальной сетевой структуры» — паттерна взаимодействий между молекулярными компонентами — позволяет с высокой точностью предсказывать индивидуальные траектории развития заболеваний [23].
Представьте себе, что мы можем заглянуть в будущее здоровья человека, наблюдая за тончайшими молекулярными изменениями задолго до появления первых симптомов. Сетевые биомаркеры делают это возможным, позволяя обнаруживать едва заметные нарушения на молекулярном уровне, когда традиционные методы диагностики еще не показывают никаких отклонений. Подобно тому, как опытный механик может предсказать поломку автомобиля по едва заметным признакам, анализ сетевых биомаркеров позволяет «услышать» первые «скрипы» в работе нашего организма.
Особенно интересно, что такой подход позволяет не просто констатировать биологический возраст, но и понять, какие системы организма стареют быстрее других. Это открывает путь к по-настоящему персонализированной профилактике. Вместо общих рекомендаций «больше двигаться и правильно питаться» появляется возможность разработать индивидуальную стратегию замедления старения, учитывающую уникальные особенности молекулярных сетей конкретного человека.
Но самое удивительное — это переход от диагностики к терапии. Сетевые биомаркеры не просто показывают проблему, они подсказывают путь к ее решению. Анализ нарушенных сетевых модулей помогает подобрать оптимальные комбинации геропротекторов — веществ, замедляющих старение. При этом эффективность терапии можно отслеживать в реальном времени, наблюдая за изменениями в молекулярных сетях.
Будущее сетевой диагностики выглядит еще более впечатляющим. Развитие технологий позволяет объединять различные типы данных — от генома до микробиома — в единую картину здоровья человека. Искусственный интеллект помогает находить сложные паттерны в этих данных, предсказывая индивидуальные траектории старения. А создание «умных» биосенсоров и их интеграция с системами телемедицины сделает такую диагностику доступной практически каждому.
Сетевой подход к изучению заболеваний человека открывает множество потенциальных биологических и клинических применений. Лучшее понимание влияния клеточных взаимосвязей на прогрессирование заболевания может привести к идентификации новых генов и путей развития болезней, которые, в свою очередь, могут стать лучшими мишенями для разработки лекарств [3].
Мы стоим на пороге новой эры в медицине, где лечение основывается не на симптомах, а на глубоком понимании индивидуальных особенностей молекулярных сетей каждого человека. Это открывает беспрецедентные возможности для профилактики и лечения возрастных заболеваний, приближая нас к мечте о здоровом долголетии.
Связь возрастных заболеваний: единая сеть патологий
Загадка коморбидности
Врачи давно заметили интересную закономерность: с возрастом болезни редко приходят поодиночке. У пожилых пациентов часто одновременно обнаруживаются сердечно-сосудистые заболевания, диабет 2 типа, остеопороз и когнитивные нарушения. Традиционная медицина объясняла это простым совпадением или общими факторами риска. Однако сетевой анализ показал гораздо более глубокую связь между этими патологиями. Развитие методов сетевого анализа привело к созданию различных типов сетей заболеваний, включая сети, связывающие болезни на основе общих генов, метаболических путей, микроРНК или клинических симптомов. Это позволяет изучать коморбидность заболеваний — их тенденцию проявляться совместно у одного пациента, что особенно важно для понимания возрастных патологий [24].
Интересно, что болезни, связанные между собой в сети заболеваний, часто демонстрируют повышенную коморбидность — то есть они с большей вероятностью встречаются у одного и того же пациента, чем можно было бы ожидать случайным образом. Это указывает на общие патофизиологические механизмы между такими заболеваниями [25], [26].
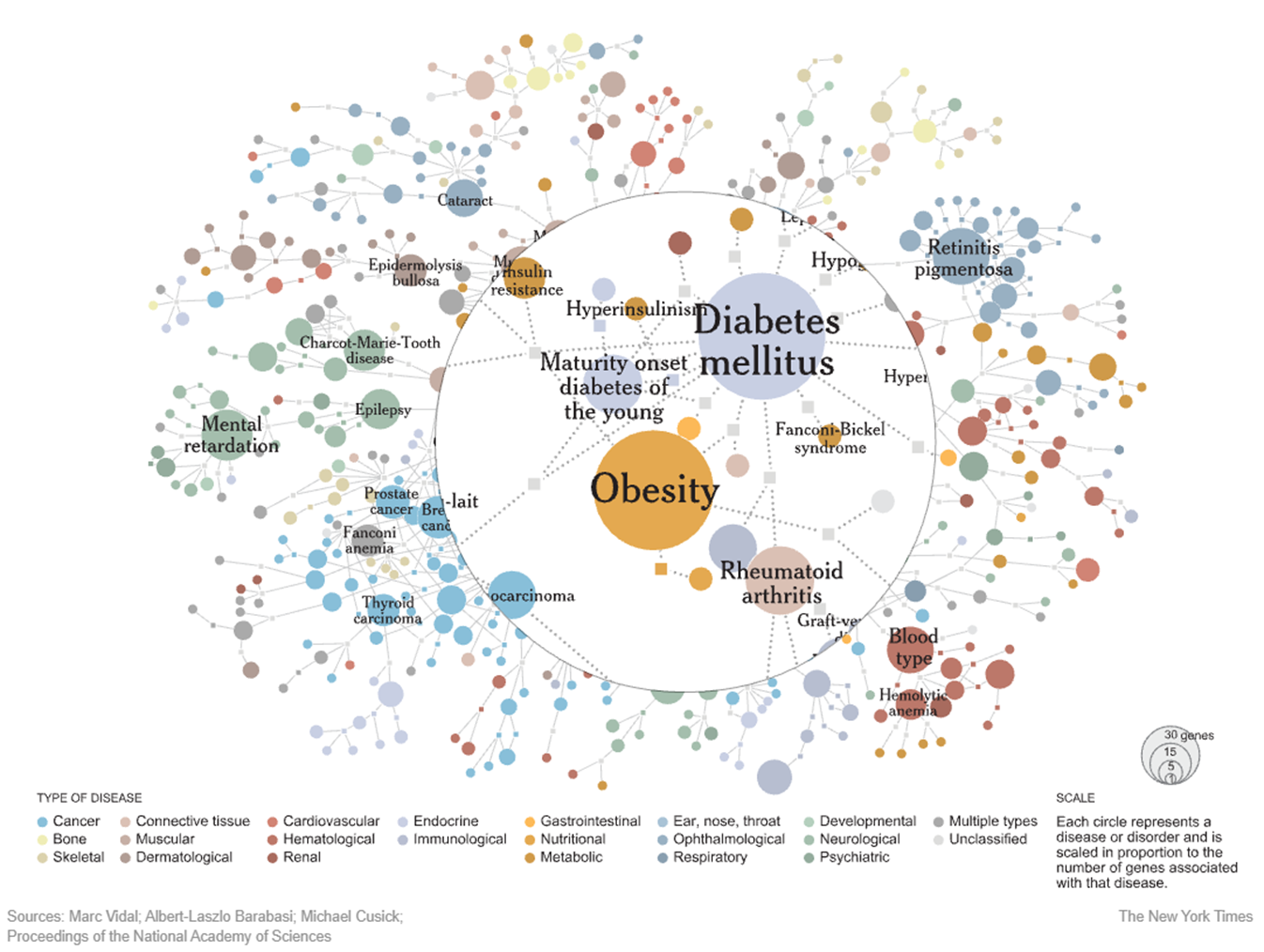
Рисунок 3. Карта взаимосвязей между заболеваниями человека («дизисом»). Визуализация показывает сеть заболеваний (обозначены кругами) и их генетических связей. Размер каждого круга пропорционален количеству генов, ассоциированных с данным заболеванием. На рисунке хорошо видно, как некоторые болезни образуют тесно связанные кластеры — например, группа метаболических заболеваний вокруг диабета и ожирения. Различные типы заболеваний обозначены разными цветами: рак (голубой), сердечно-сосудистые заболевания (красный), эндокринные нарушения (фиолетовый) и другие. Такая визуализация помогает понять, как генетически взаимосвязаны различные заболевания, что особенно важно при изучении возрастных патологий, которые часто появляются не изолированно, а в комплексе друг с другом.
Молекулярные мосты между заболеваниями
Анализ молекулярных сетей выявил несколько ключевых механизмов, связывающих различные возрастные заболевания:
Общие сигнальные пути
Сигнальный путь mTOR (мишень рапамицина млекопитающих, mechanistic target of rapamycin) выступает центральным регулятором множества клеточных процессов, нарушение которых приводит к развитию возраст-зависимых заболеваний. В сердечно-сосудистой системе mTOR необходим для нормального развития и функционирования сердца, однако его избыточная активация в пожилом возрасте связана с развитием патологий миокарда. При нейродегенеративных заболеваниях, таких как болезнь Альцгеймера, повышенная активность пути mTOR сопровождается снижением аутофагии, нарушением метаболизма глюкозы и дисфункцией митохондрий. В жировой ткани сигнальный путь mTOR регулирует процессы адипогенеза и термогенеза, влияя тем самым на развитие метаболических нарушений, включая ожирение и диабет. Таким образом, mTOR служит молекулярным мостом, объединяющим различные возрастные патологии через регуляцию ключевых клеточных процессов [12].
Фактор транскрипции NF-κB является одним из ключевых регуляторов воспалительных процессов и играет важную роль в развитии возраст-зависимых патологий. С возрастом наблюдается стойкая активация NF-κB, что приводит к хроническому воспалению и нарушению гомеостаза тканей. В частности, повышенная активность NF-κB связана с накоплением стареющих клеток, которые секретируют провоспалительные факторы, включая цитокины и хемокины (SASP). Эти факторы не только поддерживают локальное воспаление, но и способствуют системному воспалительному ответу. Экспериментальные исследования показали, что даже небольшое количество (2–3%) стареющих клеток с активированным NF-κB в тканях может оказывать значительное негативное влияние на функцию органов за счет SASP-опосредованных эффектов. Таким образом, NF-κB представляет собой центральное звено, связывающее клеточное старение, воспаление и развитие возраст-ассоциированных заболеваний [12].
Общие белковые сети
Белки теплового шока (HSP) — молекулярные «телохранители» наших клеток, обеспечивающие защиту от повреждений и поддержание их жизнеспособности. Однако с возрастом их функции ослабевают, что открывает двери для множества возраст-зависимых заболеваний. В сердечно-сосудистой системе HSP не только защищают клетки сердца от стресса, но и препятствуют образованию опасных атеросклеротических бляшек. Если же их активность снижается, это становится одной из причин развития таких патологий, как ишемическая болезнь сердца и сердечная недостаточность.
При нейродегенеративных заболеваниях, включая болезнь Альцгеймера, Паркинсона и Хантингтона, роль HSP сравнима с функцией «чистильщиков». Они предотвращают накопление токсичных белков и помогают клеткам мозга справляться с разрушительным стрессом. Однако когда эти белки начинают работать с перебоями, запускаются каскады воспаления, нейроны теряют защиту, и патология прогрессирует.
HSP также играют ведущую роль в воспалительных процессах. Их взаимодействие с иммунными рецепторами помогает регулировать баланс между воспалением и его подавлением. Но когда этот баланс нарушается, хроническое воспаление берет верх, создавая почву для таких явлений, как старческое ослабление иммунитета (инфламэйджинг).
Таким образом, HSP — это не просто белки. Это молекулярные «режиссеры», которые дирижируют сложным спектаклем клеточных процессов. Их работа объединяет разные аспекты нашего здоровья — от защиты сердца до сохранения ясности ума, превращая их в один из самых перспективных объектов для исследований и новых терапевтических стратегий [27].
Метаболические хабы
Глюкоза — это не просто основной источник энергии для клеток, но и ключевой участник сложных биохимических путей, которые меняются с возрастом. С возрастом эффективность окислительного фосфорилирования (OXPHOS), одного из главных процессов производства энергии в митохондриях, снижается. Это приводит к уменьшению соотношения АТФ/АМФ, что отражает снижение энергетического статуса клеток. В попытке компенсировать дефицит энергии клетки увеличивают активность лактатдегидрогеназы (LDH), что усиливает переход на анаэробный метаболизм и приводит к накоплению лактата.
Однако такая адаптация имеет побочные эффекты: возрастное снижение эффективности OXPHOS сопровождается увеличением уровня активных форм кислорода (АФК), что вызывает окислительный стресс. Это запускает порочный круг: повреждение митохондрий усиливает производство АФК, что, в свою очередь, ускоряет старение клеток. Процессы гликирования и нарушения утилизации глюкозы также усиливают системное воспаление и способствуют прогрессированию возрастных заболеваний, включая нейродегенеративные и сердечно-сосудистые.
Таким образом, метаболизм глюкозы играет центральную роль в механизмах старения, связывая энергетический дефицит, окислительный стресс и возрастные патологии. Изучение этих изменений открывает перспективы для разработки новых терапевтических стратегий, направленных на замедление старения и повышение качества жизни [28].
Примеры неожиданных связей
Сетевой анализ обнаружил несколько удивительных связей между заболеваниями:
Остеопороз и болезнь Альцгеймера
Оказалось, что белок остеокальцин, традиционно считавшийся специфичным для костной ткани, играет важную роль в работе мозга. Его снижение при остеопорозе может ускорять развитие когнитивных нарушений. Остеокальцин проникает через гематоэнцефалический барьер, связывается с нейронами в определенных областях мозга, предотвращает апоптоз нейронов в гиппокампе, способствует синтезу моноаминовых нейротрансмиттеров и ингибирует синтез гамма-аминомасляной кислоты. Эти клеточные и молекулярные функции могут объяснять, почему остеокальцин необходим для гиппокамп-зависимой памяти и снижения тревожного поведения [15].
Диабет и болезнь Паркинсона
Анализ молекулярных сетей выявил, что нарушение инсулинового сигналинга и метаболические изменения при диабете тесно связаны с патогенезом болезни Паркинсона. Более 60% пациентов с болезнью Паркинсона имеют нарушенную передачу инсулинового сигнала и нарушение толерантности к глюкозе. Недавние исследования показывают, что диабет 2 типа развивается из инсулинорезистентности, что приводит к различным негативным эффектам на метаболизм и воспаление. Аналогичные нарушения регуляции глюкозы и энергетического метаболизма являются ранними событиями в патогенезе спорадической болезни Паркинсона. Инсулиновые рецепторы обнаруживаются в базальных ганглиях и черной субстанции, где инсулин играет важную роль в регуляции выживания нейронов, их роста, дофаминергической передачи и поддержании синапсов [29].
Саркопения и воспаление
Саркопения, характеризующаяся прогрессивной потерей мышечной массы и силы, тесно связана с хроническим воспалением, возникающим с возрастом, известным как «воспалительное старение» (inflammaging). Уровни провоспалительных цитокинов, таких как интерлейкин-6 (IL-6) и фактор некроза опухоли альфа (TNF-α), значительно повышены у людей с саркопенией, что способствует разрушению мышечной ткани и снижению ее регенеративной способности. Одновременно, анти-воспалительные цитокины, такие как IL-10, могут замедлить мышечную атрофию, подчеркивая сложный баланс между провоспалительными и противовоспалительными сигналами.
Кроме того, мышечная ткань сама по себе является эндокринным органом, секретирующим миокины, которые влияют на воспалительные процессы и системный метаболизм. Однако с возрастом эта функция нарушается, что усиливает воспалительные реакции и ускоряет развитие саркопении. Таким образом, воспаление и саркопения образуют замкнутый круг, где мышечная дисфункция усиливает воспаление, а воспаление, в свою очередь, усугубляет потерю мышечной массы.
Этот порочный круг делает воспаление важной мишенью для профилактики и лечения саркопении, открывая перспективы для разработки новых терапевтических стратегий [30].
Практическое значение: новые терапевтические стратегии
Понимание сетевых связей между заболеваниями открывает поистине захватывающие терапевтические перспективы. Представьте себе лекарство, которое, подобно умному стратегу, способно одновременно воздействовать на несколько ключевых точек патологического процесса. Такая мультитаргетная терапия становится реальностью благодаря сетевому анализу, который позволяет не только разрабатывать новые препараты, но и находить неожиданные применения для уже существующих лекарств.
Еще более интригующей выглядит возможность предотвращать болезни до их появления. Анализируя сложные паттерны молекулярных взаимодействий, мы можем выявлять людей с повышенным риском развития определенных комбинаций заболеваний и разрабатывать для них индивидуальные профилактические стратегии. Это похоже на шахматную партию, где мы можем просчитать потенциальные «ходы» болезни на несколько шагов вперед и заранее подготовить эффективную защиту.
Кроме того, сетевой подход позволяет оптимизировать само лечение. Подобно тому, как опытный дирижер управляет оркестром, врач может точнее подбирать комбинации препаратов, предвидеть возможные побочные эффекты и в реальном времени отслеживать, как организм отвечает на терапию на системном уровне. Это открывает путь к по-настоящему персонализированной медицине, где лечение подбирается с учетом уникальных особенностей молекулярных сетей каждого пациента.
История успеха: метформин как первый препарат против старения
Метформин представляет собой яркий пример того, как сетевая медицина помогает раскрыть новые терапевтические возможности уже известных препаратов. Изначально разработанный в 1957 году как средство для лечения диабета 2 типа, метформин за 60 лет клинического применения продемонстрировал удивительно широкий спектр положительных эффектов на здоровье и продолжительность жизни [31].
Исследования показали, что метформин влияет на ключевые узлы в сети старения через несколько основных механизмов [32]:
- Метаболический путь — активация AMPK и подавление mTOR, что улучшает чувствительность к инсулину и регулирует энергетический обмен.
- Окислительный путь — снижение продукции активных форм кислорода через ингибирование комплекса I митохондрий.
- Противовоспалительный путь — подавление NF-κB сигналинга и провоспалительных цитокинов.
Благодаря воздействию на эти центральные механизмы старения, метформин показал эффективность против целого ряда возрастных заболеваний, включая сердечно-сосудистые заболевания, нейродегенеративные расстройства, различные типы рака, когнитивные нарушения.
Сейчас метформин стал первым препаратом, который тестируется в масштабном клиническом исследовании TAME (Targeting Aging with Metformin — Воздействие на старение с помощью метформина) как средство против старения [31]. Успех метформина демонстрирует, как понимание сетевых взаимодействий в процессах старения может привести к открытию новых терапевтических стратегий для продления здоровой жизни.
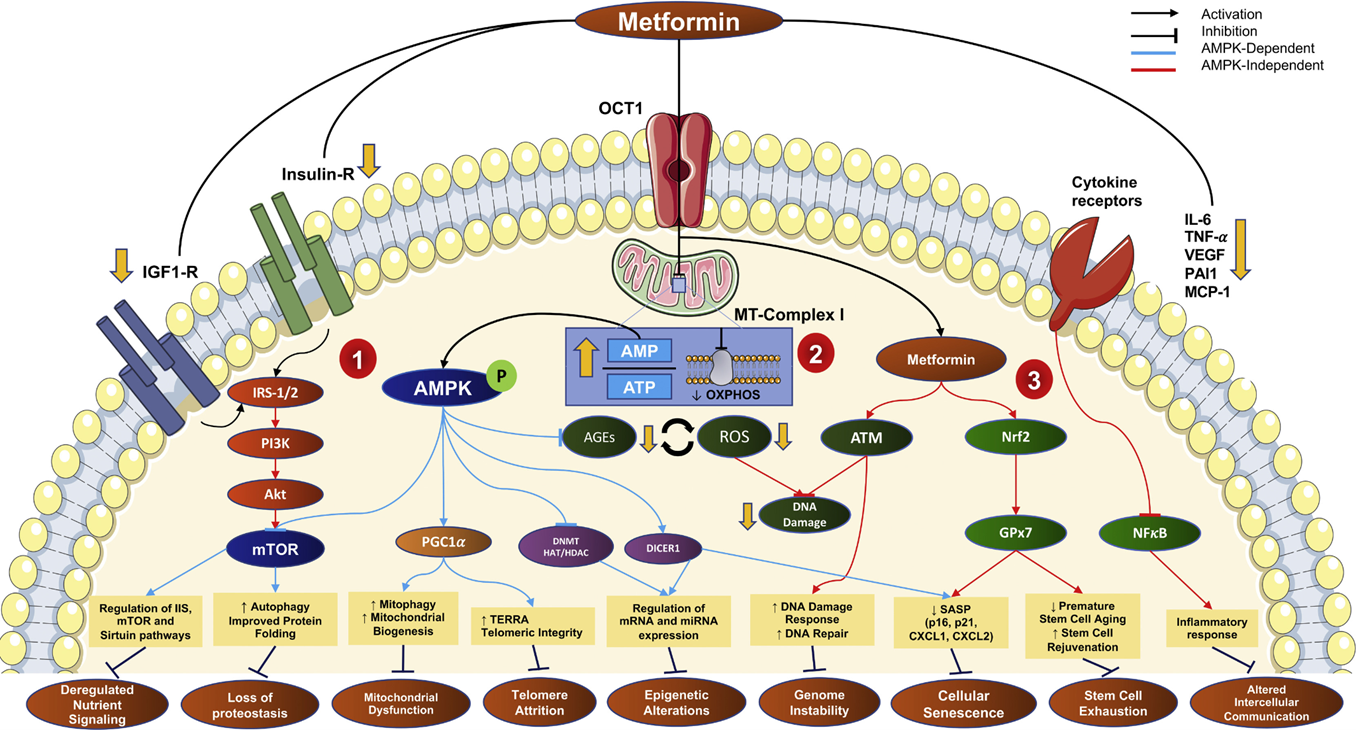
Рисунок 4. Механизмы действия метформина на ключевые признаки старения. Метформин влияет на старение через три основных пути: метаболический (1), окислительный (2) и противовоспалительный (3). После проникновения в клетку через транспортер OCT1, метформин: (1) активирует AMPK, что улучшает энергетический обмен и аутофагию; (2) снижает окислительный стресс через влияние на митохондрии; (3) уменьшает воспаление через подавление провоспалительных сигнальных путей. Все эти эффекты в совокупности замедляют ключевые процессы старения: нарушение питательного сигналинга, накопление повреждений ДНК, потерю протеостаза, клеточное старение, дисфункцию митохондрий, истощение стволовых клеток и нарушение межклеточной коммуникации.
адаптировано из [31]
Будущее терапии возрастных заболеваний: от симптомов к системным решениям
Сетевая медицина предлагает революционный подход к проблеме старения. Вместо борьбы с отдельными симптомами, новая парадигма нацелена на восстановление работы всей молекулярной сети организма. И первые результаты уже впечатляют.
Ключевое изменение — переход от симптоматического лечения к системной терапии. Воздействуя на центральные регуляторы старения, такие как mTOR, AMPK или сиртуины, мы можем одновременно влиять на метаболизм, воспаление и регенерацию тканей. Это позволяет предотвращать целый каскад возрастных заболеваний еще до их развития.
Не менее важен переход к персонализированной медицине. Современные технологии позволяют анализировать индивидуальные особенности молекулярных сетей каждого человека, прогнозировать риски и разрабатывать персональные терапевтические стратегии. Вместо стандартных схем лечения мы получаем точно настроенные инструменты для коррекции возрастных изменений.
Конечная цель этой революции — перейти от лечения болезней к управлению здоровьем. Постоянный мониторинг молекулярных показателей и своевременная коррекция нарушений позволят предотвращать развитие возрастных патологий на системном уровне. Сетевая медицина открывает дверь в будущее, где старение становится управляемым процессом, а здоровое долголетие — достижимой целью.
Персонализированная профилактика: от общих рекомендаций к точной медицине старения
Почему один размер не подходит всем
Традиционные рекомендации по здоровому старению напоминают усредненный размер одежды — кому-то слишком велики, кому-то малы. Одни люди остаются здоровыми несмотря на «вредные привычки», другие сталкиваются с серьезными проблемами, несмотря на здоровый образ жизни. Сетевая медицина помогает понять причины этих различий и разработать персонализированные стратегии профилактики.
Исследования последних лет показывают, что процесс старения определяется сложной сетью взаимодействующих молекулярных и клеточных механизмов [3]. Эта сеть уникальна для каждого человека и формируется под влиянием как генетических факторов, так и факторов окружающей среды. Подобно тому, как каждый город имеет свою уникальную транспортную сеть, каждый организм обладает собственной архитектурой молекулярных взаимодействий, определяющей его путь старения.
Современные методы анализа позволяют расшифровать эту сложную архитектуру и понять, какие узлы сети наиболее уязвимы у конкретного человека [33]. Например, у одних людей ключевую роль играют механизмы воспаления, у других — особенности энергетического обмена, а у третьих — система защиты от окислительного стресса. Это объясняет, почему стандартные рекомендации по здоровому образу жизни могут давать столь разные результаты.
Особенно важно, что сетевой анализ позволяет увидеть, как различные факторы влияют друг на друга. Исследования показывают, что гены старения часто являются центральными узлами в сетях различных возрастных заболеваний [34]. Это означает, что воздействие на один фактор может вызвать каскад изменений во всей системе, причем характер этих изменений будет зависеть от индивидуальных особенностей сети.
На основе такого понимания можно разработать действительно персонализированные стратегии профилактики. Вместо общих рекомендаций «больше двигаться и правильно питаться» появляется возможность определить, какой именно вид физической активности и какой режим питания оптимален для конкретного человека с учетом особенностей его метаболизма, циркадных ритмов и других факторов.
Будущее сетевой медицины в исследовании старения: горизонты и вызовы
Представьте себе будущее, где врач может увидеть динамическую карту молекулярных процессов в организме пациента, подобно тому, как метеоролог наблюдает за движением воздушных масс на карте погоды. Это будущее уже начинает проявляться благодаря развитию сетевой медицины, хотя путь к нему не лишен препятствий и вызовов.
Сегодня мы находимся на пороге революционных изменений в понимании процессов старения. Как отмечают Барабаши и коллеги, сетевая медицина открывает беспрецедентные возможности для понимания сложных биологических систем, однако требует преодоления значительных технологических барьеров [3]. Главный вызов заключается в том, что молекулярные «актеры» в нашем организме находятся в постоянном движении и взаимодействии, а уловить эту динамику в реальном времени — задача колоссальной сложности.
Впрочем, научное сообщество не стоит на месте. Развитие технологий анализа единичных клеток и новых биосенсоров постепенно приближает нас к возможности наблюдать за молекулярными процессами в режиме реального времени. По мере того, как эти технологии становятся более доступными, мы приближаемся к эре персонализированных «часов старения» — систем, способных точно определять биологический возраст и предсказывать индивидуальные траектории старения [33].
Особенно захватывающие перспективы открываются на стыке сетевой медицины и искусственного интеллекта. Как показывают недавние исследования, применение продвинутых алгоритмов машинного обучения позволяет не только анализировать огромные массивы данных, но и выявлять скрытые паттерны в процессах старения, которые невозможно обнаружить традиционными методами [35]. Это создает основу для разработки «умных» систем поддержки принятия решений, способных предсказывать развитие возрастных заболеваний задолго до появления первых симптомов.
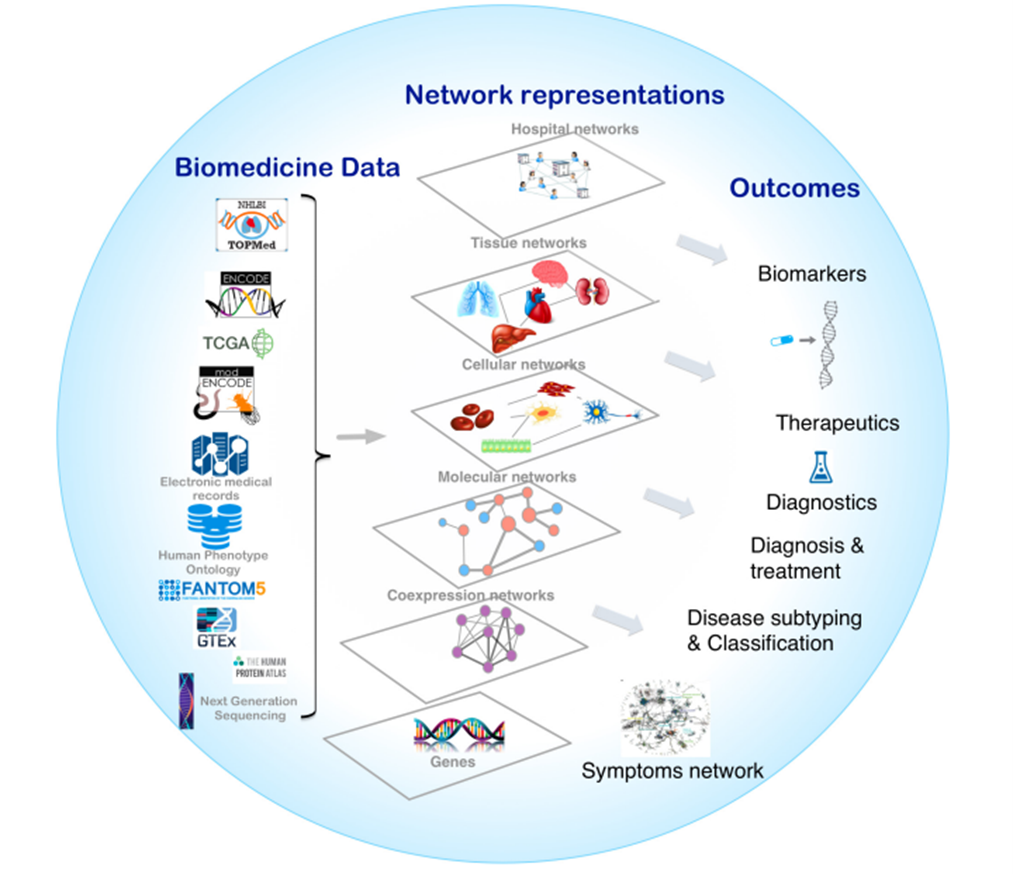
Рисунок 5. Многоуровневая архитектура сетевой медицины в исследовании старения. Современный подход объединяет разнообразные биомедицинские данные (от геномных исследований до электронных медицинских карт) с многослойным сетевым анализом — от генных взаимодействий до госпитальных сетей. Такая интеграция позволяет получать практически значимые результаты: выявлять новые биомаркеры старения, разрабатывать терапевтические стратегии и создавать более точные системы диагностики возраст-зависимых заболеваний.
адаптировано из [24]
Но технологический прогресс ставит перед нами и серьезные этические вопросы. Как обеспечить конфиденциальность столь детальной информации о здоровье человека? Как сделать передовые технологии доступными для всех, а не только для избранных? Эти вопросы требуют тщательного обсуждения всем обществом.
Будущее сетевой медицины неразрывно связано с междисциплинарным сотрудничеством. Подобно тому, как в оркестре каждый инструмент важен для создания гармоничного звучания, прогресс в этой области требует слаженной работы специалистов из разных областей — от биологов и врачей до математиков и специалистов по искусственному интеллекту.
Возможно, самое важное изменение, которое несет сетевая медицина — это переход от реактивного подхода к проактивному. Вместо того чтобы ждать развития болезней и бороться с их последствиями, мы получаем инструменты для активного управления здоровьем и замедления процессов старения. Это открывает путь к медицине будущего, где главной целью становится не лечение болезней, а поддержание оптимального функционирования организма на протяжении всей жизни.
Заключение: сетевая медицина как новая парадигма в исследовании старения
За последние десятилетия наше понимание старения прошло путь от изучения отдельных генов и белков до осознания сложнейшей сети взаимодействий, определяющих процессы старения организма. Сетевая медицина не просто предложила новый метод исследований — она изменила сам способ научного мышления о старении и возрастных заболеваниях.
Представьте себе медицину будущего: вместо того чтобы ждать появления симптомов болезни, врачи будут видеть первые признаки нарушений на уровне молекулярных сетей задолго до клинических проявлений. Как показывают исследования Барабаши и коллег, изменения в структуре молекулярных взаимодействий часто предшествуют развитию заболеваний на годы [3]. Это открывает беспрецедентные возможности для ранней профилактики и коррекции возрастных изменений.
Особенно захватывающие перспективы открываются для каждого из нас. Исследования показывают, что процесс старения глубоко индивидуален и определяется уникальным взаимодействием генетических и средовых факторов [34]. Благодаря сетевой медицине мы получаем возможность «увидеть» свой персональный путь старения — как путешественник, который впервые получил в руки подробную карту своего маршрута. Эта карта показывает не только текущее положение, но и возможные развилки пути, позволяя делать осознанный выбор более здоровой траектории.
Уже сегодня новые методы анализа сетевых взаимодействий позволяют точно оценивать биологический возраст различных систем организма и выявлять индивидуальные факторы риска [35]. В ближайшем будущем эти технологии станут доступны каждому, позволяя в режиме реального времени отслеживать эффективность различных вмешательств — от изменений в диете до новых методов лечения.
Но самое главное — сетевая медицина возвращает человеку роль активного участника в поддержании собственного здоровья. Вместо пассивного следования общим рекомендациям появляется возможность понимать, как именно различные факторы влияют на ваш организм, и выстраивать персонализированную стратегию активного долголетия. Это похоже на переход от путешествия с закрытыми глазами к осознанной навигации по карте здоровья, где каждый может выбирать оптимальный маршрут и корректировать его по мере необходимости.
В конечном счете, сетевая медицина не просто продлевает жизнь — она дает нам инструменты для сохранения активности, независимости и высокого качества жизни в пожилом возрасте. Она превращает старение из неизбежного угасания в управляемый процесс, где каждый из нас может стать режиссером собственного долголетия.
Заключительные мысли
Сетевая медицина в исследовании старения — это не просто новый научный метод, а фундаментальное изменение нашего подхода к пониманию и управлению процессами старения. Она объединяет передовые технологии, большие данные и системное мышление для решения одного из главных вызовов современности — проблемы старения населения.
Будущее, которое открывает перед нами сетевая медицина, — это не просто увеличение продолжительности жизни, а возможность сохранять здоровье, активность и высокое качество жизни на протяжении долгих лет. И хотя многие вызовы еще предстоит преодолеть, уже сегодня мы видим, как этот подход трансформирует наше понимание старения и открывает новые пути к здоровому долголетию.
Литература
- Sebastiano Filetti. (2019). Medicine in the era of network science. Endocrine. 66, 433-434;
- Jing-Dong Jackie Han. (2008). Understanding biological functions through molecular networks. Cell Res. 18, 224-237;
- Albert-László Barabási, Natali Gulbahce, Joseph Loscalzo. (2011). Network medicine: a network-based approach to human disease. Nat Rev Genet. 12, 56-68;
- Gábor I Simkó, Dávid Gyurkó, Dániel V Veres, Tibor Nánási, Peter Csermely. (2009). Network strategies to understand the aging process and help age-related drug design. Genome Med. 1, 90;
- Emilie Chautard, Nicolas Thierry-Mieg, Sylvie Ricard-Blum. (2010). Interaction networks as a tool to investigate the mechanisms of aging. Biogerontology. 11, 463-473;
- Как мультиомиксы раздвигают границы современной биологии;
- Как микробиота поможет в борьбе со старением?;
- Marina Wolfson, Arie Budovsky, Robi Tacutu, Vadim Fraifeld. (2009). The signaling hubs at the crossroad of longevity and age-related disease networks. The International Journal of Biochemistry & Cell Biology. 41, 516-520;
- Stephen Y. Chan, Joseph Loscalzo. (2012). The Emerging Paradigm of Network Medicine in the Study of Human Disease. Circulation Research. 111, 359-374;
- Huiling Xue, Bo Xian, Dong Dong, Kai Xia, Shanshan Zhu, et. al.. (2007). A modular network model of aging. Molecular Systems Biology. 3;
- 10.1016/jsb.2020.03.015;
- David Papadopoli, Karine Boulay, Lawrence Kazak, Michael Pollak, Frédérick Mallette, et. al.. (2019). mTOR as a central regulator of lifespan and aging. F1000Res. 8, 998;
- Valter D. Longo, Brian K. Kennedy. (2006). Sirtuins in Aging and Age-Related Disease. Cell. 126, 257-268;
- Antero Salminen, Kai Kaarniranta. (2012). AMP-activated protein kinase (AMPK) controls the aging process via an integrated signaling network. Ageing Research Reviews. 11, 230-241;
- Yumeng Li, Xutong Tian, Juyue Luo, Tongtong Bao, Shujin Wang, Xin Wu. (2024). Molecular mechanisms of aging and anti-aging strategies. Cell Commun Signal. 22;
- Roberto A. Avelar, Javier Gómez Ortega, Robi Tacutu, Eleanor J. Tyler, Dominic Bennett, et. al.. (2020). A multidimensional systems biology analysis of cellular senescence in aging and disease. Genome Biol. 21;
- Andres Kriete, Bahrad A. Sokhansanj, Donald L. Coppock, Geoffrey B. West. (2006). Systems approaches to the networks of aging. Ageing Research Reviews. 5, 434-448;
- Franck Peysselon, Sylvie Ricard-Blum. (2011). Understanding the biology of aging with interaction networks. Maturitas. 69, 126-130;
- Juulia Jylhävä, Nancy L. Pedersen, Sara Hägg. (2017). Biological Age Predictors. EBioMedicine. 21, 29-36;
- Steve Horvath. (2013). DNA methylation age of human tissues and cell types. Genome Biology. 14, R115;
- Nazish Sayed, Yingxiang Huang, Khiem Nguyen, Zuzana Krejciova-Rajaniemi, Anissa P. Grawe, et. al.. (2021). An inflammatory aging clock (iAge) based on deep learning tracks multimorbidity, immunosenescence, frailty and cardiovascular aging. Nat Aging. 1, 598-615;
- Как и почему искусственный интеллект биологический возраст определял;
- Uday S. Shanthamallu, Casey Kilpatrick, Alex Jones, Jonathan Rubin, Alif Saleh, et. al.. (2024). A Network-Based Framework to Discover Treatment-Response–Predicting Biomarkers for Complex Diseases. The Journal of Molecular Diagnostics. 26, 917-930;
- Abhijeet R. Sonawane, Scott T. Weiss, Kimberly Glass, Amitabh Sharma. (2019). Network Medicine in the Age of Biomedical Big Data. Front. Genet.. 10;
- Pankaj Kumar Chauhan, Ramanathan Sowdhamini. (2022). Integrative network analysis interweaves the missing links in cardiomyopathy diseasome. Sci Rep. 12;
- Marc Vidal, Michael E. Cusick, Albert-László Barabási. (2011). Interactome Networks and Human Disease. Cell. 144, 986-998;
- Christian R. Gomez. (2021). Role of heat shock proteins in aging and chronic inflammatory diseases. GeroScience. 43, 2515-2532;
- Silvia Ravera, Marina Podestà, Federica Sabatini, Monica Dagnino, Daniela Cilloni, et. al.. (2019). Discrete Changes in Glucose Metabolism Define Aging. Sci Rep. 9;
- Jose A. Santiago, Judith A. Potashkin. (2013). Shared dysregulated pathways lead to Parkinson's disease and diabetes. Trends in Molecular Medicine. 19, 176-186;
- Tiantian Wang. (2022). Searching for the link between inflammaging and sarcopenia. Ageing Research Reviews. 77, 101611;
- Ameya S. Kulkarni, Sriram Gubbi, Nir Barzilai. (2020). Benefits of Metformin in Attenuating the Hallmarks of Aging. Cell Metabolism. 32, 15-30;
- Die Hu, Fangfang Xie, Yongwei Xiao, Chen Lu, Jianing Zhong, et. al.. (2021). Metformin: A Potential Candidate for Targeting Aging Mechanisms. Aging and disease. 12, 480;
- Spencer G. Farrell, Arnold B. Mitnitski, Kenneth Rockwood, Andrew D. Rutenberg. (2016). Network model of human aging: Frailty limits and information measures. Phys. Rev. E. 94;
- Jiguang Wang, Shihua Zhang, Yong Wang, Luonan Chen, Xiang-Sun Zhang. (2009). Disease-Aging Network Reveals Significant Roles of Aging Genes in Connecting Genetic Diseases. PLoS Comput Biol. 5, e1000521;
- B Chen, A J Butte. (2013). Network Medicine in Disease Analysis and Therapeutics. Clin Pharmacol Ther. 94, 627-629.