
Как мультиомиксы раздвигают границы современной биологии
01 декабря 2023
Как мультиомиксы раздвигают границы современной биологии
- 858
- 0
- 7
Системная биология в изучении живых организмов подобна нескончаемому конвейеру. Чем больше мультиомиксных данных мы получим для каждого организма, тем быстрее поймем, как они работают, что у них общего и как протекала эволюция жизни на Земле. Но это не точно.
Рисунок в оригинальном разрешении.
иллюстрация Карины Илиопуло
-
Автор
-
Редакторы
-
Иллюстратор
Темы
В продолжении цикла по мультиомиксным технологиям мы выясним, есть ли в фундаменте наук о жизни место для еще нескольких кирпичиков, и как системной биологии, замешанной на мультиомиксных данных, удается разложить по полочкам сложные процессы, казавшиеся ученым неуловимыми. На одном краю временной шкалы такой подход позволяет проследить работу генов живого организма практически в реальном времени, а на другом — приподнимает завесу тайны над извилистыми тропами эволюции. Как развивается мозг рыбки данио от икринки до эмбриона? Зачем микробы меняют наш геном? Когда можно ждать лекарство от старости и как оценить свой биологический возраст? Постараемся ответить на эти вопросы!
Мультиомиксные технологии
На «Биомолекуле» уже разбирались методы и технологии молекулярной биологии, в том числе протеомные и геномные. В связи с технологическим прогрессом всё чаще применяют их комбинацию, причем к ним добавляются и другие «омики». В спецпроекте «Мультиомиксные технологии» мы расскажем не столько о самих методах, сколько об их применении в самых разных областях — фундаментальной науке, медицине, экологии, сельском хозяйстве. Мы рассмотрим, как калейдоскоп множества методов позволяет лучше увидеть общую картину, ответить на интересующие ученых вопросы и продвинуться в решении практических задач.
Партнер спецпроекта — аффилированные компании «Филип Моррис Интернэшнл» в России, ФМИ (PMI Affiliates in Russia).
В этой статье мы поговорим, как применение мультиомиксных (МО) технологий расширяет наши знания о фундаментальных законах жизни [1]. Может показаться, что основные открытия в биологии уже сделаны, однако это все еще самая свободная от ограничений и быстро развивающаяся наука. Согласно всеобщему тренду, объем информации в современной биологии стремительно растет, в связи с чем постановка правильных вопросов и интерпретация результатов исследований вышли на новый уровень сложности — сделав научный процесс еще более захватывающим.
Человечество научилось редактировать геном, использовать бактерий и другие организмы для экспрессии нужных нам генов. Спектр возможных экспериментов и получаемых из них данных крайне широк и зачастую ограничивается лишь воображением, главное — получить эти данные правильно, а затем сделать из них верные выводы.
Клетки многоклеточных организмов (включая человеческий) очень разнообразны, а помимо этого, они постоянно растут, дифференцируются и погибают, образуя сложные клеточные ансамбли и микроокружения; эта непрекращающаяся динамика делает их изучение еще более сложным. Детальное картирование этих процессов в пространстве и времени открывает целый пласт новых данных, настолько объемный, что разобраться в нем сразу просто нереально, но велики и ставки — потенциально он содержит ключевую информацию о том, как устроены живые организмы.
По своей сути, мультиомиксные технологии — это исследовательская стратегия объединения нескольких уровней молекулярных данных. Такой подход еще называют системной биологией, и многие считают ее единственным верным путем к открытию функций всех генов организма. МО-технологии вращаются вокруг разных звеньев центральной догмы молекулярной биологии: ДНК→РНК→белок. Single-cell методы позволяют давать количественную оценку геномной, экзомной и эпигеномной информации ДНК (метилирование ДНК, доступность хроматина и модификации гистонов). Затем можно охарактеризовать уже РНК — транскриптомно и эпитранскриптомно. Ну а приправить это все протеомными, фосфопротеомными и метаболомными данными для белков. Прибавьте к этому методы компьютерного анализа данных (Data science и нейросети) — и получите огромный арсенал для проведения фундаментальных и (до)клинических исследований, начиная от создания биохимических атласов клеток и тканей и заканчивая изучением молекулярной патологии пока неизлечимых заболеваний. Так, «Клеточный атлас человека», опираясь на single-cell анализ, подчеркнул непризнанную ранее учеными гетерогенность разных типов клеток и дал новые возможности найти их патологические состояния, от рака до болезни Альцгеймера.
Однако для изучения отдельных клеток необходимо разрушить ткань — что означает своими руками стереть пространственный контекст, в котором эти клетки существуют. Именно здесь на помощь приходит пространственная мультиомика — она позволяет профилировать клетки и ткани в их природном окружении, сохраняя и делая видимыми взаимодействия с соседними клетками и неклеточными структурами.
Помимо этого, мультиомиксные технологии помогают разгадать многие загадки эволюции — от биологии развития живых существ до палеогенетики. Современные исследования на мультиомиксной базе позволяют подступиться к таким сложным объектам, как нервная система — или проанализировать такие многофакторные процессы, как эмбриогенез или старение. Как ученые отслеживают зависимость от генотипа к фенотипу, как погружаются в тайны работы нервной системы и каким целям служит пространственная мультиомика? В этой статье мы постараемся ответить на эти вопросы, приводя примеры исследований из различных областей современной биологии.
Тернистые пути эволюции
Зачем создавать мультиомиксные базы данных всего живого?
Эволюционная биология развития (иногда ее называют также evo-devo) — быстро развивающаяся дисциплина, сопоставляющая развитие разных организмов с целью найти общие мотивы — такие, которые не удается подметить ни с помощью традиционной эволюционной биологии, ни с помощью одной только биологии развития. Замечательный пример этой науки ищите здесь: «Жизнь и путешествия замечательных клеток нервного гребня» [2].
Биологическая эволюция определяется учеными как пространственно-временное изменение частоты аллелей с упором на изучение механизмов изменчивости или поддержания частот аллелей на уровне популяции. Сюда входят мутации, естественный отбор, генетический дрейф и рекомбинация генов. Революция в геномике привела к тому, что в наши дни публикуется все больше и больше высококачественных эталонных геномов различных модельных и немодельных организмов, показывая невероятное их разнообразие — например, NCBI каталогизировал более 78 000 аннотированных геномов, и это число продолжает быстро расти; а проект Earth BioGenome в будущем предполагает секвенирование геномов всех известных эукариотических организмов (около 1,8 млн видов). Наступление «постгеномной эры» [3] уже поспособствовало нашему пониманию горизонтального переноса генов, генетического смешения, перестройки генома, а также возникновения мутаций и адаптации к изменениям окружающей среды — хотя очень многого мы не знаем и сегодня.
За последние десятилетия мы получили более глубокое понимание процессов развития с помощью модельных систем организма, особенно молекулярных и клеточных механизмов органогенеза, морфогенеза и метаболического гомеостаза. Однако многие вопросы еще очень далеки от окончательного решения — например, врожденные дефекты организма, старение, а также естественная или вызванная болезнями смерть, — так же, как и мы далеки от полного понимания сложности и динамики жизни. Возможно, сегодняшний исследовательский кругозор сильно ограничивает работа на нескольких модельных организмах — в то время как прорывы могут ждать где-то в области «немодельных».
И все же несмотря на то, что работа на модельных организмах чем-то напоминает поиск под фонарем, мы многим им обязаны. Дань признательности отдает наш спецпроект «Модельные организмы», почитайте хотя бы статьи, посвященные Дрозофиле [4] или Грызунам [5]!
Часто в мультиомиксных исследованиях рассматриваются только удобные и хорошо зарекомендовавшие себя модели (например, плодовая мушка Drosophila melanogaster, нематода Caenorhabditis elegans, аквариумная рыбка Danio rerio и домовая мышь Mus musculus). Из-за этого наш взгляд на эволюцию развития немного предвзят, и многие нюансы эволюции других видов могут быть упущены. Применение мультиомиксных технологий к описанию новых видов позволяет заполнять пробелы в знаниях на ключевых филогенетических позициях. Это имеет не только фундаментальный, но и прикладной характер — ученые смогут получить новые варианты модельных организмов, чтобы подтвердить или опровергнуть на них те или иные биологические теории.
Растущее масштабное геномное секвенирование различных видов и применение инструментов редактирования генов на основе CRISPR/Cas9 позволили распространить текущие исследования evo-devo на немодельные организмы. Прочтение геномов, транскриптомов и протеомов разных видов живых существ позволило ученым создать огромное эволюционное древо жизни (рис. 1), а затем изучить, на каких этапах разошлись в своем развитии различные клады и виды.
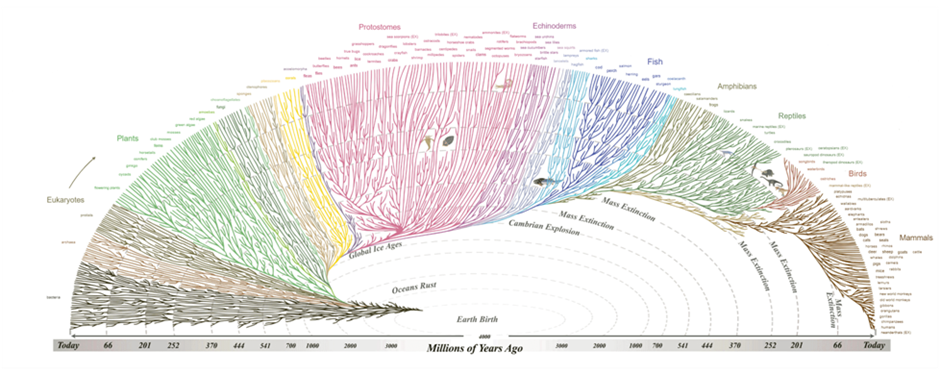
Рисунок 1. Древо жизни иллюстрирует усложнение и растущее разнообразие видов живых существ, начиная с самого зарождения нашей планеты. Не Иггдрасиль, конечно, но гораздо интереснее.
На сегодняшний день геномные базы данных созданы только для конкретных групп животных (например, ANISEED для оболочников, Echinobase для иглокожих и MolluscDB для моллюсков) при огромной нехватке информации о многих других. Более того, существующие базы данных не могут дать нам сравнительную информацию по имеющимся в них организмам. Поэтому ученым было необходимо создание мультиомной платформы или базы данных животных evo-devo путем интеграции обширных геномных и транскриптомных ресурсов из различных репрезентативных групп животных. Также требуется разработать удобные инструменты для всестороннего анализа этих данных. Однако такая база или платформа долгое время отсутствовала.
Наконец, в 2022 году учеными из Китайского Океанологического Университета был создан один из первых прототипов такой платформы — EDomics [6]. База создавалась путем интеграции нескольких текущих геномных баз данных уже традиционных и нескольких новых модельных организмов (рис. 2). Помимо вышеперечисленных, в базу были включены данные и о новых «нестандартных» организмах, таких как аксолотль, двоякодышащие рыбы, минога, ланцетники, асцидия, морской гребешок, кораллы и губки.
Всего на данный момент отобрано 40 видов живых существ — по отнюдь не случайному принципу. Кажется, что мультиомы всего из 40 видов — это очень мало, особенно на фоне всеобщего биологического разнообразия. Однако информация о каждом из видов была необходима, чтобы заполнить пробелы об основных эволюционных событиях: формировании зародышевых листков, возникновении радиальной и двусторонней симметрии, а также об эволюционных переходах от первичноротых ко вторичноротым и от беспозвоночных к позвоночным формам, плюс выход из воды на сушу.
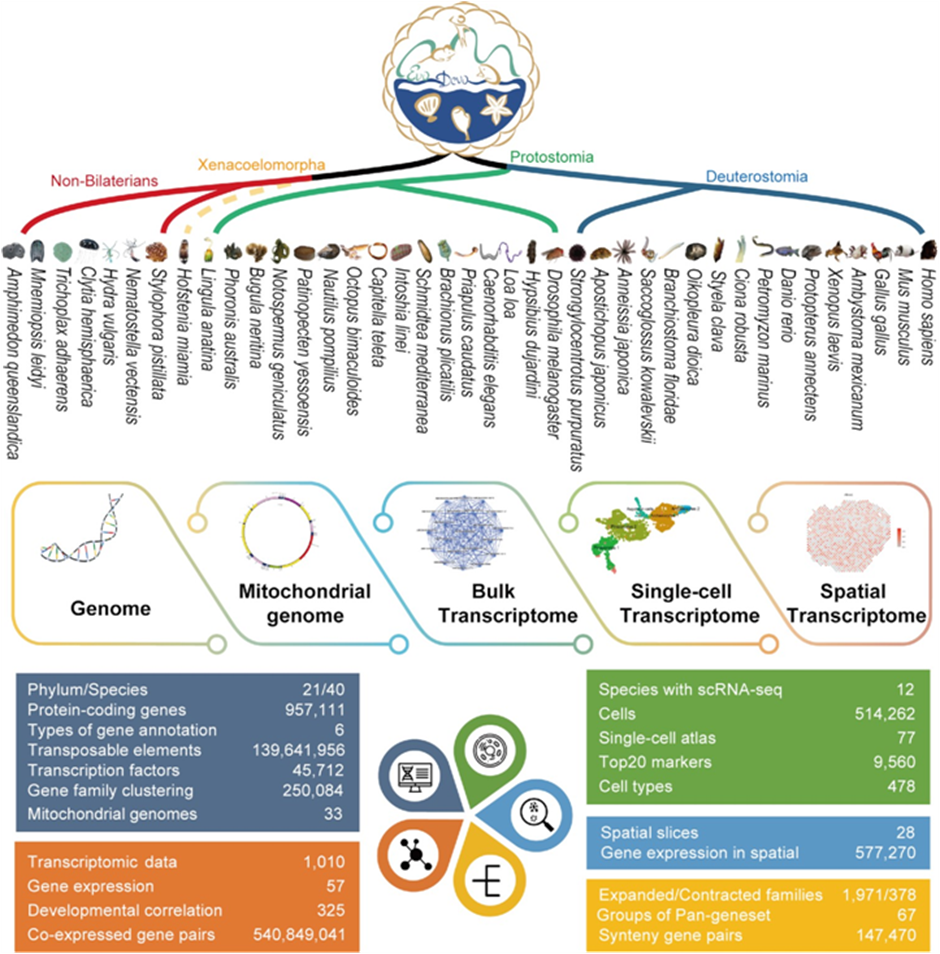
Рисунок 2. Текущий состав мультиомной базы данных EDomics. 40 видов животных, представленных на данный момент в EDomics, разделены на филумы: небилатерии, Xenacoelomorpha (билатерии) (виды представлены пунктирной линией из-за спорного филогенетического сходства), Protostomia и Deuterostomia. База содержит геном, митохондриальный геном, объемный транскриптом и single-сell транскриптом для каждого вида. Также на рисунке можно увидеть статистические данные о текущем содержимом базы данных.
В настоящее время база EDomics фокусируется на репрезентативных видах многоклеточных животных. Охват видов будет увеличиваться по мере реализации геномных проектов (например, Earth Biogenome Project и Vertebrate Genomes Project). На сегодняшний день EDomics — наиболее полный интегрированный ресурс мультиомиксных данных для репрезентативных видов различных групп животного царства. Он содержит 40 высококачественных геномов и 1010 объемных транскриптомов, полученных от всех основных типов животных. Это также позволяет систематически просматривать данные single-cell секвенирования РНК с различных аспектов (кластеры клеток, клеточные маркеры, экспрессия генов и информация об их пространственном расположении). Более того, ключевые транскрипционные факторы и отслеживание геномов клеточных линий можно удобно анализировать и сравнивать между видами, используя интерактивные биоинформатические инструменты, уже представленные в базе данных. Можно с уверенностью сказать, что в будущем таких баз данных с перекрестным инструментарием станет еще больше. Возможно, со временем они все сольются в сингулярности в единую базу данных для всех видов на планете.
Эволюционные истоки биоминерализации яиц
Как нам известно, в ходе эволюции размножение вне водной среды стало возможным благодаря появлению двух репродуктивных стратегий: откладке яиц и плацентарному развитию. У зауропсидов и некоторых млекопитающих (Monotremata) стратегия откладки яиц основывалась на использовании яйца с мягкой или твердой скорлупой для защиты эмбриона. Эта адаптация достигла своего пика у птиц, появившихся примерно 102 млн лет назад.
Одно из замечательных недавних применений мультиомиксного подхода — изучение эволюции биоминерализации яиц у яйцекладущих животных. Яичная скорлупа — это уникальная биокерамика на основе карбоната кальция (CaCO3), которая необходима для размножения птиц. В ее состав входит 95% кальцита и 3,5% органической матрицы; скорлупа защищает содержимое яйца от проникновения микробов и механических повреждений, обеспечивает газообмен и снабжает эмбрион кальцием для развития скелета. У позвоночных яичная скорлупа встречается у таксонов Sauropsida (птицы и пресмыкающиеся) и в меньшей степени у Mammalia (яйцекладущие утконосы).
Кальцификация яичной скорлупы птиц является одним из самых быстрых известных процессов биоминерализации CaCO3 и в итоге приводит к получению материала с превосходными механическими свойствами. Неудивительно, что этот процесс так заинтересовал ученых. Исследования биоминерализации яичной скорлупы птиц за последние десятилетия привели к детальной характеристике ее белковых и минеральных компонентов. Недавно наше понимание этого процесса значительно улучшилось благодаря высокопроизводительным технологиям (то есть протеомике, транскриптомике, геномике и биоинформатике) [7]. В настоящее время доступны более или менее полные протеомы яичной скорлупы для девяти видов птиц. Это позволило исследователям идентифицировать ключевые белки, составляющие набор инструментов для биоминерализации яичной скорлупы.
Протеом яичной скорлупы птиц содержит как кооптированные белки (то есть произошедшие от генов уже существующих, но с другими функциями), так и белки, узко специфичные именно для яичной скорлупы. Среди белков, связанных с яичной скорлупой (см. врезку), присутствуют ключевые функциональные домены, предназначенные для связывания кальция, везикул и белков. Современные технические достижения в сочетании с прогрессом в анализе ультраструктуры минералов открыли путь для новых гипотез минерального зарождения и роста кристаллов при формировании яичной скорлупы птиц, включая перенос аморфного CaCO3 в везикулах из клеток матки в место минерализации яичной скорлупы.
За последние десятилетия развитие мощности мультиомиксных технологий помогло оценить сложность органических матриц многих видов птиц. Выяснилось, что эволюция яичной скорлупы у зауропсидов сопровождалась как рекрутированием существующих генов биоминерализации (OCX-32, EDIL3, OC-116/MEPE и OPN), так и рождением новых генов благодаря дупликации, которые затем получили узкую специализацию для этого процесса (XCA-1 и OCX-36) (см. рис. 3, а также врезку выше).
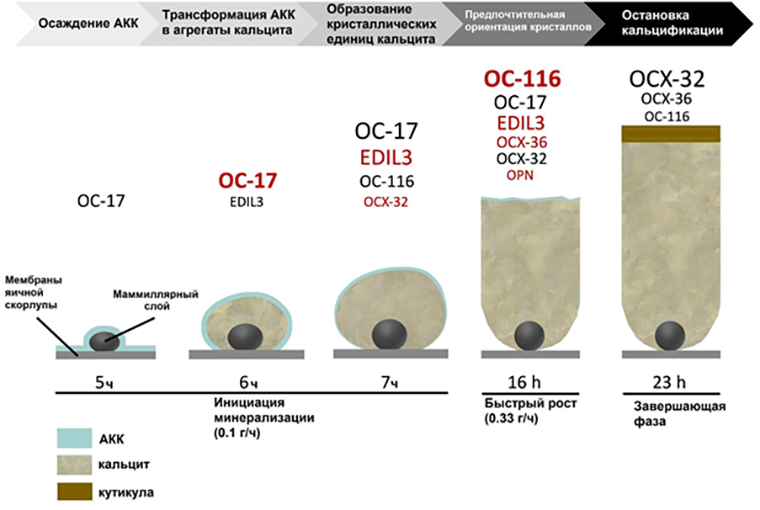
Рисунок 3. Шесть основных белков минерализации скорлупы куриных яиц. Изображение подготовлено по данным протеомного анализа на каждой стадии; размер шрифта пропорционален количеству белка (красным помечены белки, экспрессирующиеся в избытке).
АКК — аморфный карбонат кальция.
на основе [7]
Анализ экспрессируемых белков методами масс-спектрометрии в конкретных тканях должен опираться на тканеспецифичные геномные последовательности, которые их кодируют. В этих исследованиях протеомика и транскриптомика должны идти рука об руку с геномикой, что рождает пресловутую мультиомиксность. Такой подход называют протеогеномикой. Подробнее об этом подходе и его применении к изучению опухолей можно почитать в интересной статье специалиста в данной области, Сергея Мошковского — «Правдивая история о протеогеномике» [20].
Как следствие, огромный поток геномных данных разных видов птиц в рамках проекта «10 000 геномов птиц» (2015–2020 гг.) расширил наше понимание эволюции генов белков яичной скорлупы, однако предстоит еще немало работы. Например, МО-данные по рептилиям и утконосу еще крайне скудные. Для крокодилов получен протеом лишь одного вида, и в нем пока идентифицировано очень мало белков (58 против 904 из протеома скорлупы куриного яйца); при этом многие стандартные для птичьих яиц белки в нем отсутствуют. Крокодилы — это очень древние ящеры, которые пережили динозавров, а их ближайшие родственники из ныне живущих существ — птицы. Их изучение прольет свет на эволюцию процесса. В настоящее время лучше всего изучен, конечно же, процесс биоминерализации куриных яиц. Чем больше мультиомиксных данных мы получим, тем понятней станет, как разные животные (от динозавров до птиц и утконосов) эволюционно развились до биоминерализации прочной и функциональной скорлупы.
Плюрипотентные клетки и происхождение многоклеточности
Широко распространенная, не то чтобы надежно проверенная гипотеза происхождения многоклеточных животных, состоит в том, что они произошли от одноклеточного предка с апикальной ресничкой, окруженной микровиллярным воротником [21]. Этот предок, по мнению ученых, напоминает как современные клетки-хоаноциты губок, так и одноклеточные хоанофлагелляты, которые также снабжены жгутиками и воротником из микроворсинок.
Исследователи решили проверить эту теорию транскриптомным анализом, сравнивая транскриптомы, стадии развития и биохимию трех основных типов клеток губок — хоаноцитов, плюрипотентных мезенхимальных археоцитов и эпителиальных пинакоцитов — с хоанофлагеллятами и другими одноклеточными голозойными [21]. Неожиданно для себя они обнаружили, что транскриптом хоаноцитов губок наименее похож на транскриптомы хоанофлагеллят и содержит множество генов, уникальных либо для животных, либо только для губок. Плюрипотентные археоциты, напротив, активируют гены, которые контролируют пролиферацию клеток и экспрессию генов как в других стволовых клетках многоклеточных животных, так и на стадиях пролиферации двух одноклеточных голозойных животных, включая вышеупомянутых колониальных хоанофлагеллят.
Хоаноциты губки Amphimedon Queenslandica неустойчивы и легко превращаются в археоциты, которые, в свою очередь, могут дифференцироваться в другие клетки. Эти преобразования клеток губок подобны трансформациям одноклеточных голозойных. В совокупности это отвергает гомологию хоаноцитов губок и хоанофлагеллят, а также общепринятую теорию, согласно которой первые многоклеточные животные представляли собой простые клубки клеток с ограниченной способностью к дифференцировке. Вместо этого результаты намекают, что первая животная клетка была способна переходить между несколькими состояниями — аналогично современным трансдифференцирующимся и стволовым клеткам. Это открывает нам новое понимание того, как животные дошли до многоклеточности и научились дифференцировать свои клетки в разные ткани единого организма.
Почему же нам так важно изучать механизмы плюрипотентности и дифференцировки клеток? Дело в том, что плюрипотентные клетки могут дифференцироваться во все типы клеток, кроме клеток внезародышевых органов (плаценты и желточного мешка) [22]. При этом нехватка человеческих органов для трансплантации представляет собой одну из крупнейших неудовлетворенных медицинских потребностей во всем мире и непрерывно растет параллельно росту населения. Плюрипотентные стволовые клетки человека (ПСК), полученные из бластоцист или «перепрограммированные» из соматических, — потенциально неограниченный источник донорских органов. Однако, несмотря на годы попыток и исследований, создание полностью функциональных органов in vitro пока где-то за горизонтом.
Чтобы добежать до горизонта, ученые разработали подход in vivo, известный как межвидовая комплементация бластоцисты, который включает инъекцию ПСК одного вида в бластоцисты другого вида с отключенным органогенезом. Во время эмбриогенеза мутантный эмбрион реципиента заполняет пустую нишу отсутствующего органа донорскими ПСК и, таким образом, генерирует химерный орган, обогащенный клетками донорского вида. Одним из наилучших животных-хозяев такого метода являются свиньи — из-за сходства с людьми по анатомии, физиологии, размеру органов и характеристикам клеточного цикла. Эксперименты по межвидовому выращиванию органов хорошо показали себя на примере мышей и крыс. Однако, когда дело касается комплементации бластоцист человека и свиньи, оказывается, что человеческие ПСК неэффективно способствуют образованию химерных органов у ранних эмбрионов свиней. При этом уровень химеризма намного ниже, чем у химер крысы и мыши, независимо от состояния плюрипотентности, времени инъекции и количества инъецированных клеток. Это говорит о наличии серьезного ксеногенного барьера между человеком и свиньей на раннем этапе эмбриогенеза.
Для понимания межвидовых различий развития животных была использована технология single-cell РНК секвенирования (scRNA-seq). Ее применили для картирования ландшафтов транскриптома и понимания молекулярной регуляции раннего развития млекопитающих [23–27]. Межвидовое сравнение транскриптомов ранних эмбриональных тканей на одноклеточном уровне также помогло раскрыть молекулярную основу многих консервативных и дивергентных процессов развития среди нескольких видов млекопитающих [26]. Таким образом ученые провели межвидовое сравнение транскриптомов свиней, людей и яванских макак и выявили ряд видоспецифичных особенностей во время раннего эмбриогенеза. Было показано, что лиганд-рецепторная несовместимость и дифференциальное сродство в молекулах клеточной адгезии является частью ксеногенного барьера, равно как и несовпадение сроков развития между донорскими ПСК и клетками животного-хозяина. Проведенное single-cell исследование дало ученым важный ресурс для разработки эффективных стратегий по усилению химерного вклада человеческих ПСК в эмбрионах свиней.
Что было первым — взрослая особь или личиночная форма?
Появление в океане многоклеточных животных, или Metazoa, около 600 миллионов лет назад стало революцией жизни на Земле. Результатом многоклеточности стало невероятно разнообразное и процветающее животное царство в наши дни. Двухфазный жизненный цикл, состоящий из личиночной и взрослой формы, стал отличительной чертой многих типов многоклеточных животных. Такая смена жизненных форм занимает центральное место в эволюции многоклеточных животных и обеспечивает пластичность развития и морфологии для экологических адаптаций.
Однако то, как возникли личинки многоклеточных животных, остается одной из главных загадок эволюции, и тут есть две гипотезы:
- Гипотеза «сначала личинки» предполагает, что первые многоклеточные животные были похожи на ныне живущих личинок, с более поздней эволюцией двухфазного жизненного цикла и появлением взрослой особи. Эта гипотеза до определенного момента считалась общепринятой, поскольку согласуется с эволюционным путем развития от простых форм к сложным.
- Гипотеза «сначала взрослые» говорит, что первые многоклеточные животные были взрослыми формами, а двухфазный жизненный цикл возник гораздо позже через личиночную интеркаляцию.
МО-исследования позволяют нарисовать молекулярный портрет личиночных и взрослых стадий, а также дать понимание эволюции двухфазной модели многоклеточных животных. Неплохой объект для исследования судьбы личиночных форм — моллюски. Они имеют древнее докембрийское происхождение и рано приобрели радиальную симметрию. Этот крупнейший тип морских существ с 100 000+ существующих видов обладает поразительным морфологическим разнообразием, а развиваются они не напрямую, а через уникальную стадию свободно плавающей личинки-трохофоры. Эти личинки присутствуют по крайней мере у трети всех видов морских животных (то есть у трохозойных животных, включая моллюсков и кольчатых червей) и могут дать ключ к вопросу происхождения морских личинок в целом.
Недавнее завершение нескольких геномных проектов по моллюскам значительно расширило наше понимание архитектуры их геномов, однако эти исследования не дают картины пространственно-временной транскрипции генов в течение онтогенеза, которая имеет решающее значение. Чтобы добавить красок картине, в новом исследовании ученые провели комплексное профилирование онтогенетических транскриптомов моллюсков, уделив особое внимание морскому гребешку Patinopecten yessoensis (рис. 4) [28], [29].
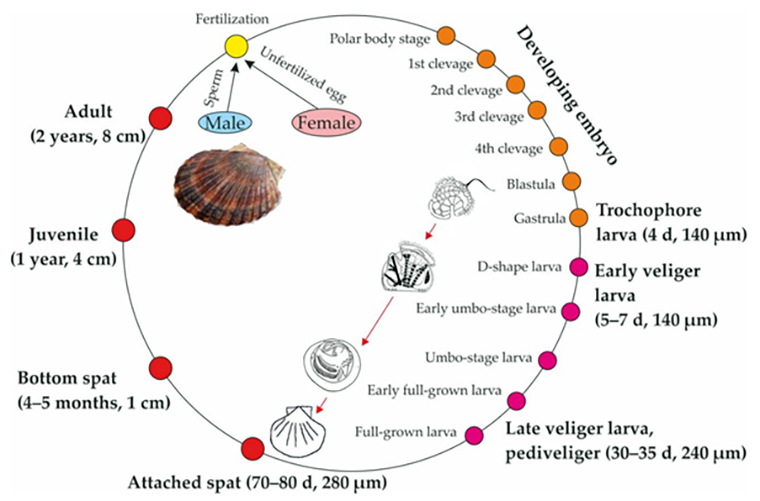
Рисунок 4. Жизненный цикл развития морского гребешка от оплодотворенной яйцеклетки до взрослой особи. После оплодотворения яйцеклетка проходит несколько стадий дробления, превращаясь сначала в бластулу (зародыш, состоящий из одного слоя клеток), а затем в гаструлу (зародыш с многослойными зародышевыми листками). Постепенно появляется трохофора — свободно плавающая планктонная морская личинка с несколькими рядами ресничек. Потом личинка вырастает до парусника-велигера, а там уже рукой подать до окончательной метаморфозы в полноценную особь гребешка, который биоминерализует свою раковину и закрепляется на дне морском.
Удивительно, но представшая транскриптомная картина эволюции развития трохофор и других типов морских личинок не подтверждают преобладающую гипотезу «сначала личинки». Вместо этого она рисует сцену «сначала взрослые особи», не только подтверждая прежние данные древнего и общего происхождения многоклеточных/двусторонних реснитчатых личинок (например, консервативная экспрессия генов в апикальном органе личинки и передней кишке, а также наличие древнего личиночного компонента микроРНК60), но и предполагает, что этот тип протоличинок вторично произошел от предка многоклеточных животных.
Биохимия растений
Яркий пример мультиомиксного подхода для глобального анализа сложной биохимии опубликовали в журнале Frontiers in Plant Science ученые из США [30]. В своей работе они комплексно изучили процесс аутофагии [31], [32] на примере модельного травянистого растения резуховидка Таля — оно же арабидопсис (Arabidopsis thaliana) (рис. 5). Аутофагия — это управляемое «самопереваривание» клетки, при котором органеллы и макромолекулы поглощаются особыми везикулами (аутофагосомами) и переносятся в вакуоль, где разлагаются с последующей утилизацией продуктов распада. Исследователи пробовали определить функцию гена без априорных знаний о нем на основе мультиомиксных данных — в работе определяли транскриптом и липидом.
Генетическое исследование аутофагии выявило влияющие на нее гены (их пометили шифром ATG — от AuTophaGy). Первоначально их нашли в дрожжах Saccharomyces cerevisiae, а затем — и в других организмах, включая растения. Для сравнения исследователи выбрали два мутантных аллеля: ATG9 (AT2G31260) и ATG7 (AT5G45900), а также растения без мутаций. Ортологи этих консервативных генов найдены даже у человека, что говорит о становлении аутофагии еще на заре эволюции. В ходе исследования выяснилось, что работа этих генов и запуск аутофагии напрямую зависит от наличия азота в почве. Отсутствие азота запускало аутофагию у «генетически здорового» растения, а вот у мутантов она не начиналась.
Чтобы понять связь фактора внешней среды с работой генов, ученые отсняли липидомный профиль листьев и корней: количественно оценили содержание около 100 липидов и визуализировали клеточное распределение 15 липидных молекул, используя single-cell технологии. Затем было оценено относительное содержание примерно 26 000 (!) транскриптов из тканей листьев и корней растений «дикого типа», а также мутантных atg7 и atg9, выращенных либо в нормальных условиях (богатых азотом) и либо при азотном голодании (когда должна бы начаться аутофагия). Мультиомика довершила сделанное, подсветив молекулярный эффект каждой мутации.
Оказалось, что у мутантов atg7 аутофагия была полностью заблокирована, а сами растения стали крайне чувствительны к нехватке питательных веществ к почве, а также к дефициту углерода и азота. Ну а ген atg9 кодирует единственный интегральный мембранный белок основного механизма аутофагии и участвует в развитии и расширении аутофагосомы. Поэтому мутации в гене atg9 привели к неспособности высвободить аутофагосомы из эндоплазматического ретикулума. Вероятно, это также связано с неспособностью клеток включать мембранные липиды в развивающуюся органеллу.
В целом стало понятно, что мутация atg7 оказывает большее влияние на оцениваемый учеными транскриптом и липидом, чем мутация atg9. Эта разница в величине молекулярного ответа на каждую из мутаций отражалась и на листьях, и на корнях. При этом листья показали более сильный молекулярный ответ на мутации, чем корни. Наблюдения показали, что в результате мутаций и изменений в окружающей среде аутофагия сработала в разных органах по-разному — это дает понимание функциональной роли генов и окружающей среды в аутофагии у растений.
Микробиология
Помимо клеток нашего организма, не стоит забывать и об их соседях — микробиоте кишечника, наших симбионтах [36]. Известно, что микробы помогают нам добывать питательные вещества из пищи [37], отвечают за иммунитет [38], влияют на эволюцию вида [39] и могут даже изменить наше поведение [40]. Фенотипы сложных организмов формируются под влиянием как самого организма-хозяина, так и его микробиоты — ученые даже ввели специальный термин голобионт, чтобы описать дискретную экологическую единицу, состоящую из хозяина и проживающих с ним совместно видов. Соответственно, голоомиксный подход будет интегрировать молекулярную информацию от всех сожителей в составе такого голобионта (рис. 7) [41].
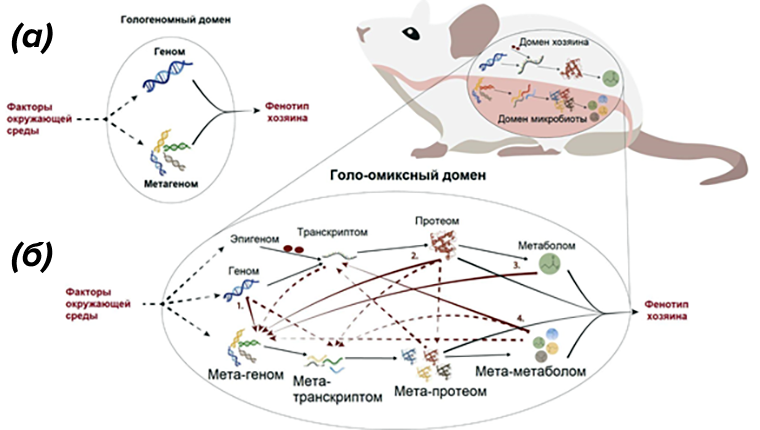
Рисунок 7. От гологеномики к голоомиксам.
(а) — гологеномный домен;
(б) — взаимодействие хозяина и микробиоты внутри голоомиксного домена проиллюстрировано здесь на примере увеличения просветной поверхности кишечника хозяина. Красные стрелки указывают голо-омиксные взаимодействия между организмом хозяина и микробиотой. Сплошные красные стрелки указывают на взаимодействия, уже описанные в научной литературе, тогда как пунктирные — на пока только потенциальные голоомиксные взаимодействия. Сплошные черные стрелки указывают уровни «омиксов», влияющих на фенотип хозяина, а пунктирные — уровни, которые подвержены влиянию факторов окружающей среды.
Голоомиксный инструментарий требует как сложных методологических, так и аналитических инструментов. И если все методики более-менее известны (это секвенирование нуклеиновых кислот и масс-спектрометрия), то сегодняшняя аналитика пока совсем в зачатке. Как следствие, лишь немногие исследовательские группы в мире могут эффективно реализовать у себя в лабораториях голоомиксный подход. Генетические особенности хозяина часто определяют состав микробиоты. Например, у разных особей может отличаться биосинтез антибактериальных пептидов [42], состав слизистой оболочки кишечника [43] или процессы ферментативного расщепления питательных веществ [44]. Взаимозависимость между экспрессией генов хозяина и микроорганизмов тоже встречается довольно часто. Например, введение в кишечник рыбок данио бактерий Lactobacillus rhamnosus подавляет у рыб транскрипцию генов метаболизма холестерина и триглицеридов, что снижает долю этих веществ в организме, но зато повышает содержание жирных кислот [37].
В другом исследовании на мышах было показано, что метаболизм бутирата, добываемого микробиотой кишечника из жирных кислот, влияет на потребление кислорода эпителием и приводит к стабилизации транскрипционного фактора, индуцируемого гипоксией (HIF). Этот фактор напрямую регулирует иммунитет хозяина и его барьерную функцию [45]. Соответственно, употребление антибиотиков приводило к гибели микрофлоры и значительному снижению иммунитета по описанному выше сценарию. И это далеко не единственные примеры, обнаружение которых стало возможным благодаря технологиям мультиомики и голоомиксного подхода. В таблице 1 собрано несколько примеров такого взаимного влияния микробиоты на организм хозяина в разных модельных организмах.
| Уровень изучаемого омикса | Организм | Главные выводы | Номер стрелки на рисунке 7 |
|---|---|---|---|
| Геном микробной 16S РНК [46] | Мышь | Экспрессия 20 генов организма хозяина связана с составом микробиоты | 1 |
| Геном микробной 16S РНК [47] | Человек | Генетическая предрасположенность к воспалительным заболеваниям кишечника связана со снижением численности бактерий рода Roseburia в микробиоме кишечника | 1 |
| Транскриптом, метагеном [48] | Мокрица-броненосец обыкновенная | Симбиоз мокриц-броненосцев с микробиотой необходим для расщепления лигноцеллюлозы | — |
| Протеом, микробный транскриптом 16S РНК [42] | Мышь | Отсутствие в организме белка TLR5 увеличивает количество протеобактерий, уменьшает количество грамотрицательных бактерий Bacteroidetes в микробиоме и способствует воспалению кишечника | 2 |
| Метаболом, метагеном [49] | Арабидопсис | Полезные ризобактерии вызывают у растения выделение метаболита скополетина, который стимулирует поглощение железа и подавляет почвенные патогены | 3 |
| Мета-метаболом, транскриптом [45] | Эпителиальные клетки человека | Метаболизм бутирата, выделяемого микробиотой, стабилизирует транскрипционный фактор, индуцируемый гипоксией (HIF) в эпителиальных клетках человека | 4 |
| Мета-метаболом, транскриптом [50] | Эпителиальные клетки человека | Присутствие индола, выделяемого микробиотой, стимулирует экспрессию защитных генов хозяина, что приводит к более высокой устойчивости организма к внешним патогенам | 4 |
| Мета-метаболом, транскриптом [51] | Мышь | Индол, выделяемый микробиотой, контролирует экспрессию гена miR-181 хозяина, который влияет на чувствительность к инсулину и развитие ожирения | 4 |
Большинство исследований, связывающих на молекулярном уровне хозяина и микробиоту, опирались на различные таргетные подходы характеристики микробного домена (секвенирование ампликонов, целевое секвенирование РНК и вестерн-блоттинг). Однако нецелевые методы анализа (например, дробное секвенирование ДНК и дробная протеомика), которые предоставляют информацию обо всех нуклеотидах, белках и метаболитах, присутствующих в образце, постепенно дополняют или заменяют таргетные. Дробные (shotgun) методы секвенирования предполагают разбиение последовательностей на маленькие кусочки с их последующей идентификацией путем перекрестного наложения. Так уж сложилось, что метагеномные данные, необходимые для реализации гологеномного подхода к изучению молекулярных взаимодействий хозяина и микроба, часто получают из образцов, содержащих ДНК обоих доменов [52]. Прибавьте к этому постоянно снижающиеся затраты на секвенирование в сочетании с повышением вычислительной мощности в биоинформатике — все ведет к тому, что shotgun-методики будут и дальше вытеснять таргетные, а наука будет иметь дело только с большими массивами мультиомиксных данных [53].
В последние годы single-cell секвенирование [54] расширило наши возможности находить взаимосвязь между определенными генетическими свойствами и отдельными клетками, а значит, мы можем использовать их для детального изучения взаимодействий между культурами эукариотических и прокариотических клеток in vitro. Дополнительное использование пространственной метагеномики сможет показать нам распределение отдельных микробов внутри сообщества и их пространственную ориентацию относительно клеток хозяев.
Какое же прикладное и фундаментальное применение может найти подход голоомики в современных биологических науках (рис. 8)?
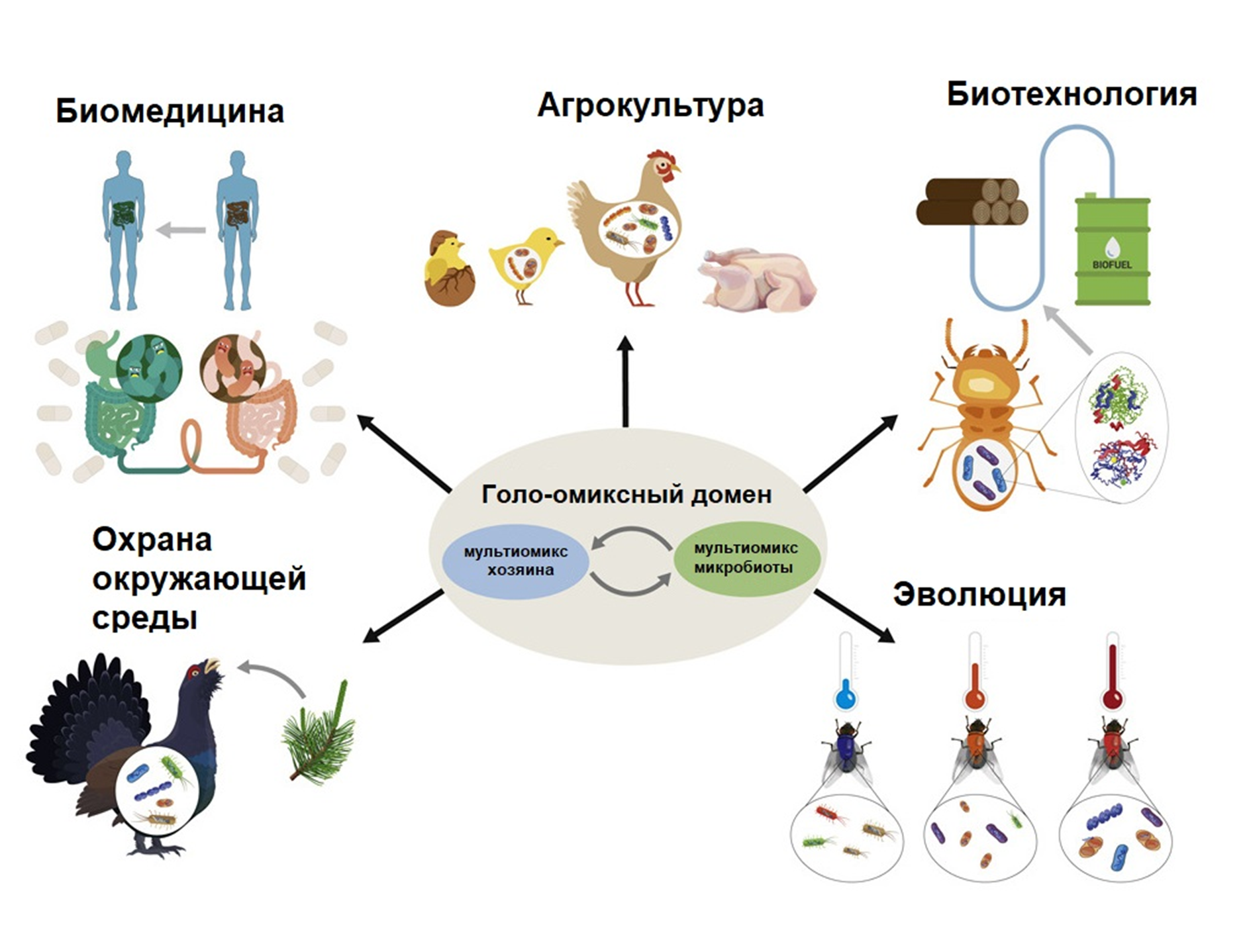
Рисунок 8. Основные применения голоомиксного подхода.
Сохранение окружающей среды путем изучения микробиоты, жизненно необходимой для выживания животного-хозяина (например, глухаря, который несколько месяцев может питаться одной только хвоей благодаря своей уникальной микробиоте).
Персонализированная биомедицина, подбирающая лечение в зависимости от индивидуальной микрофлоры человека.
Улучшение качества животноводства путем введения в корм животных новых пробиотиков. Создание усовершенствованных биореакторов для производства биотоплива.
Изучение влияния микробов-симбионтов на эволюцию многоклеточных животных и разнообразие жизни на Земле.
В первую очередь исследования взаимодействия микробиоты и хозяев повлияют на пищевую и животноводческую промышленность. Например, станет возможна разработка более экологичных кормов с пробиотиками, призванных сократить метановые выбросы в результате жизнедеятельности крупного рогатого скота. Введение необходимых добавок в пищу улучшит ветеринарный контроль и снизит смертность сложно культивируемых животных, таких как радужная форель. Исследование микробиома растений может привести к усилению их адаптации и улучшить реагирование аграрных культур на быстрое изменение климата.
Голоомиксный подход также может способствовать разработке и оптимизации новых биотехнологических решений. Например, его можно использовать для лучшего понимания систем хозяин—микробиота, которые способны ферментативно разлагать сложные полисахариды. Это поможет разработать новые стабильные способы преобразования органических отходов в промышленно важные биомолекулы и биотопливо. Многие организмы, питающиеся древесиной, способны частично переваривать лигноцеллюлозу в глюкозу, но для завершения процесса разложения им необходимы дополнительные ферменты, вырабатываемые их резидентными микробами [55]. Несколько исследований, основанных на метагеномике и метапротеомике термитов, показали, что их микробиота отвечает за выработку некоторых наиболее сложных ферментов, необходимых для разложения лигноцеллюлозы [55]. Большинство таких сложных биохимических реакций происходит в анаэробной среде; следовательно, создание биореакторов — это сложный процесс с кучей нюансов. Голоомиксный подход способен помочь в определении конкретных условий для создания биореактора. Изучив ферментативный и метаболический вклад микроорганизмов и животных-хозяев, можно добиться оптимальных химических условий, имитирующих кишечную среду хозяев [56].
Включение голоомиксного подхода в биомедицинские исследования открывает перспективы более эффективного лечения многих социально значимых заболеваний человека. У большинства людей в промышленно развитых обществах наблюдается деградация микробиоты кишечника [57], что повышает вероятность аутоиммунных заболеваний [58], синдрома раздраженного кишечника [47], диабета или колоректального рака [59]. Однако взаимосвязь между этими заболеваниями и дисбалансом микрофлоры кишечника еще только предстоит раскрыть с помощью мультиомики и голоомиксного подхода. Чем лучше мы станем понимать, как влияют друг на друга микробы и человек, тем быстрее окажемся в светлом будущем персонализированной медицины.
Например, использование фекальной трансплантации [60], [61] (то есть переноса фекального материала от здорового донора к пациенту с желудочно-кишечным расстройством) в настоящее время исследуется как метод лечения ряда кишечных заболеваний. Несмотря на некоторые успехи (например, одобрение лечения рекуррентной инфекции Clostridioides difficile), эффективность такой терапии часто различается у разных пациентов, несмотря на одинаковое лечение [62]. Возможно, мульти- и голоомиксный подход повысят продуктивность такого лечения путем сопоставления генотипа фекальных доноров и реципиентов, аналогично процедурам трансплантации органов.
Голоомиксный подход может пригодиться и в изучении экологии и эволюции видов [63], например, как формируется голобионт и как сплетаются биохимические пути хозяина и микробиоты. Гологеномика может рассказать о влиянии микроорганизмов на адаптацию позвоночных к изменению климата и среды обитания или на распространение видов, придавая им повышенную способность к адаптации [64]. Ученые выяснили, что микробы могут подарить своим хозяевам устойчивость к токсинам [65], жаркому климату [66], болезням [67] и, конечно же, помогать им усваивать питательные вещества [37].
Кроме того, микробиота кишечника напрямую связана со старением организма, о чем мы еще непременно упомянем далее. В общем, мультиомиксы буквально вдохнули новую жизнь в фундаментальные микробиологические исследования, и теперь нам остается лишь не утонуть в огромных массивах информации «хозяев» и «жильцов».
Нейробиология
В первой статье цикла — «Факты и легенды о мультиомиксных технологиях» [1] — мы разобрали коннектомную работу по воссозданию 3D-модели нервной системы червя Caenorhabditis elegans на всех стадиях развития по микроскопическим срезам. Однако применение single-cell технологий в нейробиологии и не думает замедляться. Новые методы и подходы позволили прикоснуться к нервной системе позвоночных организмов, которая явно сложнее, чем у червя. В одном из исследований последних лет [68] ученые смогли детально изучить развитие нервной системы рыбки Danio rerio от икринки до полноценного эмбриона со спонтанной двигательной активностью, используя single-cell подход (рис. 9).
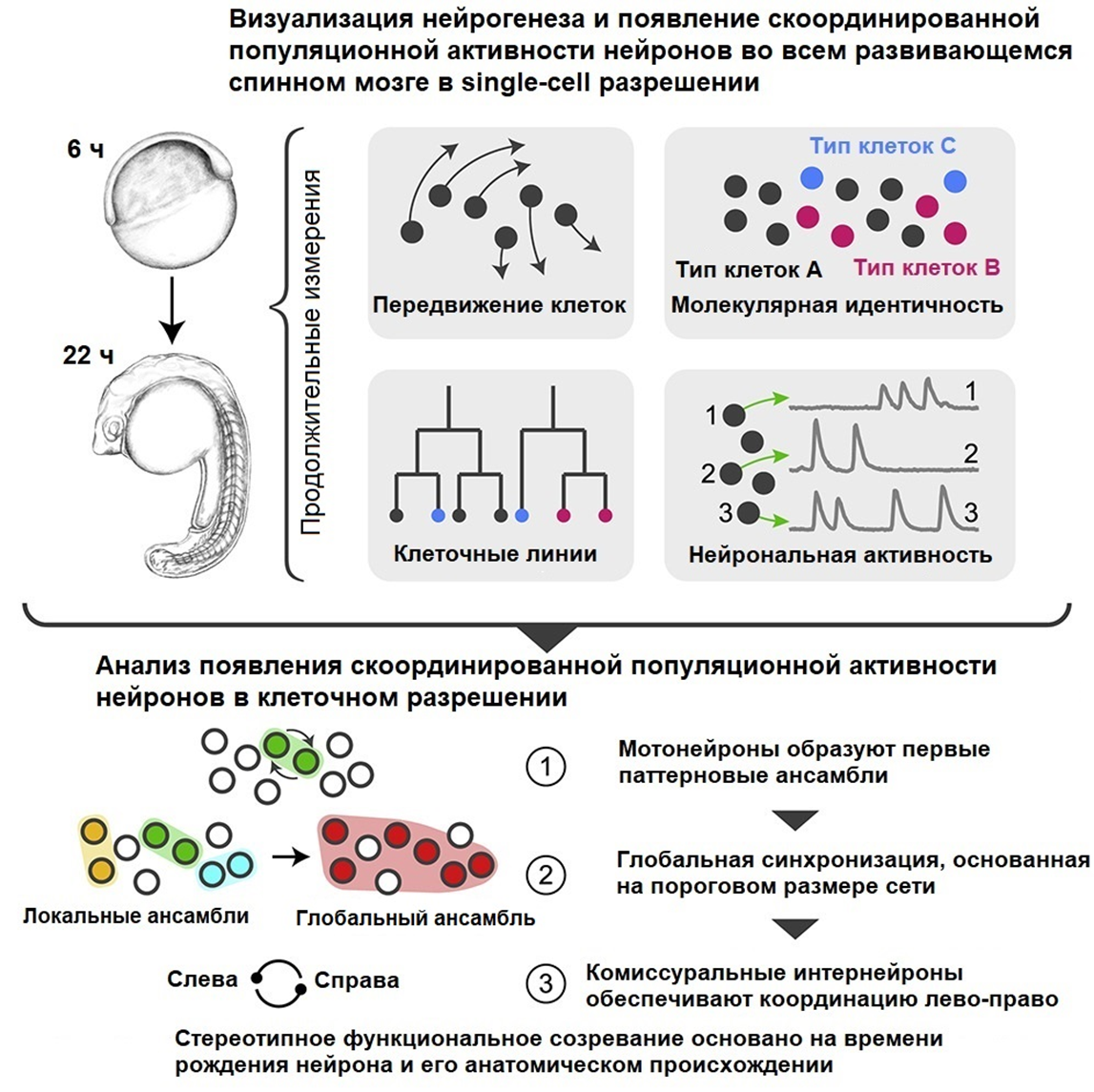
Рисунок 9. Реконструкции развития и созревания эмбрионального спинного мозга на уровне отдельных клеток. Благодаря single-cell технологиям ученые научились различать клетки между собой и отслеживать их миграцию. Так удалось наблюдать зарождение самых первых мотонейронов, образующих локальные ансамбли, передавая друг другу сигнатуры электрической активности. Объединяясь, локальные ансамбли достигают порога глобальной нейрональной синхронизации. По мере роста в сеть включаются также дорсальные комиссуральные интернейроны, генерирующие чередующиеся лево- и правосторонние вспышки активности, которые и довершают картину нервной деятельности, лежащую в основе первого спонтанного двигательного поведения эмбриона.
адаптировано из [68]
Чтобы заблокировать спонтанные мышечные сокращения на протяжении всего развития нейронов и сохранить при этом паттерн нейронной активности, исследователи вводили в икринки на стадии одной клетки специально разработанную мембраносвязанную мРНК ɑ-бунгаротоксина — змеиного нейротоксина, обрывающего нервно-мышечную передачу. Через шесть часов после оплодотворения будущим эмбрионам вводили ген флуоресцентного сенсора кальция [69], чтобы отслеживать нервную проводимость и ток ионов по мере их появления. Кроме того, ученые иммунологически пометили интересующие их популяции нейрональных клеток. Однако главным ноу-хау данного неивазивного метода стала решетчатая светолистовая микроскопия (основана на лазерной интерференции), визуализирующая все это размеченное богатство развивающейся нервной системы на уровне отдельных клеток. Чтобы уменьшить цифровой шум, применили астрофизическую технологию — адаптивную оптику.
Видео 1. Пошаговая реконструкция развития двигательной цепи спинного мозга рыбы. Сперва исследователи визуализировали развитие целого эмбриона на уровне одиночных клеток. Затем на основе полученного клеточного атласа начали отслеживать нервные клетки-предшественники (через 17 часов после оплодотворения, когда те начали формировать спинной нерв). Потом клетки-предшественники начали дифференцироваться в нейроны, и исследование переключилось на высокоскоростную функциональную визуализацию, чтобы отследить спинномозговую активность нейронов в течение следующих часов. Спинной мозг созревал прямо у ученых на глазах и проявлял скоординированное чередование левосторонних и правосторонних паттернов нервной активности, которое выражалось в спонтанном скручивании хвоста у эмбриона.
видеоаннотация к статье [68].
Для описания нейрональной активности были разработаны новые компьютерные методы, реконструировавшие развитие и объединение нейронов в локальные популяции, порождающие скоординированные паттерны активности, а затем образующие глобальную сеть во всем спинном мозге. Это помогло сделать вывод, что моторные нейроны — лидеры всей цепочки, рекрутирующие соседние нервные клетки себе в помощь. В течение следующих двух часов эти локальные группы нейронов объединяются и растут дальше, пока не сформируют глобальную синхронизированную сеть.
Интересно, что синхронизация этой сети критически зависит от «критической массы» возбудимых нейронов и связей, способных поддерживать эту синхронность. Наконец, возникшая нейрональная сеть рекрутирует интернейроны, в результате чего возникают чередующиеся левосторонние и правосторонние вспышки нервной активности, опосредующие самое первое движение в жизни маленькой рыбки — подергивание и сворачивание хвоста. Развитие таких нейронных сетей, способных к левосторонней и правосторонней самокоординации носит фундаментальное значение для понимания того, как возникают локомоторные функции у позвоночных животных.
Сейчас можно смело утверждать, что подходы мультиомики позволяют исследователям получить уникальную картину пространственно-временной экспрессии генов в развивающейся ЦНС. Мультиплексное профилирование эпигеномов и транскриптомов отдельных клеток вместе с системами динамического отслеживания клеточных клонов — просто джокер в колоде методов изучения биологии развития. Несмотря на значительные достижения в исследованиях развития модельных организмов, новые подходы к дифференцировке и перепрограммированию клеток in vitro, по-видимому, станут следующим шагом в преодолении основных этических и технических ограничений в исследованиях развития болезней человека. Недавние достижения в культивировании стволовых клеток, таких как органоиды головного мозга, в сочетании с методами мультиомного профилирования, уже начали прокладывать новые пути для изучения молекулярных и клеточных основ развития, эволюции и зарождения нейродегенеративных заболеваний.
Эмбриогенез
Развитие многоклеточных животных — это качественный скачок в сложности по сравнению с одноклеточной жизнью в двух аспектах: дифференциация и пространственная организация клеток. Когда-то считалось, что оплодотворенная яйцеклетка сама по себе очень сложная, так как скрывает всю пространственную и композиционную дифференциацию взрослой особи. Однако теперь ясно, что на самом деле она довольно проста, а вот будущая сложность эмбриона и взрослой особи возникает из-за начальной нагрузки генетических программ: многократного применения пространственной (а)симметрии для поэтапного построения сложного эмбриона. У эмбрионов позвоночных, как и у других типов, предварительная организация плана тела возникает до явной специфической дифференцировки клеток, поэтому этот процесс очень сложно отследить.
Увеличение пространственной и клеточной гетерогенности трудно отслеживается и на молекулярном уровне. Многие открытия эмбриогенеза были сделаны в результате генетических исследований и экспериментальной эмбриологии, но, к сожалению, эти анализы обычно фокусируются лишь на нескольких факторах транскрипции или секретируемых сигнальных молекулах. В действительности же процесс развития зародыша затрагивает изменения сразу во многих внутриклеточных и межклеточных молекулярных схемах. Последние технологические достижения позволили картировать мРНК в отдельных клетках с течением времени, что позволяет прослеживать дифференцировку клеток в развивающихся эмбрионах.
В 2016 появился универсальный метод транскриптомики отдельных клеток, основанный на капельной микрофлюидике [72]. Используя этот подход, исследователи проследили за каждой клеткой эмбриона лягушки Xenopus tropicalis в течение первого дня жизни после оплодотворения икринки. Выяснилось, что после оплодотворения икринка подвергается 12 быстрым делениям, в течение которых зиготическая транскрипция подавляется. Полученные четыре тысячи клеток изначально плюрипотентны. Однако в течение двух часов после активации зиготической транскрипции при переходе от средней бластулы эмбрионы проходят гаструляцию с образованием основных зародышевых слоев, за которыми следует детерминация тканей и прогрессивная дифференцировка клеток.
Наряду со своим более крупным родственником Xenopus laevis, эта лягушка — наиболее изученный модельный организм для исследования раннего развития позвоночных.
В ходе работы были профилированы эмбрионы лягушки 1) до начала зиготической транскрипции, 2) во время стадии принятия клеточной судьбы и 3) на ранней стадии появления зачатка хвоста — момент, когда сформировались десятки различных типов клеток, дающих начало всему многообразию тканей и органов. Детальную судьбу клеток лягушки в течение этих стадий и генетические профили сравнили с недавними транскриптомными анализами рыбок Danio rerio. Исследователи отметили общие черты и различия в дифференцировке эмбриональных клеток в этих двух кладах позвоночных, эволюционные пути которых разошлись около 400 миллионов лет назад.
Другой важной работой по эмбриогенезу человека стал мультиомиксный single-cell анализ предимплантационных эмбрионов человека [73], — когда оплодотворенная яйцеклетка только готовится внедриться в стенку матки. После имплантации начинается 8-недельный эмбриональный период, а затем с 10 недели стартует фетальный период, или период финального созревания плода.
7-дневный преимплантационный эмбриогенез включает в себя первые клеточные циклы жизни, в течение которых тотипотентная оплодотворенная яйцеклетка (из которой вырастает целый организм) дает начало первым дифференцированным типам клеток с последующей имплантацией в матку и развитием эмбриона. Оказывается, этот период беременности куда как далек от идеального механизма швейцарских часов. Понимание развития яйцеклетки на этой стадии имеет первостепенное значение для выявления причин бесплодия, неудачной имплантации, самопроизвольного аборта, а также нарушений развития плода. Хотя это и противоречит здравому смыслу, но преимплантационные эмбрионы человека очень склонны к хромосомной нестабильности не только после экстракорпорального оплодотворения (ЭКО), но и при естественном зачатии.
Зачастую числовые и структурные хромосомные аномалии могут возникнуть после оплодотворения яйцеклетки во время митоза (деления клеток бластоцисты), что приводит к хромосомному мозаицизму, при котором генетически разные клеточные линии с разным набором хромосом сосуществуют в одном и том же эмбрионе. Частые геномные аномалии у человеческих преимплантационных эмбрионов — главная причина потери беременности, но они не обязательно препятствуют появлению здорового потомства. Распространенная проблема преимлантационного периода — анеуплоидия [74]: изменение кариотипа, при котором число хромосом в клетках не кратно гаплоидному набору.
Стремясь обеспечить успех ЭКО, многие клиники стали использовать преимплантационное генетическое тестирование на анеуплоидию (ПГТ-А) с генетическим анализом биопсии многоклеточной трофэктодермы (наружного слоя бластоцисты), чтобы отобрать наиболее «качественные» эуплоидные эмбрионы для внедрения в матку. Однако данный тест не дает четкой информации о возможности выживания плода, поскольку мозаицизм при сегментарных анеуплоидиях не всегда приводит к потере беременности и вообще как-то вредит здоровью. Поэтому интерпретация «мозаичного» результата ПГТ-А остается сложной клинической задачей — и врачи часто используют его без фундаментального понимания биологии (сегментарных) анеуплоидных клеток человеческого эмбриона.
Из исследований клеточных линий млекопитающих и дрожжей мы знаем, что конституциональные (присутствующие во всех клетках) анеуплоидии могут вызывать эффект дозировки генов, способный оказать серьезное влияние на развитие — например, приводить к клеточному стрессу, снижающему экспрессию генов пролиферации, метаболизма нуклеиновых кислот и процессинга белков. Кроме того, экспрессия генов может и повышаться — тех, что участвуют в формировании эндоплазматического ретикулума, лизосомальных путях и мембранных функциях клеток. Однако все это не сулит ничего хорошего для будущего плода.
На мышиных эмбрионах с индуцированной хромосомной нестабильностью и мозаицизмом анеуплоидии было показано [75], что анеуплоидные клетки во внутренней клеточной массе подвергаются апоптозу, тогда как в трофэктодерме они сохраняются (пусть и с более низкой скоростью клеточного цикла) [76]. Ну а это, в свою очередь, лишает применяемый в клиниках генетический анализ трофэктодермы всякого смысла.
Несмотря на свою неоспоримую важность, молекулярные и индивидуальные клеточные реакции на анеуплоидию у эмбрионов человека остаются в значительной степени неизвестными для науки. Недавние достижения в области малозатратных single-cell технологий дают ученым возможность изучить изменения в экспрессии генов в мозаичных человеческих эмбрионах, состоящих как из анеуплоидных, так и из нормальных эуплоидных клеток.
В работе 2023 года [73] исследователи постарались охарактеризовать анеуплоидию и реконструировали сеть регуляции генов в преимплантационных эмбрионах человека, а также исследовали экспрессию генов и нарушения развития, вызванные анеуплоидией. В исследовании было использовано single-cell секвенирование генома и транскриптома (G&T-seq). На геномном уровне было показано, что приобретенные числовые и структурные хромосомные аберрации встречаются на всех стадиях раннего эмбриогенеза практически во всех клеточных линиях. На уровне транскриптома ученым удалось идентифицировать регуляторы клеточной идентичности и обнаружить сеть из 248 факторов транскрипции из 10 основных регуляторных модулей генов линий клеток преимплантационных эмбрионов человека.
Интегрируя геномную и транскриптомную информацию, исследователи смогли раскрыть, как на уровни экспрессии влияют потери или приросты соответствующих генов в эмбриональных клетках в преимплантационном развитии человека. Кроме того, было выявлено, как гены транскрипционных факторов с аберрантным числом копий нарушают экспрессию их родственных генов-мишеней в регионах с нормальным количеством хромосом. Выяснилось, что большинство анеуплоидных клеток демонстрируют задержку в своем развитии и пониженную приспособленность, что указывает на конкуренцию клеток внутри мозаичного диплоидно-анеуплоидного эмбриона. В результате это может способствовать отбору против анеуплоидных клеток в пользу диплоидных и рождению здорового потомства от мозаичных диплоидно-анеуплоидных эмбрионов.
Геронтология
Еще одним крупным направлением для мультиомики стала геронтология. Старение — сложный многофакторный процесс, который влечет за собой многочисленные сопутствующие заболевания, поэтому здесь сложно отделить зерна от плевел. И хотя «Биомолекула» выпускала в свое время спецпроект «Старение и долголетие» (см., например, статью «Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить» [77]), нельзя сказать, чтобы кто-то ясно понимал, как именно происходит старение и реально ли его остановить или хотя бы замедлить у людей.
Главной причиной смерти многоклеточного организма от старости одно время считали предельное количество делений соматических клеток из-за деградации теломер при каждом их делении (предел Хейфлика) — теломеры заканчиваются, клетки больше не делятся, замирают в определенной фазе, а затем включают апоптоз. Дело в том, что на стадии зародыша у человека работает фермент теломераза, который удлиняет теломеры, однако после рождения этот фермент работать перестает. Делиться бесконечно могут лишь стволовые и раковые клетки, ведь их теломераза работает постоянно.

Рисунок 11. Элизабет Перриш 一 бизнесвумен, руководитель стартапа BioViva и первый в мире человек, решившийся в зрелом возрасте на генную терапию по удлинению своих теломер. В сентябре 2015 г., в возрасте 44 лет, она прилетела в столицу Колумбии, где в частной клинике получила более сотни уколов препарата, содержащего ген белка фоллистатина. Как ранее показали лабораторные исследования, его активация наращивает мышечную массу у мышей. Вторая внутривенная инъекция содержала вирусный вектор, несущий ген фермента теломеразы. На данный момент Элизабет прекрасно выглядит, хотя ее возраст уже перевалил за 50 лет. Впрочем неизвестно, последствия ли это генной терапии или современные достижения в области косметологии. Женщину многократно критиковали за распространение лженауки, а видные ученые сомневались в эффективности и безопасности ее поступка.
Однако генная терапия, позволяющая активировать теломеразу в клетках, считается небезопасной, ведь она не до конца исследована и с высокой вероятностью может вызвать рак. Впрочем, это не остановило американку Элизабет Периш, руководителя стартапа BioViva, от смелого эксперимента над своим организмом (рис. 11). В 2015 году женщина внутривенно ввела себе генетические конструкции, запускающие экспрессию генов теломеразы в организме.
Разработки компании BioViva основаны на исследованиях 2012 года Марии Бласко из Национального ракового центра Испании [78]. Тогда вместе с группой коллег исследовательнице удалось нарастить теломеры у мышей с помощью аденоассоциированного вирусного вектора [79], несущего ген фермента теломеразы TERT. Роста раковых клеток у подопытных животных не наблюдалось, хотя ученые этого очень опасались.
Генетическая терапия старения запрещена FDA (Food and Drug Administration, Управление по пищевым продуктам и лекарствам США). Поэтому Элизабет Перриш пришлось делать это нелегально в одной из стран Южной Америки — следовательно, информацию о проведенной терапии сложно проверить, кроме как поверив на слово самой женщине. Стала ли Элизабет благодаря этому вмешательству вечно молодой и бессмертной — узнаем лет через 50. На данный момент вышла одна научная статья [80], где ученые отмечают рост теломер на концах ее хромосом, а биологический возраст на основе биомаркеров старения [81] — в районе 25 лет (на данный момент подопытной 52 года). Тем не менее, причинно-следственная связь между деградацией теломер и старением — это очень сложный вопрос, требующий множества исследований. Ведь на наш геном, протеом и метаболом воздействуют еще сотни факторов, а активность теломеразы может привести к превращению клеток в злокачественные. Следовательно, теломеразная терапия пока остается лишь предметом для экспериментов на животных и еще не скоро войдет в клинический обиход.
Поэтому у геронтологов остается еще миллион вопросов про этот сакральный и фундаментальный для всего живого процесс. Какие факторы разрушают наш геном и ускоряют приближение старости? Почему некоторые виды позвоночных, такие как голый землекоп [82], обладают пренебрежимым старением [83]?
Тут явно не обойтись без всеобъемлющего мультиомиксного анализа, отслеживающего превращения биомолекул на всех стадиях жизни клеток. В настоящее время существуют различные национальные проекты по биобанкированию образцов, полученных от множества людей, для последующего омикс-анализа. Например, это биобанки данных мультиомиксных проектов по исследованию старения, такие как MARK-AGE [84], EUROBATS и UKBiobank [85].
Анализ возрастной корреляции включает в себя большие объемы данных, полученных в результате различных омиксных анализов, таких как (эпи)геномика, транскриптомика, протеомика, метаболомика и микробиомика. Основные преимущества этого метода включают анализ всех возможных данных, относящихся к одному человеку или большой группе людей, а также общих и индивидуальных характеристик с многомерной точки зрения. Одной из главных целей этого подхода служит выявление маркеров старения [81] и новых мишеней для борьбы с ним, а ищут биомаркеры, как правило, при помощи глубоких нейронных сетей.
Ткани и органы разных людей стареют с разной скоростью. Старение физиологических систем приводит к хроническим заболеваниям и синдромам, которые связаны с нарушением обмена веществ. Поэтому ожидается, что характеристика биомаркеров, связанных со старением, проложит путь к открытию новых мишеней по борьбе с этим недугом. На сегодняшний день не существует ни одного достоверного биомаркера старения, который мог бы адекватно отражать биологический возраст организма. Однако с уверенностью можно сказать, что такие биомаркеры явно существуют — осталось лишь вывести корреляцию между возрастом и результатами мультиомиксных исследований. Американская федерация исследований старения предложила следующие критерии для поиска биомаркеров старения:
- Прогнозирование скорости старения. Другими словами, биомаркер должен точно показать, на каком этапе жизни находится человек. Эта характеристика должна быть лучшим предиктором продолжительности жизни, чем хронологический возраст. Конечно, для этого потребуется длительное наблюдение за человеческой популяцией в течение всей жизни либо косвенные суждения, основанные на исследованиях других млекопитающих.
- Отслеживание процессов, лежащих в основе старения. При этом стоит учитывать процессы, которые лежат в основе хронических заболеваний, а не являются их следствием.
- Возможность многократного тестирования без причинения вреда человеку. Например, это могут быть анализы крови или методы микроскопической визуализации. Кроме того, хорошим биомаркером возрастной функциональности организма служит тест на локомоторную активность [86], а также базовые физиологические показатели: артериальное давление и индекс массы тела.
- Наличие биомаркера как у людей, так и у других млекопитающих лабораторных животных, чтобы сохранилась возможность проведения доклинических испытаний.
МО-исследования, объединяющие данные эпигеномики, транскриптомики, протеомики, метаболомики и микробиомики могут дать нам полную картину процесса.
Эпигенетика
Одной из первых омиксных технологий в геронтологии стали эпигенетические исследования. Оценка биологического возраста на основе метилирования ДНК стала широко обсуждаться учеными в последнее десятилетие, начиная с 2013 года. Исследования эпигенетических модификаций ДНК показали, что возрастные изменения в метилировании ДНК связаны с более высоким биологическим возрастом, по сравнению с хронологическим. На данный момент одной из популярных причин эрозии теломер считается активность клеточных рекомбиназ, активирующихся в ответ на повреждение ДНК, которое вызывается возрастной депрессией мобильных элементов генома [87]. Это явление назвали эпигенетическим ускорением старения.
Первой попыткой измерить биологический возраст человека считаются «эпигенетические часы», открытые в 2013 году американским исследователем Стивом Хорватом [88]. В своем исследовании Стив нашел 353 участка ДНК, у которых с возрастом появляются или исчезают метильные метки. Соответственно, чем больше характерных меток в определенных участках генома, тем старше клетка и весь организм. Вслед за Хорватом придумали еще несколько версий «эпигенетических часов» — «часы Ханнэма» [89], «часы Левина» [90] и другие. Один из самых последних вариантов предложил сам Стив Хорват — он назвал их GrimAge (от английского слова grim — «мрачный»): чем выше этот эпигенетический возраст у человека, тем более мрачные новости его ждут о продолжительности своей жизни. GrimAge — это инструмент, который позволяет нам взглянуть на эпигенетическое ускорение старения с новой точки зрения. Продольные когортные исследования показали, что GrimAge может с достаточно высокой точностью предсказать время до развития рака или коронарной болезни сердца. Рост биологического возраста на основе этих эпигенетических часов увеличивается с ростом индекса массы тела пациентов и напрямую коррелирует с образом жизни [91]. Из этого можно вывести, что организм человека стареет неравномерно, и процесс этот может ускоряться. Основным индикатором биологического возраста по GrimAge является метилирование исключительно рибосомальной ДНК. На основе GrimAge разработан биоинформатический инструмент, отслеживающий скорость старения по эпигенетическим показателям — AgeAccelGrim.
Транскриптомика
В исследовании старения не обошлось и без транскриптомики — известно, что глубокие возрастные изменения затрагивают в том числе и профиль транскрипции. Такие профили строят по разным группам РНК, в том числе длинным некодирующим (днРНК), циркулярным (циркРНК) и экзосомальным РНК. Из-за разнообразия методов и подходов единого определения связи старения с транскриптомными изменениями не существует.
В работе 2015 года [92] ученые провели мета-анализ 7074 образцов крови и описали 11 908 генов, экспрессирующих предикторы биологического возраста. Им удалось построить предсказательную модель со средней ошибкой между хронологическим и прогнозируемым возрастом в 7,8 года.
Другое важное исследование 2018 года было посвящено транскриптомам фибробластов кожи человека [93], которые записали у 133 человек в возрасте 1–94 лет, чтобы проверить, закодированы ли в них признаки старения. Ученые использовали метод ансамблевого машинного обучения, в котором несколько математических моделей объединяются для решения одной проблемы. Такой сплав молекулярной биологии и биоинформатики позволил совладать с огромным массивом данных. После скармливания нейросетям всех транскриптомов, ученым удалось предсказать биологический возраст с погрешностью в 4 года. Неплохой результат, но все еще уступающий в точности «эпигенетическим часам».
Затем в этой же работе ученые использовали свой ансамбль алгоритмов для тестирования на транскриптомах 10 пациентов, больных прогерией, и утверждают, что их метод единственный, который способен предсказать темпы ускоренного старения у людей с этим генетическим заболеванием. Что ж, будем ждать более развернутых когортных исследований.
Протеомика
Протеомные исследования также нашли свою нишу в геронтологии [94]. Ведь с возрастом экспрессия некоторых белков уменьшается, что можно проследить на протеомном профиле. Это гораздо более показательный анализ, ведь, в отличие от генов и РНК, белки — это конечный продукт, определяющий фенотип. Протеомике уделяется все больше внимания в исследованиях старения, поскольку ее результаты хорошо воспроизводятся при соблюдении протокола сбора образцов. Однако протеомика все еще слишком дорога и ограниченно применима в клинической практике.
На основе сканирования сомы плазмы был проанализирован 1301 белок от 120 участников; 10 из них связали со старением, а именно: GDF15, NPPB, CTSV, EFEMP1, ADAMTS5, CHRDL1, FSHB, MMP12, SOST и PTN. В большой когорте из 3301 пациентов было показано, что протеомные часы старения точно предсказывают возраст человека.
В протеоме плазмы долгожителей выявлены топ-10 белков, связанных с нездоровым старением (CRTAC1, CDKL1, CD14 и AOPEP) и здоровым старением (TGFBI, TAS1R3, IGFAS, CRISP3 и CLEC3B) — эти белки можно использовать в качестве биомаркеров старения. В частности, отдельного изучения заслуживает GDF15 — митоген, участвующий в иммунном ответе и иммунном старении, поскольку его концентрация увеличивается у пожилых людей независимо от пола и расы. Однако нужны более объемные клинические исследования этих белков и дальнейшая омиксная интеграция, чтобы получить уверенность в результатах.
Несмотря на эти достижения в протеомике старения, 100%-надежных протеомных биомаркеров все еще нет. Основные причины — доступность технологий масс-спектрометрии, отбор образцов, единство протоколов пробоподготовки. Также этот способ анализа сильно затруднен из-за протеомной гетерогенности среди разных групп населения, разного пола или наличия у пациентов заболеваний, не связанных с возрастом. Лишь немногие белки не зависят от фенотипа испытуемых и адекватно отражают только старение.
Метаболомика
Метаболомика дает огромное количество информации, особенно в мультиомиксном формате. В ходе метаболомного и эпигенетического анализа, изучающего старение населения Великобритании, были обнаружены значительные разнонаправленные изменения в нескольких метаболических путях организма — катаболизме коэнзима А; и метаболизме витамина Е, лизина, триптофана и тирозина. Основными факторами, влияющими на продолжительность жизни и старение, оказались пути метаболизма гормона роста, а также инсулина/инсулиноподобного фактора роста (инсулин/ИФР-1) в различных организмах, от дрожжей до млекопитающих (включая человека).
В другом исследовании было идентифицировано 2678 метаболитов плазмы в группе из 150 человек (30–100 лет). Уровни моно- и диацилглицеринов, а также фосфосерина снижались с возрастом. С другой стороны, продукт протеолиза l-γ-глутамил-l-лейцин увеличивался независимо от пола во время старения. Однако уровни 25-гидроксигексановой кислоты, эйкозапентаеновой кислоты и фосфосерина показали отрицательную тенденцию у пожилых людей. Таким образом, можно обнаружить влияние старения на распределение липидов в организме человека [95].
Немецкий исследователь Иоганнес Хертель с коллегами в 2016 году предложили использовать метаболомику для прогнозирования биологического возраста — метод получил название «метаболомные часы старения» [96]. Они основывали свой анализ ЯМР-спектроскопии мочи. Аналогично, Ван ден Аккер и др. разработали инновационный метаболомный метод измерения биологического возраста [96] (метаболомные профили сыворотки крови собирали также при помощи ЯМР). Чтобы оценить хронологический возраст, ученые использовали линейную модель, оценивающую зависимость между метаболическими переменными, — MetaboAge. Исследование показало, что превышение MetaboAge над хронологическим возрастом соответствует метаболическим нарушениям в работе сердца.
Микробиомика
Как уже было сказано ранее, перспективным направлением в изучении биологии старения, тесно связанным с метаболомикой, являются микробиологические исследования. Ученые уже пытались охарактеризовать микробиоту кишечника долгожителей, чтобы определить, существует ли связь между микрофлорой и долголетием человека. У пожилых людей микробиота кишечника связана с иммунным гомеостазом хозяина, нарушение которого может привести к хроническим заболеваниям воспалительного характера. Хроническое воспаление, нейродегенерация и метаболический синдром также объясняются теорией воспалительного старения.
С возрастом постоянный дисбаланс микробиоты приводит к воспалительной реакции в слизистой оболочке кишечника. Используя ген 16S рРНК и методы метагеномного секвенирования, ученые смогли построить самую длинную траекторию старения микробиоты кишечника человека. Они проанализировали состав и функцию кишечных микробов у 247 здоровых людей в возрасте 0–110 лет [97]. Кстати, микробиота кишечника китайских долгожителей была более разнообразной, чем у молодых людей. Кроме того, исследование показало, что у пожилых людей (не долгожителей) выявляется специфический фенотип микробиоты, снижается количество бактерий с противовоспалительным и иммуномодулирующим действием, таких как Bacteroides, Ruminococcus, Faecalibacterium, Parabacteroides и Clostridium [98]. Быть может, употребление в пищу пробиотиков позволит нам омолодиться?
Сложности и перспективы мультиомиксного подхода в гериатрии
Интегромика, МО-технологии и системная биология обеспечили несколько инструментов в изучении старения и мер против него — влияние на микробиоту, терапию половыми гормонами и гормоном роста, использование антиоксидантов. Учитывая сложность и неоднородность процесса старения, интегромика и системная биология не только предоставляют статические карты молекул, но также используются для описания изменений молекул с течением времени.
Хотя методы мультиомики имеют большой потенциал, есть препятствия к их широкому внедрению. Во-первых, они дороги и требуют специального оборудования и высококвалифицированного персонала для анализа данных. Во-вторых, качество данных может быть неравномерным, их источник — неточным, а нестандартная выборка может вызвать проблемы при сборе и проверке информации. Например, самая большая проблема в метаболомных исследованиях заключается в обработке и анализе данных, поскольку в биологических организмах присутствуют тысячи разнородных метаболитов. Эти трудности усугубляются различиями между людьми и отсутствием общепринятых протоколов анализа данных. Следовательно, необходимо продвигать междисциплинарные усилия и стандартизацию процедур в клинических исследованиях. Также следует провести продольные когортные исследования с большими выборками. Особенно не хватает продольных исследований [99], чтобы определить последовательность событий, на которые влияет изменение микробиоты с возрастом.
Модельные организмы с малой продолжительностью жизни и менее сложной микробиотой, а также установленные биомаркеры старения облегчают геронтологические исследования. Например, было показано, что у нематод, плодовых мух и мышей целостность барьера кишечного эпителия снижается с возрастом и аналогичным образом связана со старением у человека. Таким образом, нам не обязательно наблюдать за долгоживущей популяцией людей, чтобы сделать какие-то выводы.
Прекрасное будущее системной биологии
Потенциал мультиомиксных технологий растет параллельно с технологическим прогрессом, позволяя изучать биологические процессы во всей их сложности методами системной биологии. Буквально каждый день выходят исследования, использующие новые мультиомиксные single-сеll и пространственные технологии для изучения тканей; появляются новые способы картирования генома и транскриптома; становятся более доступными секвенирование и масс-спектрометрия. К пространственной мультиомике с успехом подключаются методы визуализации, такие как трехмерная микроскопия сверхвысокого разрешения [100] и иммунохимические методы анализа. Базы данных пополняются новыми генетическими и белковыми последовательностями — на радость биоинформатикам. Огромные массивы данных подстегивают развитие Data Science и создание новых алгоритмов по изучению этих последовательностей. Наконец-то мы можем найти достойное применение нейросетям и по максимуму использовать мощности доступных нам суперкомпьютеров. В одной статье невозможно перечислить все области применения данных технологий, однако мы постарались упомянуть наиболее перспективные. Для более подробного освещения вопроса пришлось бы написать целую книгу, но и она бы быстро устарела с учетом скорости развития технологий и методов.
Что же ждет нас в будущем? Уже сейчас заметно, что мультиомиксные технологии кардинально меняют парадигму биологических исследований. Системный подход к изучению биологических объектов позволяет детально разобрать сложные процессы, не упуская никаких деталей — со временем такой подход станет золотым стандартом. Ученые будут изучать не отдельную «омику», а весь путь биомолекул от генетической программы до ее конечного продукта. Чем больше функций генов мы изучим, тем дальше мы продвинемся к передовой генной терапии и исцелению неизлечимых пока заболеваний. Исследования биологии развития и эволюции живых организмов наверняка заставят нас пересмотреть общепринятые теории о происхождении жизни на Земле.
В следующих статьях цикла мы подробно обсудим применение системных подходов по изучению генома, транскриптома, протеома и прочих «омов» в сферах медицины, экологии и сельского хозяйства.
Литература
- Факты и легенды о мультиомиксных технологиях;
- Жизнь и путешествия замечательных клеток нервного гребня;
- Геном человека: как это было и как это будет;
- Модельные организмы: дрозофила;
- Модельные организмы: грызуны;
- Jiankai Wei, Penghui Liu, Fuyun Liu, An Jiang, Jinghan Qiao, et. al.. (2023). EDomics: a comprehensive and comparative multi-omics database for animal evo-devo. Nucleic Acids Research. 51, D913-D923;
- Nathalie Le Roy, Lilian Stapane, Joël Gautron, Maxwell T. Hincke. (2021). Evolution of the Avian Eggshell Biomineralization Protein Toolkit – New Insights From Multi-Omics. Front. Genet.. 12;
- Jun Xing, Olivier Wellman-Labadie, Joel Gautron, Maxwell T. Hincke. (2007). Recombinant eggshell ovocalyxin-32: Expression, purification and biological activity of the glutathione S-transferase fusion protein. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 147, 172-177;
- Aurélie Kapusta, Alexander Suh, Cédric Feschotte. (2017). Dynamics of genome size evolution in birds and mammals. Proc. Natl. Acad. Sci. U.S.A.. 114;
- Joeöl Gautron, Emi Murayama, Alain Vignal, Mireille Morisson, Marc D. McKee, et. al.. (2007). Cloning of Ovocalyxin-36, a Novel Chicken Eggshell Protein Related to Lipopolysaccharide-binding Proteins, Bactericidal Permeability-increasing Proteins, and Plunc Family Proteins. Journal of Biological Chemistry. 282, 5273-5286;
- Cristianne M. M. Cordeiro, Hamed Esmaili, George Ansah, Maxwell T. Hincke. (2013). Ovocalyxin-36 Is a Pattern Recognition Protein in Chicken Eggshell Membranes. PLoS ONE. 8, e84112;
- Joël Gautron, Sophie Réhault-Godbert, Géraldine Pascal, Yves Nys, Maxwell T. Hincke. (2011). Ovocalyxin-36 and other LBP/BPI/PLUNC-like proteins as molecular actors of the mechanisms of the avian egg natural defences. Biochemical Society Transactions. 39, 971-976;
- M. T. Hincke, C. P. W. Tsang, M. Courtney, V. Hill, R. Narbaitz. (1995). Purification and immunochemistry of a soluble matrix protein of the chicken eggshell (ovocleidin 17). Calcif Tissue Int. 56, 578-583;
- Ivan Mikšík, Statis Paradis, Adam Eckhardt, David Sedmera. (2018). Analysis of Siamese Crocodile (Crocodylus siamensis) Eggshell Proteome. Protein J. 37, 21-37;
- Maxwell, T. Hincke. (2012). The eggshell: structure, composition and mineralization. Front Biosci. 17, 1266;
- Dimitra Athanasiadou, Wenge Jiang, Dina Goldbaum, Aroba Saleem, Kaustuv Basu, et. al.. (2018). Nanostructure, osteopontin, and mechanical properties of calcitic avian eggshell. Sci. Adv.. 4;
- Claire Bardet, Sidney Delgado, Jean-Yves Sire. (2010). MEPE evolution in mammals reveals regions and residues of prime functional importance. Cell. Mol. Life Sci.. 67, 305-320;
- Pauline Marie, Valérie Labas, Aurélien Brionne, Grégoire Harichaux, Christelle Hennequet-Antier, et. al.. (2015). Quantitative proteomics and bioinformatic analysis provide new insight into protein function during avian eggshell biomineralization. Journal of Proteomics. 113, 178-193;
- Lilian Stapane, Nathalie Le Roy, Maxwell T. Hincke, Joël Gautron. (2019). The glycoproteins EDIL3 and MFGE8 regulate vesicle-mediated eggshell calcification in a new model for avian biomineralization. Journal of Biological Chemistry. 294, 14526-14545;
- Правдивая история о протеогеномике;
- Shunsuke Sogabe, William L. Hatleberg, Kevin M. Kocot, Tahsha E. Say, Daniel Stoupin, et. al.. (2019). Pluripotency and the origin of animal multicellularity. Nature. 570, 519-522;
- Ствол и ветки: стволовые клетки;
- Priscila Ramos-Ibeas, Fei Sang, Qifan Zhu, Walfred W. C. Tang, Sarah Withey, et. al.. (2019). Pluripotency and X chromosome dynamics revealed in pig pre-gastrulating embryos by single cell analysis. Nat Commun. 10;
- Zhigang Xue, Kevin Huang, Chaochao Cai, Lingbo Cai, Chun-yan Jiang, et. al.. (2013). Genetic programs in human and mouse early embryos revealed by single-cell RNA sequencing. Nature. 500, 593-597;
- Liying Yan, Mingyu Yang, Hongshan Guo, Lu Yang, Jun Wu, et. al.. (2013). Single-cell RNA-Seq profiling of human preimplantation embryos and embryonic stem cells. Nat Struct Mol Biol. 20, 1131-1139;
- Tomonori Nakamura, Ikuhiro Okamoto, Kotaro Sasaki, Yukihiro Yabuta, Chizuru Iwatani, et. al.. (2016). A developmental coordinate of pluripotency among mice, monkeys and humans. Nature. 537, 57-62;
- Fan Zhou, Rui Wang, Peng Yuan, Yixin Ren, Yunuo Mao, et. al.. (2019). Reconstituting the transcriptome and DNA methylome landscapes of human implantation. Nature. 572, 660-664;
- Jing Wang, Lingling Zhang, Shanshan Lian, Zhenkui Qin, Xuan Zhu, et. al.. (2020). Evolutionary transcriptomics of metazoan biphasic life cycle supports a single intercalation origin of metazoan larvae. Nat Ecol Evol. 4, 725-736;
- Alexander G. Dvoretsky, Vladimir G. Dvoretsky. (2022). Biological Aspects, Fisheries, and Aquaculture of Yesso Scallops in Russian Waters of the Sea of Japan. Diversity. 14, 399;
- Geng Ding, Yosia Mugume, Maria Emilia Dueñas, Young Jin Lee, Meiling Liu, et. al.. (2023). Biological insights from multi-omics analysis strategies: Complex pleotropic effects associated with autophagy. Front. Plant Sci.. 14;
- Аутофагия, протофагия и остальные;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Модельные организмы: арабидопсис;
- Beata Brzychczyk, Zbigniew Kowalczyk, Jan Giełżecki. (2016). Evaluation of Usefulness of the Designed Laboratory Photobioreactor for Microalgae Cultivation in Controlled Conditions. Agricultural Engineering. 20, 13-22;
- Michela Cecchin, Jovan Simicevic, Louise Chaput, Manuel Hernandez Gil, Laura Girolomoni, et. al.. (2023). Acclimation strategies of the green alga Chlorella vulgaris to different light regimes revealed by physiological and comparative proteomic analyses. Journal of Experimental Botany. 74, 4540-4558;
- Зоопарк в моем животе;
- Silvia Falcinelli, Simona Picchietti, Ana Rodiles, Lina Cossignani, Daniel L. Merrifield, et. al.. (2015). Lactobacillus rhamnosus lowers zebrafish lipid content by changing gut microbiota and host transcription of genes involved in lipid metabolism. Sci Rep. 5;
- Hsin-Jung Wu, Eric Wu. (2012). The role of gut microbiota in immune homeostasis and autoimmunity. Gut Microbes. 3, 4-14;
- Seth M. Rudman, Sharon Greenblum, Rachel C. Hughes, Subhash Rajpurohit, Ozan Kiratli, et. al.. (2019). Microbiome composition shapes rapid genomic adaptation ofDrosophila melanogaster. Proc. Natl. Acad. Sci. U.S.A.. 116, 20025-20032;
- Shan Liang, Xiaoli Wu, Feng Jin. (2018). Gut-Brain Psychology: Rethinking Psychology From the Microbiota–Gut–Brain Axis. Front. Integr. Neurosci.. 12;
- Lasse Nyholm, Adam Koziol, Sofia Marcos, Amanda Bolt Botnen, Ostaizka Aizpurua, et. al.. (2020). Holo-Omics: Integrated Host-Microbiota Multi-omics for Basic and Applied Biological Research. iScience. 23, 101414;
- Frederic A. Carvalho, Omry Koren, Julia K. Goodrich, Malin E.V. Johansson, Ilke Nalbantoglu, et. al.. (2012). Transient Inability to Manage Proteobacteria Promotes Chronic Gut Inflammation in TLR5-Deficient Mice. Cell Host & Microbe. 12, 139-152;
- Netta Mäkinen, Miika Mehine, Jaana Tolvanen, Eevi Kaasinen, Yilong Li, et. al.. (2011). MED12 , the Mediator Complex Subunit 12 Gene, Is Mutated at High Frequency in Uterine Leiomyomas. Science. 334, 252-255;
- Aspen T. Reese, Fátima C. Pereira, Arno Schintlmeister, David Berry, Michael Wagner, et. al.. (2018). Microbial nitrogen limitation in the mammalian large intestine. Nat Microbiol. 3, 1441-1450;
- Caleb J. Kelly, Leon Zheng, Eric L. Campbell, Bejan Saeedi, Carsten C. Scholz, et. al.. (2015). Crosstalk between Microbiota-Derived Short-Chain Fatty Acids and Intestinal Epithelial HIF Augments Tissue Barrier Function. Cell Host & Microbe. 17, 662-671;
- Taichi A. Suzuki, Megan Phifer‐Rixey, Katya L. Mack, Michael J. Sheehan, Dana Lin, et. al.. (2019). Host genetic determinants of the gut microbiota of wild mice. Molecular Ecology. 28, 3197-3207;
- Floris Imhann, Arnau Vich Vila, Marc Jan Bonder, Jingyuan Fu, Dirk Gevers, et. al.. (2018). Interplay of host genetics and gut microbiota underlying the onset and clinical presentation of inflammatory bowel disease. Gut. 67, 108-119;
- Marius Bredon, Jessica Dittmer, Cyril Noël, Bouziane Moumen, Didier Bouchon. (2018). Lignocellulose degradation at the holobiont level: teamwork in a keystone soil invertebrate. Microbiome. 6;
- Ioannis A. Stringlis, Ke Yu, Kirstin Feussner, Ronnie de Jonge, Sietske Van Bentum, et. al.. (2018). MYB72-dependent coumarin exudation shapes root microbiome assembly to promote plant health. Proc. Natl. Acad. Sci. U.S.A.. 115;
- Tarun Bansal, Robert C. Alaniz, Thomas K. Wood, Arul Jayaraman. (2010). The bacterial signal indole increases epithelial-cell tight-junction resistance and attenuates indicators of inflammation. Proc. Natl. Acad. Sci. U.S.A.. 107, 228-233;
- Anthony T. Virtue, Sam J. McCright, Jasmine M. Wright, Monica T. Jimenez, Walter K. Mowel, et. al.. (2019). The gut microbiota regulates white adipose tissue inflammation and obesity via a family of microRNAs. Sci. Transl. Med.. 11;
- Ran Blekhman, Julia K. Goodrich, Katherine Huang, Qi Sun, Robert Bukowski, et. al.. (2015). Host genetic variation impacts microbiome composition across human body sites. Genome Biol. 16;
- Christopher Quince, Alan W Walker, Jared T Simpson, Nicholas J Loman, Nicola Segata. (2017). Shotgun metagenomics, from sampling to analysis. Nat Biotechnol. 35, 833-844;
- Секвенирование единичных клеток (версия — Metazoa);
- Jinfeng Ni, Gaku Tokuda. (2013). Lignocellulose-degrading enzymes from termites and their symbiotic microbiota. Biotechnology Advances. 31, 838-850;
- Johanna Gutleben, Maryam Chaib De Mares, Jan Dirk van Elsas, Hauke Smidt, Jörg Overmann, Detmer Sipkema. (2018). The multi-omics promise in context: from sequence to microbial isolate. Critical Reviews in Microbiology. 44, 212-229;
- Vinod K. Gupta, Sandip Paul, Chitra Dutta. (2017). Geography, Ethnicity or Subsistence-Specific Variations in Human Microbiome Composition and Diversity. Front. Microbiol.. 8;
- Jean-François Bach. (2002). The Effect of Infections on Susceptibility to Autoimmune and Allergic Diseases. N Engl J Med. 347, 911-920;
- Qiang Feng, Suisha Liang, Huijue Jia, Andreas Stadlmayr, Longqing Tang, et. al.. (2015). Gut microbiome development along the colorectal adenoma–carcinoma sequence. Nat Commun. 6;
- Чем пахнет здоровье?;
- Микробы из глубинки. Стоит ли нам трансплантировать себе фекалии дикарей, чтобы вернуть былое здоровье;
- Hani Sbahi, Jack A Di Palma. (2016). Faecal microbiota transplantation: applications and limitations in treating gastrointestinal disorders. BMJ Open Gastroenterol. 3, e000087;
- Eugene Rosenberg, Omry Koren, Leah Reshef, Rotem Efrony, Ilana Zilber-Rosenberg. (2007). The role of microorganisms in coral health, disease and evolution. Nat Rev Microbiol. 5, 355-362;
- Antton Alberdi, Ostaizka Aizpurua, Kristine Bohmann, Marie Lisandra Zepeda-Mendoza, M. Thomas P. Gilbert. (2016). Do Vertebrate Gut Metagenomes Confer Rapid Ecological Adaptation?. Trends in Ecology & Evolution. 31, 689-699;
- Emilie Macke, Martijn Callens, Luc De Meester, Ellen Decaestecker. (2017). Host-genotype dependent gut microbiota drives zooplankton tolerance to toxic cyanobacteria. Nat Commun. 8;
- Nancy A. Moran, Yueli Yun. (2015). Experimental replacement of an obligate insect symbiont. Proc. Natl. Acad. Sci. U.S.A.. 112, 2093-2096;
- Stephan P. Rosshart, Brian G. Vassallo, Davide Angeletti, Diane S. Hutchinson, Andrew P. Morgan, et. al.. (2017). Wild Mouse Gut Microbiota Promotes Host Fitness and Improves Disease Resistance. Cell. 171, 1015-1028.e13;
- Yinan Wan, Ziqiang Wei, Loren L. Looger, Minoru Koyama, Shaul Druckmann, Philipp J. Keller. (2019). Single-Cell Reconstruction of Emerging Population Activity in an Entire Developing Circuit. Cell. 179, 355-372.e23;
- Загадочный кальциевый язык;
- Модельные организмы: данио рерио;
- Roman A. Li, Marja Talikka, Sylvain Gubian, Colette vom Berg, Florian Martin, et. al.. (2021). Systems Toxicology Approach for Assessing Developmental Neurotoxicity in Larval Zebrafish. Front. Genet.. 12;
- James A. Briggs, Caleb Weinreb, Daniel E. Wagner, Sean Megason, Leonid Peshkin, et. al.. (2018). The dynamics of gene expression in vertebrate embryogenesis at single-cell resolution. Science. 360;
- Elia Fernandez Gallardo, Alejandro Sifrim, Joel Chappell, Jonas Demeulemeester, Jennifer Clara Herrmann, et. al. A multi-omics genome-and-transcriptome single-cell atlas of human preimplantation embryogenesis reveals the cellular and molecular impact of chromosome instability — Cold Spring Harbor Laboratory;
- Неинвазивная диагностика анеуплоидий у плода: от идеи к продукту;
- Shruti Singla, Lisa K. Iwamoto-Stohl, Meng Zhu, Magdalena Zernicka-Goetz. (2020). Autophagy-mediated apoptosis eliminates aneuploid cells in a mouse model of chromosome mosaicism. Nat Commun. 11;
- Helen Bolton, Sarah J. L. Graham, Niels Van der Aa, Parveen Kumar, Koen Theunis, et. al.. (2016). Mouse model of chromosome mosaicism reveals lineage-specific depletion of aneuploid cells and normal developmental potential. Nat Commun. 7;
- Старческие капризы природы: почему люди прекращают стареть, а мыши не успевают жить;
- Bruno Bernardes de Jesus, Elsa Vera, Kerstin Schneeberger, Agueda M. Tejera, Eduard Ayuso, et. al.. (2012). Telomerase gene therapy in adult and old mice delays aging and increases longevity without increasing cancer. EMBO Mol Med. 4, 691-704;
- Крохотные курьеры: как аденоассоциированные вирусы спасают жизни;
- Patrick E Sewell. (2022). Systemic Human Htert Aav Gene Transfer Therapy And The Effect On Telomere Length And Biological Age, A Case Report. J Regen Biol Med;
- Как и почему искусственный интеллект биологический возраст определял;
- Преодолевшие старение. Часть I. Кому выпал эволюционный джекпот?;
- Преодолевшие старение. Часть II. Дети подземелья;
- Alexander Bürkle, María Moreno-Villanueva, Jürgen Bernhard, María Blasco, Gerben Zondag, et. al.. (2015). MARK-AGE biomarkers of ageing. Mechanisms of Ageing and Development. 151, 2-12;
- Luke C. Pilling, Janice L. Atkins, Kirsty Bowman, Samuel E. Jones, Jessica Tyrrell, et. al.. (2016). Human longevity is influenced by many genetic variants: evidence from 75,000 UK Biobank participants. Aging. 8, 547-560;
- Shawn Hiew, Leila Eibeck, Carine Nguemeni, Daniel Zeller. (2023). The Influence of Age and Physical Activity on Locomotor Adaptation. Brain Sciences. 13, 1266;
- Галицкий В. А. (2009). Эпигенетическая природа старения. Цитология.51, 388–397;
- Steve Horvath. (2013). DNA methylation age of human tissues and cell types. Genome Biology. 14, R115;
- Gregory Hannum, Justin Guinney, Ling Zhao, Li Zhang, Guy Hughes, et. al.. (2013). Genome-wide Methylation Profiles Reveal Quantitative Views of Human Aging Rates. Molecular Cell. 49, 359-367;
- Levine M. E. Epigenetic biomarkers of aging. In: Biomarkers of Human Aging / ed. by Moskalev A. Cham: Springer International Publishing, 2019. P. 155–171;
- Ake T. Lu, Austin Quach, James G. Wilson, Alex P. Reiner, Abraham Aviv, et. al.. (2019). DNA methylation GrimAge strongly predicts lifespan and healthspan. Aging. 11, 303-327;
- Marjolein J. Peters, Roby Joehanes, Luke C. Pilling, Claudia Schurmann, Karen N. Conneely, et. al.. (2015). The transcriptional landscape of age in human peripheral blood. Nat Commun. 6;
- Jason G. Fleischer, Roberta Schulte, Hsiao H. Tsai, Swati Tyagi, Arkaitz Ibarra, et. al.. (2018). Predicting age from the transcriptome of human dermal fibroblasts. Genome Biol. 19;
- Adiv A. Johnson, Maxim N. Shokhirev, Tony Wyss-Coray, Benoit Lehallier. (2020). Systematic review and analysis of human proteomics aging studies unveils a novel proteomic aging clock and identifies key processes that change with age. Ageing Research Reviews. 60, 101070;
- Mariona Jové, Ianire Maté, Alba Naudí, Natalia Mota-Martorell, Manuel Portero-Otín, et. al.. (2016). Human Aging Is a Metabolome-related Matter of Gender. GERONA. 71, 578-585;
- Johannes Hertel, Nele Friedrich, Katharina Wittfeld, Maik Pietzner, Kathrin Budde, et. al.. (2016). Measuring Biological Age via Metabonomics: The Metabolic Age Score. J. Proteome Res.. 15, 400-410;
- Elena Biagi, Simone Rampelli, Silvia Turroni, Sara Quercia, Marco Candela, Patrizia Brigidi. (2017). The gut microbiota of centenarians: Signatures of longevity in the gut microbiota profile. Mechanisms of Ageing and Development. 165, 180-184;
- Fedor Galkin, Polina Mamoshina, Alex Aliper, Evgeny Putin, Vladimir Moskalev, et. al.. (2020). Human Gut Microbiome Aging Clock Based on Taxonomic Profiling and Deep Learning. iScience. 23, 101199;
- Власов В.В. (1996). Структуры медицинских исследований. РМЖ. 7;
- STORM над PALMами: как современная микроскопия высокого разрешения позволила посмотреть на одиночные молекулы.







