«Швейцарский нож» вирусной армии: разгадан секрет обратной транскриптазы
12 мая 2008
«Швейцарский нож» вирусной армии: разгадан секрет обратной транскриптазы
- 4606
- 1
- 2
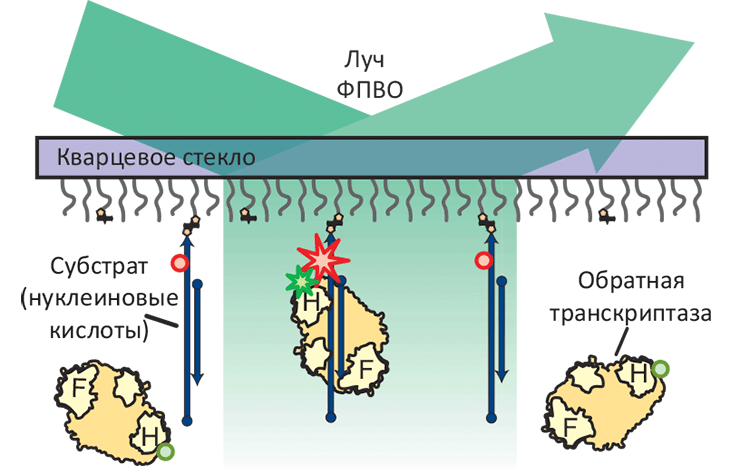
Схема эксперимента, основанного на измерении резонансного переноса энергии флуоресценции (FRET) и позволяющего определить ориентацию одиночной молекулы обратной транскриптазы (ОТ). Субстраты ОТ, представляющие собой различные гетеродуплексы РНК и ДНК, ковалентно присоединены к кварцевой подложке и помечены флуоресцентным красителем Cy5 (красные звезда и круги); РНКазный домен ОТ (H-домен) помечен красителем Cy3 (зелёные звезда и круги). В такой схеме, измерение флуоресценции полного внутреннего отражения (ФПВО) позволяет следить за ориентацией молекулы ОТ в пространстве. Звёзды означают излучающую молекулу флуорофора, круги — неизлучающую.
-
Автор
-
Редакторы
Обратная транскриптаза — фермент, представляющий самую сущность ретровирусов, таких как ВИЧ. Он обладает двумя различными каталитическими активностями и имеет сродство к нескольким формам нуклеиновых кислот, — гетеродуплексам из ДНК и РНК. С помощью оригинальной методики, позволяющей следить за ориентацией одной-единственной молекулы этого фермента, учёные описали поведение обратной транскриптазы и «засекли» его переключение между разными формами.
Для саморепликации в клетке-«хозяине» ретровирусы, такие как ВИЧ, должны создать двуцепочечную ДНК-копию своего одноцепочечного РНК-генома. В результате этого элегантного, хотя зачастую и смертельно опасного процесса, один из важнейших ретровирусных ферментов — обратная транскриптаза (ОТ), или ревертаза, — синтезирует цепочку длиной ≈20 000 нуклеотидных пар, а поток генетической информации при этом противоположен «общепринятому» (ДНК→РНК). ОТ является излюбленной мишенью для разработчиков противовирусных препаратов — как минимум половина выпускаемых средств, нацеленных на излечение СПИДа, направлена именно на этот белок. Процесс обратной транскрипции весьма сложен — ведь ферменту приходится работать с несколькими различными формами одно- и двуцепочечных РНК и/или ДНК, различать их между собой и «переключаться» в нужный режим — дело непростое. И вот в журнале Nature за авторством Аббонданзиери (Abbondanzieri) и его коллег вышла работа, описывающая, как обратной транскриптазе удаётся различить между собой различные субстраты на промежуточных этапах обратной транскрипции [1].
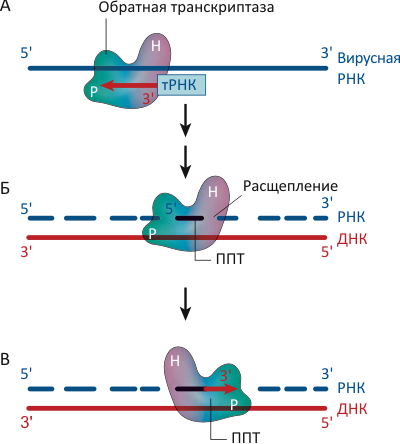
Рисунок 1. Обратная транскриптаза (ОТ) вируса иммунодефицита человека (ВИЧ) преобразует одноцепочечный РНК-геном вируса в двуцепочечную молекулу ДНК. А. Для синтеза первой («минусовой») цепи ДНК фермент использует в качестве праймера молекулу транспортной РНК (тРНК) из клетки «хозяина», присоединяясь к 3′-концу тРНК полимеразным (P) доменом. Б. После того, как «минусовая» цепь ДНК уже синтезирована, ОТ расщепляет РНК-«матрицу», связываясь с дуплексом РНКазным (H, от термина RNase H) доменом, оставляя тем не менее не тронутыми полипуриновые тракты (ППТ). В. Для синтеза второй («плюсовой») цепи ДНК ОТ использует оставшиеся ППТ в качестве праймеров, опять соединяясь с дуплексом в полимеразном режиме.
Обратная транскриптаза обладает двумя различными ферментативными активностями: ДНК-полимеразной, «копируя» РНК- или ДНК-шаблон в комплементарную ДНК-цепь, и активностью РНКазы H, катализируя расщепление цепи РНК в составе РНК/ДНК дуплекса на маленькие фрагменты — после того, как она уже послужила матрицей для синтеза первой («минусовой») цепи ДНК (см. рис. 1). Однако некоторые фрагменты РНК — называемые полипуриновыми трактами (ППТ) — фермент «пропускает», не допуская их деградации. Последовательность и структура этих участков довольно необычна, что, видимо, и позволяет им остаться незамеченными белками семейства РНКаз H [2].
Как и другие ДНК-полимеразы, ОТ начинает синтез ДНК с праймеров — коротких фрагментов нуклеиновых кислот, которые образуют как бы «затравку» для синтеза парной цепи. Для синтеза «минусовой» цепи ДНК ОТ использует в качестве праймера присутствующие в заражённых клетках молекулы транспортной РНК (тРНК). Для образования второй («плюсовой»), комплементарной первой, цепи фермент использует ППТ-фрагменты, оставшиеся от расщепления РНК-«матрицы» после работы ОТ в РНКазном режиме (рис. 1б).
Детали взаимодействий обратной транскриптазы ВИЧа с различными субстратами на молекулярном уровне были выяснены ранее путём анализа структур ОТ в комплексе с различными дуплексами нуклеиновых кислот — ДНК/ДНК и РНК/ДНК [2], [3]. Также было изучено поведение фермента, связывающегося с комплексом ДНК/ДНК в присутствии дезоксирибонуклеотидов — «строительных блоков» ДНК, выстраиваемых ДНК-полимеразой в комплементарную цепочку и сшиваемых между собой [4]. В результате этих структурных и биохимических экспериментов удалось показать, что ОТ взаимодействует как с обеими молекулами нуклеиновой кислоты в составе дуплекса, так и со «свободными» нуклеотидами; при этом её полимеразный (P) сайт связывает 3′-конец праймера. В режиме же расщепления РНК фермент взаимодействует с комплексом РНК/ДНК, и его H-каталитический домен связывается с цепью РНК [2] (рис. 1). Однако невыясненным оставалось то, как обратная транскриптаза отличает ППТ-фрагменты цепи РНК в качестве праймера для синтеза «плюсовой» ДНК-цепочки от остальной последовательности РНК, уже использованной в качестве матрицы, и расщепляемой в РНКазном режиме.
В статье Аббонданзиери [1] приведены удивительные данные о механизмах взаимодействия обратной транскриптазы с различными нуклеиновыми кислотами и их дуплексами. Для определения ориентации одиночной (!) молекулы ОТ по отношению к связанному РНК/ДНК гибриду, учёные использовали измерения резонансного переноса энергии флуоресценции (FRET) между различными молекулами-флуорофорами, которыми помечали как фермент, так и субстрат (см. картинку в заглавии). В отличие от типичных биохимических экспериментов, изучающих популяции молекул и их комплексов, спектроскопические методики вроде FRET позволяют непосредственно наблюдать за одиночными молекулярными событиями в реальном времени. Для анализа FRET две интересующие исследователей молекулы — в данном случае, обратную транскриптазу и нуклеиновую кислоту, — помечают флуоресцирующими химическими группами, миграция флуоресцентной энергии между которыми зависит от расстояния и может использоваться для оценки межмолекулярных взаимодействий.
Исследователи обнаружили, что если обратная транскриптаза связывается с дуплексом, состоящим из сравнительно длинной (≈50 нуклеотидов) цепи ДНК (соответствующей «минусовой» цепи), и довольно короткого сегмента РНК (соответствующего остатку «матрицы»), фермент переходит в РНКазный режим. При этом полимеразный домен остаётся не задействованным, не связывая свободный 3′-конец РНК-сегмента. Однако если молекула РНК представляет собой полипуриновый тракт (ППТ), Р-домен активизируется и связывается с 3′-концом ППТ-сегмента в готовности удлинять его, синтезируя «плюсовую» цепь ДНК (рис. 2).
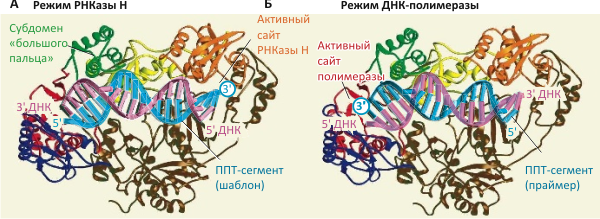
Рисунок 2. Будучи частью РНК вирусного генома, полипуриновый тракт (ППТ) служит шаблоном для синтеза «минусовой» цепи ДНК. А. До расщепления РНК ППТ-сегментов обратная транскриптаза связывается с последовательностью ППТ (синим цветом) в режиме РНКазы H (т.е. H-домен ОТ находится в непосредственной близи 3′-конца ППТ, показанного кругом), предотвращая связывание P-домена и преждевременный синтез ДНК. Б. Когда вся РНК по соседству с ППТ «выщеплена», позволяя ППТ-последовательности выступать в роли праймера, ОТ связывается с дуплексом в полимеразном режиме (когда P-домен оказывается вблизи 3′-конца ППТ), чтобы запустить синтез «плюсовой» цепи. Видимо, обратная транскриптаза ВИЧа спонтанно «переключается» между этими режимами связывания и, соответственно, функциями.
В работе также показано, что в присутствии свободных нуклеотидов доля молекул ОТ, связанных с ППТ-праймером в полимеразном режиме, возрастает. Более того, если в качестве праймера для «плюсовой» цепи выступает ДНК-последовательность, подавляющая доля молекул обратной транскриптазы «переключается» в режим полимеразы. Эти результаты наглядно показывают, что специфическое строение ППТ-сегментов не столько защищает их от расщепления, сколько образует эффективный праймер для полимеризации второй цепочки ДНК.
Что особенно интересно, обратная транскриптаза может, по видимому, «перескакивать» из одной ориентации по отношению к дуплексу в другую — и это без необходимости диссоциации комплекса. Этот переход оказался довольно неожиданным, особенно если учитывать сложную картину межмолекулярных взаимодействий фермент–субстрат. Кроме того, учёным удалось выяснить, что свободные нуклеотиды могут связываться с ОТ в комплексе с дуплексом, где праймер замещен химически-модифицированным «терминирующим» олигонуклеотидом, не способным к элонгации, стабилизируя «полимеразную» ориентацию фермента в составе комплекса. Образование таких «тупиковых» комплексов уже описывалось ранее [5] в контексте затруднения разблокировки терминирующих олигонуклеотидов и превращения их в обычные праймеры.
В работе было сделано и ещё одно важное наблюдение: невирапин (nevirapine) — противовирусный препарат, связывающийся в основании субдомена «большого пальца» обратной транскриптазы ВИЧа (рис. 2а) и ингибирующий фермент, — увеличивает частоту переходов ОТ между «полимеразной» и «РНКазной» ориентациями фермента в составе комплекса с гетеродуплексом РНК/ДНК. Это взаимодействие, меняющее сродство разных форм фермента к субстрату, может лежать в основе механизма действия подобных препаратов, — что уже, впрочем, обсуждалось и ранее [6], [7].
Работа Аббонданзиери наглядно показывает необходимость понимания того, как ориентационная динамика обратной транскриптазы связана с активностью этого белкá. Их открытие, кроме того, ставит вопрос, не возникает ли примеров подобной «молекулярной акробатики» на более ранних этапах работы ОТ — при связывании тРНК в качестве праймера для синтеза «минусовой» ДНК-цепи? Другой вопрос — для всех ли ферментов, обладающих более чем одной функцией, характерно такое ориентационное поведение? В качестве примеров подобных белков можно привести ДНК-полимеразу, которая, помимо своей основной функции, имеет и неполимеразную активность, или другие ферменты, «должности» которых связаны с нуклеиновыми кислотами, — хеликазы, лигазы, топоизомеразы, интегразы и эндонуклеазы рестрикции. Какими бы не были ответы на эти вопросы, относительно обратной транскриптазы уже понятно, что этот фермент оказался намного более «гибким» в работе с нуклеиновыми кислотами, чем можно было предположить ранее.
Литература
- Elio A. Abbondanzieri, Gregory Bokinsky, Jason W. Rausch, Jennifer X. Zhang, Stuart F. J. Le Grice, Xiaowei Zhuang. (2008). Dynamic binding orientations direct activity of HIV reverse transcriptase. Nature. 453, 184-189;
- Stefan G. Sarafianos, Kalyan Das, Chris Tantillo, Arthur D. Clark, Jianping Ding, et. al.. (2001). Crystal structure of HIV-1 reverse transcriptase in complex with a polypurine tract RNA:DNA. EMBO J. 20, 1449-1461;
- A. Jacobo-Molina, J. Ding, R. G. Nanni, A. D. Clark, X. Lu, et. al.. (1993). Crystal structure of human immunodeficiency virus type 1 reverse transcriptase complexed with double-stranded DNA at 3.0 A resolution shows bent DNA.. Proceedings of the National Academy of Sciences. 90, 6320-6324;
- H. Huang. (1998). Structure of a Covalently Trapped Catalytic Complex of HIV-1 Reverse Transcriptase: Implications for Drug Resistance. Science. 282, 1669-1675;
- Peter R Meyer, Suzanne E Matsuura, A.Mohsin Mian, Antero G So, Walter A Scott. (1999). A Mechanism of AZT Resistance. Molecular Cell. 4, 35-43;
- Chockalingam Palaniappan, Jin K. Kim, Michele Wisniewski, Philip J. Fay, Robert A. Bambara. (1998). Control of Initiation of Viral Plus Strand DNA Synthesis by HIV Reverse Transcriptase. J. Biol. Chem.. 273, 3808-3816;
- Jay A. Grobler, Geetha Dornadula, Michele R. Rice, Amy L. Simcoe, Daria J. Hazuda, Michael D. Miller. (2007). HIV-1 Reverse Transcriptase Plus-strand Initiation Exhibits Preferential Sensitivity to Non-nucleoside Reverse Transcriptase Inhibitorsin Vitro. J. Biol. Chem.. 282, 8005-8010;
- Eddy Arnold, Stefan G. Sarafianos. (2008). Molecular biology: An HIV secret uncovered. Nature. 453, 169-170.