«Следствие ведут...»: изучаем новую белковую мишень в иммуноонкологии
29 ноября 2017
«Следствие ведут...»: изучаем новую белковую мишень в иммуноонкологии
- 887
- 0
- 2
Антитела уничтожают злокачественные опухоли.
сайт astrazeneca.ru
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Иммунитет — вещь непростая. Он обеспечивает нашу защиту от вторжения всевозможных вирусов и бактерий. В то же время иммунитет порой становится нашим врагом, начиная атаковать собственный организм. Тогда говорят о развитии аутоиммунных заболеваний. К счастью, это случается не так уж и часто — всего в 5% случаев [1]. Такая вот противоречивая натура. Но, как известно, запретный плод сладок, а чем сложнее явление, тем больше хочется найти заветную разгадку. Не хотите попробовать «приручить» иммунную систему?
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В этой статье я бы хотела познакомить читателя со своей исследовательской работой, которую проводила в лаборатории структурной биоинформатики НИУ ИТМО, рассказать о такой интереснейшей области, как иммуноонкология, а также осветить наиболее любопытную, на мой взгляд, часть исследования — эксперимент по молекулярной динамике исследуемой белковой мишени.
Иммуноонкология, или Попытка использовать иммунитет против рака
Иммунноонкология как наука возникла сравнительно недавно. Первые разработки в этой области осуществили в 80-х годах прошлого века [2]. Как можно догадаться из названия, эта наука ставит своей задачей борьбу со злокачественными опухолями, или раком, посредством собственных защитных сил организма — иммунной системы.
Как же это происходит? Терапевтическими агентами в области иммунноонкологии являются так называемые ингибиторы контрольных точек иммунного ответа или иммуночекпоинт-ингибиторы [3]. Контрольными точками называют молекулы, которые способны влиять на передачу различных сигналов внутри организма, усиливая их или же, наоборот, выключая. Воздействуя на контрольные точки иммунной системы, можно попытаться добиться того, чтобы иммунитет работал так, как мы сами того пожелаем.
Но этот процесс не так прост, как кажется, поскольку для того, чтобы тот или иной сигнал, например, был усилен, необходимо наличие так называемых костимулирующих сигналов. Костимулирующие сигналы — это окружающие клетку сигналы-«соседи», которые подсказывают ей, что все происходит правильно, и придают «уверенности в себе». Например, рецепторы Т-лимфоцитов (TCR) могут взаимодействовать со специфическими белковыми молекулами главного комплекса гистосовместимости (MHC), которые находятся на поверхности антигенпрезентирующих клеток (APC). Антигенпрезентирующими называют клетки, которые показывают Т-лимфоцитам чужеродные молекулы — антигены, — с которыми и нужно бороться (рис. 1а). Однако этого недостаточно, чтобы активировать Т-лимфоциты — необходим дополнительный сигнал. В данном случае таким сигналом служит взаимодействие молекулы CD28 на поверхности Т-лимфоцита с молекулой B7 на поверхности APC. Тогда и только тогда лимфоциты смогут уничтожать антигены, на которые им указывают APC [1].
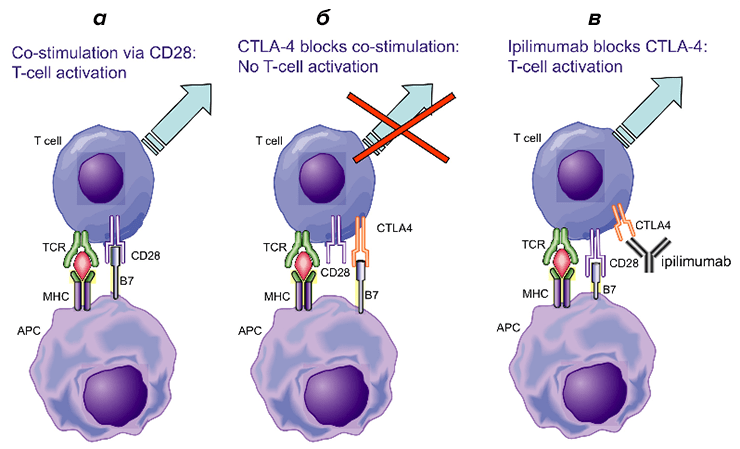
Рисунок 1. Зависимость активации Т-лимфоцитов от типа сигналов, которые получает клетка. а — Костимулирующие сигналы. б — Ингибирующие сигналы. в — Под действием ипилимумаба (блокируется ингибирующий сигнал и включается стимулирующий). Условные обозначения: APC — антигенпрезентирующая клетка; CTLA-4 — антиген 4 цитотоксических Т-лимфоцитов; MHC — главный комплекс гистосовместимости; TCR — рецептор Т-клетки.
Аналогичный механизм справедлив и для подавления тех или иных сигналов: вместо CD28 на поверхности Т-лимфоцита может присутствовать другая молекула — CTLA-4, которая может связываться с молекулой B7 по такому же принципу, как и CD28. Однако такое связывание будет говорить Т-лимфоциту о том, что уничтожать найденный антиген вовсе не нужно (рис. 1б). Соответственно, в зависимости от того, какие дополнительные сигналы, стимулирующие или ингибирующие, преобладают, такая судьба и будет ожидать антиген, попавший в организм.
Опасность состоит в том, что вся эта система работает идеально до тех пор, пока в организме не начинают происходить злокачественные трансформации. Когда это случается, работа таких контрольных точек, как CTLA-4, приводит к тому, что иммунные клетки просто перестают узнавать клетки опухолевые. К тому же последние научились разнообразным механизмам обхода иммунитета и использованию системы контрольных точек в своих целях [4].
Исходя из этого, становится понятной мечта о «ручном» иммунитете, а также идея о том, как именно работают препараты из области иммуноонкологии. Как правило, они представляют собой антитела к ингибиторам контрольных точек иммунного ответа (как CTLA-4), задача которых — не дать ингибиторам осуществлять свою основную задачу. Пример — ипилимумаб (рис. 1в). Тогда стимулирующие сигналы снова вступают в игру, и Т-лимфоциты могут продолжать свою работу, в том числе и в отношении злокачественных клеток.
Белок CIS — новая мишень в иммуноонкологии
Разумеется, CTLA-4 не единственный пример контрольных точек иммунного ответа. Если внимательно изучить литературные данные, можно узнать о существовании такого белка, как CIS, который регулирует сигнальный путь JAK/STAT, отвечающий в том числе за выработку различных цитокинов (в частности, интерлейкин IL-15). Цитокины — это медиаторы (посредники), запускающие синтез иммунных клеток [5]. Только в данном случае задействованы не Т-лимфоциты, а другие иммунные клетки — естественные киллеры. Их козырь — вычисление и устранение опухолевых клеток [6] — настоящие наемные убийцы! Белок CIS является контрольной иммунной точкой в рассматриваемом сигнальном пути, так как он способен блокировать передачу сигналов и тем самым подавлять выработку IL-15.
Антитела к ингибиторам контрольных точек иммунного ответа, например, пембролизумаб, сейчас довольно успешно выходят на стадию клинических испытаний — неотъемлемого этапа разработки лекарства, когда оно проходит испытание на эффективность и безопасность на человеке [7]. А некоторые из этих антител уже присутствуют на рынке фармпрепаратов (как упомянутый выше ипилимумаб). Но несмотря на эти успехи, существуют и определенные проблемы, связанные непосредственно с белковой природой антител, а именно их высокой иммунногенностью, сложностью в разработке, а также повышенными требованиями к хранению [8]. Именно поэтому в ходе исследования мы решили сосредоточиться на разработке классической малой молекулы в этой области. К тому же к применению этого подхода располагает и строение мишени, как мы увидим далее.
Как и следует из названия лаборатории, работали мы с использованием методов биоинформатики и структурной биологии, пытаясь смоделировать структуру мишени и ее поведение в организме, а также найти фрагменты органических соединений, из которых было бы возможно получить низкомолекулярный ингибитор.
Как вы, наверное, уже начали догадываться, сама идея схожа с приведенным выше примером. Заблокировав работу CIS с помощью малой молекулы, по аналогии с блокадой CTLA-4, мы позволим сигналам передаваться по пути JAK/STAT. А значит, будут вырабатываться IL-15, а затем продолжится активное деление естественных киллеров. Экспериментально такая идея была проверена путем удаления генов, отвечающих за синтез белка CIS — мыши, у которых отсутствовал этот ген, демонстрировали высокую устойчивость к таким видам рака, как, например, меланома [5].
Что мы можем смоделировать in silico, или Литобзор, экспериментальная часть и результаты в одном флаконе
В рамках данной главы я предлагаю сосредоточиться на одном из наиболее интересных аспектов исследования — анализе данных о функционировании мишени, а также на самом эксперименте по молекулярной динамике. А чтобы получить общее представление о методах компьютерного конструирования лекарств и дизайне такого типа исследования, рекомендую прочитать статью «Драг-дизайн: как в современном мире создаются новые лекарства» [9].
Давайте немного порассуждаем. Итак, допустим, мы знаем, что белок CIS — это некая контрольная точка, заблокировав которую, вероятно, мы получим желаемый результат. Но важно понять, как именно работает белок, чтобы обрести и понимание того, что именно нужно (или не нужно) учитывать при разработке молекулы-ингибитора к данной мишени.
В недавних исследованиях группе ученых из Австралии удалось установить, что в естественных киллерах белок CIS работает так: он не дает активироваться ключевому компоненту пути JAK/STAT, а именно JAK-киназе. С одной стороны, он присоединяется к фосфорилированной аминокислоте — тирозину, расположенному на JAK-киназе, что не позволяет последней перейти в активированное состояние. С другой — он также способен напрямую участвовать в уничтожении JAK-киназы в протеасоме (своеобразная мусорная корзина для клеточных компонентов). Происходит это при помощи еще одного белка — элонгина B/C (рис. 2) [10], [11]. С этим белком все тоже не так очевидно. Существуют данные о том, что наличие или отсутствие свободного элонгина в клетке влияет на возможность присоединения CIS к фосфорилированному тирозину (pTyr) на JAK-киназе [5], [10]. Это для нас критически важно, ведь наша задача — разработать молекулу, аналогичную pTyr по своим свойствам, чтобы она связалась с CIS, заблокировав его работу. Но тогда, если элонгин влияет на присоединение тирозина, то, вероятно, он будет как-то влиять и на возможность присоединения к разработанной молекулы?
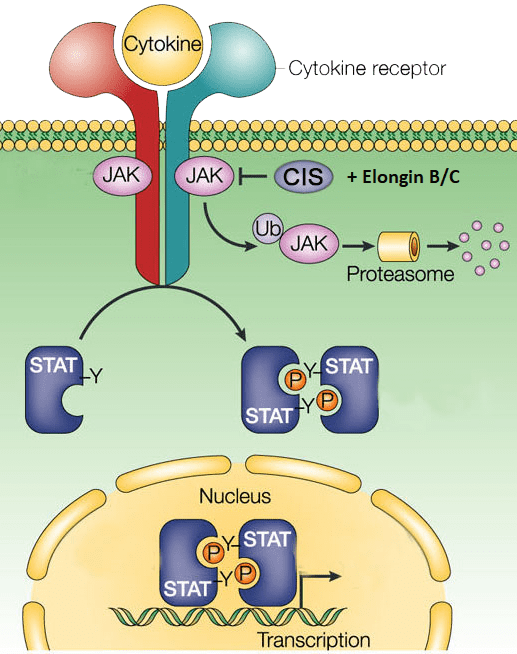
Рисунок 2. Схема сигнального пути JAK/STAT и место воздействия белка CIS.
Как разобраться с этой гипотезой в рамках биоинформатических методов? Предположим, что если элонгин играет некую роль в присоединении CIS к pTyr, то, возможно, имеет место стабилизация консервативного для всех белков семейства SOCS SH2-домена. SH2-домен — это участок, состоящий из примерно 100 аминокислот, которые образуют 2 альфа-спирали и антипараллельный бета-слой (рис. 3). Наличие этого участка дает белку возможность присоединяться к фосфорилированному тирозину, расположенному на других белках, что и происходит в случае CIS.
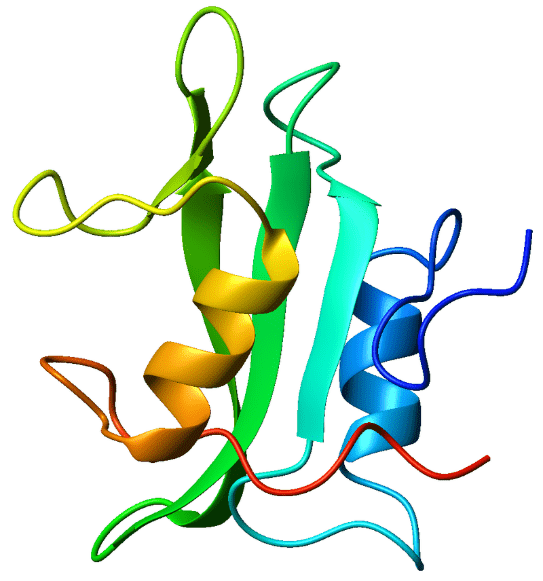
Рисунок 3. Структура SH2-домена.
Сформулировав гипотезу таким образом, можно провести эксперимент по молекулярной динамике, задачей которой является симуляция поведения белковой молекулы (или целого комплекса) в организме. Конечно, в рамках компьютерного эксперимента делают ряд допущений, например, исследуемую молекулу помещают в кубик воды, как преобладающего компонента в цитозоле, где и функционирует CIS. Симуляцию проводят в течение ограниченного времени: чем оно больше, тем, вполне ожидаемо, будут более достоверные результаты. Однако этот параметр ограничивается вычислительными мощностями и наличием/отсутствием графического процессора (в нашем случае процесс длился 100 наносекунд).
Давайте перейдем к наиболее интересной части эксперимента, а именно результатам, и узнаем, что мы можем выяснить в ходе такого моделирования. Рассмотрим график зависимости среднеквадратического отклонения (RMSD, Å) от времени симуляции (нс) (рис. 4).
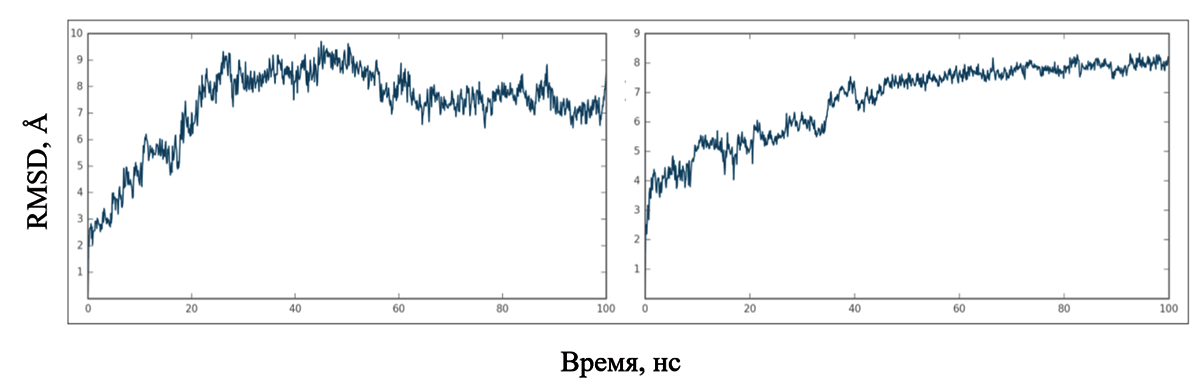
Рисунок 4. Зависимость RMSD от времени симуляции (нс). Слева результат для комплекса CIS—элонгин В/С; справа — для белка CIS.
скриншот из программы Maestro, Schrodinger Inc.
Выражаясь простым языком, график говорит нам о том, приобрела ли исследуемая молекула стабильность за время симуляции или нет. Как можно заключить из графиков, как CIS, так и его комплекс с элонгином в конце концов достигают определенного плато. Однако даже невооруженным глазом видно, что CIS сам по себе выходит на постоянную несколько раньше, да и плато выглядит ровнее — меньше колебаний вокруг установившегося значения. А это значит, что с одной стороны, 100 наносекунд вполне достаточно, чтобы увидеть какие-либо изменения, происходящие с данными молекулами, а с другой — можно сделать вывод о том, что комплекс менее стабилен, чем сам белок.
Дополним эту картину еще одним графиком — зависимостью среднеквадратической флуктуации (RMSF, Å) от номера конкретной аминокислоты в молекуле белка (или комплекса), изображенной на рис. 5.
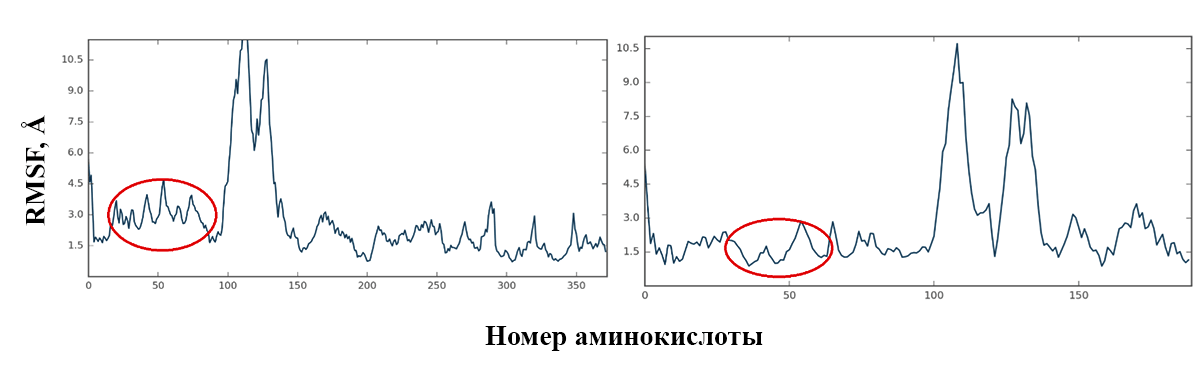
Рисунок 5. Зависимость RMSF от номера той или иной аминокислоты. Красным выделены регионы, соответствующие SH2-домену. Слева результат для комплекса CIS—элонгин В/С; справа — для белка CIS.
скриншот из программы Maestro, Schrodinger Inc.
Здесь мы подбираемся вплотную к поставленной гипотезе — найдем аминокислоты, принадлежащие SH2-домену в обоих случаях, и сравним подвижность (флуктуацию) в каждом из них. И снова мы видим, что подвижность достаточно сильно различается (взгляните на максимальные значения в пределах выделенных участков по оси RMSF на каждом графике). Причем, когда CIS находится вне комплекса, эта подвижность намного меньше — значит, стабилизации данного участка при образовании комплекса с элонгином не происходит.
Таким образом, оба графика не противоречат друг другу и так или иначе опровергают гипотезу, выдвинутую в начале эксперимента. Конечно, это не означает, что элонгин никак не влияет на присоединение pTyr, и что литература ошибается — ни в коем случае! Существует множество механизмов, по которым это может происходить — и мы проверили один из них. По крайней мере, теперь мы знаем, что в дальнейшем сможем оперировать только структурой белка CIS вне каких-либо комплексов, ведь образование такового не стабилизирует белок и не повлияет на разработку молекулы-ингибитора.
Вкратце о других методах
Трехмерную структуру белка CIS, которая использовалась в том числе и в опыте по молекулярной динамике (экспериментально она, к сожалению, не установлена), мы получили с помощью метода гомологичного моделирования, о котором (как и о процессе фолдинга белка de novo в целом) можно подробно узнать из статьи «Торжество компьютерных методов: предсказание строения белков» [12].
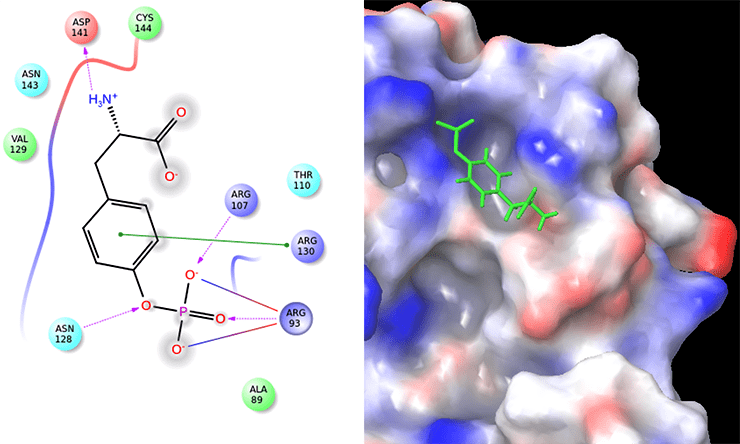
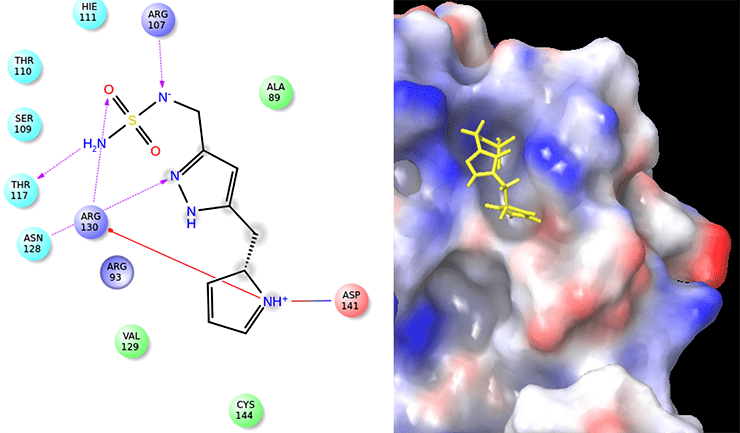
Для разработки прототипа низкомолекулярного ингибитора использовали молекулярный докинг небольшой библиотеки простейших органических соединений в заранее определенную область связывания. Молекулярный докинг (от англ. dock — стыковка) — это один из методов компьютерного моделирования, который позволяет предсказать взаимовыгодное положение двух молекул относительно друг друга для образования устойчивого комплекса. После проведения докинга наиболее удачные фрагменты этих соединений скомбинировали между собой и провели повторный докинг. О том, по какому принципу подбираются и оцениваются те или иные фрагменты, можно прочитать в статье «Виртуальные тропы реальных лекарств» [13]. На рисунках 6 и 7 показано сравнение расположения одного из соединений-лидеров и самого фосфорилированного тирозина (он взаимодействует с CIS в естественных условиях) внутри кармана связывания, а также сравнение аминокислот, участвующих во взаимодействии с указанной областью на поверхности белка.
Конечно, процесс анализа библиотеки для докинга можно было автоматизировать, что и станет следующим этапом работы. Для меня как начинающего исследователя в этой области было интересно и важно проделать все этапы работы самостоятельно, чтобы понять логику исследования in silico, с чем, надеюсь, у меня получилось познакомить, и, главное, заинтересовать читателя.
В результате такой комплексной работы мы получили первоначальные данные и наработки относительно функционирования малоизученной мишени — белка CIS — и продумали, какого типа низкомолекулярные ингибиторы смогут эффективно блокировать его работу. Например, они, вероятнее всего, должны содержать ароматические кольца для формирования устойчивых пи-связей, а также сульфамидную группу для улучшения растворимости.
Мы в ответе за тех, кого приручили
В завершение хотелось бы отметить еще одну, очень важную мысль, которая до этого никак не прозвучала в статье. Полагаю, читатель уже неоднократно задал себе вопрос о том, насколько вообще рациональна такая терапия?
Вопрос справедливый, ведь когда ученые попытались предложить терапию с помощью IL-15, которые бы вводились непосредственно в организм, от этой идеи пришлось довольно быстро отказаться, так как возникали достаточно агрессивные токсические реакции [14]. К тому же, разве не достаточное количество методов лечения злокачественных опухолей сейчас существует?
На самом деле все эти замечания абсолютно верны, и, кроме того, существует риск возникновения аутоиммунных реакций, даже если интерлейкины не будут вводиться напрямую, а будут активно вырабатываться собственным организмом. Поэтому очень важно понимать, насколько ответственной является разработка такого соединения-ингибитора. Безусловно, идеальным вариантом применения иммунотерапии рака является ее комбинация с другими методами лечения [14].
Главное — не забывать о том, что, нарушая работу того или иного сигнального пути, мы неизбежно влияем на какие-то другие процессы в организме, поскольку абсолютно все взаимосвязано между собой. Поэтому чем детальнее и точнее продумано исследование, изучена литература, проведены предварительные испытания (в том числе и моделирование, которое также позволяет ответить на ряд важных вопросов), тем больше шансов получить действительно стоящую разработку, которая сможет спасти не одну жизнь.
Литература
- Иммунитет: борьба с чужими и… своими;
- J. Couzin-Frankel. (2013). Cancer Immunotherapy. Science. 342, 1432-1433;
- Drew M. Pardoll. (2012). The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 12, 252-264;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Rebecca B Delconte, Tatiana B Kolesnik, Laura F Dagley, Jai Rautela, Wei Shi, et. al.. (2016). CIS is a potent checkpoint in NK cell–mediated tumor immunity. Nat Immunol. 17, 816-824;
- Eric Vivier, Elena Tomasello, Myriam Baratin, Thierry Walzer, Sophie Ugolini. (2008). Functions of natural killer cells. Nat Immunol. 9, 503-510;
- Родионова А. (2017). MSD набирает пациантов для КИ нового иммуноонкологического препарата. Vademecum;
- Jerry L. Adams, James Smothers, Roopa Srinivasan, Axel Hoos. (2015). Big opportunities for small molecules in immuno-oncology. Nat Rev Drug Discov. 14, 603-622;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Philip J. Jensik, Lydia A. Arbogast. (2015). Regulation of cytokine-inducible SH2-containing protein (CIS) by ubiquitination and Elongin B/C interaction. Molecular and Cellular Endocrinology. 401, 130-141;
- Ke Shuai, Bin Liu. (2003). Regulation of JAK–STAT signalling in the immune system. Nat Rev Immunol. 3, 900-911;
- Торжество компьютерных методов: предсказание строения белков;
- Виртуальные тропы реальных лекарств;
- Theofanis Floros, Ahmad A. Tarhini. (2015). Anticancer Cytokines: Biology and Clinical Effects of Interferon-α2, Interleukin (IL)-2, IL-15, IL-21, and IL-12. Seminars in Oncology. 42, 539-548.