
Следующая после болезни Альцгеймера: описана новая форма деменции
25 июня 2019
Следующая после болезни Альцгеймера: описана новая форма деменции
- 2035
- 0
- 7
Описанный в статье вид деменции — LATE-энцефалопатия — не зря так назван. Он поражает людей в возрасте 80 лет и старше. По предположению ученых, вклад LATE-энцефалопатии в заболеваемость деменцией может быть серьезно недооценен.
-
Автор
-
Редактор
Рабочая группа по LATE-энцефалопатии выпустила отчет, в котором обобщила клинические, генетические и нейровизуализационные признаки этой болезни. LATE-энцефалопатия известна с середины 2000-х годов, но только сейчас накопленные сведения позволили с уверенностью выделить ее в отдельное заболевание. В этом материале «Биомолекула» рассказывает о содержании отчета.
Что такое LATE-энцефалопатия?
LATE-энцефалопатия (limbic-predominant age-related TDP-43 encephalopathy, LATE; связанная с возрастом TDP-43-энцефалопатия с преимущественным поражением гиппокампа) — это поражение головного мозга, связанное с накоплением белка TDP-43 в нейронах и глиальных клетках. В норме этот белок расположен в ядрах клеток. Он регулирует трансляцию и транскрипцию многих белков в центральной нервной системе, в частности, тех, которые вовлечены в процессы аутофагии и очистки клеток от поврежденных элементов. Кроме этого, TDP-43 участвует в организации движения молекул внутри аксона. При LATE-энцефалопатии TDP-43 фосфорилируется, что приводит к образованию агрегатов белка [1]. Массивы измененного белка накапливаются в цитоплазме клеток и начинают нарушать их работу. Кроме этого, скопления протеина обнаруживают при болезни Альцгеймера (БА) [2] и лобно-височной деменции (ЛВД).
Выделение учеными LATE-энцефалопатии в отдельное заболевание стало ответом на сложности, возникшие с БА. Существует доказанная корреляция между когнитивным снижением у пожилых людей и нейродегенеративными изменениями по альцгеймеровскому типу (накоплением бета-амилоида [3] и тау-белка в нервных клетках). Чем сильнее были эти изменения, тем выраженнее нарушались когнитивные функции. При более внимательном взгляде на проблему оказалось, что у людей в возрасте старше 80 лет такая связь прослеживается не настолько явно, и это требовало объяснения. «Альцгемейровские» изменения не соответствовали когнитивному снижению: они оказались менее выраженными, чем ожидалось при таких когнитивных нарушениях. В итоге сложилось впечатление, что параллельно с «альцгеймеровскими» процессами в нервной ткани проходят еще какие-то, но ученые не могли их зафиксировать.
Ответ на вопрос пришел из исследований уже известных неврологических заболеваний — бокового амиотрофического склероза (БАС — заболевания, которым страдал Стивен Хокинг) и ЛВД. В 2006 году описали белок TDP-43, который в фосфорилированном виде играет большую роль в патогенезе этих расстройств [4]. Через год обнаружили, что фосфорилированный TDP-43 накапливается в клетках головного мозга у людей старше 80 лет, которые не страдают ни БАС, ни ЛВД, но при этом обнаруживают клиническую картину деменции, схожую с БА [5]. У таких пациентов значительно ухудшалась память: в первую очередь эпизодическая (кратковременная). Научные наблюдения следующих лет позволили выделить когнитивное снижение при накоплении TDP-43 в отдельное заболевание с рядом специфических черт.
Биология новой деменции
В ходе исследований обнаружили пять генов, которые связаны с возникновением LATE-энцефалопатии. При этом нейродегенеративном заболевании зафиксированы мутации в генах GRN (на 17-й хромосоме) и TMEM106B (на 7-й хромосоме) [6]. Мутации в этих же генах сопровождают лобно-височную деменцию и склероз гиппокампа. О последнем состоянии мы еще поговорим, но сейчас важно обратить внимание на то, что на генетическом уровне существует пересечение между ЛВД и LATE-энцефалопатией. Мы уже знаем, что между ними есть общность в виде отложений фосфорилированного TDP-43, но теперь мы видим и генетическую связь этих заболеваний. Кроме упомянутых двух генов с развитием LATE-энцефалопатии связаны гены ABCC9 (на 12-й хромосоме), KCNMB2 (на 3-й хромосоме) и APOE (на 19-й хромосоме) [6]. Последний хорошо известен тем, что увеличивает риск развития БА.
Основной морфологический субстрат новой деменции — это накопление фосфорилированного TDP-43. Отложение протеина происходит во многих отделах головного мозга. Агрегаты TDP-43 обнаруживают в лимбической системе, обонятельных луковицах, коре головного мозга, базальных ганглиях и стволе (рис. 1) [7].
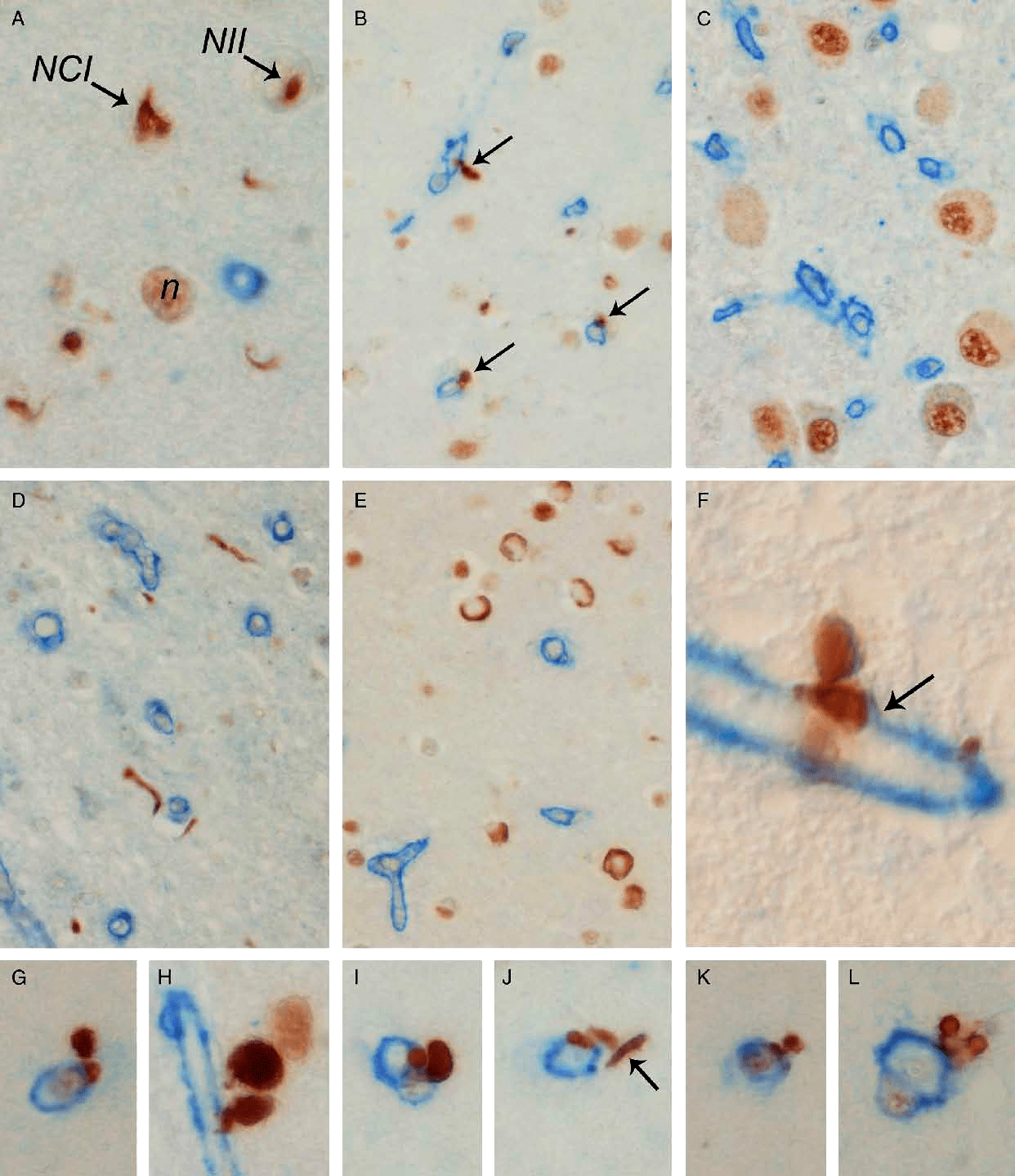
Рисунок 1. Включения TDP-43 (коричневый цвет) при лобно-височной дегенерации в различных отделах головного мозга. Голубым цветом окрашен коллаген 4-го типа.
На основании материалов вскрытий пациентов с LATE-энцефалопатией ученые выяснили этапность поражения головного мозга при этом расстройстве. На первом этапе изменению подвергаются миндалевидные тела, затем патологический процесс захватывает гиппокамп. Завершающие процессы происходят в средней лобной извилине. Для посмертной диагностики LATE-энцефалопатии рекомендовано проводить иммуногистохимическое исследование тканей из этих трех областей мозга.
Из-за сложностей нейровизуализации заболевание, к сожалению, обнаруживают уже на стадии структурных нарушений в гиппокампе. Способы нейровизуализации, которые широко доступны врачам и ученым, не обладают достаточной чувствительностью для выявления изменений в миндалевидных телах при LATE-энцефалопатии. Поэтому гиппокамп, лучше доступный для визуализации, получил особое внимание специалистов.
Очень важно было найти разницу между изменениями в гиппокампе при LATE-энцефалопатии, при болезни Альцгеймера и при гиппокампальном склерозе как отдельном состоянии.
Склеротические нарушения в структуре гиппокампа — первое обнаруженное, но не единственное отличие LATE-энцефалопатии от БА. Склероз гиппокампа — это потеря нервных клеток в основании гиппокампа и в области CA1 с последующим замещением глиальной тканью (рис. 2). Этот процесс не совпадает по объему с поражением гиппокампа при БА, которое имеет более обширный характер.
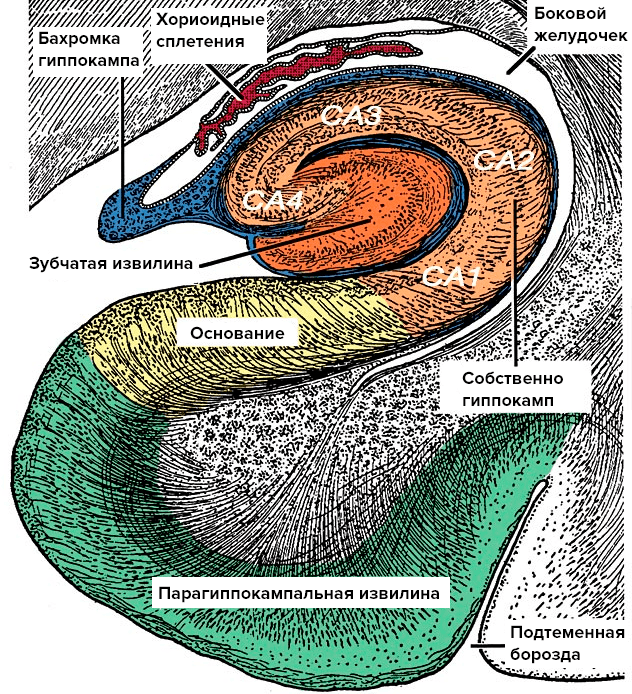
Рисунок 2. Анатомия гиппокампа. Гиппокамп — это сложно устроенная часть головного мозга, которая скрыта под толщей больших полушарий. При гиппокампальном склерозе патологический процесс затрагивает основание гиппокампа и область CA1.
Также необходимо отделить нарушения структуры гиппокампа при LATE-энцефалопатии от гиппокампального склероза. Склероз гиппокампа как самостоятельное структурное изменение встречается при эпилепсии, нейроинфекциях и некоторых нейродегенеративных заболеваниях. Существует два принципиальных различия между этими типами изменений гиппокампа:
- Поражение лимбических структур (гиппокампа и миндалевидных тел) при LATE-энцефалопатии происходит в большей степени, чем при гиппокампальном склерозе. При этомчем выраженнее структурные нарушения в миндалевидных телах, тем сильнее когнитивное снижение у пациента [8].
- Поражение гиппокампа, вызванное отложениями фосфорилированного TDP-43, всегда двустороннее, в отличие от гиппокампального склероза, который может быть односторонним.
Самостоятельный гиппокампальный склероз также может сопровождать LATE-энцефалопатию, и в этом случае прогрессирование деменции будет быстрым (рис. 3).
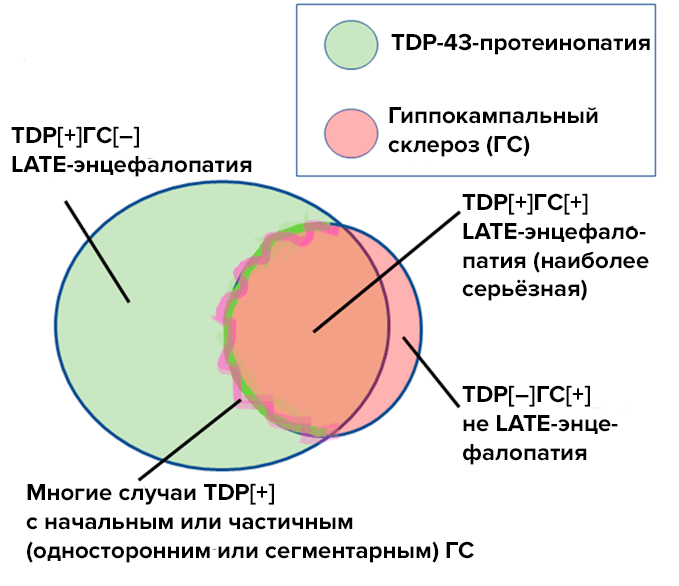
Рисунок 3. TDP-43-протеинопатия, или LATE-энцефалопатия (зеленый круг), и гиппокампальный склероз (розовый круг) — это самостоятельные заболевания. При сочетании этих патологий у пациентов ппоисходит быстрое прогрессирование деменции. Часть случаев LATE-энцефалопатии сопровождается частичным или односторонним гиппокампальным склерозом (розово-зеленая зона на границе розового круга).
Клиническая картина LATE-энцефалопатии
Ключевой признак LATE-энцефалопатии — нарушение эпизодической памяти у лиц старше 80 лет. Этот симптом сближает LATE-энцефалопатию с БА, и дифференциальный диагноз между ними — это сложная и не решенная до конца задача. Клинически LATE-энцефалопатия сопровождается преимущественным поражением памяти без нарушений настроения и поведения. Также при LATE-энцефалопатии в отличие от БА не возникает афазии (нарушений речи) и психотических симптомов (бреда и галлюцинаций). В этом свете течение LATE-энцефалопатии можно назвать доброкачественным, хотя сложно использовать это слово в отношении непрерывно прогрессирующего неврологического заболевания, приводящего к потере самостоятельности.
Куда более заметные различия можно обнаружить между LATE-энцефалопатией и лобно-височной деменцией, при которых происходит отложение TDP-43 в нервных клетках. LATE-энцефалопатия начинается в возрасте 80 лет и старше, а ЛВД поражает людей меньшего возраста, иногда даже в 50 лет. Последняя сопровождается эмоциональными изменениями, такими как уплощение эмоций или их огрубление и стереотипизацию. При ЛВД можно обнаружить нарушение социальной дистанции или сексуальную расторможенность. LATE-энцефалопатия не сопровождается подобными симптомами. При ней развивается деменция с преимущественным поражением памяти. Нейровизуализация при LATE-энцефалопатии обнаруживает также поражение лимбической системы мозга, чего не происходит при ЛВД. Лобно-височная деменция, в свою очередь, вызывает более обширные и выраженные изменения в коре головного мозга, чем LATE-энцефалопатия.
Что нам дает новый тип деменции?
Авторы отчета признают, что определение LATE-энцефалопатии как отдельного заболевания — это только начало пути. Впереди еще много исследований, которые должны пролить свет на возникновение и течение заболевания, а также открыть путь к его лечению. Однако признание LATE-энцефалопатии уже дало многое.
Сейчас в клинических исследованиях фиксируют большое количество пациентов пожилого возраста, которые демонстрируют признаки когнитивного снижения с преимущественным поражением памяти и атрофией гиппокампа, но при исследованиях у них не обнаруживают характерный для БА амилоидоз. Доля таких пациентов достигает 15-30% от числа людей, включенных в исследование [9]. Что с ними происходит? Чем они болеют? LATE-энцефалопатия становится ответом на этот вопрос.
Часть случаев деменции, которая диагностирована как проявление БА, может оказаться вызвана совсем не ею, а нейродегенеративным заболеванием, описанным в отчете. Это касается людей в возрасте 80 лет и старше — той возрастной группы, число представителей которой постепенно увеличивается благодаря достижениям медицины. К сожалению, пока не существует достоверных биомаркеров LATE-энцефалопатии за исключением определения отложений TDP-43 в нервных и глиальных клетках. Мы не можем брать биопсию головного мозга у всех пациентов с подозрением на LATE-энцефалопатию. По этой причине придется придумывать пока что-то более безопасное, чем инвазивное вмешательство.
Решением может стать внедрение системы ATN, которая помогает отделить случаи деменции при БА от других деменций с «альцгеймеровской» симптоматикой (рис. 4). При помощи различных способов нейровизуализации мы можем определить, есть ли у пациента бета-амилоид (A) и тау-протеин (Т), а также идет ли в мозге человека процесс нейродегенерации (N).
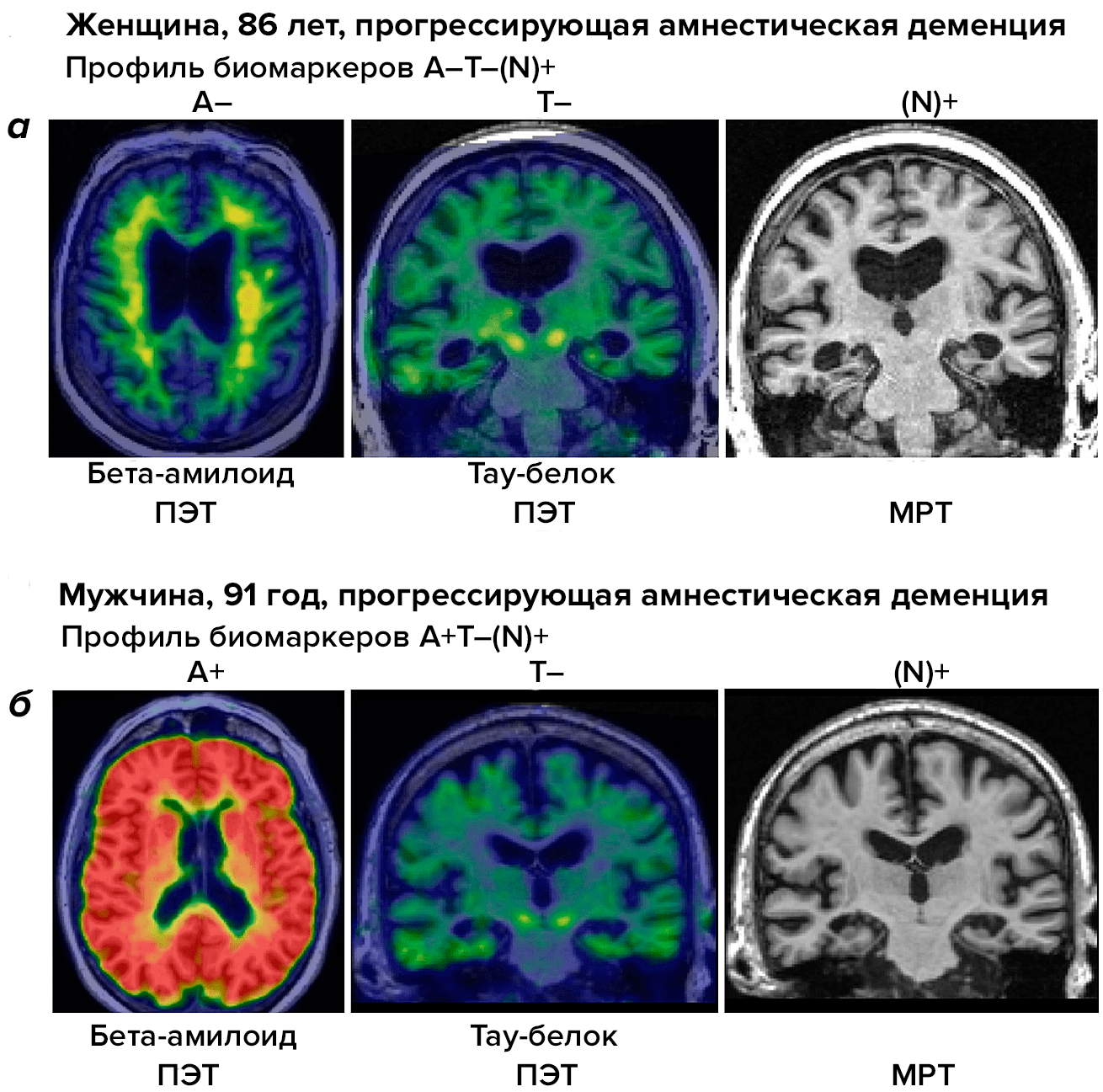
Рисунок 4. Система ATN для дифференциальной диагностики болезни Альцгеймера и других нейродегенеративных заболеваний у пожилых людей. На панели а видны результаты сканирования мозга при разных методах нейровизуализации у пациентки с подозрением на БА. ПЭТ (позитронно-эмиссионная томография) для выявления бета-амилоида (А) и тау-протеина (Т) не дает положительного результата. МРТ для выявления нейродегенеративного поражения (N) дает положительный результат. В последующем при вскрытии у пациентки диагностирована LATE-энцефалопатия. На панели б мы видим результаты сканирования мозга другого пациента с подтвержденной БА. ПЭТ на бета-амилоид и тау-протеин дает положительный ответ, как и МРТ, нацеленная на поиск нейродегенеративных изменений.
Те случаи, когда есть клиника альцгеймеровской деменции, но структурные и молекулярные изменения не соответствуют ей, формируют пул SNAP (Suspected Non-Alzheimer’s Pathology). Это деменции с патогенезом, отличным от патогенеза БА. Различия в патогенезе требуют разных подходов к лечению заболеваний. В последнее время амилоидная гипотеза БА получает серьезные удары: лекарства, нацеленные на уничтожение бета-амилоида или предотвращение его отложения, не показывают эффективности в клинических исследованиях. Основная причина, которую обсуждают специалисты, заключается в том, что отложение бета-амилоида не причина БА, а сопутствующий процесс. Мы еще не смогли обнаружить основной процесс патогенеза, а значит, не можем в него вмешаться. Описанная LATE-энцефалопатия дает второй, альтернативный ответ на вопрос «Почему при БА не эффективны препараты против амилоида?». Этот ответ звучит следующим образом: возможно, у кого-то из пациентов вовсе не болезнь Альцгеймера, а LATE-энцефалопатия. Если это окажется так, нам нужно будет разрабатывать новые методы лечения, отличные от уже известных способов терапии деменции.
Литература
- Masato Hasegawa, Tetsuaki Arai, Takashi Nonaka, Fuyuki Kametani, Mari Yoshida, et. al.. (2008). Phosphorylated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Ann Neurol.. 64, 60-70;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- M. Neumann, D. M. Sampathu, L. K. Kwong, A. C. Truax, M. C. Micsenyi, et. al.. (2006). Ubiquitinated TDP-43 in Frontotemporal Lobar Degeneration and Amyotrophic Lateral Sclerosis. Science. 314, 130-133;
- Catalina Amador-Ortiz, Zeshan Ahmed, Cynthia Zehr, Dennis W. Dickson. (2007). Hippocampal sclerosis dementia differs from hippocampal sclerosis in frontal lobe degeneration. Acta Neuropathol. 113, 245-252;
- Peter T Nelson, Dennis W Dickson, John Q Trojanowski, Clifford R Jack, Patricia A Boyle, et. al.. (2019). Limbic-predominant age-related TDP-43 encephalopathy (LATE): consensus working group report. Brain. 142, 1503-1527;
- Wen-Lang Lin, Monica Castanedes-Casey, Dennis W. Dickson. (2009). Transactivation Response DNA-Binding Protein 43 Microvasculopathy in Frontotemporal Degeneration and Familial Lewy Body Disease. Journal of Neuropathology and Experimental Neurology. 68, 1167-1176;
- Nazanin Makkinejad, Julie A. Schneider, Junxiao Yu, Sue E. Leurgans, Aikaterini Kotrotsou, et. al.. (2019). Associations of amygdala volume and shape with transactive response DNA-binding protein 43 (TDP-43) pathology in a community cohort of older adults. Neurobiology of Aging. 77, 104-111;
- Brian A. Gordon, Tyler Blazey, Yi Su, Anne M. Fagan, David M. Holtzman, et. al.. (2016). Longitudinal β-Amyloid Deposition and Hippocampal Volume in Preclinical Alzheimer Disease and Suspected Non–Alzheimer Disease Pathophysiology. JAMA Neurol. 73, 1192.





