На руинах памяти: настоящее и будущее болезни Альцгеймера
05 мая 2017
На руинах памяти: настоящее и будущее болезни Альцгеймера
- 12289
- 1
- 16
рисунок Софи Найденовой
-
Автор
-
Редакторы
«Нужно начать терять память, пусть частично и постепенно, чтобы осознать, что из нее состоит наше бытие. Жизнь вне памяти — вообще не жизнь». Эти слова принадлежат известному режиссеру Луису Бунюэлю, чья мать в конце своей жизни страдала деменцией. Постепенная, но неотвратимая потеря памяти, а вместе с ней и личности, способна напугать каждого. Что может предложить современная наука для борьбы с этим страшным недугом — болезнью Альцгеймера?
Спецпроект «биомолекулы» и Forbes
Совместный спецпроект «биомолекулы» и журнала Forbes посвящен биотеху, стартапам, экономическим и финансовым аспектам научной жизни. В несколько переработанном виде статьи будут выходить также на сайте Forbes.
Куратор рубрики — Антон Гопка, основатель компании Atem Capital.
На сайте Forbes статья вышла под названием «Проблема на триллион: о борьбе с болезнью Альцгеймера».
Екатерина Павловна родилась в 1947 году. Она окончила строительное училище, работала маляром-штукатуром, а после выхода на пенсию стала подрабатывать вахтером в общежитии. В какой-то момент ей это надоело, и она бросила работать. Через год от инфаркта умер ее муж. У Екатерины Павловны остались дочь Елена и сын Павел. Те уже обзавелись своими семьями, и по выходным, когда позволял рабочий график, большая семья навещала бабушку в ее квартире в спальном районе города.
Персонаж статьи является вымышленным. Однако это не отменяет того факта, что существуют тысячи историй, подобных изложенной.
Всё шло своим чередом, пока родственники не отметили появление некоторых странностей в поведении Екатерины Павловны. Дочь Елена стала замечать, что в холодильнике часто оказываются просроченные продукты, а мама пытается из них что-то готовить, не понимая несоответствия в датах. Обеды постепенно упрощались, а затем и вовсе стали безвкусными. В доме начал копиться всякий хлам, а сама мама подолгу носила одни и те же вещи, даже если они становились грязными. Екатерина Павловна всё чаще забывала недавние события: могла уйти из дома, когда они с дочерью договорились встретиться в квартире, путалась в датах. Мужа Елены она начала называть братом. Тот списывал всё на старческие странности, и Елена соглашалась с ним.
Однажды Елена попросила Екатерину Павловну поставить чайник. Пожилая женщина взяла электрический чайник, поставила его на плиту и начала чиркать спичками, зажигая газ. Елена кинулась к матери и остановила ее. Стало ясно, что дальше так продолжаться не может. После разговоров с друзьями и изучения информации в интернете Елена поняла, что Екатерине Павловне нужен врач. На счастье, в их городе было несколько врачей, специализировавшихся на подобных расстройствах. На приеме врач долго беседовал с Екатериной Павловной, задавал вопросы и дочери. Наконец он попросил Екатерину Павловну выйти из кабинета и сообщил Елене, что у ее матери, вероятно, болезнь Альцгеймера.
Гаснущее солнце памяти
Болезнь Альцгеймера (БА) — это неврологическое заболевание, в основе которого лежит атрофия гиппокампа, теменной и височной коры головного мозга. Основное проявление болезни — деменция, то есть прогрессирующее снижение когнитивных функций (внимания, памяти, интеллекта), которое приводит к потере социально-бытовых навыков, вплоть до утраты способности к самообслуживанию. Есть и другие неврологические и психические симптомы болезни, но они в меньшей степени влияют на состояние пациента.
Деменция при болезни Альцгеймера обладает рядом признаков, отличающих ее от прочих видов деменции. Альцгеймеровская деменция даже на ранних этапах значительно поражает биографическую память человека. У пациента возникают искажения и утрата воспоминаний. Это касается даже самых важных моментов: имен и количества детей, смерти близких. На глазах происходит катастрофическая потеря всего прошлого опыта человека, разрушение его личности.
Кроме того, быстро теряются навыки (праксис), способность совершать даже простые действия. Этот симптом называется апраксией. Также снижается способность пациента распознавать предметы и узнавать людей (агнозия). В дополнение к этому возникают специфические речевые нарушения: слова и слоги заменяются близкими по звучанию. Со временем речь становится всё менее связной и в конце концов может полностью утратиться (афазия). Комплекс «афазия-апраксия-агнозия» с высокой вероятностью указывает на болезнь Альцгеймера. Итогом развития болезни становится полная потеря пациентом способности себя обслуживать, в том числе самостоятельно есть, передвигаться и контролировать тазовые функции.
В МКБ-10 разделены формы деменции при болезни Альцгеймера с ранним и поздним началом (рис. 1). Деменция при БА с ранним началом характеризуется дебютом в возрасте до 65 лет, более быстрым течением и преобладанием симптомов афазии-апраксии-агнозии. Раннее начало чаще связано с семейным анамнезом заболевания. Если человек страдает такой формой болезни Альцгеймера, то риск заболеть у его детей составляет около 50%. Деменция при БА с поздним началом проявляется после 70 лет и протекает медленнее, с преимущественным поражением памяти; болезнь возникает спорадически (случайно).
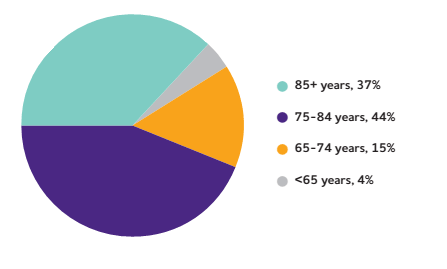
Рисунок 1. Распределение пациентов с болезнью Альцгеймера в США по возрастным группам. Пациенты в возрасте до 65 лет составляют всего 4% от общего количества заболевших.
Согласно оценкам ученых, чем старше человек, тем выше у него риск заболеть БА (рис. 2). Американские исследователи прогнозируют значительное увеличение числа случаев болезни Альцгеймера, поскольку население развитых стран (в том числе США) продолжает стареть (рис. 3) [1].
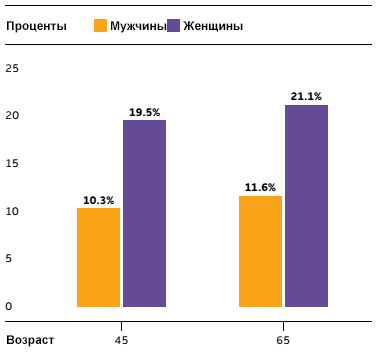
Рисунок 2. Риск возникновения болезни Альцгеймера в течение жизни. При достижении 65 лет риск развития БА у женщин составляет 21,1%, то есть заболевает каждая пятая женщина, достигшая этого возраста. Среди мужчин БА развивается приблизительно у каждого десятого. Чем старше человек, тем выше риск развития деменции.
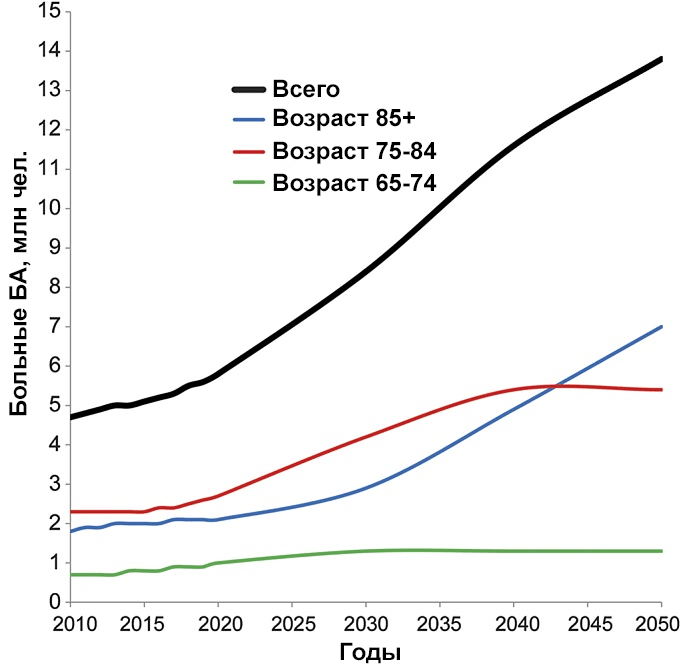
Рисунок 3. Ожидаемый рост количества пациентов с болезнью Альцгеймера в США.
Продолжительность жизни населения увеличивается, соответственно, растет и количество людей пожилого и старческого возраста. У каждого из нас есть высокие шансы дожить до возраста старше 65 лет. В этой возрастной группе приблизительно каждый деcятый страдает болезнью Альцгеймера, причем у женщин риск заболеть вдвое выше. А если мы возьмем группу людей в возрасте 85 лет и старше, то в ней заболевшим будет уже каждый третий. Успехи в сфере медицины продлили человеку жизнь, но привели к тому, что набирает обороты новая проблема — болезнь Альцгеймера, против которой нет эффективного лекарства. Люди стали меньше умирать от сердечно-сосудистых и онкологических заболеваний. Освободившееся место быстро заняла болезнь Альцгеймера (рис. 4). Чем старше становится человек, тем выше вероятность развития этой болезни и смерти от нее (рис. 5).
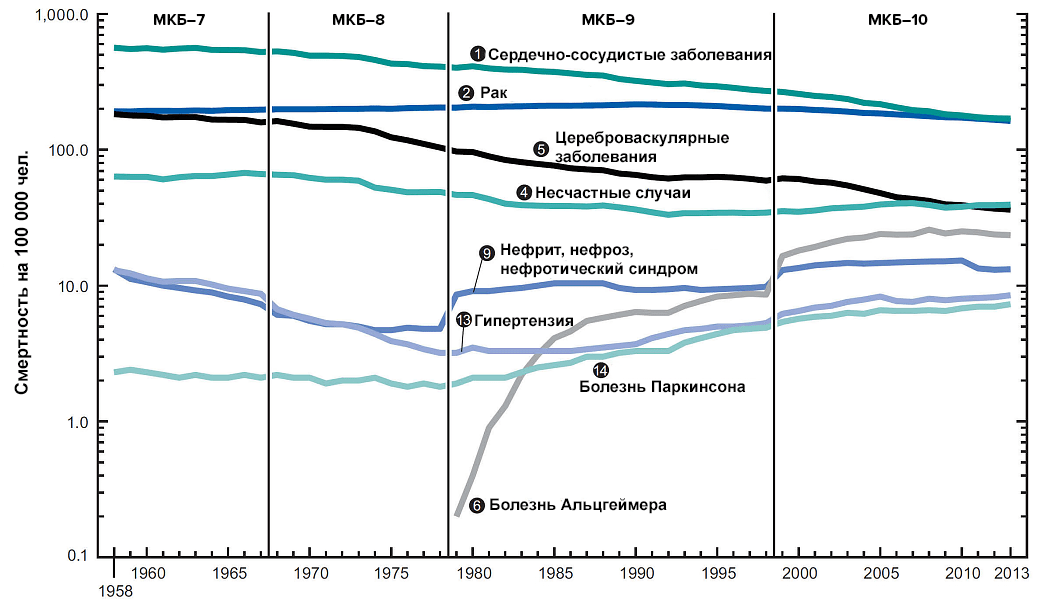
Рисунок 4. Рост смертности от болезни Альцгеймера в США в последние 30 лет. Отражено количество смертей от БА в сравнении со смертями от других заболеваний. МКБ — Международная классификация болезней. Число в кружкé — место, занимаемое тем или иным заболеванием в рейтинге ведущих причин смерти 2013 года. Чтобы увидеть рисунок в полном размере, нажмите на него.
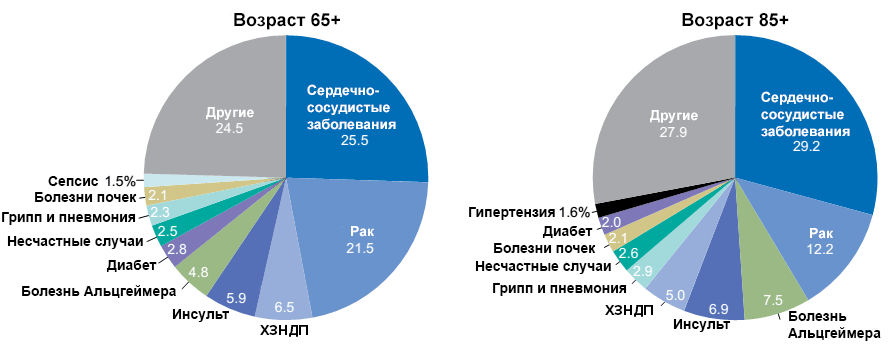
Рисунок 5. Смертность от болезни Альцгеймера в разных возрастных группах. Данные по каждой из 10 ведущих причин смерти приведены в процентном выражении от общего количества смертей. ХЗНДП — хронические заболевания нижних дыхательных путей. Чтобы увидеть рисунок в полном размере, нажмите на него.
В настоящее время в мире насчитывается 47 млн пациентов с деменцией и ежегодно фиксируется более 7 млн новых случаев заболевания. Две трети от этих показателей — это вклад болезни Альцгеймера. В США сейчас проживают 5,5 млн пациентов с таким диагнозом. Приблизительное число россиян, страдающих БА, оценивается не менее чем в миллион человек. Подсчет пациентов в нашей стране затруднен тем, что по этому заболеванию не ведется отдельного регистра. В последние годы все исследователи болезни Альцгеймера сходятся во мнении, что количество пациентов с этим расстройством будет увеличиваться вместе с продолжительностью жизни населения, и Россия не станет исключением из этого общемирового тренда. К 2030-му году прогнозируют заболеваемость на уровне 75 млн случаев по всему миру, а к 2050-му — 132 млн. Однако в научном сообществе существует и альтернативная точка зрения, подкрепленная статистикой, согласно которой такого уж катастрофического роста заболеваемости БА нет. Некоторые исследователи считают, что можно говорить даже о снижении количества случаев деменции (по крайней мере, в США [2]), и связывают это с возросшим уровнем образования населения. Время покажет, кто оказался прав.
Внутри головы
Заболевание Екатерины Павловны началось не в тот момент, когда она стала путаться в сроках годности продуктов, а на несколько лет раньше. Это известно благодаря продолжительным наблюдениям с использованием позитронно-эмиссионной томографии (ПЭТ) мозга пожилых людей. Характерными гистологическими признаками болезни Альцгеймера являются β-амилоидные бляшки и нейрофибриллярные клубки в коре головного мозга. Известно, что β-амилоид возникает из специфического белка-предшественника (APP). В нейроне APP нарезается ферментами и превращается в β-амилоид, скопления которого можно увидеть под микроскопом (рис. 6б). Его функция ясна не до конца, но известно, что β-амилоид обладает противомикробной активностью [3], [4], [5] и участвует в реализации врожденного иммунитета [6]. Нейрофибриллярные клубки состоят из гиперфосфорилированного тау-белка (рис. 6a) [7]. Функция тау-белка в норме заключается в стабилизации микротрубочек в аксонах нейронов и обеспечении нормального транспорта веществ внутри нейрона. Как показывают исследования, появление скоплений тау-белка может быть вызвано воздействием β-амилоида, вмешивающегося в работу аксонального транспорта [8].
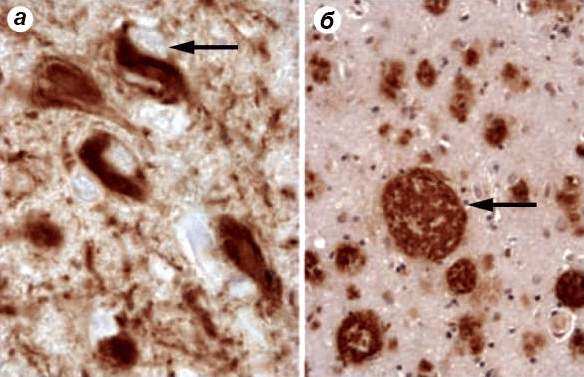
Рисунок 6. Гистологические признаки болезни Альцгеймера. а — Скопления тау-белка; б — амилоидные бляшки
На основе данных о β-амилоиде была выдвинута амилоидная гипотеза болезни Альцгеймера. Изменения в когнитивном статусе напрямую связали с накоплением этого белка в тканях человеческого мозга. Однако сейчас в научном сообществе в пользу β-амилоидной гипотезы высказываются всё более осторожно. В одной из статей по этой теме авторы написали, что β-амилоид представляется необходимым, но не достаточным для старта БА [9]. Подробнее о патогенезе болезни Альцгеймера можно прочесть на «биомолекуле» в статье «Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен» [10].
По последним данным, распространенность внеклеточных отложений β-амилоида в коре головного мозга коррелирует с когнитивным снижением меньше, чем количество скоплений тау-белка внутри клеток (рис. 7). Кроме того, последовательность появления тау-белка в различных отделах головного мозга соотносится с возникновением тех или иных симптомов болезни Альцгеймера. На начальных стадиях заболевания больше всего страдает кратковременная память, и тогда же нейрофибриллярные клубки обнаруживают в гиппокампе. При дальнейшем развитии болезни возникают нарушения зрительного восприятия и исполнительской функции, что коррелирует с появлением тау-белка в специализированных отделах головного мозга.
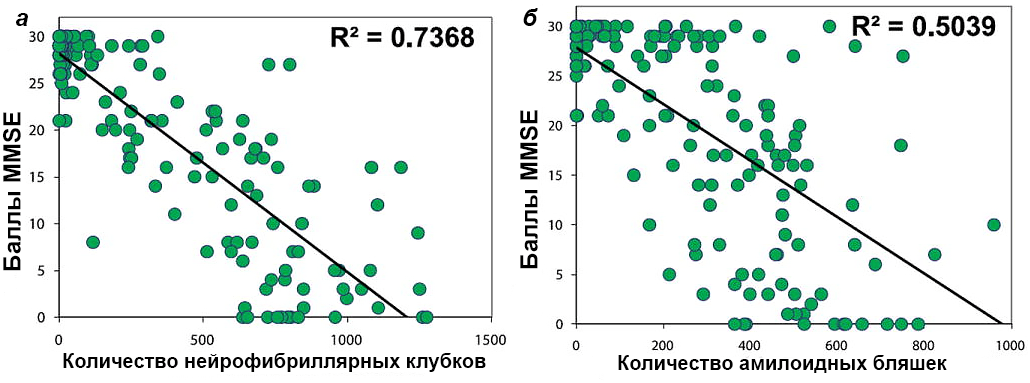
Рисунок 7. Корреляция когнитивного снижения в баллах MMSE с распространенностью нейрофибриллярных клубков (а) и амилоидных бляшек (б). Коэффициент корреляции с когнитивным снижением, измеренным по стандартному тесту MMSE, в случае тау-белка выше. Чтобы увидеть рисунок в полном размере, нажмите на него.
При более широком взгляде на проблему возникновения болезни Альцгеймера ученые выдвигали и других кандидатов на роль «главного злодея», например, ген APOE, точнее, его аллель E4 [11]. Вариабельность этого гена имеет значение для спорадической (случайной) формы болезни Альцгеймера. У обладателей варианта E4 аполипопротеина Е повышается риск развития болезни Альцгеймера, атеросклероза, неблагоприятного исхода травмы мозга и быстрого прогрессирования рассеянного склероза. В головном мозге ApoE вовлечен в метаболизм холестерина и иммунный ответ. Как ApoE4 связан с болезнью Альцгеймера, до конца не понятно, но последние исследования дают надежду на скорое разрешение этой загадки. Изоформа ApoE4, связываясь с рецептором на поверхности нейрона, вызывает более активную выработку β-амилоида, чем формы ApoE2 и ApoE3 [12]. Это открытие особенно интересно, так как уже разрабатываются молекулы, которые могут сделать ApoE4 похожим на ApoE3 (apoE4 structure correctors, apoE4SCs).
Диагностика
Для того чтобы предположить развитие болезни Альцгеймера у пациента, не нужно делать прижизненную биопсию головного мозга. Существуют более безопасные способы диагностики: нейровизуализация и поиск биомаркеров.
Упомянутая ранее ПЭТ имеет ряд недостатков: изотопные препараты для ПЭТ малодоступны в небольших городах, срок жизни изотопа невелик (и по этой причине его нельзя перевезти на большие расстояния), существует и проблема специфичности маркера (для определения разных признаков БА нужны разные меченые вещества — например, ПЭТ с меченой глюкозой выявляет нарушение метаболизма в отделах мозга, отвечающих за обучение и память).
Другим способом диагностики может быть магнитно-резонансная томография (МРТ) головного мозга с оценкой различных показателей его структуры. В настоящее время мы можем оценить степень атрофии гиппокампа и коры больших полушарий. Эти показатели достоверно свидетельствуют о текущей болезни Альцгеймера [13]. Нейровизуализация ценна тем, что позволяет выявить обратимые формы деменции (опухоль, нормотензивную гидроцефалию). Нейрохирургическое вмешательство в таких случаях позволит быстро и эффективно помочь пациенту.
Лабораторные тесты также могут подтвердить диагноз болезни Альцгеймера: например, можно измерить уровни тау-белка и β-амилоида в спинномозговой жидкости [14] или плазме крови [15]. Ну а еще можно сделать генетический анализ — определить собственное сочетание аллелей гена APOE, доставшихся от родителей.
Лекарство для ума
После того как у Екатерины Павловны диагностировали болезнь Альцгеймера, врач назначил ей лечение в соответствии с современными рекомендациями. Несмотря на неполное понимание молекулярных основ БА, можно точно сказать, что при этом заболевании снижается активность ацетилхолиновой системы головного мозга (о роли ацетилхолина в жизни человека можно прочесть на нашем сайте [16]), и известно это уже с 1970-х годов [17]. Потому-то именно ацетилхолиновая система стала главной мишенью терапии БА.
Первым лекарством от болезни Альцгеймера был такрин (Cognex, Pfizer), одобренный FDA к использованию в 1993 году, но 20 лет спустя его перестали использовать в клинической практике, так как появились новые препараты. Такрин относится к ингибиторам холинэстеразы (ИХЭ): его действие увеличивает количество ацетилхолина в головном мозге пациентов с БА. Сейчас используют три ИХЭ: донепезил, ривастигмин и галантамин.
В 1996 году в США поступил в продажу донепезил (Aricept, Pfizer), в дальнейшем его использование было одобрено и в других странах. Препарат считается эффективным в отношении деменции при болезни Альцгеймера любой степени тяжести [18]. По последним данным, объем мировых продаж донепезила превышает $ 4 млрд: сейчас это самый назначаемый препарат среди ИХЭ.
Через год после одобрения донепезила в Швейцарии выпустили в продажу препарат ривастигмин (Exelon, Novartis), который также показал хорошие результаты в терапии болезни Альцгеймера [19]. В продаже можно найти ривастигмин в капсулах или растворе, а также в виде трансдермальной терапевтической системы, ТТС. Галантамин (Reminyl, Janssen-Cilag) начал свой путь в Швеции в 2000 году, поступил на рынки других стран Европы, а позже добрался и до США. Галантамин обладает доказанной эффективностью в отношении БА [20].
ИХЭ воздействуют на свою мишень — фермент холинэстеразу — разными путями, поэтому если один из препаратов этой группы оказался неэффективным, врач может назначить другой. Зато у всех ИХЭ схожие побочные эффекты, которые обусловлены воздействием на холинергическую систему организма. ИХЭ могут замедлять сердечный ритм, что потенциально опасно для людей с блокадами проводящих путей сердца и склонностью к брадикардии. К частым реакциям на прием ингибиторов ХЭ относят тошноту и рвоту, что очень плохо воспринимается пациентами и лицами, ухаживающими за ними. Другой характерный побочный эффект — потеря веса [21]. Пластырь (ТТС) с ривастигмином вызывает меньше нежелательных реакций со стороны ЖКТ. При этом ТТС обеспечивает равномерное высвобождение лекарства без резкого повышения концентрации препарата в крови. Иногда ривастигмин в форме ТТС вызывает раздражение кожи, что побуждает прекратить его использование. Кроме болезни Альцгеймера, ИХЭ применяют в терапии деменции с тельцами Леви и деменции при болезни Паркинсона.
Помимо трех перечисленных препаратов врачам доступен мемантин (Akatinol, Merz). Это лекарство воздействует на глутаматную систему головного мозга, блокируя NMDA-рецепторы глутамата [22]. Согласно современным исследованиям, мемантин в дозе 20 мг/сутки можно считать эффективным средством для терапии болезни Альцгеймера [23]. Иногда врачи рекомендуют использовать комбинацию мемантина и одного из ИХЭ. Оценка эффективности комбинированной терапии показала, что совмещение препаратов двух групп оказывает чуть более выраженное положительное влияние на когнитивный статус и повседневное функционирование пациента в сравнении с изолированным использованием ИХЭ [24]. Может потребоваться и подключение к терапии БА нейролептиков (например, рисперидона) — для коррекции поведенческих расстройств или психоза. Очевидно, что комбинирование противодементных препаратов или добавление к ним антипсихотиков ведет к удорожанию терапии (табл. 1), но, к сожалению, это не всегда вознаграждается долговременными улучшениями.
Критерием эффективности лечения деменции при БА считается замедление скорости когнитивного снижения, что оценивают по стандартизованным шкалам MMSE или MoCA-тест. Если на фоне приема препарата у пациента перестают снижаться баллы по MMSE (или хотя бы процесс замедляется), это считают несомненным успехом терапии. Также к критериям эффективности относят снижение частоты поведенческих расстройств (уходов из дома, приступов раздражительности) и сохранение самостоятельности пациента в том, что касается самообслуживания. Эти показатели тоже можно измерить по специальным шкалам.
Для оценки эффективности разрабатываемых препаратов используют те же методы. Если новый препарат оказывается не лучше уже существующих, им перестают заниматься. Часто врач не наблюдает улучшения или стабилизации когнитивного статуса, но родственники отмечают положительную динамику в поведении пациента. Препараты, применяемые для терапии болезни Альцгеймера, позволяют отсрочить потерю самостоятельности и замедлить темпы снижения когнитивных функций пациента. При этом предотвратить заболевание или обратить его течение вспять они не способны.
В России у пациентов с болезнью Альцгеймера есть возможность получать ИХЭ (галантамин и ривастигмин) бесплатно. Учреждения здравоохранения могут закупать их в рамках программы дополнительного лекарственного обеспечения (ДЛО), но выбор препарата для закупки происходит внутри самого лечебного учреждения. Вот и Екатерина Павловна после оформления необходимых документов стала получать медикаменты в местном психоневрологическом диспансере.
| Препарат (суточная доза, мг) | Стоимость месяца терапии оригинальным препаратом, руб. | Стоимость месяца терапии дженериком, руб. |
|---|---|---|
| Мемантин (20) | 2900 | 1400 |
| Донепезил (10) | Данных нет | 3000 |
| Галантамин (16) | 3700 | 2300 |
| Ривастигмин (4,6/9,5/13,3) | 3500/3700/4000 | Нет аналогов |
| Рисперидон (2) | 1000 | 900 |
Будущее терапии
Если выше мы говорили про современные средства терапии, то здесь речь пойдет о перспективах лечения болезни Альцгеймера. Увы, пока они совершенно безрадостные: за последние 14 лет не появилось ни одного нового препарата от БА, и поиск таких лекарств постепенно превращается в кладбище надежд. Екатерина Павловна будет получать симптоматическое лечение, которое позволит затормозить, но не остановить процесс. Рано или поздно болезнь возьмет свое, и пациентку ждет постепенное угасание. Если кто-то и сможет получить эффективное лекарство от болезни Альцгеймера, то это будут представители следующих поколений семьи Екатерины Павловны. Хотя никакой уверенности в скором получении эффективного препарата нет.
Последним одобренным FDA средством для терапии болезни Альцгеймера стал мемантин. Это случилось в 2003 году, а с тех пор прошло 14 лет... В настоящее время исследуют почти 100 препаратов от БА. В качестве их основных мишеней избрали β-амилоид, тау-белок и воспалительный процесс в ЦНС. Тестируют препараты и с другими механизмами действия, что отражает множественность неподтвержденных гипотез относительно молекулярных основ заболевания. Складывается впечатление, что ученые пытаются приладить к терапии болезни Альцгеймера всё, до чего догадаются (рис. 8).
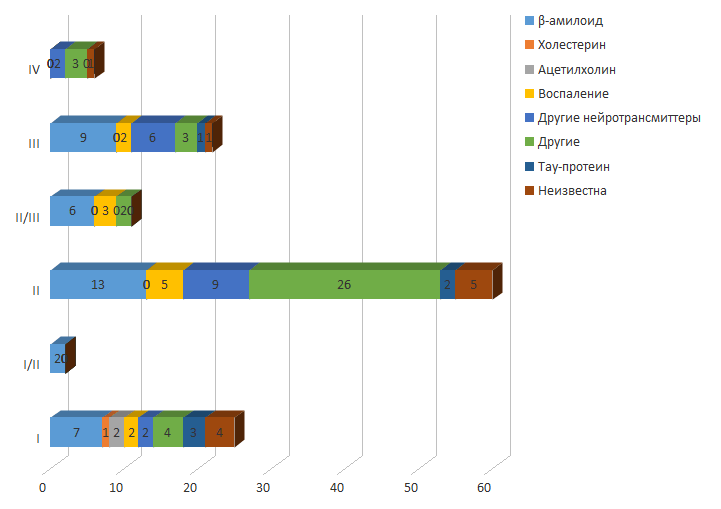
Рисунок 8. Лекарства, разрабатываемые для борьбы с болезнью Альцгеймера. Бόльшая часть лекарств проходит второй этап (II) клинических испытаний. Фаза IV подразумевает пострегистрационные исследования препаратов, доказавших свою эффективность по отношению к другим патологиям.
alzforum.org на апрель 2017 года
В поисках новых средств терапии БА β-амилоид стал самой очевидной мишенью. Фармакологические компании сосредоточили свои усилия на создании лекарства, которое может разрушать уже существующие бляшки и/или препятствовать их образованию. По данным сайта alzforum.org, из всех антиамилоидных препаратов — тех, что должны воздействовать на β-амилоид и его предшественника APP, — до клинических испытаний дошли 28. И только 10 из них участвуют в испытаниях до сих пор: остальные уже показали свою неэффективность в отношении болезни Альцгеймера. Подобная неудача говорит о том, что β-амилоид не такая уж бесспорная мишень, как представлялось ранее. Вероятно, в скором времени подходы к терапии будут пересмотрены. Клинические испытания некоторых препаратов из упомянутой группы закончатся в 2018 году, большинство же исследований завершится после 2020 года. Но даже при условии клинической эффективности новые лекарства дойдут до потребителя еще позже. При этом остается высокая вероятность того, что исследуемые препараты не покажут необходимой эффективности, и это будет самым серьезным ударом по амилоидной гипотезе. В этом случае окажется, что годы труда и миллиарды долларов были потрачены впустую, на погоню за призраком.
Одним из способов борьбы с β-амилоидом стала активная и пассивная иммунотерапия. Активная иммунотерапия — это вакцинация веществом, в ответ на введение которого организм пациента вырабатывает антитела, связывающие внеклеточные амилоидные отложения и разрушающие их с помощью иммунных реакций. Первым из препаратов для активной иммунизации стал AN-1792 — искусственно синтезированный и модифицированный β-амилоид. Во время предварительных исследований препарат показал способность снижать количество амилоидных бляшек. Однако при продолжении работ выяснилось, что вакцинация AN-1792 вела к уменьшению объема мозга в целом и увеличению желудочков. Объем гиппокампа также уменьшался. Разумеется, испытания препарата прекратили [25]. Неудачу потерпели и исследования других средств для активной иммунизации против β-амилоида. В настоящее время проходит тестирование препарата AADvac1 для активной иммунизации против тау-белка. В первой фазе клинических испытаний он показал свою безопасность и способность вызывать иммунный ответ у пациентов [26].
Пассивная иммунотерапия подразумевает введение готовых антител. Использование человеческого иммуноглобулина при болезни Альцгеймера не дало значимых положительных результатов, поэтому ученые переключились на специфические противоамилоидные антитела. Моноклональное антитело под названием кренезумаб проходит сейчас II и III фазы клинического исследования, которое курирует компания Hoffmann — La Roche. Лекарство тестируется на пациентах с преддементными изменениями когнитивных функций (mild cognitive impairment, MCI). Такой подход обосновывается малой эффективностью препаратов при развернутой картине болезни. Чем раньше начинается лечение, тем большего результата можно достичь.
Воздействовать на амилоид можно не его разрушением в уже сформированных бляшках, а предупреждением образования амилоидных отложений. На этот этап патогенеза БА нацелены ингибиторы и модуляторы β- и γ-секретаз (рис. 9) [27].
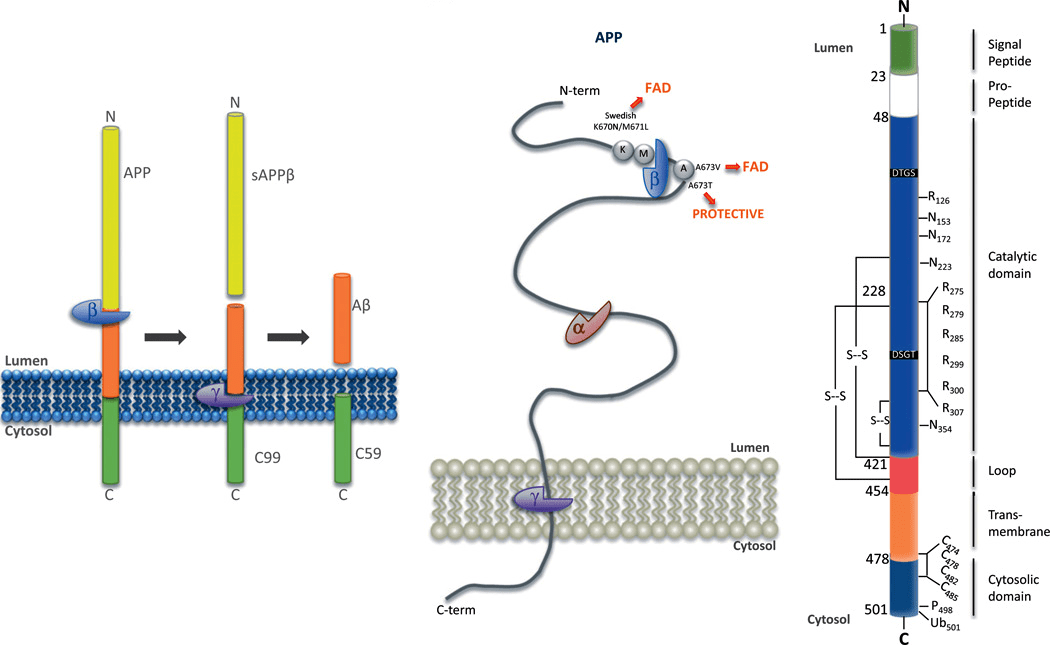
Рисунок 9. Схема процессинга белка — предшественника β-амилоида (APP). Трансмембранный белок APP разрезается на две части с помощью ферментов. Сначала работает β-секретаза, затем подключается γ-секретаза, которая вырезает β-амилоид из трансмембранного белка. Чтобы увидеть рисунок в полном размере, нажмите на него.
Молекула под названием JNJ-54861911, подавляющая активность β-секретазы, в настоящее время тестируется компаниями Janssen и Shionogi Pharma. Ее применение оказалось безопасным для разных групп пожилых пациентов, и сейчас запущена III фаза крупных клинических исследований препарата. С 2017 по 2023 год в этом проекте примет участие более полутора тысяч пациентов с начальными проявлениями болезни Альцгеймера. Если лекарство покажет свою эффективность, то на рынке оно появится еще через несколько лет. Опасения исследователей вызывают возможные побочные эффекты. Уже сейчас известно, что применение ингибиторов β-секретазы может ухудшать синаптическую пластичность [28] и вызывать депигментацию у лабораторных животных [29].
На этом пути тоже встречаются неудачи. В середине февраля 2017 года компания Merck & Co. сообщила о прерывании клинического исследования верубецестата — другого ингибитора β-секретазы [30], [31]. Он не продемонстрировал достаточной эффективности в III фазе.
В области поиска новых препаратов и подходов интересен пример компании Axovant. В команде Axovant есть два ученых, участвовавших в разработке донепезила и мемантина; компания проводит исследования нескольких препаратов против болезни Альцгеймера и деменции с тельцами Леви. Для терапии этих расстройств Axovant предлагает препарат интепирдин — антагонист определенного класса серотониновых рецепторов ЦНС, блокирование которых приводит к улучшению холинергической трансмиссии. В исследованиях компании интепирдин назначается вместе с донепезилом, то есть перед нами пока не средство для монотерапии расстройства, а адъювант — вещество, улучшающее действие основного лекарства. Примером подобного адъюванта можно считать недавно одобренный для терапии болезни Паркинсона сафинамид (Xadago, Newron Pharmaceuticals). В октябре 2016 Axovant начал годовое клиническое испытание интепирдина на 40 пациентах. Конечно, компания планирует исследовать и монотерапию деменции интепирдином, но всё равно это останется воздействием на ацетилхолиновую систему головного мозга, то есть только симптоматическим лечением.
В качестве одного из звеньев патогенеза болезни Альцгеймера часто указывают воспалительные изменения в тканях мозга. Обычные противовоспалительные препараты (ибупрофен, целикоксиб и преднизон) не показали активности в отношении БА, но ученые всё равно ведут поиски в этом направлении. Например, сейчас тестируется препарат ALZT-OP1, представляющий собой сочетание кромолина и ибупрофена. Препарат проходит III фазу клинических исследований, а результаты ожидаются после 2018 года. Отчасти с воздействием на воспалительный компонент патогенеза связаны надежды, возлагаемые на испытания пиоглитазона — средства, применяемого при сахарном диабете 2 типа. В ходе исследования TOMMORROW оценивается способность пиоглитазона замедлять переход болезни Альцгеймера из стадии легких когнитивных нарушений в стадию деменции.
Опять же, такой подход к лечению болезни Альцгеймера сейчас кажется наиболее адекватным, поскольку эффективного препарата для лечения продвинутых стадий заболевания нет. Если мы не можем потушить пожар, то давайте хотя бы попытаемся спрятать спички — предлагают ученые. Как нам уже известно, изменения в мозге при болезни Альцгеймера начинаются за несколько лет до манифестации симптомов, и действие лекарств на этих ранних этапах позволит отложить проявления заболевания. Количество больных будет постепенно снижаться. Это снизит нагрузку БА на систему здравоохранения любой страны, пока эффективное лекарство не будет найдено. Кроме того, очень важна разработка скрининговых методов, позволяющих быстро и достоверно определять начальные стадии когнитивных нарушений при болезни Альцгеймера (а в идеале и не дожидаясь их).
Несмотря на продолжающиеся поиски препаратов от болезни Альцгеймера, ситуация с ее лечением не выглядит обнадеживающей. Население развитых стран стремительно стареет и хочет жить всё дольше, при этом система здравоохранения не готова к росту числа пациентов с деменцией, уход за которыми требует всё бóльших затрат. Несмотря на внушительный объем потраченных усилий и грантовых вливаний в исследования, почти все новые лекарства оказываются неэффективными. Несколько препаратов, всё-таки одобренных для клинического применения, лечат лишь симптомы, да и то на короткой дистанции.
Очевидно, что главная причина неудач кроется в отсутствии надежной модели заболевания для достоверного тестирования лекарств. Если несколько десятилетий назад ученые видели корень проблемы в накоплении агрегатов «неправильного» белка, с которым удастся быстро разобраться, то сейчас они склоняются к тому, что причины заболевания лежат гораздо глубже — в нарушении работы нейронов и их взаимоотношений с глией. И тут на передний план выходит другое препятствие: мы всё еще недостаточно хорошо понимаем, как работает головной мозг и как взаимодействуют его компоненты. Чтобы разобраться с болезнью Альцгеймера, ученым, возможно, придется вернуться к более фундаментальным вопросам нейробиологии и подробнее изучить изменения, происходящие в головном мозге в процессе старения. Решение этих фундаментальных проблем даст нам надежду на появление эффективных препаратов для лечения БА и других патологий ЦНС.
Заключение
Лечение на несколько месяцев замедлило прогрессирование болезни у Екатерины Павловны. Но затем болезнь взяла свое. Несмотря на дорогостоящую терапию, Екатерина Павловна постепенно теряла память. Со временем она начала называть свою дочь подругой, сестрой, а затем и мамой. Сын, который появлялся редко, совсем стерся из памяти Екатерины Павловны, как и все внуки. Дочери пришлось уйти с работы, чтобы ухаживать за матерью. От радостной и гостеприимной пожилой женщины не осталось и следа. Мир Екатерины Павловны сузился до квартиры в многоэтажке спального района на окраине города.
Однажды Екатерина Павловна сбежала из дома, и семья искала ее полдня. Женщину обнаружили у почты, куда она пришла в девять вечера за пенсией. С тех пор ее стали запирать. Когда дочь уходила из дома, Екатерина Павловна стучала в двери и кричала, чтобы ее выпустили. Елена плакала в подъезде, но нужно было идти за продуктами и лекарствами.
...Прошло полтора года. Екатерина Павловна уже носила подгузники и не могла сама залезать в ванну. Она уже почти не говорила и только бесконечно ходила из комнаты в комнату, раздражая Елену. Еще через полгода Екатерина Павловна передвигалась по квартире с большим трудом, а затем и вовсе перестала вставать. Дочь кормила ее с ложки, обрабатывала пролежни. Однажды у Екатерины Павловны неожиданно поднялась температура и появился кашель. Через неделю она умерла от пневмонии в своей постели, повторив путь тысяч стариков по всей планете.
Средняя продолжительность жизни человека с верифицированной болезнью Альцгеймера составляет 4–8 лет после постановки диагноза. Продолжительность жизни пациента напрямую зависит от качества ухода за ним. Сама по себе деменция становится причиной смерти только на терминальных стадиях заболевания: работа мозга нарушается настолько, что он перестает справляться с поддержанием жизненных функций. В США за период с 2000 по 2014 год смертность от болезни Альцгеймера выросла на 89%, при этом смертность от «стандартных» причин типа сердечных заболеваний снизилась. Косвенно это указывает на то, что уход за пациентами с деменцией стал лучше. Хорошо это или плохо — другой вопрос.
В остальных случаях причиной смерти становятся инфекционные заболевания: пневмония, восходящая инфекция мочевыделительной системы, сепсис на фоне пролежней. Умирают пациенты и от сопутствующей патологии: сердечно-сосудистые и онкологические заболевания не обходят стороной тех, кто уже чем-то болен.
Успехи современной медицины и качество ухода позволяют продлевать жизнь людям пожилого возраста независимо от того, какими болезнями они страдают. Несмотря на отсутствие значительных успехов в терапии болезни Альцгеймера, у нас остается надежда. Эту надежду подогревают исследования, организуемые по всему миру и финансируемые множеством стран. Разработаны глобальные и региональные планы предупреждения деменции и борьбы с ней. Ученые и врачи пытаются совместно противостоять эпидемии, которая незаметно подкрадывается к нам. Тысячи специалистов не сдаются вопреки неудачам и продолжают изучать механизмы развития патологии, потенциальные способы ее терапии и ранней диагностики.
Есть надежда и на помощь со стороны фундаментальных исследований работы нервной системы. Одной из таких программ является BRAIN Initiative (Brain Research through Advancing Innovative Neurotechnologies®). В объеме более $ 1,5 млрд в течение 2017–2025 годов ее будет финансировать правительство США в рамках подписанного уходящим президентом в декабре 2016 года Акта о медицине 21-го века (21st Century Cures Act). Программа построена так, что к 2025 году должна дать практический результат для здравоохранения. Среди вопросов, решаемых BRAIN Initiative, есть исследования памяти, в частности работы гиппокампа — области головного мозга, с поражения которой начинается болезнь Альцгеймера. Благодаря развитию нейробиологии мы постепенно начинаем понимать, как работает головной мозг. Без этого понимания нам не найти решения глобальной проблемы болезни Альцгеймера.
Консультантом при написании этой статьи выступил Антон Гопка.
Литература
- L. E. Hebert, J. Weuve, P. A. Scherr, D. A. Evans. (2013). Alzheimer disease in the United States (2010-2050) estimated using the 2010 census. Neurology. 80, 1778-1783;
- Kenneth M. Langa, Eric B. Larson, Eileen M. Crimmins, Jessica D. Faul, Deborah A. Levine, et. al.. (2017). A Comparison of the Prevalence of Dementia in the United States in 2000 and 2012. JAMA Intern Med. 177, 51;
- Stephanie J. Soscia, James E. Kirby, Kevin J. Washicosky, Stephanie M. Tucker, Martin Ingelsson, et. al.. (2010). The Alzheimer's Disease-Associated Amyloid β-Protein Is an Antimicrobial Peptide. PLoS ONE. 5, e9505;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Todd E. Golde. (2016). Alzheimer disease: Host immune defence, amyloid-β peptide and Alzheimer disease. Nat Rev Neurol. 12, 433-434;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- Murray Grossman. (2010). Primary progressive aphasia: clinicopathological correlations. Nat Rev Neurol. 6, 88-97;
- K. A. Vossel, K. Zhang, J. Brodbeck, A. C. Daub, P. Sharma, et. al.. (2010). Tau Reduction Prevents A -Induced Defects in Axonal Transport. Science. 330, 198-198;
- Erik S Musiek, David M Holtzman. (2015). Three dimensions of the amyloid hypothesis: time, space and 'wingmen'. Nat Neurosci. 18, 800-806;
- Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен;
- Болезнь Альцгеймера: ген, от которого я без ума;
- Yu-Wen Alvin Huang, Bo Zhou, Marius Wernig, Thomas C. Südhof. (2017). ApoE2, ApoE3, and ApoE4 Differentially Stimulate APP Transcription and Aβ Secretion. Cell. 168, 427-441.e21;
- Wahlund L.O., Westman E., van Westen D., Wallin A., Shams S., Cavallin L. et al. (2017). Imaging biomarkers of dementia: recommended visual rating scales with teaching cases. Insights Imaging. 8, 79–90;
- Anne M. Fagan. (2014). CSF Biomarkers of Alzheimer’s Disease: Impact on Disease Concept, Diagnosis, and Clinical Trial Design. Advances in Geriatrics. 2014, 1-14;
- Bob Olsson, Ronald Lautner, Ulf Andreasson, Annika Öhrfelt, Erik Portelius, et. al.. (2016). CSF and blood biomarkers for the diagnosis of Alzheimer's disease: a systematic review and meta-analysis. The Lancet Neurology. 15, 673-684;
- Молекула здравого ума;
- Francis P.T., Palmer A.M., Snape M., Wilcock G.K. (1999). The cholinergic hypothesis of Alzheimer's disease: a review of progress. J. Neurol. Neurosurg. Psychiatry. 66, 137–147;
- Jacqueline Birks, Richard J Harvey. (2006) Donepezil for dementia due to Alzheimer's disease;
- Jacqueline S Birks, John Grimley Evans. (2015) Rivastigmine for Alzheimer's disease;
- Clement Loy, Lon Schneider. (2006) Galantamine for Alzheimer's disease and mild cognitive impairment;
- Soysal P., Isik A.T., Stubbs B., Solmi M., Volpe M., Luchini C. et al. (2016). Acetylcholinesterase inhibitors are associated with weight loss in older people with dementia: a systematic review and meta-analysis. J. Neurol. Neurosurg. Psychiatry. 87, 1368–1374;
- Очень нервное возбуждение;
- Rupert McShane, Almudena Areosa Sastre, Neda Minakaran. (2006) Memantine for dementia;
- Taim Muayqil, Richard Camicioli. (2012). Systematic Review and Meta-Analysis of Combination Therapy with Cholinesterase Inhibitors and Memantine in Alzheimers Disease and Other Dementias. Dement Geriatr Cogn Disord Extra. 2, 546-572;
- Yun Li, Yahong Liu, Zhaojun Wang, Yongjun Jiang. (2013). Clinical trials of amyloid-based immunotherapy for Alzheimer's disease: end of beginning or beginning of end?. Expert Opinion on Biological Therapy. 13, 1515-1522;
- Petr Novak, Reinhold Schmidt, Eva Kontsekova, Norbert Zilka, Branislav Kovacech, et. al.. (2017). Safety and immunogenicity of the tau vaccine AADvac1 in patients with Alzheimer's disease: a randomised, double-blind, placebo-controlled, phase 1 trial. The Lancet Neurology. 16, 123-134;
- Robert Vassar, Peer-Hendrik Kuhn, Christian Haass, Matthew E. Kennedy, Lawrence Rajendran, et. al.. (2014). Function, therapeutic potential and cell biology of BACE proteases: current status and future prospects. J. Neurochem.. 130, 4-28;
- Severin Filser, Saak V. Ovsepian, Mercè Masana, Lidia Blazquez‐Llorca, Anders Brandt Elvang, et. al.. (2015). Pharmacological Inhibition of BACE1 Impairs Synaptic Plasticity and Cognitive Functions. Biological Psychiatry. 77, 729-739;
- Will next-gen BACE inhibitors dodge side effects? (2016). Kloster Seeon meeting on BACE proteases in health and disease;
- Carroll J. (2017). Another Alzheimer's drug flops in pivotal clinical trial. Science News;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера.