Сломать нельзя чинить
13 июня 2024
Сломать нельзя чинить
- 548
- 0
- 7
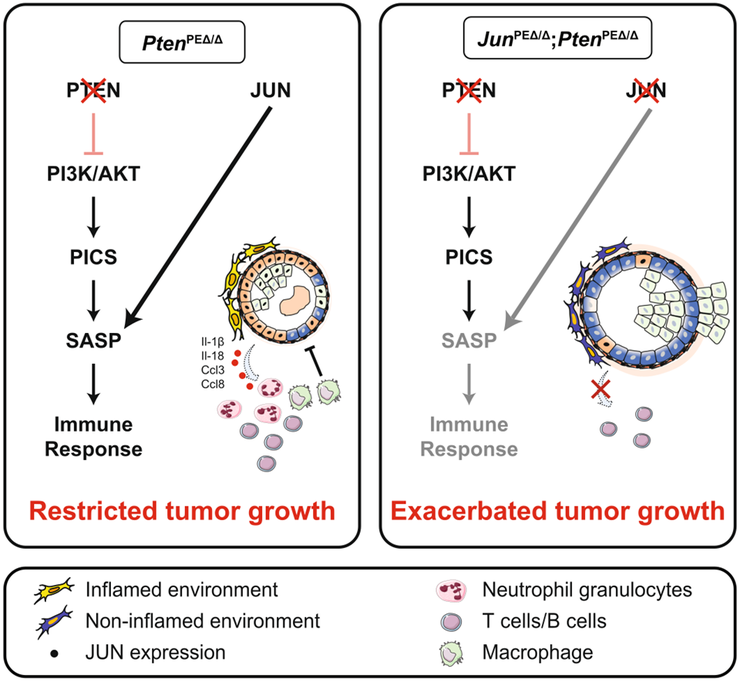
При раке простаты транскрипционный фактор JUN способствует индукции иммунного ответа на опухоль и снижает рост опухоли. Это довольно неожиданное наблюдение, поскольку традиционно Jun считается онкогеном, демонстрирует важность молекулярного контекста для оценки вклада того или иного белка в развитие злокачественной опухоли в каждом конкретном случае.
-
Автор
-
Редакторы
Одна из стратегий борьбы с онкологическими заболеваниями — сломать в раковых клетках всё так, чтобы они уже точно не смогли дальше расти и размножаться. И тут начинается гонка вооружений. Ученые находят белок, который надо ингибировать — раковые клетки находят способ не реагировать на ингибитор. Теперь для одного из ингибиторов ученые поняли, что именно позволяет игнорировать терапию. Это уже шах или просто ход конем?
Иммунотерапия онкологических заболеваний насчитывает множество стратегий, среди которых есть и помощь иммунитету больного. Она заключается в том, чтобы найти и элиминировать раковые клетки — это могут быть биспецифические [2] (а то и триспецифические) антитела, которые будто бы «за ручку» ведут Т лимфоциты к опухолевым клеткам, или ингибиторы иммунных чекпоинтов, которые не дают раковым клеткам обманывать цитотоксические Т-клетки. Нередко эти стратегии сочетают, чтобы усилить ответ. Большинство исследований в этой области сфокусировано на привлечении Т-лимфоцитов и клеток естественных киллеров (NK) к борьбе с неоплазией. Однако антираковый потенциал миелоидных клеток врожденного иммунитета, например, нейтрофилов [3], также интересует ученых.
В журнале Science Translational Medicine недавно была опубликована статья [4] с описанием преклинических испытаний биспецифического антитела, связывающего маркер Т-лимфоцитов CD3 с онкофетальным антигеном Claudin 6 (CLDN6). В норме этот белок не представлен в тканях взрослого человека, но он часто экспрессируется в разнообразных гематологических опухолях. Ученые не просто создали антитело — их идея заключается в том, чтобы вводить больным не готовый иммуноглобулин, а липидные наночастицы, несущие РНК, в которую биспецифическое антитело закодировано (аналогичный подход используется в мРНК вакцинах). Тесты на мышах и макаках-крабоедах показали, что высокая концентрация антитела в крови в таком случае сохраняется дольше, чем при прямом введении иммуноглобулина.
В случае нейробластомы динутуксимаб (моноклональное антитело к гликолипиду GD2, являющееся в настоящее время важной частью стратегии лечения данного типа опухоли) недостаточно эффективно привлекает в опухоль нейтрофилы — и при этом активирует систему комплемента, что вызывает боли у пациентов. Однако эти проблемы можно по крайней мере частично решить, изменив изотип терапевтического антитела с G на A, как показано в новом исследовании, опубликованном в Journal for Immunotherapy of Cancer [5]. Использование изотипа А вместо G значительно усилило цитотоксическую активность нейтрофилов в опухоли. Экспериментальная терапия новой изоформой динутуксимаба была скомбинирована с блокадой CD47, чтобы усилить иммунный ответ. Эта комбинация дала положительный результат на клеточных линиях и увеличила продолжительность жизни модельных животных с нейробластомой.
Раковые клетки несут на своей поверхности так называемые «неоантигены» — когда-то обычные белки, которые вследствие мутаций частично изменили свою первичную структуру. Чтобы активировать Т-лимфоциты, специальные антигенпрезентирующие клетки (чаще всего дендритные клетки [6]) должны продемонстрировать эти неоантигены. Однако презентация неоантигенов может быть подавлена опухолью. И это еще одно слабое место иммунной системы, которое использует злокачественное новообразование, чтобы подавить антираковый иммунный ответ. К счастью, этот процесс можно обратить. В новом исследовании [7] на белках BCL9/BCL9L было продемонстрировано, что блокирование активности этих белков в опухоли способствует инфильтрации дендритных клеток в новообразование и презентации ими неоантигенов.
Свою гипотезу авторы статьи проверили на искусственно выращенных в мышах опухолях. Вырезанные из животных неоплазии послужили in vitro моделью для экспериментального ингибирования BCL9/BCL9L. Следующий эксперимент проводился уже на животных с подсаженной опухолью. Оказалось, что в отсутствие BCL9/BCL9L или при ингибировании его активности дендритные клетки активируют сигнальный путь TAK1/NF-𝛋B/IRF1. Подробности можно найти в статье журнала Nature Signal transduction and targeted therapy [7].
Довольно часто различные терапевтические средства тестируются на мышиных моделях с перевиваемыми опухолями. В зависимости от задач исследования, это может быть опухоль, полученная от животного того же вида — и тогда исследование касается более общих механизмов борьбы с каким-то типом неоплазии. А может быть и такое, что опухолевые клетки получены от пациента — так называемые PDX-модели (Patient-derived xenograft). И тогда речь идет о персонализированной медицине — так зачастую тестируются различные лекарственные средства для борьбы с конкретной опухолью, содержащей свой набор критически важных мутаций. Но когда нужно исследовать молекулярные механизмы, лежащие в основе функционирования опухолевых клеток, чаще к исследованию привлекают генетически модифицированных животных. Причем по мере развития наших знаний о различных способах редактирования генома генетические модели становятся все сложнее и сложнее. Ученые из университета Дьюка (США) создали модель мыши с обонятельной нейробластомой.
Обонятельная нейробластома —это достаточно редкая форма неоплазии, которая, как считалось (но, впрочем, это не было доказано), развивается из клеток обонятельного эпителия. Сложная генетически модифицированная мышиная модель включала инактивацию наиболее значимых генов-онкосуппрессоров Rb1 и Trp53 и активацию онкогена Myc. Ткане- и времяспецифичность развития опухоли достигались совместным использованием систем CRISPR-Cas9 [8] и Cre-рекомбиназы, а также аденовирусной доставки — подробности опубликованы в журнале Cancer Cell [9].
Уже довольно давно терапевтической целью в борьбе со многими формами неоплазий стал белок PARP — полимераза поли-АДФ-рибозы. В клетке синтез поли-АДФ-рибозы служит сигналом о повреждении ДНК, поэтому всевозможные ингибиторы PARP рассматриваются как возможные препараты в борьбе с раковыми клетками, которые, как и другие клетки (и даже больше, чем другие в силу их активной пролиферации), нуждаются в системах репарации ДНК. В случае ингибирования PARP ожидается, что множественные незамеченные одно- и двухцепочечные разрывы ДНК будут несовместимы с жизнью клетки. Но не всё так просто — ингибиторы PARP сталкиваются с резистентностью, в том числе за счет включения механизма аутофагии [10]. В новой статье в журнале Molecular Cancer Research [11] ученые исследовали ингибитор ALK (этот фермент участвует в регуляции аутофагии) — сможет ли он усилить эффективность ингибиторов PARP. Тестируя кризотиниб (ингибитор ALK) в сочетании с олапарибом (PARP-ингибитор) на клетках, резистентных к олапарибу, исследователи наблюдали сниженую выживаемость, так же, как и в культивируемых органоидах, полученных от пациентов. Следующим этапом валидации результата была проверка на PDX-моделях: в этом случае это были опухоли, сформированные из клеток человеческого рака яичников. Опухоли в PDX-моделях уменьшались в размере — это было вызвано образованием активных форм кислорода, множественными повреждениями ДНК и сниженным активирующим фосфорилированием AKT, mTOR и, следовательно, сниженным ингибирующим фосфорилированием субстрата mTOR ULK1. В данном случае аутофагия, которая может быть амбивалентна — как прораковая, защищающая злокачественные клетки от терапевтических препаратов, так и контрраковая, сыграла на стороне терапии.
Тем временем, группа ученых из Шанхая обнаружила белок DOT1L, который, как сообщается, несет значительную долю ответственности за устойчивость опухоли к терапевтическим PARP ингибиторам при не-BRCA мутантном раке яичников. Согласно статье, опубликованной в журнале Molecular Cancer [12], PARP1 напрямую связывается с промотором гена DOT1L и таким образом ведет к увеличенной экспрессии этого белка. В свою очередь, DOT1L активирует транскрипцию двух других генов — PLCG2 и ABCB1 — через регуляцию метилирования гистонов. Высокая экспрессия PLCG2 связана с более плюрипотентным (stem-like) и метастатически активным фенотипом злокачественного новообразования, устойчивым к терапии PARP ингибиторами. А ген ABCB1 связан с экспортом связанных токсинов из клетки, и ассоциируется с устойчивостью ко многим терапевтическим препаратам.
Направленное ингибирование DOT1L делает раковые клетки чувствительными к ингибиторам PARP (уже известный олапариб был использован и в этом исследовании) как в культурах, так и в in vivo тестировании на мышиной модели.
Больше статей:
- Combining anti-VEGFR and anti-EGFR Antibodies: Randomized Phase II Study of Irinotecan and Cetuximab with/without Ramucirumab in Second-line Colorectal Cancer:(ECOG-ACRIN E7208) [13] — вторая линия терапии при RAS-специфичном колоректальном раке — комбинированное использование антител к рецепторам эпителиального фактора роста (EGFR) и рецептора фактора роста эндотелия сосудов (VEGFR) — сообщение о второй стадии клинических испытаний.
- Final results of RIGHT Choice: Ribociclib plus endocrine therapy vs combination chemotherapy in premenopausal women with clinically aggressive HR+/HER2− advanced breast cancer [14] — сравнение двух методов терапии при агрессивном HR+/HER2- раке молочной железы у женщин в период пременопаузы.
- First-line venetoclax combinations versus chemoimmunotherapy in fit patients with chronic lymphocytic leukaemia (GAIA/CLL13): 4-year follow-up from a multicentre, open-label, randomised, phase 3 trial [15] — итог четырехлетнего наблюдения за пациентами третьей стадии испытаний комбинированной терапии с использованием ингибитора Bcl2 венетоклакса при хроническом лимфолейкозе.
- Four-year overall survival update from the phase III HIMALAYA study of tremelimumab plus durvalumab in unresectable hepatocellular carcinoma [16] — сравнение эффективности и уровня выживаемости при комбинированной терапии антителами (тремелимумаб и дурвалумаб) против мультикиназного ингибитора сорафениба, в иной редакции опубликовано также в Journal of Clinical Oncology [17].
- Integrative molecular and spatial analysis reveals evolutionary dynamics and tumor-immune interplay of in situ and invasive acral melanoma [18] — протеомный и транскриптомный анализ эволюционного развития акрально-лентигинозной меланомы от локализованного до инвазивного состояния.
- Metabolic landscape of head and neck squamous cell carcinoma informs a novel kynurenine/Siglec-15 axis in immune escape [19] — метаболомное исследование плоскоклеточной карциномы и возможных путей истощения CD8+ Т-лимфоцитов в опухоли.
- Sintilimab (anti-PD-1 antibody) plus chidamide (histone deacetylase inhibitor) in relapsed or refractory extranodal natural killer T-cell lymphoma (SCENT): a phase Ib/II study [20] — новое моноклональное антитело к иммунному чекпоинту PD1 при рецидивирующей или рефрактерной экстранодальной NK/T лимфоме.
- The burden of cardiovascular disease and risk for subsequent major adverse cardiovascular events in survivors of childhood cancer: a prospective, longitudinal analysis from the St Jude Lifetime Cohort Study [21] — бремя сердечно-сосудистых заболеваний и рисков у людей, перенесших рак в детском возрасте, основанное на данных за 50 лет (с 1962 по 2012 годы).
- Translational insights and overall survival in the U31402-A-U102 study of patritumab deruxtecan (HER3-DXd) in EGFR-mutated NSCLC [22] — первая стадия испытаний конъюгированного с ингибитором топоизомеразы-1 моноклонального антитела к рецептору человеческого эпидермального фактора роста 3 (HER3) при немелкоклеточном раке легкого.
Литература
- Torben Redmer, Martin Raigel, Christina Sternberg, Roman Ziegler, Clara Probst, et. al.. (2024). JUN mediates the senescence associated secretory phenotype and immune cell recruitment to prevent prostate cancer progression. Mol Cancer. 23;
- Терапевтические моноклональные антитела;
- SciNat за январь 2024 #2: миграции внутри Евразии, перепрограммирование нейтрофилов в опухоли и предпочтение кодонов в плазматических клетках;
- Christiane R. Stadler, Ursula Ellinghaus, Leyla Fischer, Hayat Bähr-Mahmud, Martin Rao, et. al.. (2024). Preclinical efficacy and pharmacokinetics of an RNA-encoded T cell–engaging bispecific antibody targeting human claudin 6. Sci. Transl. Med.. 16;
- Chilam Chan, Marjolein Stip, Maaike Nederend, Marco Jansen, Elsemieke Passchier, et. al.. (2024). Enhancing IgA-mediated neutrophil cytotoxicity against neuroblastoma by CD47 blockade. J Immunother Cancer. 12, e008478;
- Дендритные клетки: профессиональные разведчики в «Опухолевой войне»;
- Fenglian He, Zhongen Wu, Chenglong Liu, Yuanyuan Zhu, Yan Zhou, et. al.. (2024). Targeting BCL9/BCL9L enhances antigen presentation by promoting conventional type 1 dendritic cell (cDC1) activation and tumor infiltration. Sig Transduct Target Ther. 9;
- Разнообразие и эволюция систем CRISPR/Cas;
- John B. Finlay, Abbie S. Ireland, Sarah B. Hawgood, Tony Reyes, Tiffany Ko, et. al.. (2024). Olfactory neuroblastoma mimics molecular heterogeneity and lineage trajectories of small-cell lung cancer. Cancer Cell. 42, 1086-1105.e13;
- Как клетка убирает мусор;
- Janice M. Santiago-O'Farrill, Alicia Blessing Bollu, Hailing Yang, Vivian Orellana, Marc Pina, et. al.. (2024). Crizotinib enhances PARP inhibitor efficacy in ovarian cancer cells and xenograft models by inducing autophagy. Molecular Cancer Research;
- Chaohua Liu, Jiana Li, Fei Xu, Lihua Chen, Mengdong Ni, et. al.. (2024). PARP1-DOT1L transcription axis drives acquired resistance to PARP inhibitor in ovarian cancer. Mol Cancer. 23;
- Howard S Hochster, Paul Catalano, Michelle Weitz, Edith P Mitchell, Deirdre Cohen, et. al.. (2024). Combining anti-VEGFR and anti-EGFR antibodies: Randomized phase II study of irinotecan and cetuximab with/without ramucirumab in second-line colorectal cancer:(ECOG-ACRIN E7208). JNCI: Journal of the National Cancer Institute;
- Yen-Shen Lu, Eznal Izwadi Bin Mohd Mahidin, Hamdy Azim, Yesim Eralp, Yoon Sim Yap, et. al.. (2024). Final results of RIGHT Choice: Ribociclib plus endocrine therapy vs combination chemotherapy in premenopausal women with clinically aggressive HR+/HER2− advanced breast cancer. JCO;
- Moritz Fürstenau, Arnon P Kater, Sandra Robrecht, Julia von Tresckow, Can Zhang, et. al.. (2024). First-line venetoclax combinations versus chemoimmunotherapy in fit patients with chronic lymphocytic leukaemia (GAIA/CLL13): 4-year follow-up from a multicentre, open-label, randomised, phase 3 trial. The Lancet Oncology. 25, 744-759;
- B. Sangro, S.L. Chan, R.K. Kelley, G. Lau, M. Kudo, et. al.. (2024). Four-year overall survival update from the phase III HIMALAYA study of tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. Annals of Oncology. 35, 448-457;
- Bruno Sangro, Peter R. Galle, Robin Kate Kelley, Chaiyut Charoentum, Enrico N. De Toni, et. al.. (2024). Patient-Reported Outcomes From the Phase III HIMALAYA Study of Tremelimumab Plus Durvalumab in Unresectable Hepatocellular Carcinoma. JCO;
- Hengkang Liu, Jiawen Gao, Mei Feng, Jinghui Cheng, Yuchen Tang, et. al.. (2024). Integrative molecular and spatial analysis reveals evolutionary dynamics and tumor-immune interplay of in situ and invasive acral melanoma. Cancer Cell. 42, 1067-1085.e11;
- Xin‐Yu Zhang, Jian‐Bo Shi, Shu‐Fang Jin, Rui‐Jie Wang, Ming‐Yu Li, et. al.. (2024). Metabolic landscape of head and neck squamous cell carcinoma informs a novel kynurenine/Siglec‐15 axis in immune escape. Cancer Communications;
- Yan Gao, Haixia He, Xueping Li, Liling Zhang, Wei Xu, et. al.. (2024). Sintilimab (anti-PD-1 antibody) plus chidamide (histone deacetylase inhibitor) in relapsed or refractory extranodal natural killer T-cell lymphoma (SCENT): a phase Ib/II study. Sig Transduct Target Ther. 9;
- Rawan A Hammoud, Qi Liu, Stephanie B Dixon, Aron Onerup, Daniel A Mulrooney, et. al.. (2024). The burden of cardiovascular disease and risk for subsequent major adverse cardiovascular events in survivors of childhood cancer: a prospective, longitudinal analysis from the St Jude Lifetime Cohort Study. The Lancet Oncology. 25, 811-822;
- H.A. Yu, C. Baik, D.-W. Kim, M.L. Johnson, H. Hayashi, et. al.. (2024). Translational insights and overall survival in the U31402-A-U102 study of patritumab deruxtecan (HER3-DXd) in EGFR-mutated NSCLC. Annals of Oncology. 35, 437-447.