Смертельное оружие: бактерии на службе у насекомых
08 февраля 2021
Смертельное оружие: бактерии на службе у насекомых
- 794
- 0
- 0
Некоторые насекомые научились использовать способность мицелиальных актинобактерий синтезировать «боевые отравляющие вещества» как средство защиты от нежелательных грибов и бактерий, и образуют с ними симбиотические ассоциации
коллаж Юлии Закалюкиной (персонажи: Minuscule: Valley of the Lost Ants®)
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Симбиотические союзы между насекомыми и актинобактериями существуют миллионы лет, но активно изучаться стали сравнительно недавно. Жизнь в постоянном контакте с почвой и растительными остатками и возделывание различных грибных культур требуют от насекомых особых мер защиты от нежелательных или опасных микроорганизмов. Одним из наиболее эффективных способов такой защиты является «ношение при себе» эктосимбионтных актинобактерий, продуцирующих антибиотики непосредственно на поверхности тела насекомых. Антибиотики могут как защищать здоровье насекомых на разных стадиях жизни, так и обеспечивать сохранность их пищевых ресурсов. С каждым годом сообщений о таких симбиозах становится все больше.
Конкурс «Био/Мол/Текст»-2020/2021
 Эта статья участвовала в конкурсе «Био/Мол/Текст»-2020/2021 в номинации «Свободная тема» и будет опубликована в журнале «Наука и жизнь».
Эта статья участвовала в конкурсе «Био/Мол/Текст»-2020/2021 в номинации «Свободная тема» и будет опубликована в журнале «Наука и жизнь».

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
«Сильные, смелые, ловкие, умелые»
Насекомые начали свое эволюционное шествие уже более 479 млн лет назад [1]. За этот более чем внушительный срок они смогли создать поистине уникальные «изобретения», которые мы успешно у них заимствуем. Неизвестно, как сложилась бы судьба человечества, если бы люди еще с давних времен не научились добывать мед, долгое время служивший единственным источником концентрированных сахаров, особенно ценных для развития крупного головного мозга гоминид [2]. А шелк — одно из достояний насекомых — разве не оказал огромное влияние на мировую историю? Ведь именно он способствовал возникновению Великого шелкового пути, связавшего между собой две части света: Европу и Азию [3].
И по сей день эти удивительные животные продолжают вдохновлять исследователей и изобретателей. Одна из новых и перспективных областей науки — биомиметика — активно черпает у них идеи: от разработки новых промышленных материалов, тканей, косметики, красок [4] до создания биороботов [5] и даже для строительства будущей колонии на Марсе [6]!
Необходимость приспосабливаться к изменчивым условиям среды и осваивать различные экологические ниши послужили стимулом для развития у насекомых разнообразных морфологических форм, моделей поведения и видов социальной организации. Но особенно впечатляют «производственные достижения» многих общественных насекомых — например, архитектурные шедевры муравьев и термитов [7], обладающих «социальным интеллектом» [8]; мастерство ос и пчел, которые наладили производство строительных материалов для своих гнезд на основе растительных остатков, смоченных клейкой слюной [9], а с некоторых пор даже перешедшие на использование пластика [10]; и оборонные технологии, какими, например, обладает жук-бомбардир, способный обстреливать врага стоградусной жидкостью из отверстия в брюшке [11].
Кроме того, насекомые задолго до ученых предвосхитили расцвет так называемой «Эры антибиотиков» в фармакологии. Они уже десятки миллионов лет [12] используют антибиотики как оружие в борьбе с патогенами, приручив, а иногда и буквально привязав к себе их продуцентов — скромных грамположительных прокариот отдела Actinobacteria.
Кто же такие эти актинобактерии?
Актинобактерии, или, как их раньше называли, актиномицеты, — это разнообразная и чрезвычайно успешная группа грамположительных прокариот, многие из которых образуют мицелий, внешне подобный грибному, только гораздо тоньше — в среднем около одного микрометра толщиной (рис. 1). Способность использовать в качестве питания «трудноперевариваемые» для многих других бактерий полимеры (пектин, хитин, целлюлозу) или довольствоваться крохами, остающимися после пиршества микроорганизмов-копиотрофов; сравнительная неприхотливость к внешним условиям (например дефициту влаги); умение образовывать споры, помогающие переживать совсем уж неблагоприятные условия и расселяться, — все это позволило актинобактериям занять свое место в наземных и водных экосистемах. Однако несмотря на свою кажущуюся скромность в требованиях и неторопливость в освоении пространства, актинобактерии имеют один существенный козырь, который заставляет считаться с ними всех остальных микробов, — способность к синтезу огромного разнообразия антибиотических веществ!
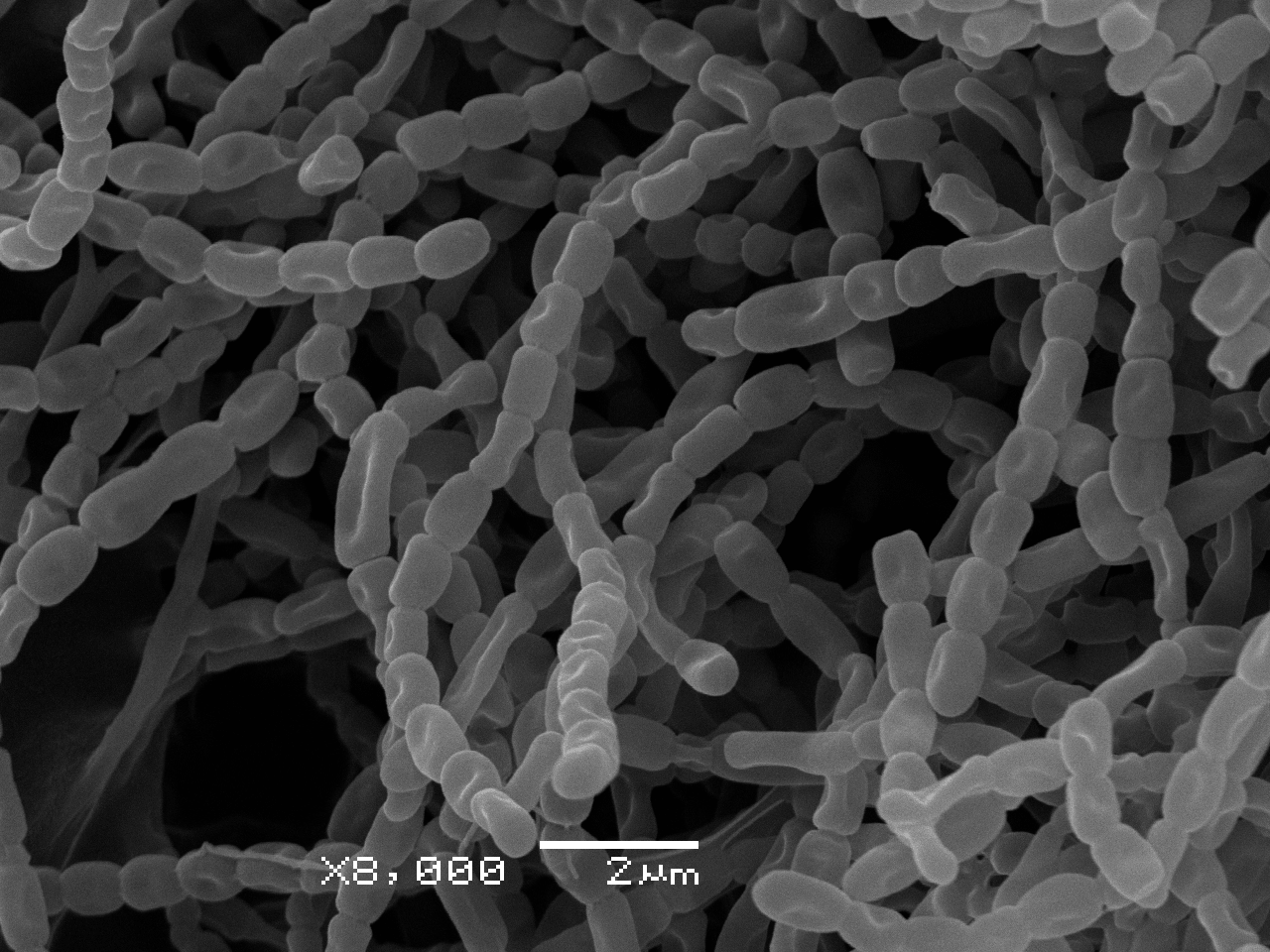
Рисунок 1. Электронная микрофотография цепочек спор Streptomyces albidoflavus A10
[16], фото автора статьи
Действительно, актинобактерии производят 2/3 всех ныне известных антибиотиков, в том числе противоопухолевые, иммуносупрессорные и противопаразитарные вещества [13], хотя только сравнительно небольшая часть их используется в медицине.
Такая уникальная способность делает актинобактерий весьма желанными партнерами для ассоциаций с другими организмами [14], и насекомые не преминули этим воспользоваться. Проживание актинобактерий на кутикуле насекомых, где они могут продуцировать антибиотики, ограждающие своих шестиногих хозяев от патогенов, — так называемые защитные эктосимбиозы [15], — возможно, и есть секрет эволюционного успеха насекомых!
Волк в осиной шкуре
Пчелиный волк... Столь грозное прозвище оса Philanthus triangulum из семейства песочных ос заслужила благодаря своей привычке нападать и утаскивать в свое логово медоносных пчел, увлеченных сбором нектара. Внезапная атака, удар ядовитым жалом... и вот уже пчелиный волк, сжимая парализованную пчелу в объятиях (рис. 2), мчится к своей норке, вырытой загодя во влажной земле. Там на глубине нескольких метров в темноте и прохладе среди усыпленных пчел вскоре будет торжественно отложено яичко, из которого предстоит вылупиться голодному «пчелиному волчонку».

Рисунок 2. Самка «пчелиного волка» Philanthus triangulum со своей жертвой
По осиному обычаю мамы не будет рядом, когда это случится, но она успела предусмотреть всё, чтобы личинке ничего не угрожало: надежно скрыла от хищников и обеспечила пищей. Однако теплая и влажная почва таит в себе весьма грозную опасность для юной личинки — микроорганизмы! Как защитить осиную деточку от разной микробной хвори?
Оказывается, осиная мать предусмотрела и это! В железах, расположенных на антеннах у осы, обитают актинобактерии рода Streptomyces. Перед тем, как отложить яичко, оса трется усиками о потолок камеры и оставляет там капельки секрета, в которых находятся клетки стрептомицетов. После того, как из яйца вылупится личинка и съест заготовленных матерью пчел, она завернется в кокон, попутно увлекая за собой и находящихся на потолке камеры бактерий [17]. В течение всего зимнего периода стрептомицеты на поверхности кокона будут вырабатывать до девяти различных антибиотиков [18], воздействующих на любые патогенные микроорганизмы. Личинка может спокойно ждать лета — она под надежной защитой!
Из грязи — да в мази! Новый антибиотик обнаружен у симбионтов «грязевых» ос
Идея поиска продуцентов новых антибиотиков у насекомых и обнаружение таковых у Philanthus triangulum побудило исследователей повнимательнее присмотреться и к другим осам. Строительство гнезд из глины, складирование в них в качестве запасов пищи парализованных насекомых и длительное созревание личинки в замкнутой камере — эти особенности образа жизни так называемых «грязевых» или роющих ос несомненно напоминают привычки пчелиных волков, а значит, предрасполагают к поиску у них возможных «защитных» актинобактерий. Расчет оказался верным: из особей Sceliphron caementarium (рис. 3) удалось выделить несколько штаммов стрептомицетов, обладающих значительной антибиотической активностью, в том числе описать новый антигрибной антибиотик сцелифролактам [19].
«Хороший, плохой, злой»: актинобактерия, гриб, короед
Гроза сосновых лесов южных и юго-восточных штатов США жук-лубоед Dendroctonus frontalis, впрочем, как и другие короеды по всему миру, не щадит ни молодых, ни старых деревьев, прокладывая извилистые ходы в живых тканях и не оставляя дереву никаких шансов (рис. 4).

Рисунок 4. Тоннели, проложенные Dendroctonus frontalis в древесине сосны
Так же, как и его родственники, лубоед не вредитель-одиночка, он главарь настоящей шайки вредителей леса! Самки жука не только прогрызают ходы в коре сосны и откладывают в них яйца, но и «засевают» их особыми грибами рода Entomocorticium, бережно хранимыми в специальных ямках на внутренней стороне груди — микангиях (рис. 5а).
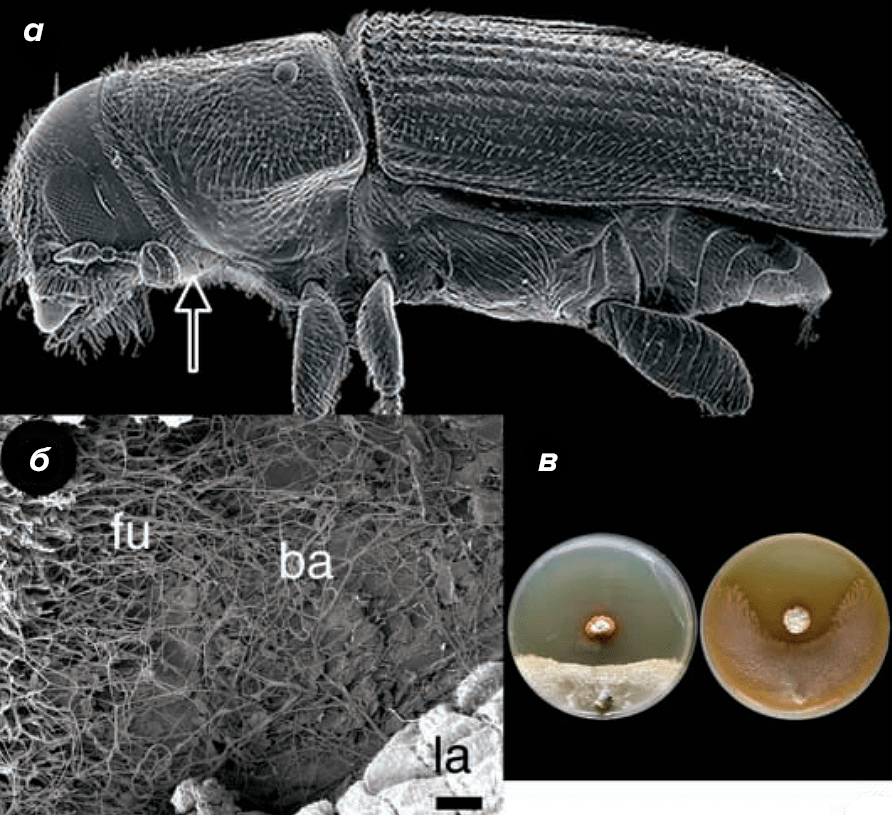
Рисунок 5. Короед, гриб и актинобактерия глазами исследователя. а — Жук Dendroctonus frontalis под сканирующим электронным микроскопом (стрелка указывает положения микангия). б — Рост гриба (fu) и актинобактерии (ba) на внутренней поверхности камеры, где обитает личинка (la). в — In vitro антагонизм: в центре чашек Петри растет актинобактерия — продуцент микангимицина, который подавляет рост Ophiostoma minus (слева) и Entomocorticium sp. (справа).
Грибы, попав во внутренние ткани дерева — флоэму, начинают обильно развиваться, а вылупляющиеся из яиц личинки жука получают полезную грибную пищевую добавку к лубяному рациону. Однако и здесь не обходится без борьбы: одновременно с «полезными» для лубоедов грибами в ходы и камеры попадают конкурентные грибы Ophiostoma minus, которых переносят обитающие на поверхности жуков крохотные клещи. Офистомовые грибы, их еще называют возбудителями «синевы» древесины, тоже активно разлагают живые ткани дерева, однако не представляют для юных короедов никакой питательной ценности, а напротив, угнетают их развитие [21].
Как широко известно, в Америке разрешено ношение оружия, и сосновые лубоеды этим пользуются: в своих микангиях-карманах они держат «заряженные» антибиотиками актинобактерии, которыми также засевают проделанные ходы (рис. 5б). Исследователям удалось выделить из чистых культур актинобактерий ранее неизвестный антибиотик микангимицин и показать, что в малых концентрациях он эффективно подавляет рост офистомового гриба (рис. 5в), в то время как милый сердцу лубоедов Entomocorticium sp. к таким дозам почти не чувствителен [20].
Подобным же образом обустроили свою жизнь и другие жуки-короеды из трибы Xyleborini — Xyleborinus saxesenii и Xyleborus affinis, называемые амброзиевыми потому, что культивируют амброзиевые грибы, в частности представителей родов Ambrosiella и Raffaelea, которыми и питаются [22]. В своих микангиях самки бережно хранят зачатки грибов, которые переносят и расселяют в прогрызаемых ходах в заболонной части ствола. Когда в ходах наконец появится белый налет мицелия, можно заняться и откладыванием яиц, ведь если грибной сад не будет процветать, самка покинет дерево или погибнет (рис. 6).

Рисунок 6. Самка Xyleborinus saxesenii за работой: тонкий белый налет на стенках туннеля — мицелий амброзиевого гриба
Выбор дерева для строительства нового гнезда вовсе не случаен: самки амброзиевых жуков ориентируется на запах этанола, образующегося в больших количествах в тканях ослабленных деревьев из-за ограниченной доступности кислорода в результате действия различных стрессорных факторов. Но не спешите упрекать будущую мать юных короедов в пагубной страсти к алкоголю! Пропитанная спиртом древесина (в среде накапливается не более 5% этанола), как нельзя лучше предназначена для роста грибных культур — Ambrosiella spp. и Raffaelea spp., — и в то же время тормозит развитие вездесущих грибов Aspergillus spp. и Penicillium spp. [23], способных вытеснить полезную культуру и обречь жуков на голодную смерть.
Но, как говорится, не спиртом единым. У амброзиевых короедов Xyleborinus saxesenii и Xyleborus affinis, оказывается, в микангиях еще кое-что припрятано: штаммы актинобактерий Streptomyces griseus, способные продуцировать известный антигрибной антибиотик циклогексимид, к которому культивируемые грибы оказались малочувствительны, а вот чужие — как раз наоборот [24]. Спирт и фунгицид — вот секрет богатых грибных урожаев!
Пострадавшей стороной во всех этих хитросплетенных короедо-грибо-актинобактериальных взаимоотношениях оказываются деревья. Экономические потери от прожорливых жуков и их грибных сожителей в США составляют порядка 30 млн долларов ежегодно [25].
Грибники-разбойники
Мелкие южноамериканские муравьи Allomerus decemarticulatus, обитающие на тропическом растении Hirtella physophora, известны благодаря искусному строительству хитрой западни для ловли крупной добычи [26].
Hirtella physophora является мирмекофитом, она предоставляет муравьям для проживания особые места: листовые «камеры», или доматии, — две полые сферы по обеим сторонам от черешка листа (рис. 7а). На каждом растении расквартировывается одна муравьиная семья, члены которой проживают в отдельных «бунгало».
Избавленные от необходимости сооружать себе жилища, муравьи Allomerus вовсе не сидят, сложа лапки: их таланты инженеров-конструкторов в полной мере раскрываются во время организации коварных ловушек.
Их ловушка представляет собой галерею, сооруженную вдоль веточки, свод которой сплетен из волосков самого растения, а также всевозможных растительных остатков. В этом своде муравьи прогрызают «иллюминаторы» под размер своей головы, чтобы быстро выскочить наружу при необходимости. Бесспорное строительное ноу-хау данного сооружения — использование гриба из порядка Chaetothyriales, которым муравьи засевают свою конструкцию: гриб быстро и густо оплетает всё мицелием, придавая сооружению большую прочность (рис. 7б).
Когда все готово к засадной охоте, муравьи прячутся внутри, выставляя в «окошки» только цепкие мандибулы, и вот уже веточка дрогнула — на нее присела муха, а может быть, даже и саранча.
Ничего не подозревающее насекомое собралось полакомиться зеленым листом и не спеша движется по странной плетеной поверхности, как вдруг его лапка проваливается в отверстие и словно попадает в капкан: на ней смыкаются чьи-то острые челюсти! Секунда — то же происходит и с другой лапкой, потом со следующей, и вот уже насекомое застряло, крепко схваченное за все конечности крошечными рыжими разбойниками, которые начинают выскакивать из укрытия и безжалостно жалить и кусать добычу (рис. 8). Постепенно прибывают все новые и новые муравьи, облепляя жертву — с крупной добычей так иногда и полдня провозятся.

Рисунок 8. «Налетай, ребята!»: жертва надежно зафиксирована охотниками
Муравьи Allomerus прекрасно понимают, чему они обязаны за возможность охотится на добычу, многократно превосходящую их размерами, и поэтому тщательно берегут свой секретный грибной материал и передают по наследству. Муравьиная королева отправляется в брачный лет с кусочком гриба, захваченного из родительского гнезда, ей важно сделать всё, чтобы и на новом месте гриб чувствовал себя превосходно. Чтобы уберечь Chaetothyriales от вытеснения другими грибами, муравьи не только удаляют споры конкурирующих грибов, но и, по всей вероятности, прибегают к помощи актинобактерий из рода Streptomyces, выделяющих противогрибной антибиотик циклогексимид [27].
Грибоводческий колхоз: битва за урожай
Но самый яркий и широко известный пример эктосимбиоза между актинобактериями и насекомыми, с которого, собственно, и началось изучение этого интереснейшего явления, — это муравьи из трибы Attini [28]. Эти шестиногие южноамериканские «фермеры» устраивают в своих подземных гнездах огромные плантации грибов семейства Lepiotaceae, произрастающих на различных органических остатках (как это принято у низших аттин) или на свежесрезанных листьях (у высших аттин, благодаря чему они также известны как муравьи-листорезы, рис. 9). Возделываемая грибная культура, во-первых, расщепляет растительные полимеры до простых сахаров (глюкозы, ксилозы и других) — подходящей пищи для взрослых тружеников, — а во-вторых, сама по себе служит отличным источником белка для подрастающей муравьиной смены [29].

Рисунок 9. Листорез Acromyrmex lundii заканчивает кройку листа
Благополучие культивируемого гриба, а значит, и высокие урожаи, обеспечивают здоровье и рост муравьиной семьи, поэтому на плантациях денно и нощно трудятся самые маленькие рабочие — минимы [30]. Они подтаскивают новый листовой субстрат, тщательно измельчают его и укладывают особым образом, подрезают разрастающиеся грибные кущи, а самое главное, зорко следят за чистотой и порядком, вовремя вынося отработанный материал и «выпалывая» посторонние микроорганизмы.
Торжественную закладку грибного сада, так же, как и у жуков-короедов, производит муравьиная королева, захватывающая с собой из родительского гнезда комочек грибной рассады (рис. 10).
Без сомнения древнейшие на Земле перепончатокрылые земледельцы вызывают немалый интерес у публики и, конечно, у исследователей [31]. Так, ученые обратили внимание на своеобразный белый налет на кутикуле некоторых видов листорезов, который при более детальном исследовании оказался ничем иным, как собственно мицелием актинобактерий [32].
Некоторое время бытовало предположение [33], что актинобактериальный налет содержит исключительно представителей рода Pseudonocardia, которых королева также приносит из отчего гнезда и уже десятки миллионов лет передает своим дочерям [34]. Обитая непосредственно на кутикуле в небольших углублениях, куда выходят протоки экзокринных желез (рис. 11), актинобактерии выделяют антибиотик, чья активность защищает съедобную для муравьев грибную культуру от гриба-вредителя рода Escovopsis.

Рисунок 11. Труженики грибных полей Acromyrmex echinatior демонстрируют «белые воротнички», представляющие собой налет актинобактерий
Широкая популяризация этой симбиотической модели между муравьями-листорезами, полезным для них грибом, грибом-паразитом и чудесной спасительницей бактерией псевдонокардией [35] привела к более детальным исследованиям: на поверхности кутикулы муравьев удалось обнаружить антибиотик валиномицин (рис. 12е и 12ж), а также показать, что особи, лишенные актинобактериального мицелия, легче заражаются и гибнут от патогенных микроорганизмов, чем особи с белым налетом (рис. 12з). Кроме того, были обнаружены представители и других родов актинобактерий, находящихся в симбиотических отношениях с листорезами [35].
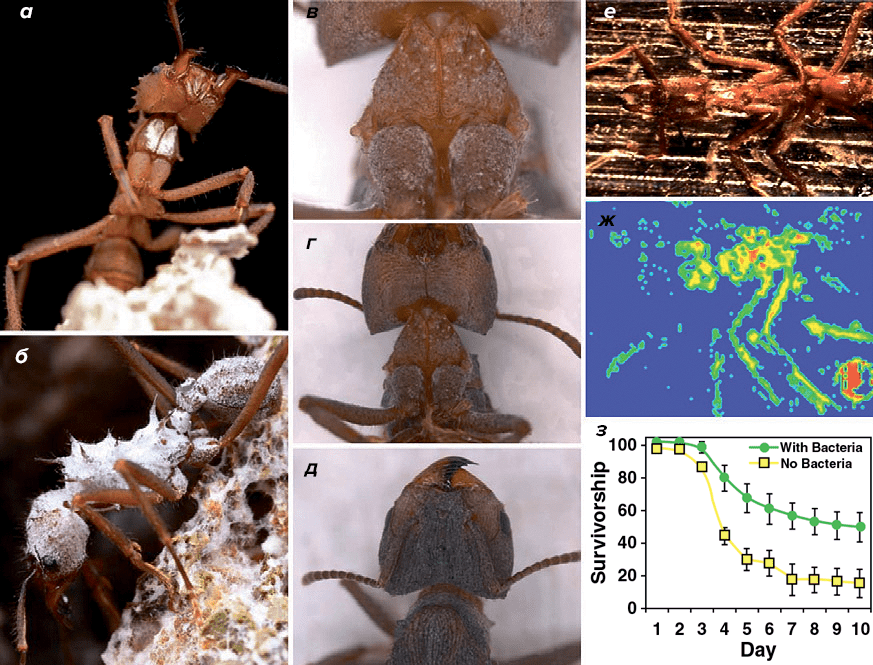
Рисунок 12. Доказательная база о наличии симбиотических отношений между муравьями-листорезами и актинобактериями. Биопленки актинобактерий на поверхности муравьев Acromyrmex echinatior (а–д). MALDI-анализ, показывающий распределение антибиотика валиномицина на поверхности кутикулы A. echinatior: самая высокая концентрация показана красным, самая низкая — синим (е, ж). Кривые выживаемости листорезов при заражении энтомопатогенным грибом: желтым маркером показаны муравьи, лишенные актинобактерий, зеленым — интактные особи (з).
Несмотря на то, что в вопросах о путях передачи актинобактерий-симбионтов, их роли в жизни муравьев и совместной коэволюции еще не поставлена точка [36], совершенно ясно, что возможность влиять на собственное здоровье и сохранность своего грибного сада с помощью антибиотиков — весьма мощное преимущество, которым могут наделить насекомых дружественные актинобактерии.
«Верной дорогой идете, товарищи»! Дальнейшие поиски симбиозов и их значение для биотехнологии
Описанные выше примеры использования насекомыми антибиотиков как химического оружия, пестицидов или лекарств пока еще немногочисленны, но продолжают пополняться. С каждым годом появляются новые работы, посвященные теме ассоциаций актинобактерий с насекомыми, например, с черными муравьями-древоточцами Camponotus vagus — одними из самых крупных на территории России и Европы (рис. 13). Обитая в мертвой древесине, они, как оказалось, находятся в тесных ассоциациях с продуцентами различных антибиотиков [37], [38].

Рисунок 13. Черный муравей-древоточец Camponotus vagus
Такие работы не только приоткрывают завесу над тайнами природы, но имеют большое значение для биотехнологии: актинобактерии также способны синтезировать множество ферментов, которым можно найти успешное применение [12], [39]. Так например, некоторые штаммы мицелиальных прокариот, выделенные из ассоциаций с насекомыми, обитающими в древесине, демонстрируют способность активно разрушать целлюлозу [40]. А такие таланты крайне востребованы для разработки методов получения биотоплива.
Но самое главное, что поиск неизвестных биологически активных веществ, которые могут обладать новыми ценными свойствами, или объяснение механизма действия уже описанных соединений [38] могут помочь в борьбе с растущей антибиотикорезистентностью [41].
Почему за миллионы лет теснейшего сожительства с бактериями-продуцентами выделяемые ими антибиотики все также эффективны и помогают насекомым, а человечество, использующее антибиотики менее ста лет, уже лицом к лицу столкнулось с мультиустойчивостью патогенов практически ко всем применяемым препаратам? Возможно, причина в тонком механизме настройки процесса продукции антибиотиков, в котором участвуют как бактерии-симбионты, так и насекомое-хозяин. А может быть, насекомые регулярно обновляют набор «полезных сожителей», черпая их из окружающей природы. В любом случае, они научились пользоваться «смертоносным химическим оружием», не оборачивая его против себя! Кажется, настало время снова у них поучиться...
Литература
- B. Misof, S. Liu, K. Meusemann, R. S. Peters, A. Donath, et. al.. (2014). Phylogenomics resolves the timing and pattern of insect evolution. Science. 346, 763-767;
- Alyssa N. Crittenden. (2011). The Importance of Honey Consumption in Human Evolution. Food and Foodways. 19, 257-273;
- Alfred J. Andrea. (2014). The Silk Road in World History: A Review Essay. The Asian review of World Histories. 2, 105-127;
- Может ли муха стать нанотехнологом?;
- Биороботы: фантастика или реальность?;
- Ng Shiwei, Stylianos Dritsas, Javier G. Fernandez. (2020). Martian biolith: A bioinspired regolith composite for closed-loop extraterrestrial manufacturing. PLoS ONE. 15, e0238606;
- Nikita Zachariah, Saurabh Singh, Tejas G. Murthy, Renee M. Borges. (2020). Bi-layered architecture facilitates high strength and ventilation in nest mounds of fungus-farming termites. Sci Rep. 10;
- Mathieu Lihoreau, Tanya Latty, Lars Chittka. (2012). An Exploration of the Social Brain Hypothesis in Insects. Front. Physio.. 3;
- K. Kudô, Sô. Yamane, S. Mateus, K. Tsuchida, Y. Itô, et. al.. (2001). Nest materials and some chemical characteristics of nests of a New World swarm-founding polistine wasp,Polybia paulista(Hymenoptera Vespidae). Ethology Ecology & Evolution. 13, 351-360;
- Mariana L. Allasino, Hugo J. Marrero, Jimena Dorado, Juan Pablo Torretta. (2019). Scientific note: first global report of a bee nest built only with plastic. Apidologie. 50, 230-233;
- E. M. Arndt, W. Moore, W.-K. Lee, C. Ortiz. (2015). Mechanistic origins of bombardier beetle (Brachinini) explosion-induced defensive spray pulsation. Science. 348, 563-567;
- Hongjie Li, Jeffrey Sosa-Calvo, Heidi A. Horn, Mônica T. Pupo, Jon Clardy, et. al.. (2018). Convergent evolution of complex structures for ant–bacterial defensive symbiosis in fungus-farming ants. Proc Natl Acad Sci USA. 115, 10720-10725;
- Essaid Ait Barka, Parul Vatsa, Lisa Sanchez, Nathalie Gaveau-Vaillant, Cedric Jacquard, et. al.. (2016). Taxonomy, Physiology, and Natural Products of Actinobacteria. Microbiol. Mol. Biol. Rev.. 80, 1-43;
- Ryan F. Seipke, Martin Kaltenpoth, Matthew I. Hutchings. (2012). Streptomycesas symbionts: an emerging and widespread theme?. FEMS Microbiol Rev. 36, 862-876;
- Martin Kaltenpoth. (2009). Actinobacteria as mutualists: general healthcare for insects?. Trends in Microbiology. 17, 529-535;
- Anna A. Baranova, Alexey A. Chistov, Anton P. Tyurin, Igor A. Prokhorenko, Vladimir A. Korshun, et. al.. (2020). Chemical Ecology of Streptomyces albidoflavus Strain A10 Associated with Carpenter Ant Camponotus vagus. Microorganisms. 8, 1948;
- Wolfgang Goettler, Martin Kaltenpoth, Gudrun Herzner, Erhard Strohm. (2007). Morphology and ultrastructure of a bacteria cultivation organ: The antennal glands of female European beewolves, Philanthus triangulum (Hymenoptera, Crabronidae). Arthropod Structure & Development. 36, 1-9;
- Martin Kaltenpoth, Tobias Engl. (2014). Defensive microbial symbionts in Hymenoptera. Funct Ecol. 28, 315-327;
- Dong-Chan Oh, Michael Poulsen, Cameron R. Currie, Jon Clardy. (2011). Sceliphrolactam, a Polyene Macrocyclic Lactam from a Wasp-AssociatedStreptomycessp.. Org. Lett.. 13, 752-755;
- J. J. Scott, D.-C. Oh, M. C. Yuceer, K. D. Klepzig, J. Clardy, C. R. Currie. (2008). Bacterial Protection of Beetle-Fungus Mutualism. Science. 322, 63-63;
- Richard W. Hofstetter, Jamie Dinkins-Bookwalter, Thomas S. Davis, Kier D. Klepzig. (2015). Symbiotic Associations of Bark Beetles. Bark Beetles. 209-245;
- Henrik H De Fine Licht, Peter H W Biedermann. (2012). Patterns of functional enzyme activity in fungus farming ambrosia beetles. Front Zool. 9, 13;
- Christopher M. Ranger, Peter H. W. Biedermann, Vipaporn Phuntumart, Gayathri U. Beligala, Satyaki Ghosh, et. al.. (2018). Symbiont selection via alcohol benefits fungus farming by ambrosia beetles. Proc Natl Acad Sci USA. 115, 4447-4452;
- Kirk J. Grubbs, Frank Surup, Peter H. W. Biedermann, Bradon R. McDonald, Jonathan L. Klassen, et. al.. (2020). Cycloheximide-Producing Streptomyces Associated With Xyleborinus saxesenii and Xyleborus affinis Fungus-Farming Ambrosia Beetles. Front. Microbiol.. 11;
- T. D. Schowalter. (2012). Ecology and Management of Bark Beetles (Coleoptera: Curculionidae: Scolytinae) in Southern Pine Forests. j integ pest manage. 3, 1-7;
- Alain Dejean, Pascal Jean Solano, Julien Ayroles, Bruno Corbara, Jérôme Orivel. (2005). Arboreal ants build traps to capture prey. Nature. 434, 973-973;
- Ryan F. Seipke, Jörg Barke, Mario X. Ruiz-Gonzalez, Jérôme Orivel, Douglas W. Yu, Matthew I. Hutchings. (2012). Fungus-growing Allomerus ants are associated with antibiotic-producing actinobacteria. Antonie van Leeuwenhoek. 101, 443-447;
- Jörg Barke, Ryan F Seipke, Sabine Grüschow, Darren Heavens, Nizar Drou, et. al.. (2010). A mixed community of actinomycetes produce multiple antibiotics for the fungus farming ant Acromyrmex octospinosus. BMC Biology. 8, 109;
- Aline Silva, Maurício Bacci Jr., Célia Gomes de Siqueira, Odair Correa Bueno, Fernando Carlos Pagnocca, Maria José Aparecida Hebling. (2003). Survival of Atta sexdens workers on different food sources. Journal of Insect Physiology. 49, 307-313;
- Hölldobler B. and Wilson E.O. The superorganism: the beauty, elegance, and strangeness of insect societies. W.W. Norton, 2009. — 522 p.;
- Ulrich G. Mueller, Nicole M. Gerardo, Duur K. Aanen, Diana L. Six, Ted R. Schultz. (2005). The Evolution of Agriculture in Insects. Annu. Rev. Ecol. Evol. Syst.. 36, 563-595;
- C. R. Currie, U. G. Mueller, D. Malloch. (1999). The agricultural pathology of ant fungus gardens. Proceedings of the National Academy of Sciences. 96, 7998-8002;
- C. R. Currie. (2003). Ancient Tripartite Coevolution in the Attine Ant-Microbe Symbiosis. Science. 299, 386-388;
- T. R. Schultz, S. G. Brady. (2008). Major evolutionary transitions in ant agriculture. Proceedings of the National Academy of Sciences. 105, 5435-5440;
- R. Sen, H. D. Ishak, D. Estrada, S. E. Dowd, E. Hong, U. G. Mueller. (2009). Generalized antifungal activity and 454-screening of Pseudonocardia and Amycolatopsis bacteria in nests of fungus-growing ants. Proceedings of the National Academy of Sciences. 106, 17805-17810;
- Ulrich G Mueller. (2012). Symbiont recruitment versus ant-symbiont co-evolution in the attine ant–microbe symbiosis. Current Opinion in Microbiology. 15, 269-277;
- Yuliya V. Zakalyukina, Mikhail V. Birykov, Dmitrii A. Lukianov, Dmitrii I. Shiriaev, Ekaterina S. Komarova, et. al.. (2019). Nybomycin-producing Streptomyces isolated from carpenter ant Camponotus vagus. Biochimie. 160, 93-99;
- В каждой бочке затычка: как тетраценомицин X затыкает бактериальные и эукариотические рибосомы;
- M B Pasti, A L Pometto, M P Nuti, D L Crawford. (1990). Lignin-solubilizing ability of actinomycetes isolated from termite (Termitidae) gut.. Applied and Environmental Microbiology. 56, 2213-2218;
- Adam J. Book, Gina R. Lewin, Bradon R. McDonald, Taichi E. Takasuka, Drew T. Doering, et. al.. (2014). Cellulolytic Streptomyces Strains Associated with Herbivorous Insects Share a Phylogenetically Linked Capacity To Degrade Lignocellulose. Appl. Environ. Microbiol.. 80, 4692-4701;
- Антибиотики и антибиотикорезистентность: от древности до наших дней.