
В каждой бочке затычка: как тетраценомицин X затыкает бактериальные и эукариотические рибосомы
29 июня 2020
В каждой бочке затычка: как тетраценомицин X затыкает бактериальные и эукариотические рибосомы
- 730
- 0
- 4
Антибиотик тетраценомицин X ингибирует элонгацию трансляции и в бактериальной, и в человеческой рибосомах
-
Автор
-
Редактор
В связи с повсеместной антибиотикорезистентностью бактерий поиск новых антибиотиков становится задачей повышенной важности. Но не менее важно разобраться в механизме действия и уже описанных соединений. Большая группа исследователей, в числе которых специалисты из Сколтеха, МГУ им. М.В. Ломоносова и Гамбургского университета, смогла детально выяснить механизм действия антибиотика тетраценомицина X и показала, что это вещество «затыкает» выводной туннель бактериальных и эукариотических рибосом.
Одной из самых обширных групп природных метаболитов, которые обладают свойствами антибиотиков или цитотоксических агентов, являются ароматические поликетиды. Наиболее известные представители этой группы: широко применяющийся в медицинской и лабораторной практике антибиотик тетрациклин и один из самых эффективных препаратов противораковой химиотерапии — доксорубицин. Куда меньше изучены ароматические поликетиды группы тетраценомицинов. Большинство веществ этой группы обладают слабой антибактериальной активностью против грамположительных бактерий, а некоторые оказывают цитотоксическое действие на отдельные линии клеток человека [1]. Как именно действуют тетраценомицины, долгое время не было понятно, но считалось, что механизм их действия близок к таковому доксорубицина, который является интеркалирующим агентом и внедряется между азотистыми основаниями ДНК, препятствуя ее удвоению. Дело в том, что тетрациклический хромофор тетраценомицинов плоский, как у доксорубицина, и теоретически может быть хорошим интеркалирующим агентом (рис. 1).

Рисунок 1. Химическая структура тетрациклина (а), доксорубицина (б) и двух антибиотиков группы тетраценомицинов (в) — тетраценомицина C и тетраценомицина X
В связи с почти повсеместной устойчивостью бактерий к известным антибиотикам исследователи проводят масштабные скрининги искусственных и природных соединений в поисках веществ с антибактериальной активностью . С помощью такого скрининга большая группа ученых, среди которых специалисты из Центра наук о жизни Сколковского института науки и технологий и МГУ им. М.В. Ломоносова, выявили в среде, где рос актиномицет Amycolatopsis sp. A23, некий ингибитор трансляции. Неизвестный агент очистили и показали, что он идентичен тетраценомицину X (TcmX), который, как уже было известно, вырабатывают актиномицеты Nocardia mediterranei и Saccharothrix sp. 10-10.
Подробнее о проблеме антибиотикорезистентности можно прочитать в спецпроекте «Антибиотики и антибиотикорезистентность» и в статьях «Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее» [2], «Антибиотики vs Бактерии. “Война Бесконечности” или всему есть предел?» [3] и «По следам антибиотиков: что могло пойти не так и как это исправить?» [4].
Обнаружение вещества из группы тетраценомицинов, которые, как принято считать, являются интеркаляторами ДНК, в ходе скрининга на ингибиторы трансляции было неожиданностью для исследователей. Чтобы определить механизм действия TcmX, ученые воспользовались элегантной репортерной системой на основе плазмиды pDualrep2 и клеток E. coli, которая позволяет определить, является ли соединение интеркалятором или ингибитором трансляции (рис. 2). Если исследуемое вещество подавляет трансляцию, то оно затормаживает рибосому в пределах модифицированной лидерной последовательности на РНК триптофанового оперона (trpL2-2Ala) в составе плазмиды, что, в свою очередь, приводит к запуску экспрессии нижележащего гена флуоресцентного белка Katushka2S, светящегося дальним красным светом. Если же вещество — интеркалятор, то в бактериальных клетках запускается SOS-ответ и активируется в нормальных условиях неактивный промотор sulA, с которого начинается синтез красного флуоресцентного белка RFP. Свечение белков Katushka2S и RFP визуально почти не различимо, поэтому авторы статьи дифференцировали их по длине волны испускаемого света, а на фотографиях для удобства анализа RFP окрашивали условным зеленым цветом, а Katushka2S — красным. С помощью описанной репортерной системы ученые установили, что TcmX является именно ингибитором трансляции, а не интеркалятором.
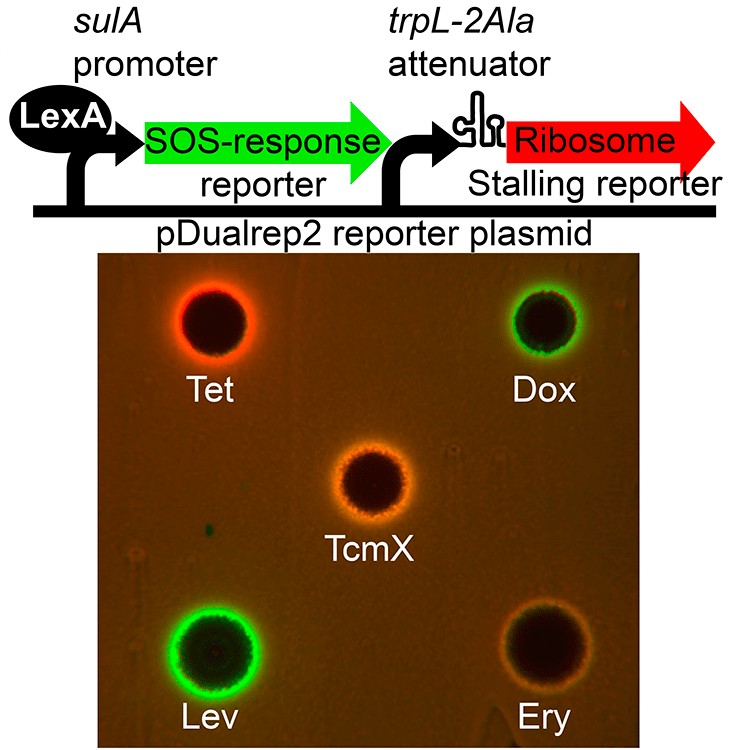
Рисунок 2. Схема репортерной системы, позволяющей определить, является ли вещество интеркалятором или ингибитором трансляции. Тетрациклин (Tet), тетраценомицин X (TcmX) и эритромицин (Ery) ингибируют трансляцию, а доксорубицин (Dox) и левофлоксацин (Lev) являются интеркаляторами ДНК. LexA — белок, запускающий SOS-ответ; trpL-2Ala — аттенуирующая последовательность, формирующаяся на РНК, на которой «зависает» рибосома.
Но как именно TcmX ингибирует трансляцию? Для ответа на этот вопрос ученые использовали клетки E. coli штамма SQ110DTC, которые, в отличие от кишечной палочки дикого типа, имеют не семь, а всего один оперон рибосомных РНК, поэтому они как нельзя лучше подходят для выявления мутаций в рРНК, обеспечивающих устойчивость к антибиотику. Секвенирование геномов клеток, резистентных к TcmX, показало, что у них имеются однонуклеотидные замены в гене, кодирующем 23S рРНК (входящей в состав большой субъединицы бактериальной рибосомы — 50S), причем все они не затрагивали тот участок, с которым взаимодействует близкий к TcmX по структуре антибиотик тетрациклин. Так было установлено, что TcmX взаимодействует с большой рибосомной субъединицей.
Для определения сайта связывания TcmX с бактериальной рибосомой ученые инкубировали рибосомы E. coli в присутствии TcmX и изучили полученные комплексы с помощью криоэлектронной микроскопии в Гамбургском университете, получив в итоге структуру комплекса с разрешением в 2,9 ангстрем (рис. 3).
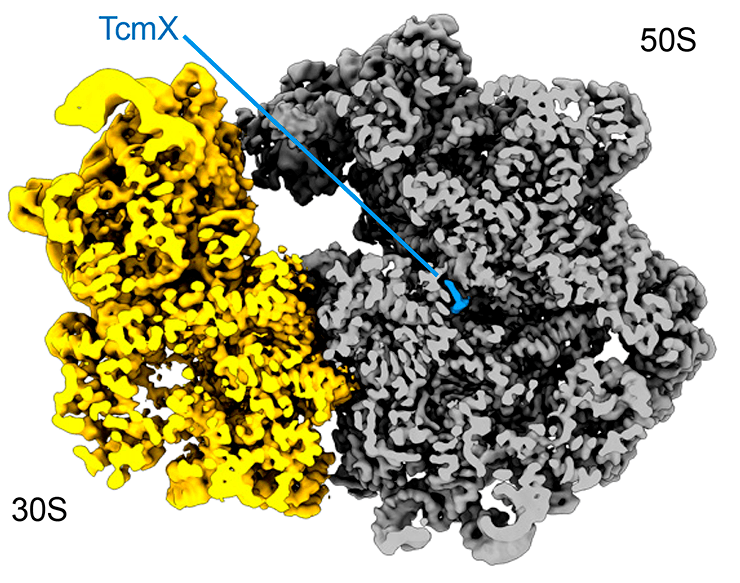
Рисунок 3. Структура бактериальной рибосомы в комплексе с тетраценомицином X
Оказалось, что тетрациклический хромофор TcmX формирует стэкинг-взаимодействия с нуклеотидами U1782 (урацил в позиции 1782) и U2586 в составе 23S рРНК, причем эти нуклеотиды объединяются в неканоническую пару U—U (рис. 4). Именно стэкинг с указанными нуклеотидами и играет ключевую роль в связывании TcmX с рибосомой.
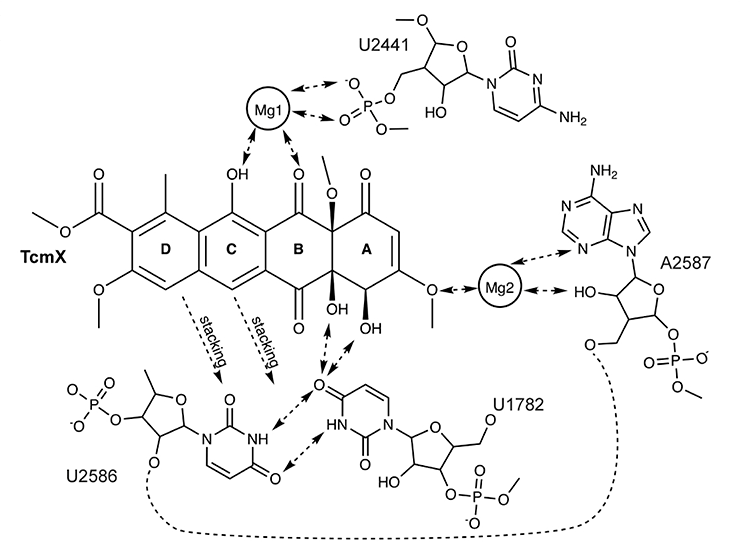
Рисунок 4. Схема взаимодействия тетраценомицина X с 23S рРНК E. coli
А что будет, если в рибосоме на указанных позициях не будет пар U—U? Будет ли такая рибосома способна связываться с TcmX? Исследователи провели сравнительный анализ последовательностей рРНК различных бактерий, и выяснили, что у 37% проанализированных бактерий на аналогичной позиции действительно есть пара U—U, причем среди них есть и важные патогены человека, такие как Neisseri gonorrhoeae, вызывающая гонорею, синегнойная палочка Pseudomonas aeruginosa, холерный вибрион Vibrio cholerae и возбудитель чумы Yersinia pestis. Однако у оставшихся 63% проанализированных бактерий вместо пары U—U есть другая неканоническая пара — C—C. После экспериментальной проверки было показано, что такие бактерии действительно устойчивы к тетраценомицину X.
Стоит отметить, что аналогичная пара U—U есть и у человеческих рибосом, поэтому TcmX теоретически может проявлять цитотоксические свойства по отношению к человеку. Ученые проинкубировали человеческие рибосомы с TcmX и определили структуру полученного комплекса с помощью криоэлектронной микроскопии с разрешением 2,8 ангстрем (рис. 5). Как оказалось, в человеческой рибосоме TcmX на самом деле формирует стэкинг-взаимодействия с нуклеотидами U3644 (аналогичен U1782 E. coli) и U4532 (аналогичен U2586 E. coli) на 28S рРНК, которые, как и в случае с кишечной палочкой, образуют неканоническую пару U—U. Эксперименты с различными линиями клеток человека — HEK293T, HepG2, MCF-7, K562 — показали, что тетраценомицин обладает выраженными цитотоксическими свойствами.

Рисунок 5. Структура человеческой рибосомы в комплексе с тетраценомицином X
Но какую именно стадию трансляции ингибирует тетраценомицин X? С помощью метода, известного как тоупринтинг (toeprinting), можно отследить, на каком этапе трансляции у рибосомы происходит «затык» [5]. Метод тоупринтинга основан на обратной транскрипции РНК, трансляцию которых начала рибосома, и разделении полученных обратных транскриптов (кДНК) с помощью электрофореза. Чем быстрее рибосома «заглохла», тем короче будет соответствующий фрагмент, синтезированный обратной транскриптазой: фермент может проводить синтез комплементарной цепочки лишь до того момента, пока не натолкнется на препятствие в виде остановившейся рибосомы. Например, под действием антибиотика эритромицина, относящегося к группе макролидов, рибосома успешно проходит первые несколько кодонов транскрипта, а потом останавливается. Иными словами, рибосома под действием макролидов все же может синтезировать короткий олигопептид, но потом останавливается, так как этот пептид не может выйти из рибосомного туннеля — именно этот туннель и перекрывает молекула антибиотика. В случае с тетраценомицином X имеет место очень похожая ситуация: рибосома проходит первые несколько кодонов, а потом останавливается, так как синтезирующийся пептид не может «высунуться» из нее. Авторы исследования заключают, что TcmX по своему механизму работы похож на макролиды и ингибирует не инициацию, а элонгацию трансляции, поскольку «затыкает» туннель, через который из рибосомы выходит созревающий пептид. Однако TcmX, в отличие от макролидов, «затыкает» не ближний, а дальний конец туннеля, поэтому под его действием рибосома может уехать чуть дальше.
Первый автор исследования Илья Остерман прокомментировал результаты исследования следующим образом:
Тетрациномицин Х подавляет работу и бактериальных, и человеческих рибосом, поэтому сам по себе не может быть антибактериальным препаратом. Однако в ходе данного исследования мы нашли новый сайт связывания антибиотика в рибосоме и новый структурный мотив ингибитора трансляции — структурные данные открывают возможность для рационального улучшения этого антибиотика с целью повысить его эффективность и селективность.
Литература
- Osterman I.A., Wieland M., Maviza T.P., Lashkevich K.A., Lukianov D.A., Komarova E.S. et al. (2020). Tetracenomycin X inhibits translation by binding within the ribosomal exit tunnel. Nat. Chem. Biol.;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- По следам антибиотиков: что могло пойти не так и как это исправить?;
- Timothy W. Nilsen. (2013). Toeprinting. Cold Spring Harb Protoc. 2013, pdb.prot077180.






