Смертельные яды стремятся в синапс
18 февраля 2023
Смертельные яды стремятся в синапс
- 3820
- 1
- 10
Синапс — это сложный механизм, состоящий из множества деталей, взаимосвязанных друг с другом. На картинке изображена художественная интерпретация схемы синапса, созданная искусственным интеллектом.
Рисунок в полном размере.
создано нейросетью Midjourney, с изменениями автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Как думаете, сколько существует способов сломать что-то одно? Много. Очень много.
В этой статье мы будем ломать ацетилхолиновый путь передачи нервного импульса разными нейротоксичными ядами и узнаем механизм их работы.
А главное, вы можете перейти по ссылке на страничку в Tilda и попробовать сами управлять синапсом в интерактивной анимации!
Конкурс «Био/Мол/Текст»-2022/2023
 Эта работа заняла второе место в номинации «Школьная» конкурса «Био/Мол/Текст»-2022/2023.
Эта работа заняла второе место в номинации «Школьная» конкурса «Био/Мол/Текст»-2022/2023.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Человеческий организм устроен очень сложно. Множество маленьких деталей, у каждой из которых свои функции, свое строение, свое место. Организм можно сравнить с компьютером. И если этот компьютер вдруг перестал включаться, причин неполадок может быть множество. Возможно, перестал работать монитор, заела кнопка включения или сгорела видеокарта, а может, вы просто забыли включить его в розетку, или во всем доме отключили электричество. Причины разные, а результат один и тот же. С человеческим организмом примерно так же. При поломке абсолютно любой детали определить сразу, что именно сломалось, чаще всего не получится, так как множество деталей трудятся над выполнением одной задачи. И если эта задача жизненно важная, то всегда найдется тот, кому будет выгодно прекратить ее выполнение.
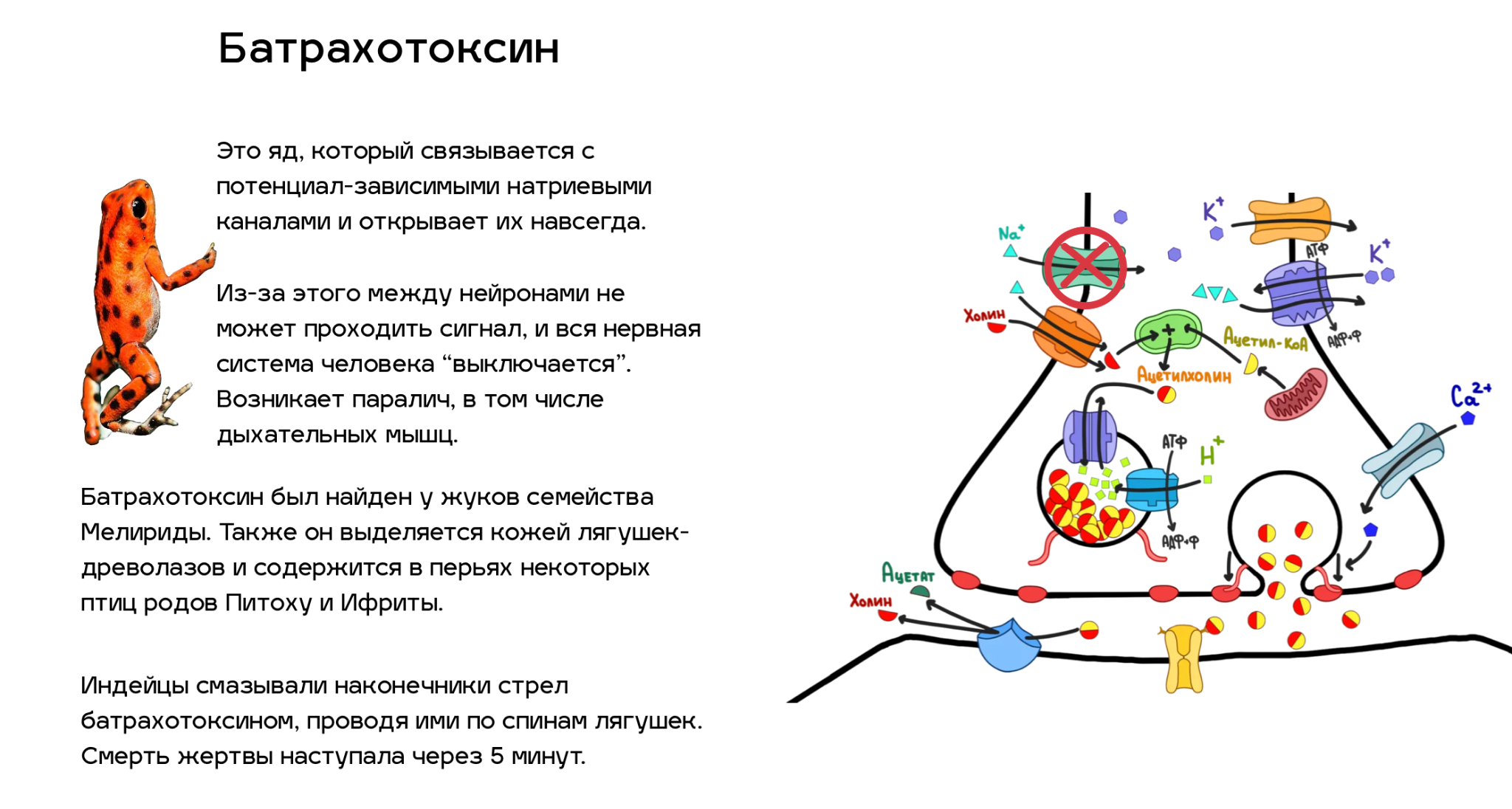
Миллионы лет естественный отбор помогал одним живым организмам подбирать подходящие яды для защиты от других. Ведь чем смертоноснее яд, чем важнее детали, которые он ломает в организме твоего врага, тем больше шансов выжить и передать гены, в которых записан рецепт этого яда, потомкам.
Поэтому все яды нацелены на то, что выгодно ломать. И одна из таких целей — это нервная система. Все движения, мысли, работа внутренних органов — все регулируется ею. Но что она из себя представляет?
Сеть нейронов и их нервные импульсы
Наша нервная система — это сеть из связанных друг с другом нейронов, которые передают между собой сигналы. Каждый такой сигнал (он же нервный импульс или потенциал действия) — это распространяющийся по мембране клетки положительный заряд. Давайте рассмотрим подробнее, как он образуется и передается от одной нервной клетки к другой.
Вокруг клеток есть много различных ионов: ионы натрия, калия, кальция, хлора. А в мембране нейронов есть белки-переносчики. Один из них называется натрий-калиевая АТФаза. Она, тратя АТФ (основную энергетическую валюту клеток), вкачивает внутрь клетки два иона К+ и выкачивает три иона Na+. Таким образом, клетка теряет три положительных заряда, а приобретает всего два, тем самым понижая свой заряд по отношению к заряду с внешней стороны мембраны. Также благодаря этому мы получаем дефицит Na+ и избыток К+ внутри клетки.
В мембране клеток присутствуют также калиевые каналы утечки. По своей сути, эти белки просто создают отверстия в мембране, через которые К+ может свободно входить в клетку и выходить из нее. Чтобы понять, куда же будет двигаться К+ по таким каналам, полезно вспомнить, что такое диффузия.
По принципу диффузии любые молекулы стремятся перейти из области с высокой концентраций в область с низкой (по градиенту концентрации). Этот принцип часто используется для транспорта молекул через мембрану. Но, разрушив АТФ (затратив энергию), можно заставить молекулу двигаться в область с высокой концентрацией (против градиента концентрации). Именно это и происходит при работе натрий-калиевой АТФазы.
Так как натрий-калиевая АТФаза делает концентрацию К+ в клетке достаточно высокой, через калиевые каналы утечки К+ будет стремиться выйти из клетки, чтобы уравновесить концентрацию внутри и снаружи. Выходя, он будет уносить с собой положительный заряд и создавать внутри мембраны заряд около —70 мВ по сравнению с зарядом снаружи клетки. Однако равновесной концентрация К+ все равно не станет, так как выходить из клетки калию будет мешать отрицательный заряд на внутренней стороне мембраны.
Все вышеперечисленное происходит, когда нейрон не возбужден. Но стоит только какому-то внешнему стимулу повысить заряд внутренней стороны мембраны до порогового значения (примерно на 20 мВ или больше), тут же откроются потенциал-зависимые натриевые каналы. Так как внутри клетки создан дефицит Na+, при открытии этих каналов он сразу хлынет внутрь — и тем самым повысит заряд еще больше. Когда заряд дойдет до +50 мВ, потенциал-зависимые натриевые каналы закроются, и в дело вступят потенциал-зависимые калиевые каналы. По ним, несдерживаемый отрицательным зарядом, калий начнет массово выходить из клетки, тем самым понижая заряд и возвращая мембрану в состояние покоя.
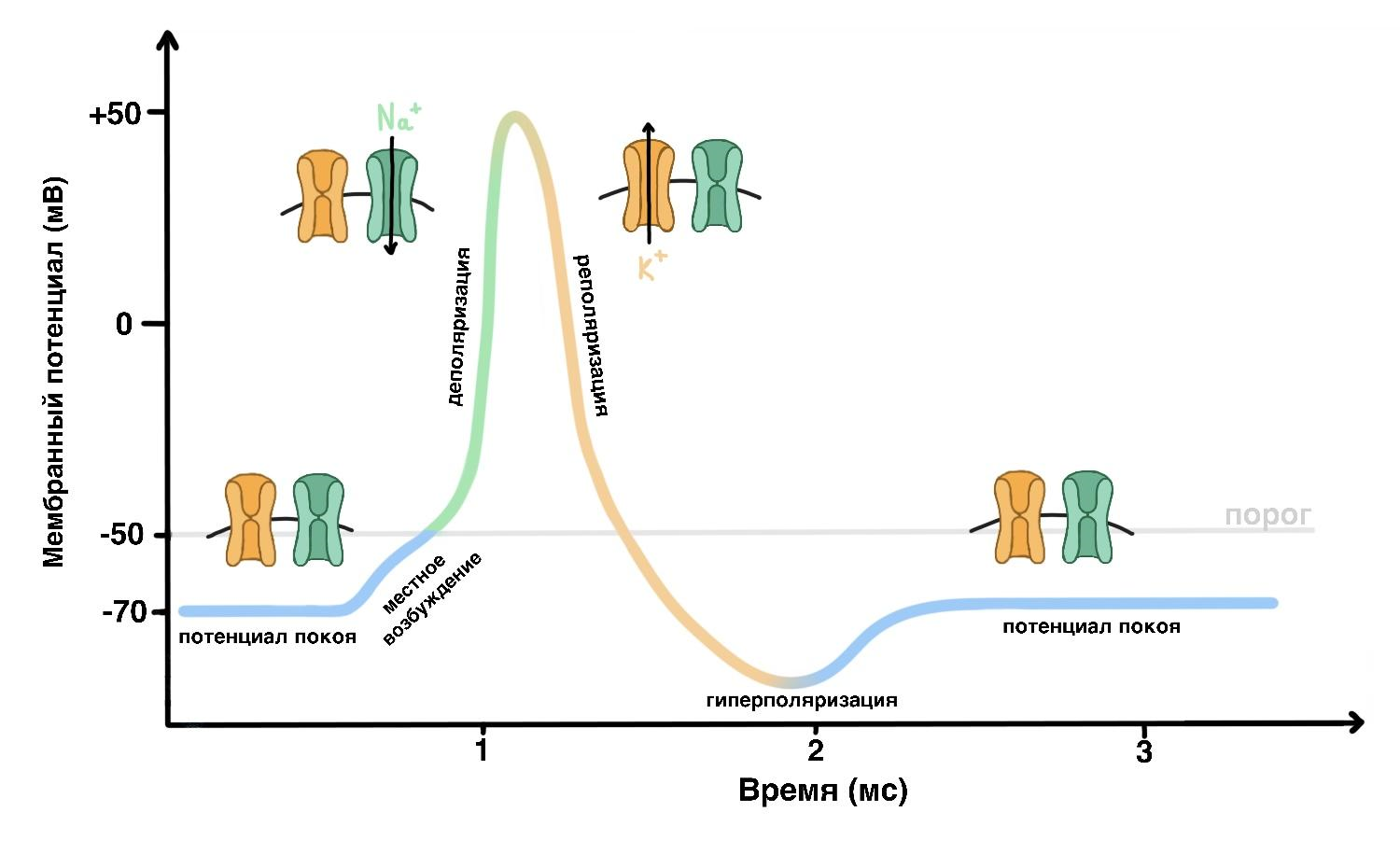
Рисунок 1. Потенциал действия. При потенциале покоя потенциал-зависимые калиевые и натриевые каналы закрыты. Когда заряд из-за местного возбуждения достигает порогового значения, натриевые каналы открываются, заряд повышается (происходит деполяризация). После натриевые каналы закрываются, калиевые каналы открываются, происходит понижение заряда (реполяризация). Понижение заряда мембраны ниже потенциала покоя называется гиперполяризацией.
рисунок автора статьи
Это резкое повышение и понижение заряда внутри мембраны и называют нервным импульсом (рис. 1). Так как потенциал действия основан на разнице градиентов натрия и калия, необходимо некоторое время, чтобы эту разницу можно было восстановить. Поэтому один участок не может возбуждаться непрерывно.
Благодаря потенциалу действия сигнал может передвигаться внутри одной клетки. Но для передачи нервного импульса между разными клетками существует специальное соединение, которое называется синапс (рис. 2).
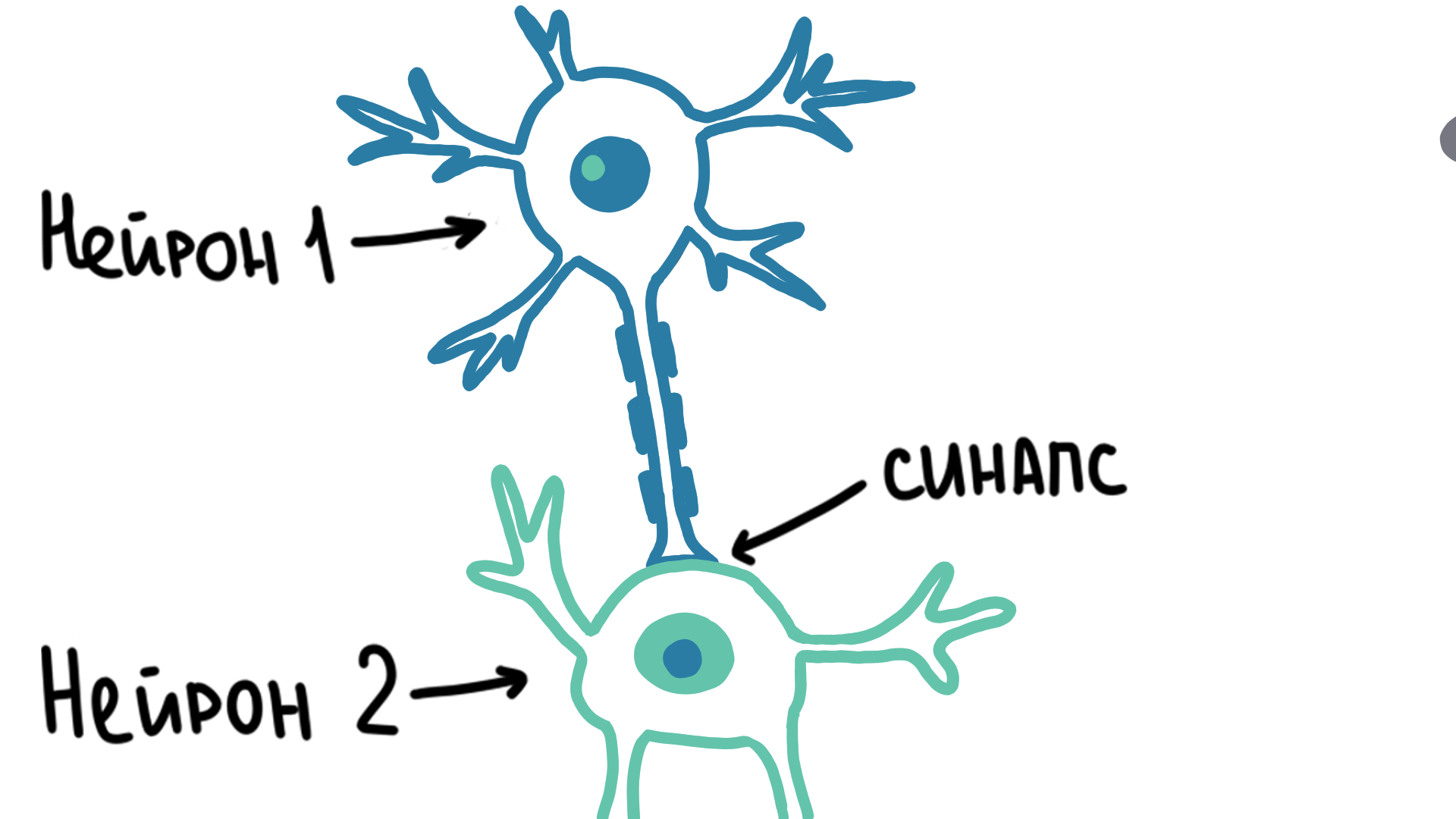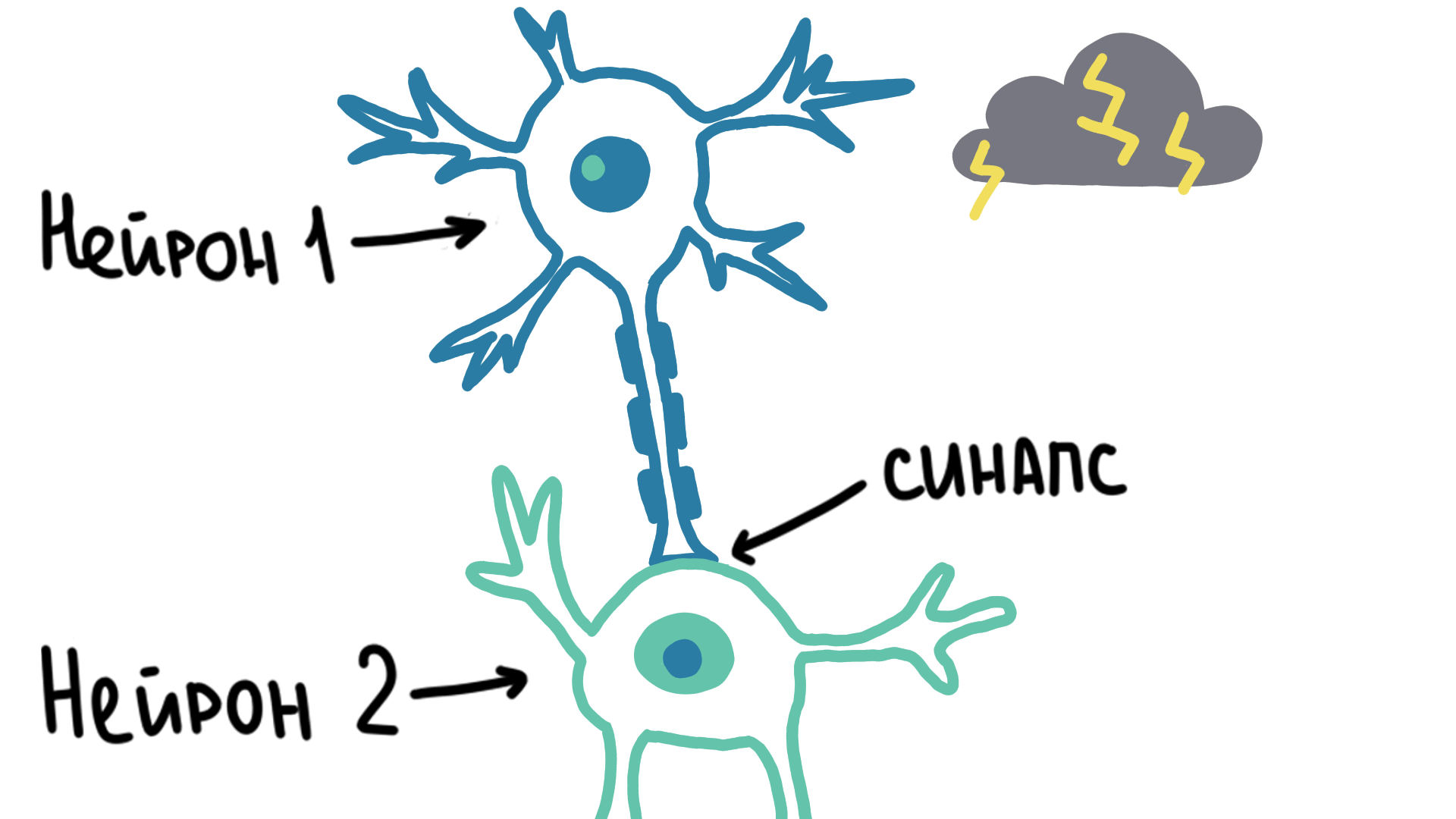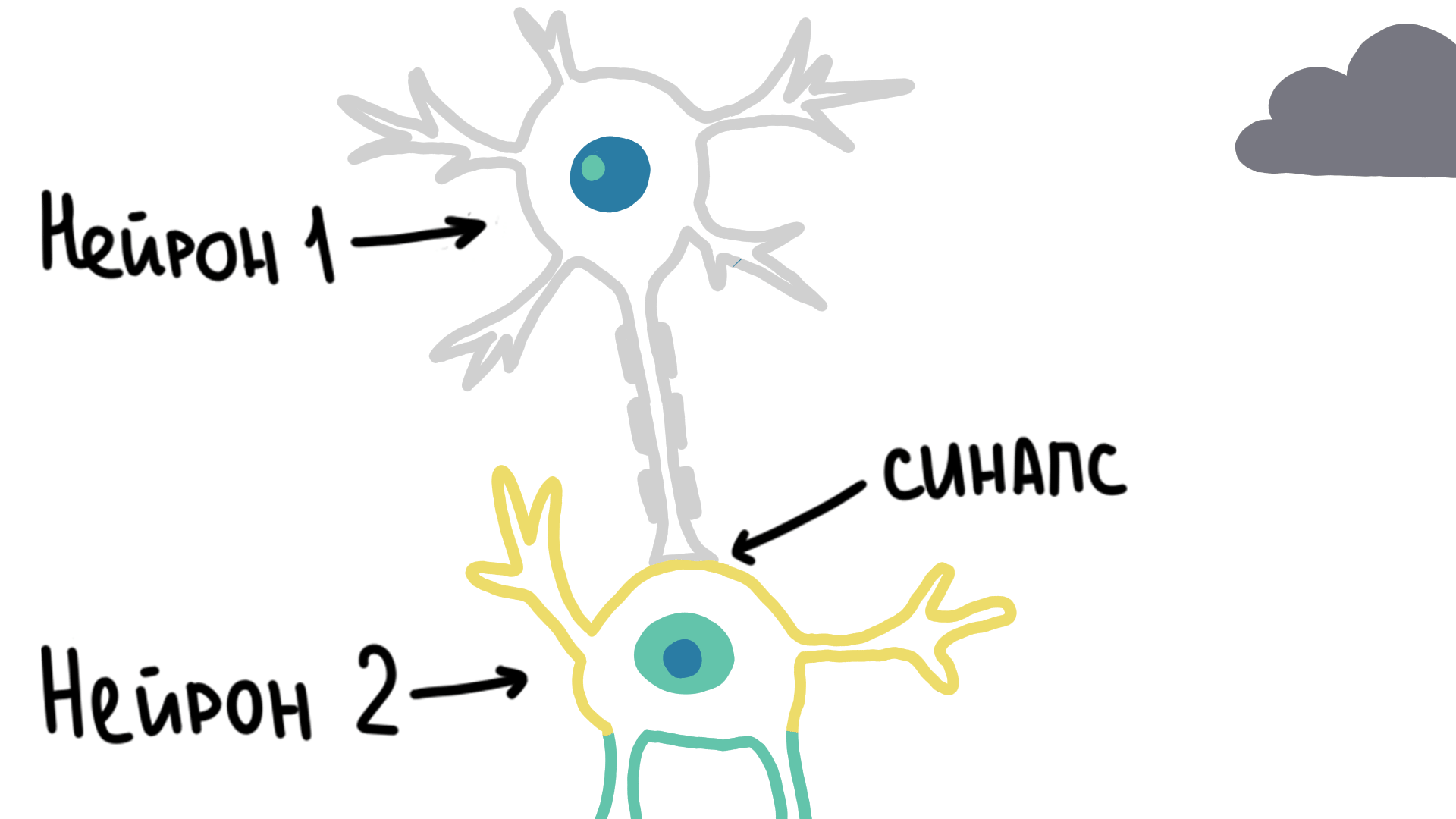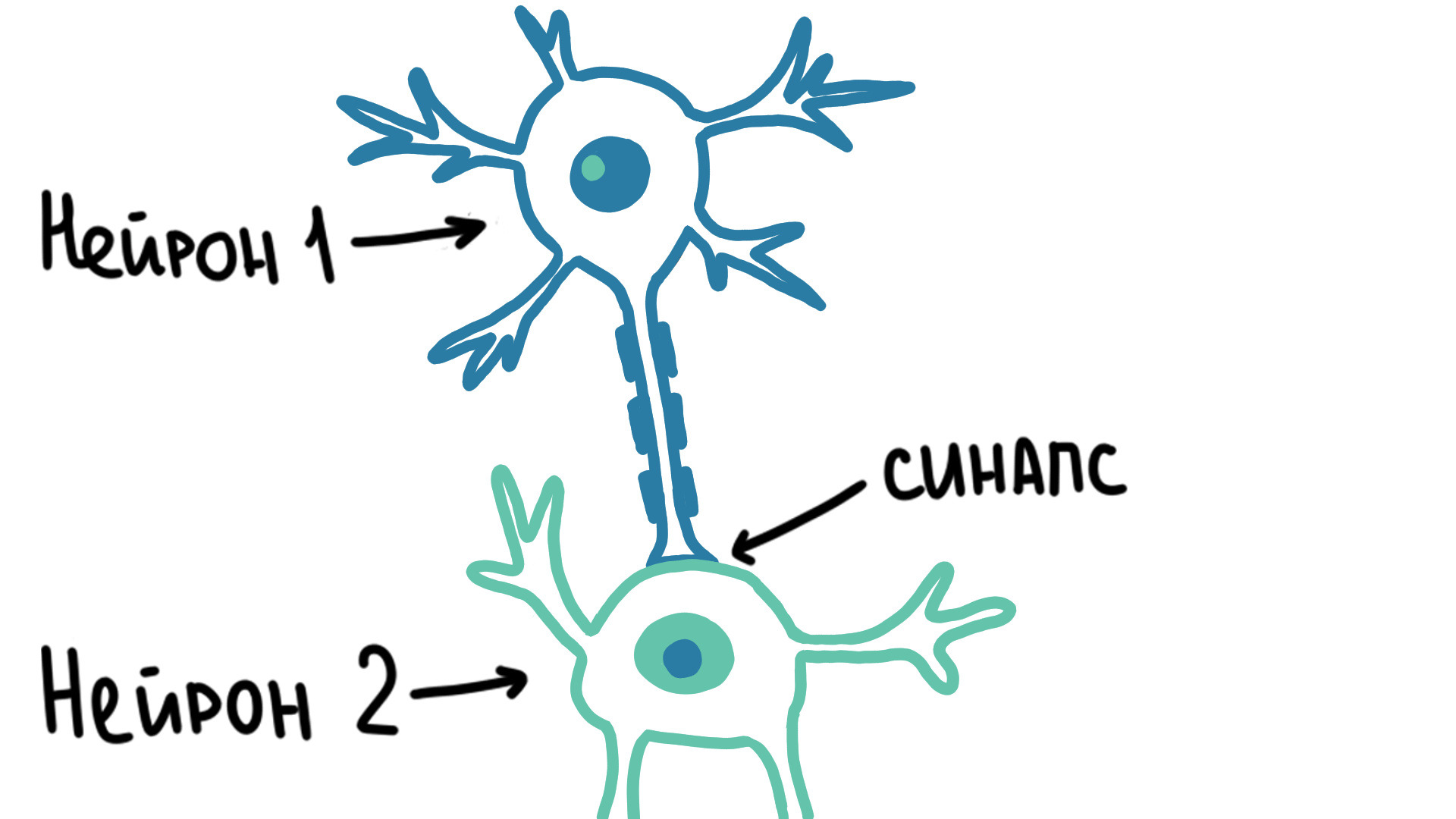
Рисунок 2. Молния изображает передаваемый нервный сигнал. Он быстро распространяется по нейрону, но перейти на другой нейрон может только через синапс, причем с небольшой задержкой.
рисунок автора статьи
Синапсы бывают химические и электрические. В электрических синапсах белковые каналы просто соединяют цитоплазму обоих клеток, тем самым потенциал действия распространяется так же, как и внутри одной клетки. Но таких синапсов у высокоорганизованных животных гораздо меньше, чем химических, о которых речь пойдет далее.
В классическом химическом синапсе первый нейрон в ответ на электрический импульс выпускает в синаптическую щель хранящееся в везикулярных пузырьках химическое вещество — нейромедиатор. В ответ на электрический импульс везикулы сливаются с мембраной клетки, нейромедиатор выходит наружу и с помощью рецепторов улавливается вторым нейроном, а затем снова превращается в импульс.
Синаптические везикулы лежат в основе функционирования нервной системы, ведь они обеспечивают передачу нервных импульсов от одной клетки к другой. Их тщательно изучают, и в этом ученым помогают модели строения синаптических окончаний, где сконцентрированы эти маленькие пузырьки [1].
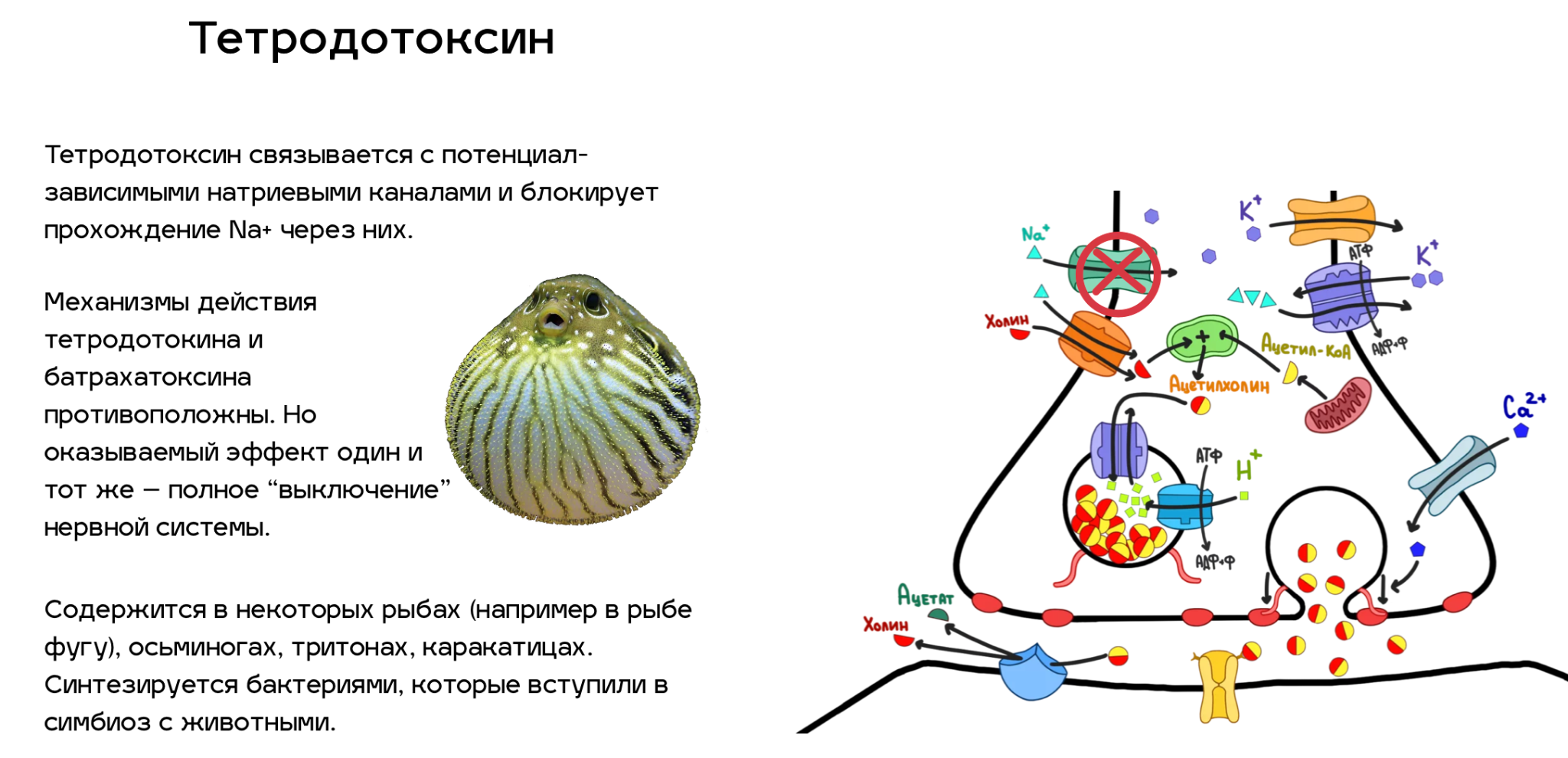
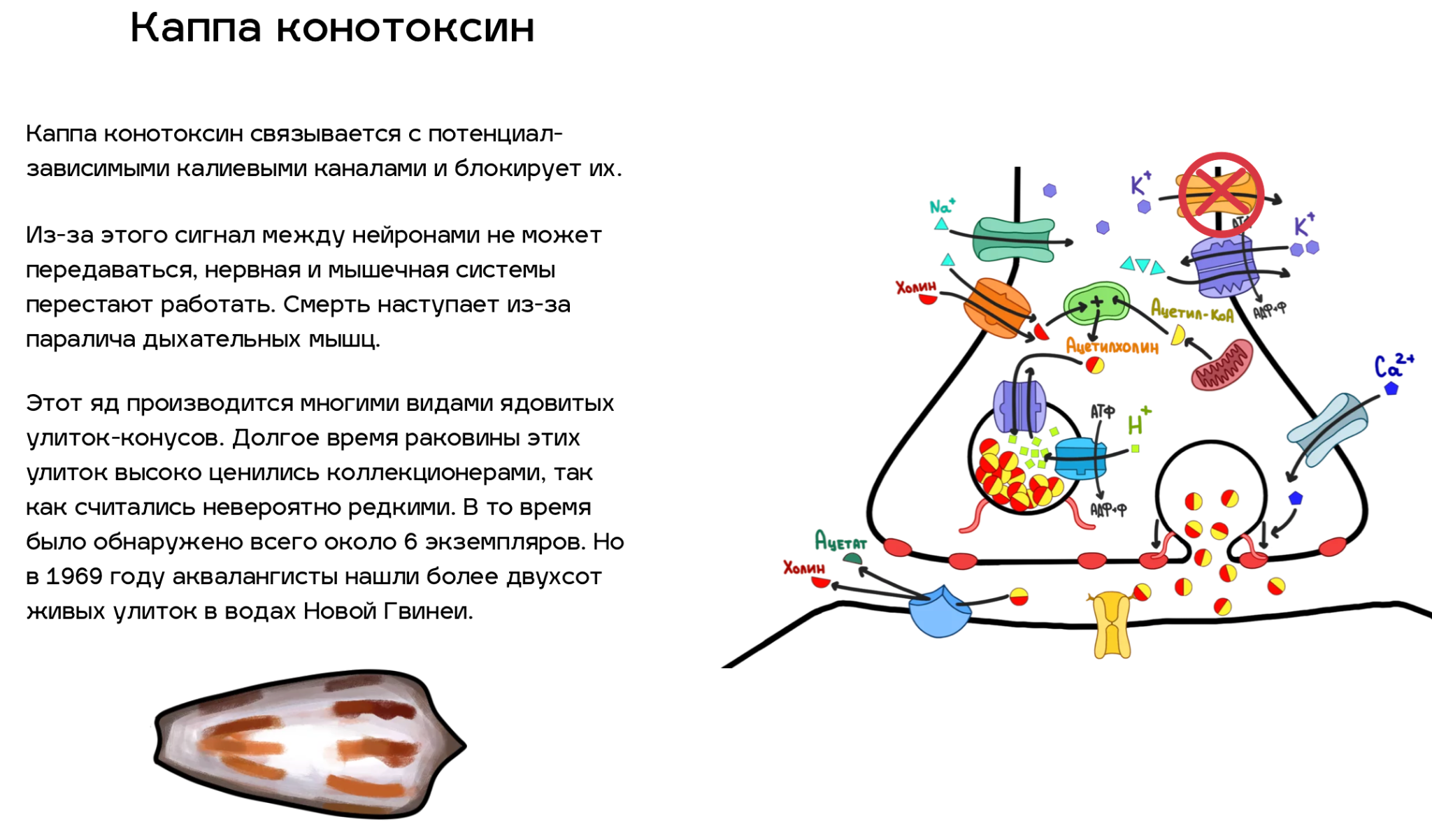
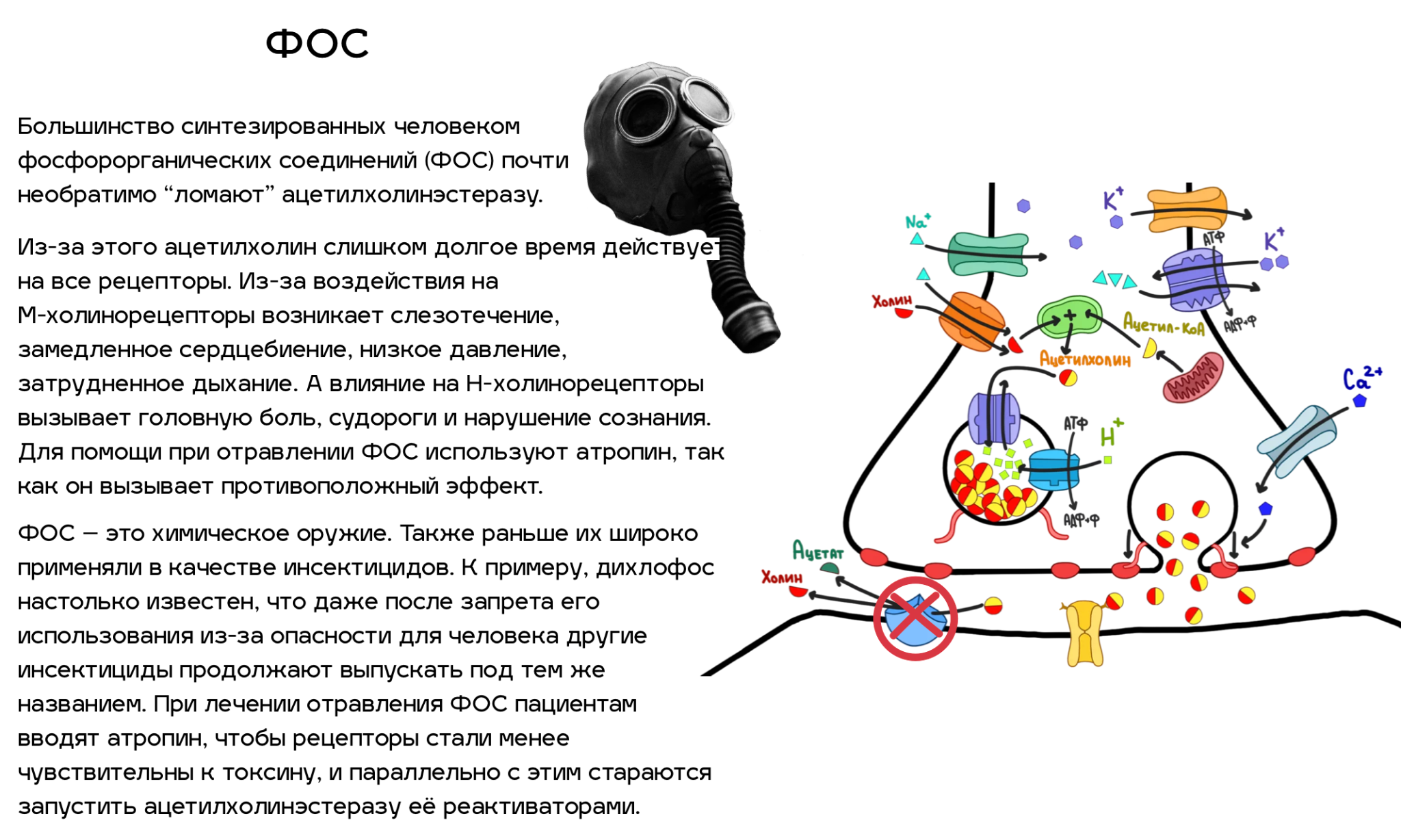
Соединение между нейроном и любой другой клеткой, которой он передает сигналы, также называют синапсом. Химические вещества, которые используются в синапсах, могут быть разными для разных целей. Для жизненно необходимой регулировки мышечных сокращений, работы сердца, легких и многого другого используется ацетилхолин (о нем на «Биомолекуле» есть отдельная статья [2]). Поэтому многие яды нацелены на поломку пути передачи сигналов с его помощью. А синапсы, которые используют ацетилхолин в качестве посредника, называют холинергическими.
Из чего состоит холинергический синапс
Для того, чтобы понять, что можно сломать в холинергическом синапсе, давайте разберемся, какие детали в нем есть (рис. 3).
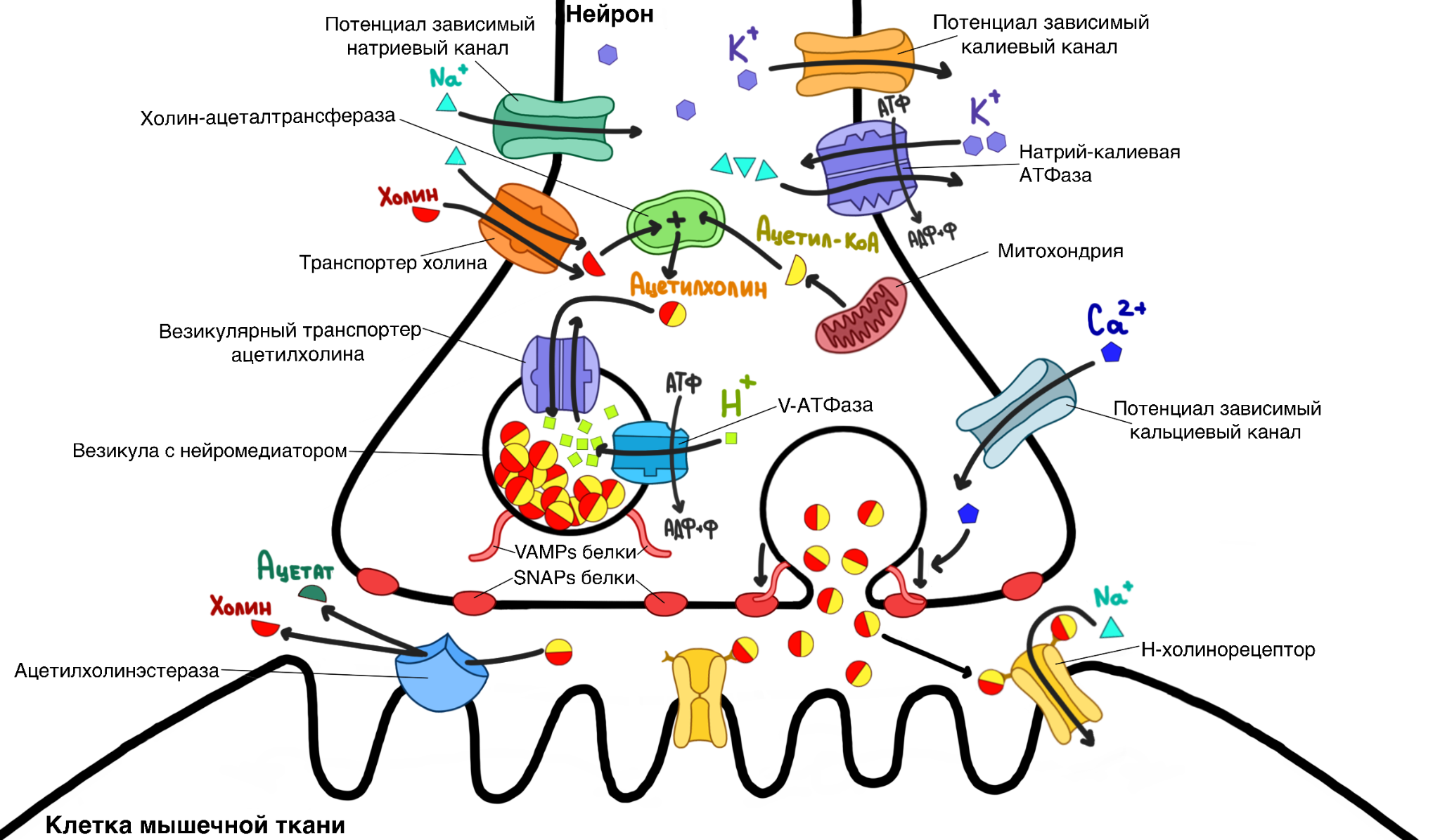
Рисунок 3. Нервно-мышечный синапс. Отметим, что все белки (кроме рецепторов), присутствующие в нем, можно найти во всех холинергических синапсах. Пройдя по ссылке, вы сможете сами «включить» и «выключить» всех главных участников процесса передачи нервного импульса в клетке. Попробуйте, это очень увлекательно!
рисунок автора статьи
Транспортер холина
Благодаря этому ферменту холин транспортируется внутрь клетки. Так как во внешней среде концентрация Na+ больше, чем внутри клетки, ион натрия стремится попасть внутрь. Поэтому он без затраты АТФ может проходить через транспортер. Но вместе с ним, уже против градиента концентрации, в клетку переносится холин. Из-за такого одновременного переноса холин перемещается без затраты энергии.
Холин-ацетилтрансфераза
Этот фермент переносит ацетильную группу с молекулы Ацетил-КоА на холин. Так образуется молекула ацетилхолина, которая и будет работать как нейромедиатор.
V-АТФаза
V-АТФаза нужна для увеличения концентрации H+ внутри везикулы. Используя АТФ, она получает энергию для переноса H+ через мембрану везикул, против градиента концентрации.
Везикулярный транспортер ацетилхолина
Так как в везикуле высокая концентрация H+, ионы водорода стремятся выйти в цитоплазму. А благодаря такому движению H+ ацетилхолин можно перемещать в везикулу против градиента концентрации без затраты АТФ.
Потенциал-зависимый кальциевый канал
Когда до синапса доходит нервный импульс, этот канал открывается, и, так как снаружи кальция больше, чем внутри, кальций устремляется внутрь синапса. Там кальций способствует слиянию везикулы с мембраной.
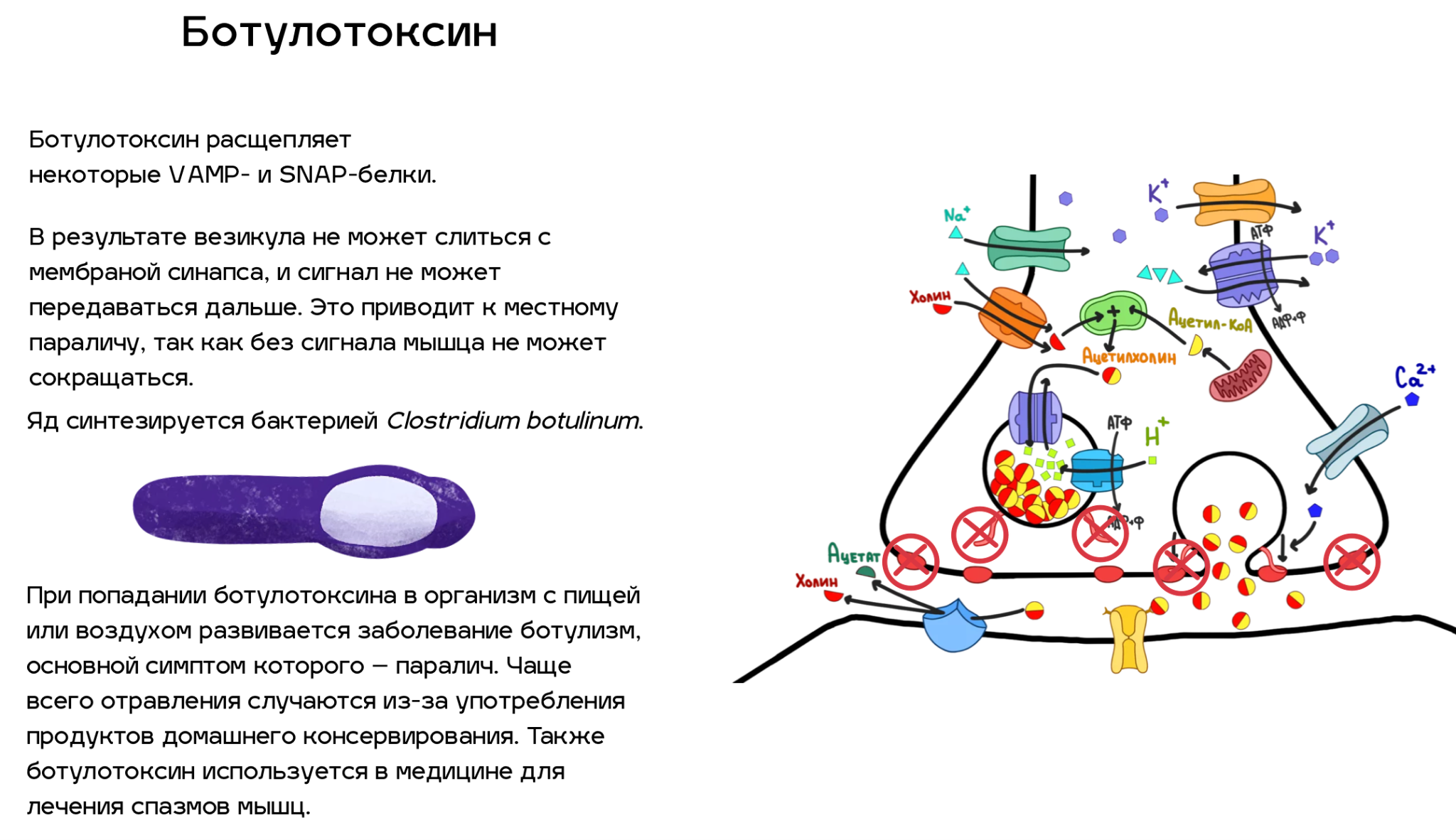
VAMPs и SNAPs белки
VAMPs — это белки, располагающиеся на мембране везикулы. SNAPs — белки на мембране окончания синапса. После того, как кальций вошел в клетку, VAMPs и SNAPs взаимодействуют друг с другом, и ацетилхолин высвобождается в межклеточное пространство.
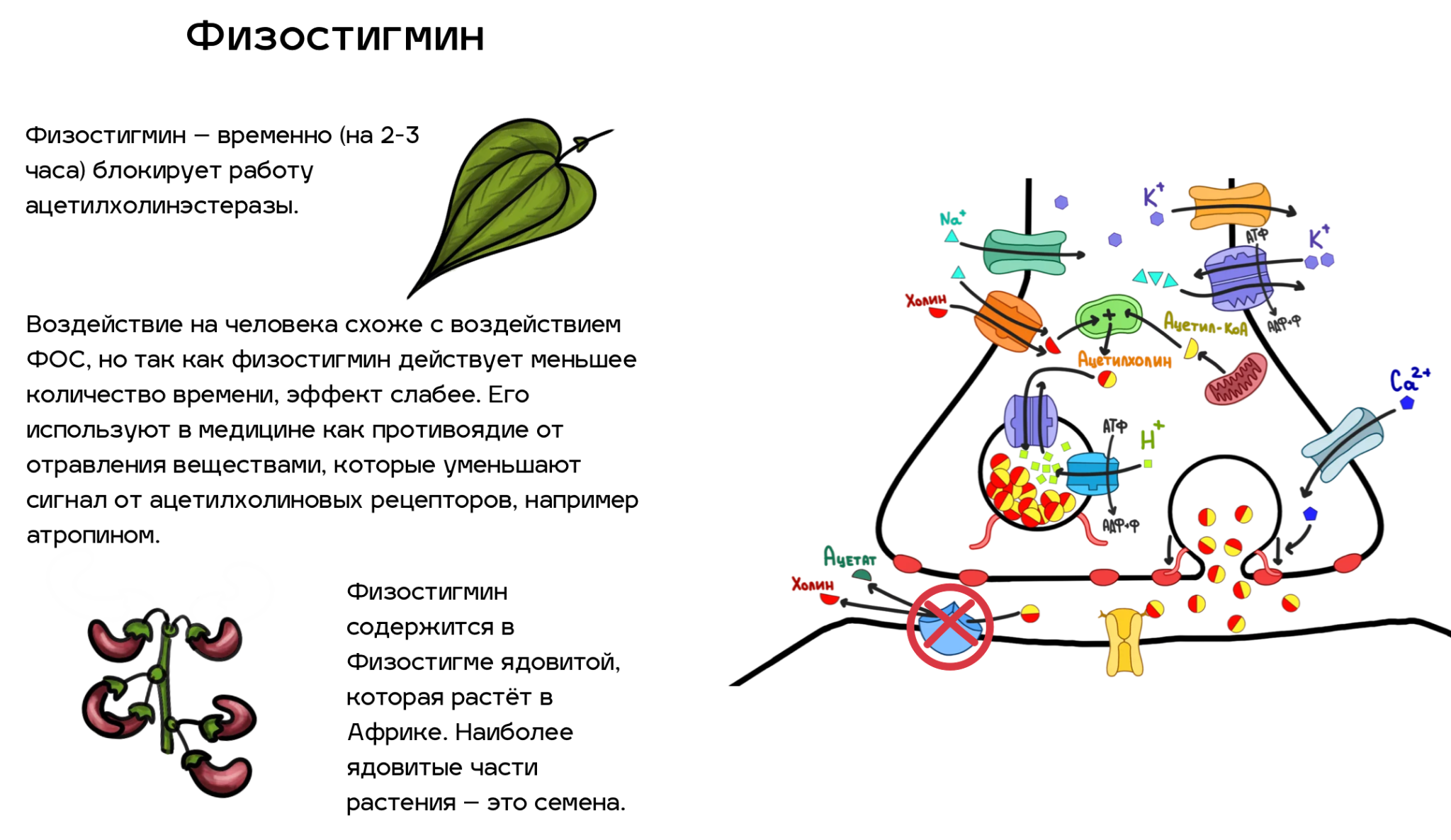
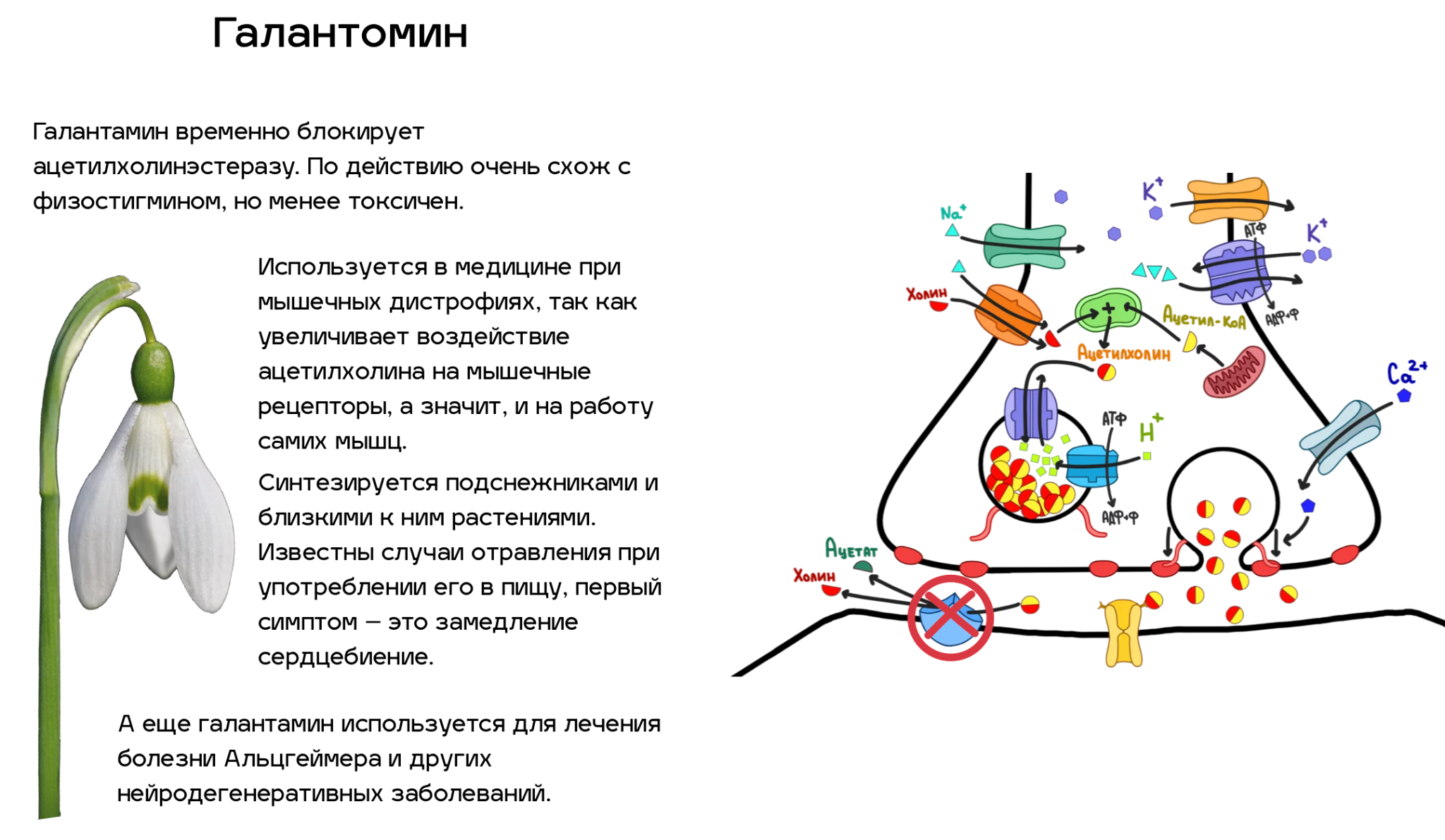
Ацетилхолинэстераза
Ацетилхолинэстераза работает в синаптической щели и заставляет ацетилхолин расщепляться до ацетата и холина. Она поддерживает нормальный уровень действия ацетилхолина на рецепторы.
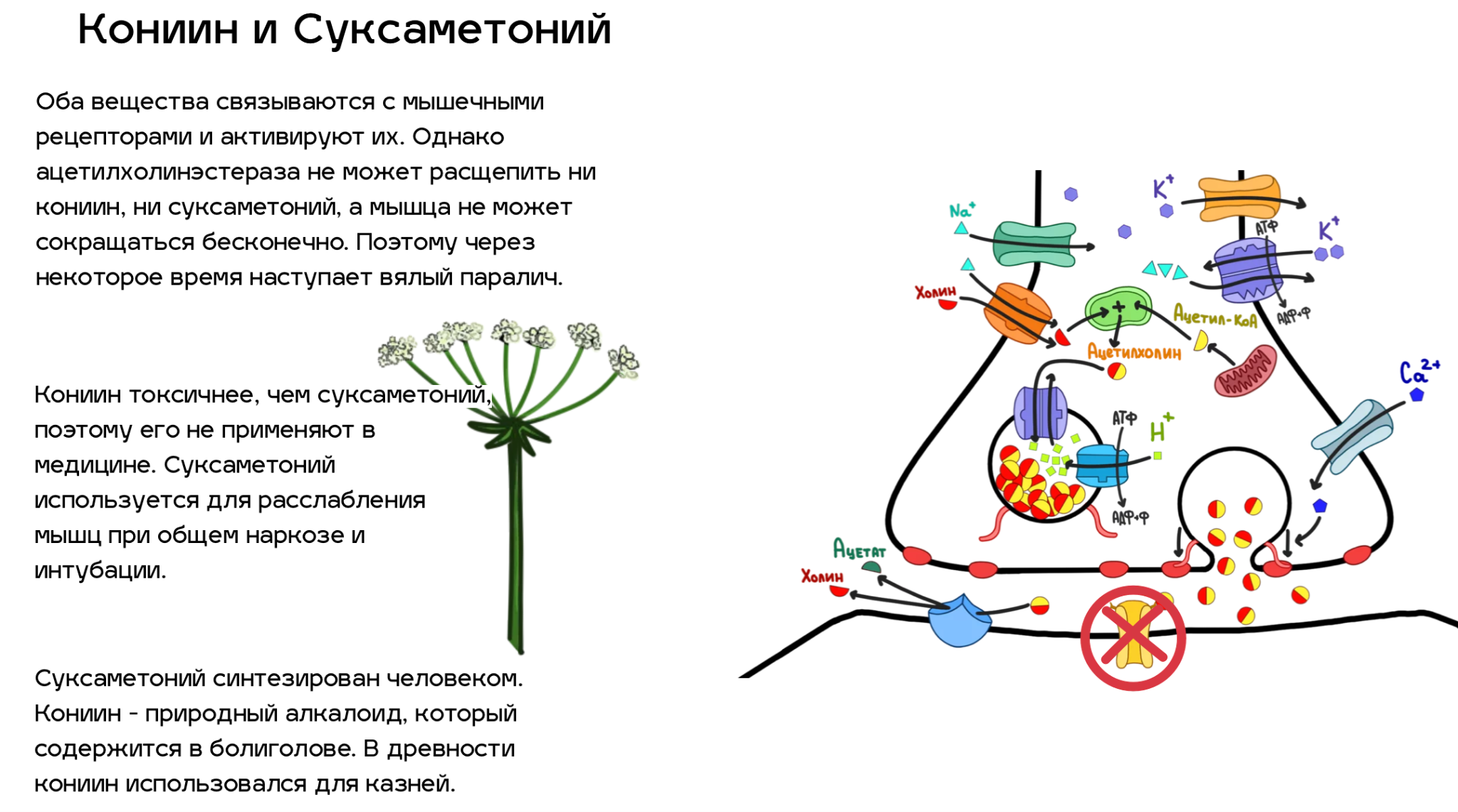
Ацетилхолиновый рецептор
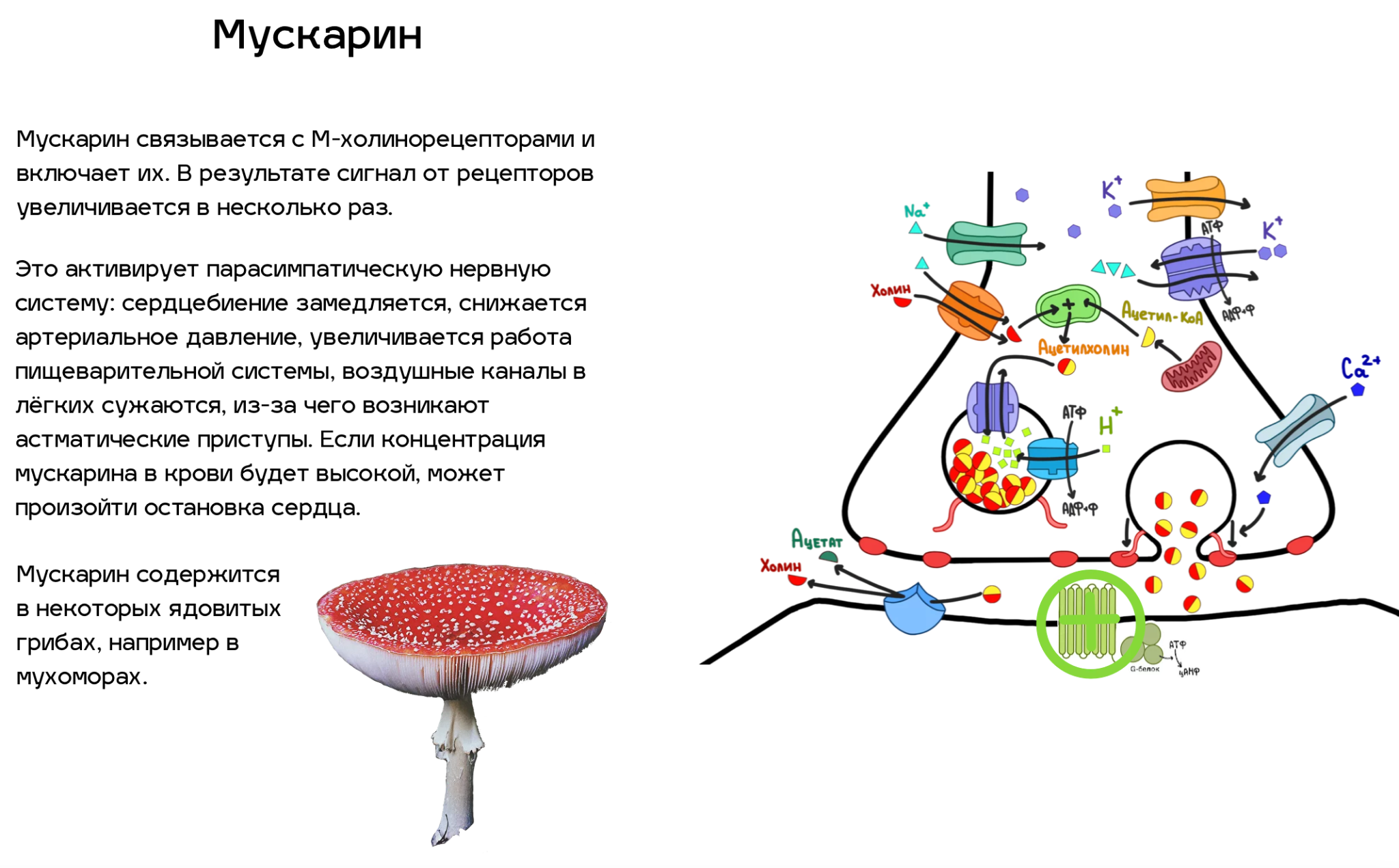
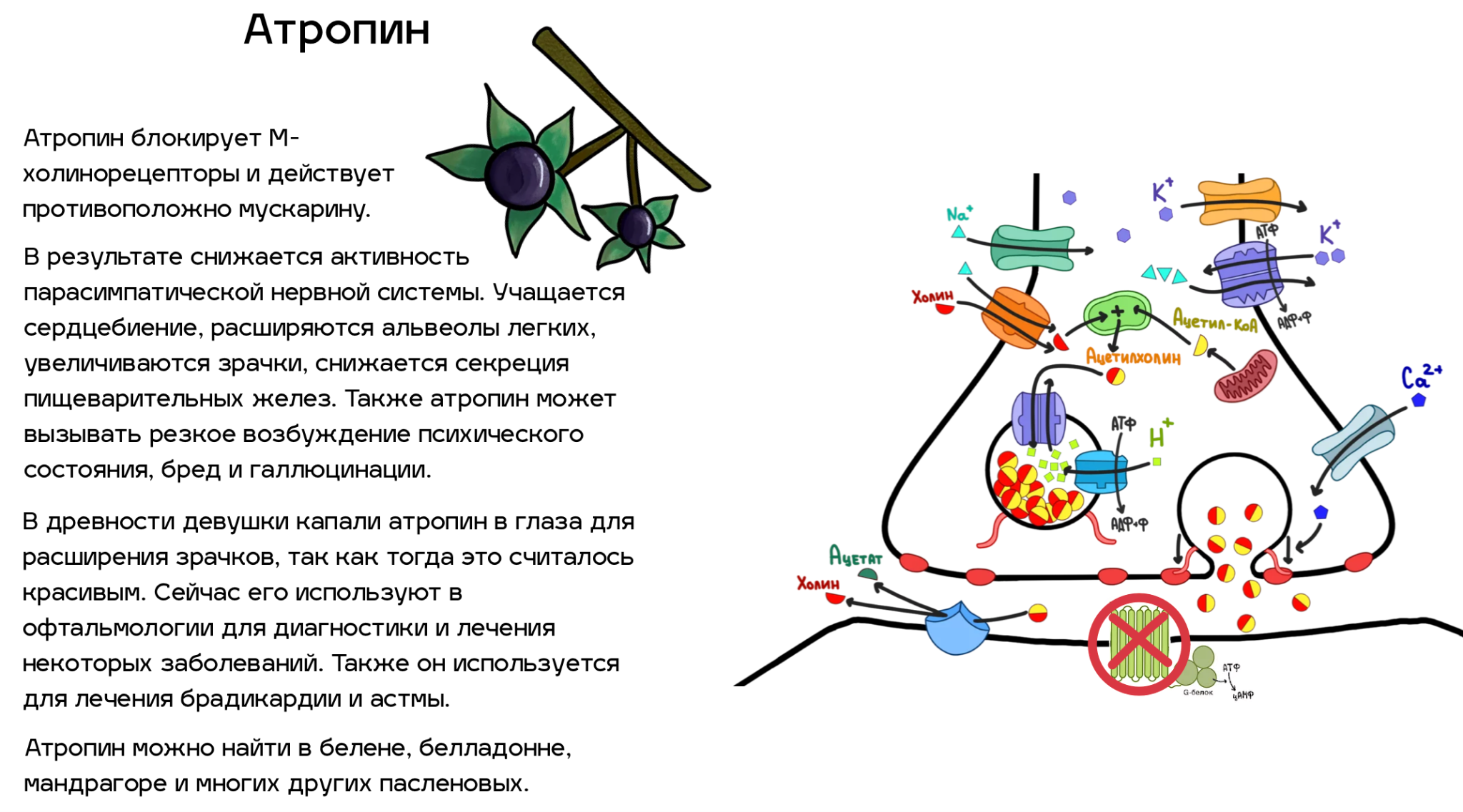
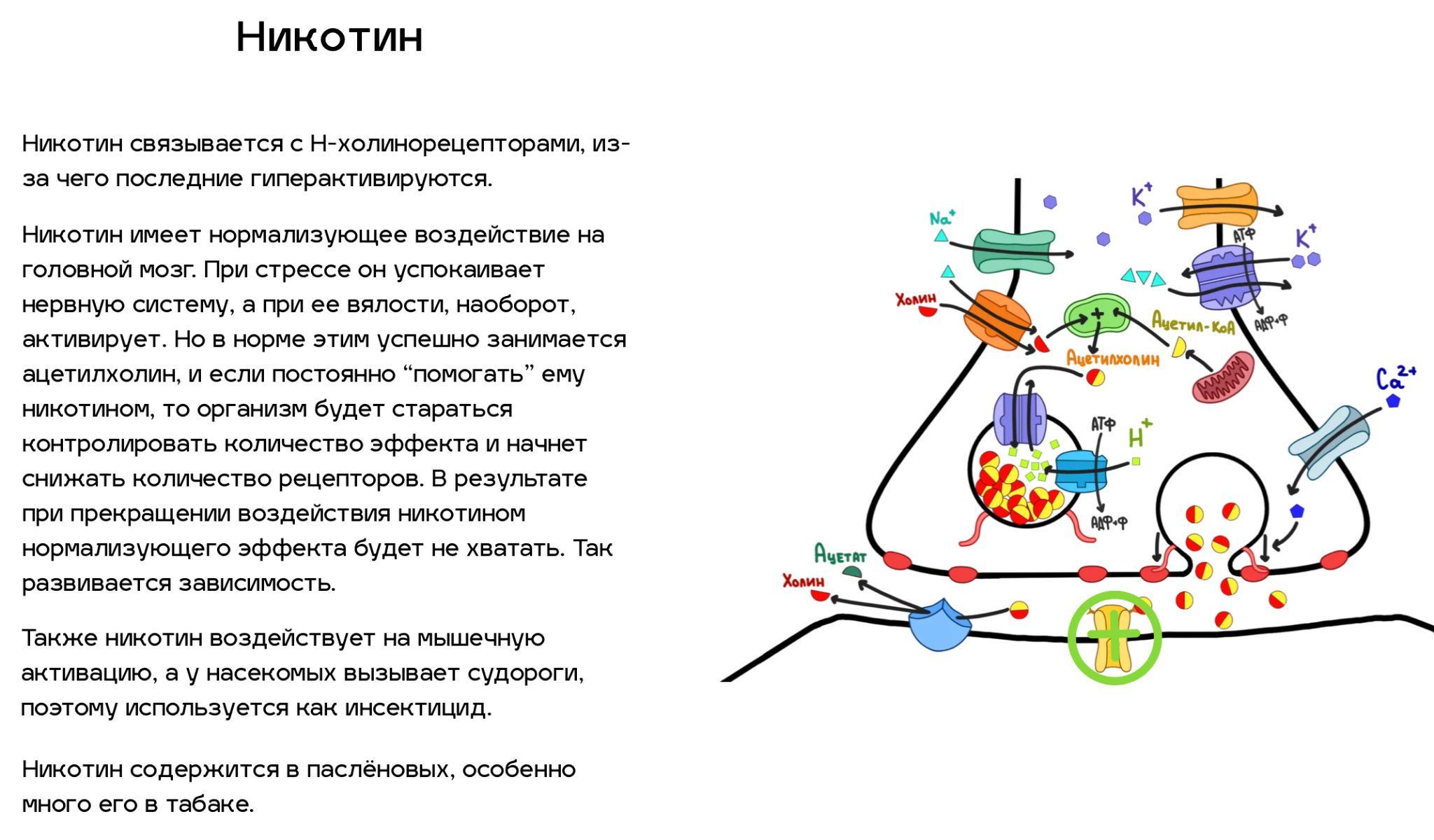
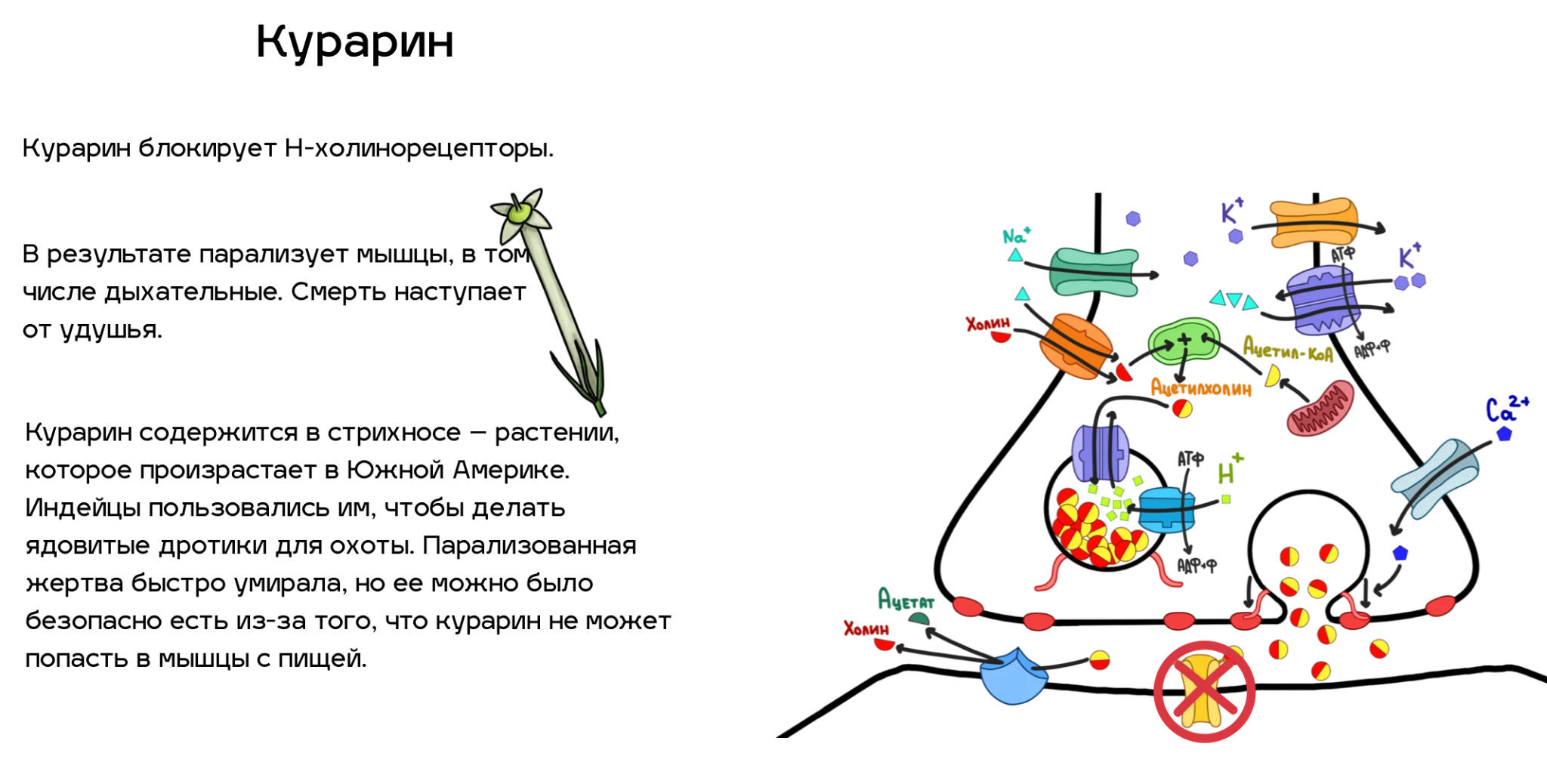
Рецепторы, находящиеся на мембране другой клетки, связываются с ацетилхолином и передают сигнал дальше. Но передавать этот сигнал можно по-разному. Рецепторы к ацетилхолину бывают двух типов (рис. 4): никотиновые ацетилхолиновые (Н-холинорецепторы) и мускариновые ацетилхолиновые (М-холинорецепторы) .
Подробнее о работе этих рецепторов читайте в статье «Никотин как алкалоид» [3].
Н-холинорецепторы (они изображены на общей схеме) в основном отвечают за мышечные сокращения в нейромышечных синапсах и за цикл сна и бодрствования в головном мозге. Эти рецепторы работают как натриевый канал: связывают две молекулы ацетилхолина и открывают свои ворота для катионов (в основном натрия). А натрий уже влияет на что-то другое, например, дает сигнал мышце, что нужно сокращаться.
М-холинорецепторы регулируют работу внутренних органов (сердцебиение, дыхание, пищеварение и т.д.). Эти рецепторы ассоциированы с G-белками и при связывании молекулы ацетилхолина активируют его, после чего одна из субъединиц G-белка включает аденилатциклазу, которая производит цАМФ. И уже цАМФ запускает каскад реакций дальше.
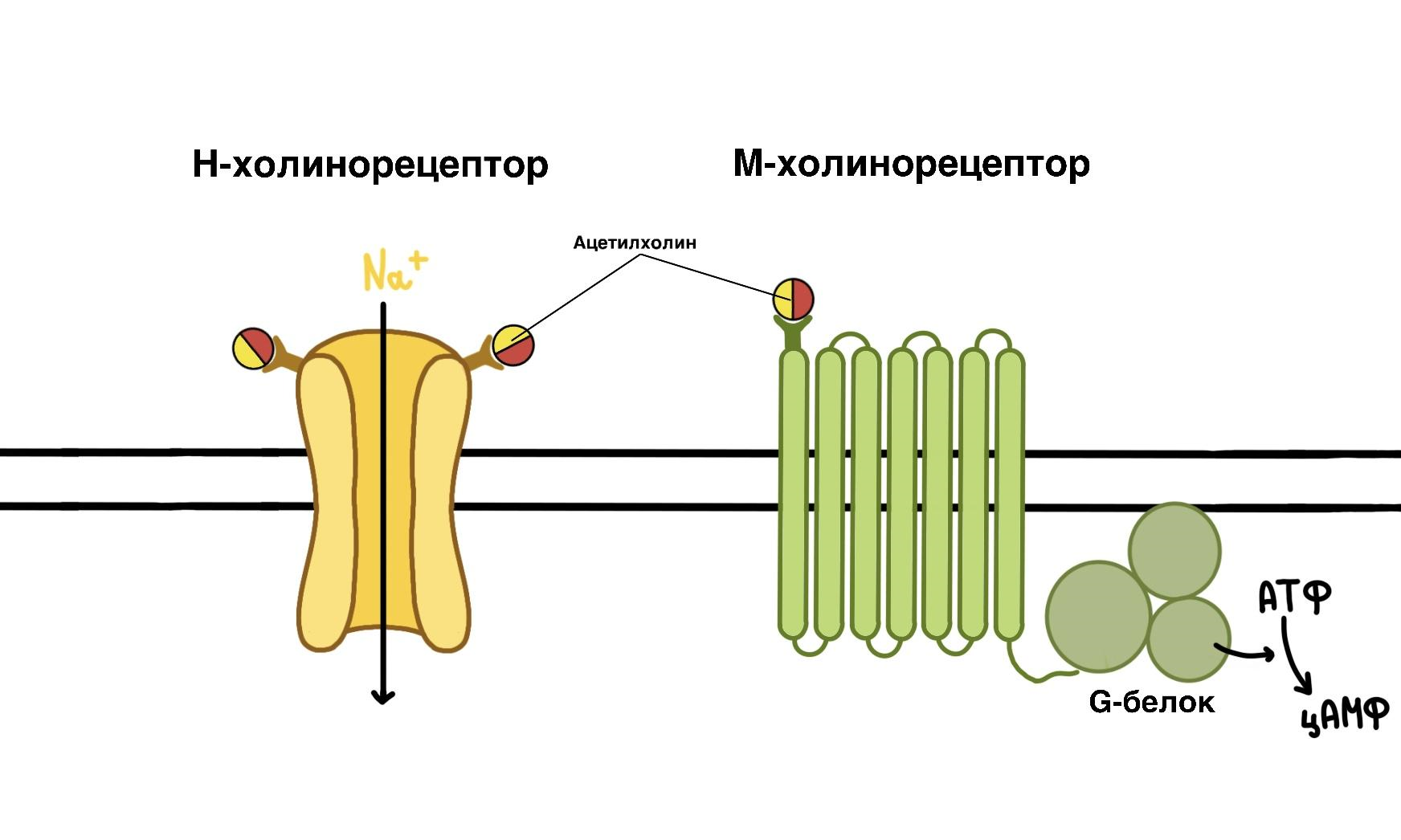
Рисунок 4. Виды ацетилхолиновых рецепторов. Н-холинорецептор — ионный канал; М-холинорецептор — рецептор, ассоциированный с G-белком.
рисунок автора статьи
Подснежник для тебя, яд — для синапса
Итак, мы разобрались, как синапс работает. Теперь давайте посмотрим, какие из всех этих деталей можно сломать. Спойлер — почти все. Список ядов, нарушающих ацетилхолиновый путь передачи нервных импульсов, который приведен ниже (рис. 5), далеко не полный. Однако это самые известные яды, и с некоторыми из них люди сталкиваются достаточно часто (например, никотин). По большей части, это соединения природного происхождения, но и некоторые знаменитые синтетические яды мы также упомянули.
Так как человеческая нервная система схожа с нервной системой животных, то все эти токсины будут работать не только против человека. Строго говоря, человек чаще всего и не является целевой жертвой большинства природных ядов. Очевидно, что растения с ядовитыми листьями защищаются не от людей, а от своих природных врагов — насекомых или животных. А то, что токсин действует еще и на человека — это скорее дополнительный эффект, иногда даже работающий не так, как задумывалось.
Как вы могли заметить, упомянутые на рисунках вещества воздействуют не на все белки в синапсе. Нами были рассмотрены только самые изученные, но есть и другие. Например, гемихолиниум-3, который блокирует работу транспортера холина. Или растительный уабаин, блокирующий натрий-калиевую АТФазу. Также есть различные блокаторы V-АТФазы. Их исследуют в качестве компонентов противораковой терапии из-за способности мешать опухоли закислять межклеточное пространство, что помогает уменьшить вероятность повреждения тканей и образования метастазов. Помимо этого, для потенциальной терапии рака (аденокарциномы легких) исследовался везамикол — блокатор везикулярного транспортера ацетилхолина.
Заключение
Существует бесчисленное множество разнообразных молекул, способных нарушить функционирование целого ряда синаптических белков. Некоторые из них имеют биологическое происхождение (яды растений и животных), а другие синтезированы человеком. Для чего же изучать эти соединения? Во-первых, знание об источниках природных токсинов поможет людям избежать отравления ими. Во-вторых, понимая механизмы действия этих веществ, можно использовать их для лечения того или иного заболевания, а также синтезировать на их основе более эффективные препараты.
Вещества, влияющие на работу нервной системы, окружают нас повсюду: в цветах, в животных, на полках аптек и в табачном дыме. Одни из них вызывают болезни, другие помогают их лечить. Изучение этих соединений приоткроет вам занавес в сложные, но захватывающие механизмы работы нервной системы.
Литература
- В полном объеме: синаптические везикулы в трехмерной модели синапса;
- Молекула здравого ума;
- Никотин как алкалоид;
- Холл Д., Гайтон А. Медицинская физиология. М: «Логосфера», 2018. — 1328 с.;
- Barrett K., Barman S., Brooks H.,Yuan J. Ganong’s Review of Medical Physiology. 25th Edition. McGraw Hill Medica, 2016. — 768 p.;
- J. P. Dumbacher, T. F. Spande, J. W. Daly. (2000). Batrachotoxin alkaloids from passerine birds: A second toxic bird genus ( Ifrita kowaldi ) from New Guinea. Proc. Natl. Acad. Sci. U.S.A.. 97, 12970-12975;
- John P. Dumbacher, Avit Wako, Scott R. Derrickson, Allan Samuelson, Thomas F. Spande, John W. Daly. (2004). Melyrid beetles ( Choresine ): A putative source for the batrachotoxin alkaloids found in poison-dart frogs and toxic passerine birds. Proc. Natl. Acad. Sci. U.S.A.. 101, 15857-15860;
- Samuel D. Robinson, Qing Li, Aiping Lu, Pradip K. Bandyopadhyay, Mark Yandell, et. al.. (2017). The Venom Repertoire of Conus gloriamaris (Chemnitz, 1777), the Glory of the Sea. Marine Drugs. 15, 145;
- Franz Worek, Horst Thiermann, Timo Wille. (2020). Organophosphorus compounds and oximes: a critical review. Arch Toxicol. 94, 2275-2292;
- Alex Proudfoot. (2006). The Early Toxicology of Physostigmine. Toxicological Reviews. 25, 99-138;
- «Постнаука»: Как никотин влияет на работу головного мозга?;
- Peter A. Crooks, Linda P. Dwoskin. (1997). Contribution of CNS nicotine metabolites to the neuropharmacological effects of nicotine and tobacco smoking. Biochemical Pharmacology. 54, 743-753;
- David Prvulovic, Harald Hampel, Johannes Pantel. (2010). Galantamine for Alzheimer's disease. Expert Opinion on Drug Metabolism & Toxicology. 6, 345-354;
- Mario Pérez-Sayáns, José Manuel Somoza-Martín, Francisco Barros-Angueira, José Manuel Gándara Rey, Abel García-García. (2009). V-ATPase inhibitors and implication in cancer treatment. Cancer Treatment Reviews. 35, 707-713;
- Vera Michel, Zongfei Yuan, Shobha Ramsubir, Marica Bakovic. (2006). Choline Transport for Phospholipid Synthesis. Exp Biol Med (Maywood). 231, 490-504;
- Aaron Dom, Kathleen Brown, Jamie Lau, Brent Thornhill, Clayton Crabtree, et. al.. (2014). Vesamicol, an inhibitor of vesicular acetylcholine transporter, causes apoptosis in human lung adenocarcinomas (151.3). FASEB j.. 28.