
В полном объеме: синаптические везикулы в трехмерной модели синапса
09 июля 2014
В полном объеме: синаптические везикулы в трехмерной модели синапса
- 5177
- 3
- 6
Тонкое строение синаптических везикул является ключом к пониманию работы внутриклеточного мембранного транспорта
-
Автор
-
Редакторы
Синаптические везикулы обеспечивают связь между нейронами, а значит, их изучение является необходимым для понимания того, как функционирует нервная система. Кроме того, везикулы являются моделью для изучения общих для всех клеток механизмов клеточного транспорта. Новая трехмерная модель синапса включает 300 тысяч белков в атомарном разрешении. Эта подробная модель открывает новые возможности для изучения тонких механизмом работы синаптических везикул.
По приблизительным оценкам, в среднем в эукариотической клетке содержится 7,9×109 молекул белков [1]. Удивительно, но такое огромное число молекул не ведет к хаосу и неразберихе, а обеспечивает точное выполнение всех клеточных функций, в которых у каждой молекулы есть свои место и задача. Благодаря подробному изучению различных клеточных процессов и молекулярных путей, ученые проникают все глубже в понимание тонкой клеточной организации. Важное место в таких исследованиях занимает исследование работы синаптических пузырьков (везикул), ведь они не только являются основой функционирования нашей нервной системы, но и представляют собой модель для изучения общих принципов мембранного транспорта. Не даром в 2013 году за исследования везикулярного транспорта вручена Нобелевская премия по физиологии и медицине [2]!
Синаптические везикулы — это маленькие мембранные пузырьки, находящиеся в синаптических окончаниях нейронов (особые расширения на концах нейронных отростков, обеспечивающие связь между нейронами). Синаптические везикулы заполнены медиаторами — химическими веществами, которые изменяю работу нейронов. Когда везикулы сливаются с мембраной синаптического окончания, медиатор попадает в щель между синаптическими окончаниями двух нейронов и таким образом передает сигнал от одного нейрона к другому. Благодаря тому, что все синаптические везикулы сконцентрированы в синаптических окончаниях, их легко выделять из изучаемых тканей для анализа. Поэтому именно судьба синаптических везикул — это один из самых хорошо изученных сейчас клеточных путей.
Известно, что он состоит из трех этапов. Сначала пузырек прикрепляется к специальному участку синаптической мембраны — активной зоне (этот этап называется докинг). Потом он подготавливается к слиянию с синаптической мембраной (прайминг) и, в конце концов, сливается с ней, высвобождая медиатор в синаптическую щель (экзоцитоз). Параллельно на синаптической мембране происходит эндоцитоз с образованием пузырька, который постепенно обеспечивается всеми необходимыми молекулами и медиатором для восполнения запаса везикул.
Для того, чтобы более полно описать работу синаптической везикулы и синаптичсекого окончания, необходимо подробно изучить ее молекулярное строение и белковый состав. Первая модель синаптического пузырька с атомным разрешением появилась еще семь лет назад [3]. В этой работе ученым удалось изучить некоторые особенности устройства везикулы, — например, они обнаружили, что белковые молекулы занимают около 20% поверхности мембраны везикулы, и при этом липидные компоненты мембраны представлены, по больше части, «жесткими» малоподвижными липидами. Новая работа ученых из Гёттингена позволила дополнить эти данные и подробно охарактеризовать соотношение различных белковых молекул внутри синаптического пузырька [4].
Группа исследователей под руководством Силвио Риццоли использовала комплексный подход, объединив количественный иммуноблоттинг, масс-спектрометрию, электронную микроскопию и флуоресцентную микроскопию высокого разрешения, что позволило им охарактеризовать не только количество разных белков в везикулах и в цитоплазме вокруг них, но и их расположение внутри синаптического окончания. На первом этапе своего исследования они выделили синаптические окончания из образцов мозга крысы. Сделать это можно с помощью центрифугирования в градиенте полисахарида (в данной работе был использован синтетический полисахарид Ficoll, но подобный эксперимент можно провести и с обыкновенной сахарозой).
Разные компоненты клетки имеют разную плотность, поэтому, если разрушенные клетки (гомогенат) поместить в пробирку с несколькими слоями растворов сахара разной концентрацией и начать вращать на центрифуге, органеллы распределяться по этим слоям, выбирая слой с близкой плотностью. При разрушении нервных клеток синаптические окончания отрываются от нейронных отростков и образуют так называемые синаптосомы, которые можно обнаружить в слое с 9% концентрацией полисахарида Ficoll (рис. 1). Полученный образец синаптосом исследователи, прежде всего, изучили с помощью электронного микроскопа. Это помогло охарактеризовать пространственные параметры синаптосом: их размер, количество синаптических пузырьков в одной синаптосоме, объем этих пузырьков.
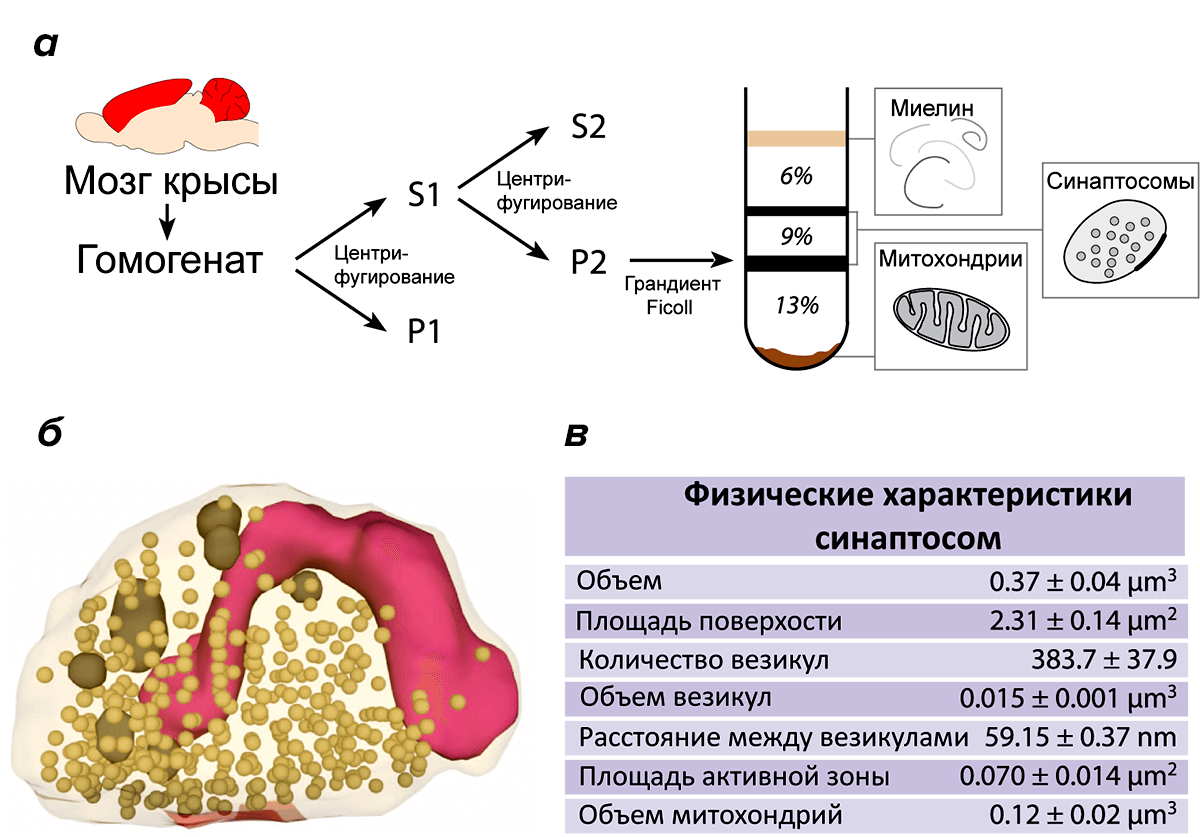
Рисунок 1. Синаптосомы. а — Схема приготовление препарата синаптосом. б — Реконструкция синаптосомы по электронным микрофотографиям. Красным отмечена активная зона, темно-бежевым — синаптические везикулы, темно-серым — более крупные органеллы, розовым — митохондрия.
Убедившись, что процедура выделения синаптосом не изменила содержащееся в них количество белков, ученые вычислили концентрацию 62 различных белков с помощью количественного иммуноблоттинга. Суть этого метода заключается в сравнении количества каждого из белков в экспериментальном образце и в контрольных образцах с заранее известной концентрацией белка. Полученные результаты хорошо согласовывались с более ранними исследованиями. Отклонение было обнаружено только для белка SV2 (synaptic vesicle 2): в данном исследовании его количество было оценено как 12 копий на один синаптический пузырек, тогда как в других исследованиях — 1,7 и 5 копий.
Метод иммуноблоттинга основан на работе антител, которые распознают только целые белки, содержащие определенную последовательность аминокислот. При этом, если часть белков при приготовлении экспериментального образца (гомогената клеток) была разрушена и/или утратила необходимую аминокислотную последовательность, эта фракция белков не будет распознана. Именно поэтому иммуноблоттинг помог исследовать только около 40,5% общего содержания белков в синаптосомах. Для того, чтобы сделать оценку количества белков более точной, исследователи обратились к количественной масс-спектрометрии — к методу iBAQ (intensity-based absolute quantification, основанный на интенсивности полный подсчет). iBAQ вычисляет количество того или иного белка, учитывая все пептиды, которые могли появиться при его разрушении. Использование этого метода помогло увеличить долю проанализированных белков до 88,4%, при этом результаты хорошо коррелировали с данными, полученными при иммуноблоттинге.

Рисунок 2. Белковый состав пресинаптического окончания на примере синаптическо-го белка VAMP2. На рисунках в первом столбце изображены схемы препаратов, AZ — активная зона, ves — везикулы. Во втором и третьем столбцах — иммуногистохимическая окраска на белки VAMP2, маркер активной зоны (Bassoon или Bungarotoxin) и маркер синаптических пузырьков (Synaptophysin). В столбцах 4–6 — распределение белков VAMP2, Amphiphysin, Syntaxin 16 в синапсе. Более яркая окраска показывает большее количество белка интереса в данном участке синаптосомы.
Внутренним контролем служило то, что белки, образующие различные белковые комплексы (например, структурные белки везикулярных кластеров или белки активной зоны) были обнаружены в правильных соотношениях. Интересным и неожиданным открытием оказалось то, что количество белков, задействованных на разных этапах везикулярного цикла, разительно отличается. Количество белков комплекса SNARE (необходимого для слияния синаптического пузырька с синаптической мембраной) составляло 20–26 тысяч копий в одной синаптосоме, хотя для экзоцитоза одной везикулы достаточно 1–3 копий этого комплекса. При этом в одной синаптосоме всего около 4 тысяч молекул клатрина и около 2,3 тысяч молекул динамина. Для работы одного синаптического пузырька нужно 150–180 копий клатрина, а значит, всего клатрина, который присутствует в одном синапсе, хватит для экзоцитоза только 7% везикул этого синапса. Аналогичные расчеты для динамина показывают, что его количество достаточно для экзоцитоза всего 11% везикул. При этом количество белков, необходимых для эндоцитоза везикул (для замешения использованных пузырьков), было еще ниже — от 50 до 150 копий.
Для того, чтобы объяснить эти неожиданные результаты, ученые предположили, что для некоторых белков их точное расположение в месте использования может компенсировать недостаточное количество копий. В то же время, белки, количество которых оказалось удивительно большим, могут располагаться в синапсе очень рассеянно, поэтому в каждом конкретном месте синапса их концентрация будет низкой. Проверить эти предположения исследователям помогло использование флуоресцентной микроскопии высокого разрешения — метода STED-микроскопии [5] (Stimulated Emission Depletion Microscopy, микроскопия на основе подавления спонтанного испускания). В качестве контрольных образцов ученые использовали культуру нейронов гиппокампа и нервно-мышечное окончание взрослых крыс.
С помощью флуоресцентной микроскопии было изучено расположение 62 различных белков относительно активной зоны синапса и везикулярного кластера (скопления везикул в синаптическом окончании). Оказалось, что большинство белков распределено в объеме синапса более-менее равномерно (учитывая, что большинство белков активной зоны находится в активной зоне, а везикулярный кластер занимает почти весь объем синаптосомы). Таким образом, компенсация за счет особенностей распределения для белков синапса не характерна, а значит, вопрос о том, почему количество копий одних белков значительно больше количества копий других, остается открытым.
Полученные с помощью STED-микроскопии данные помогли исследователям построить трехмерную реконструкцию синаптического окончания, содержащую 60 различных белков (рис. 3). Все белки были смоделированы с атомарной точностью и расположены в характерных участках синапса, в соответствии с полученными экспериментальными результатами и литературными данными. Эта модель демонстрирует, что синаптическое окончание достаточно плотно заполнено везикулами, что, вероятно, препятствует свободному перемещению молекул и органелл. Возможно, что большое количество копий некоторых белков является эволюционным приспособлением к этой особенности строения синаптического окончания, помогающим обеспечить быстрое высвобождение медиатора в синаптическую щель. При этом образование новых везикул взамен использованных (эндоцитоз) может проходить гораздо медленнее без вреда для функционирования синапса. Это может объяснить небольшое количество копий эндоцитозных белков. При этом для того чтобы обеспечить нормальную работу синаптического окончания, нужно иметь большой запас готовых везикул, что и показывают результаты трехмерной реконструкции.
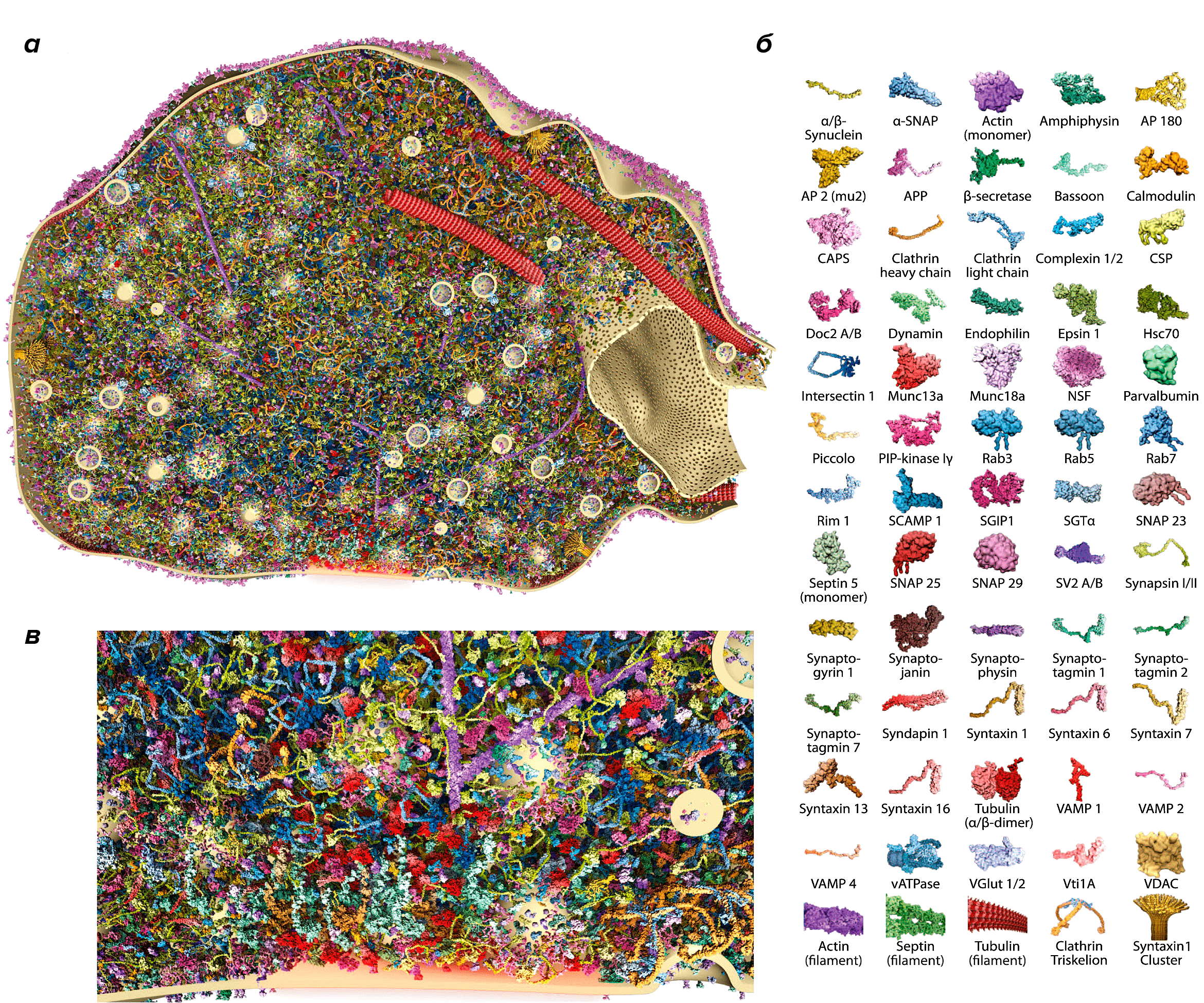
Рисунок 3. Трехмерная реконструкция синапса. а — Срез через синаптическое окончание. Изображение содержит 60 белков, которые расположены в количестве копий и местоположениях, определенных с помощью микроскопии. б — Белки, указанные на реконструкции синапса. в — Увеличенное изображение активной зоны.
Полученные немецкими учеными результаты позволяют более подробно описать функционирование синаптического окончания и работу системы везикулярного транспорта. Стало понятно, что в условиях высокой плотности везикул, количество и расположение белков в синаптическом окончании должно строго контролироваться. Но на вопрос о том, каким образом контролируется количество копий каждого из белков, предстоит ответить новым исследованиям. Осуществляется ли этот контроль на уровне транскрипции, трансляции или транспорта этих белков от тела нейрона к синаптическому окончанию? Возможно, что важную роль в этом контроле играют сами синаптические везикулы, которые могут связывать свободные белки и, таким образом, снижать их концентрацию в цитоплазме. Более подробно предстоит изучить и особенности регуляции трансмембранных белков синаптических пузырьков, которым было уделено немного внимания в описанной работе.
За последние два десятилетия компьютерные технологии начали вносить значительный вклад во все естественные науки, в том числе и в биологию. Наряду с масштабным анализом больших объемов данных и компьютерным моделированием различных биологических процессов, все большие обороты набирает научная визуализация, которая является областью компьютерной графики. Если на ранних этапах развития этой области ученым удавалось создавать только трехмерные модели белков и некоторых других молекул, то сейчас вычислительные мощности позволяют моделировать сравнительно крупные объекты — большие молекулярные комплексы и целые вирусы.
Отличным примером результатов научной визуализации могут послужить работы российской компании Visual Science в их проекте «Зоопарк вирусов» — самые подробные на данный момент научно достоверные модели ВИЧ и вируса гриппа. Специалисты Visual Science объединяют данные огромного количества работ по молекулярной биологии, вирусологии и кристаллографии, мнения экспертов ведущих научных центров мира и результаты молекулярного моделирования, полученные научным отделом компании.
О другом примере детальной научной визуализации было рассказано в этой статье. Уже сейчас можно утверждать, что такие подробные трехмерные модели помогают ученым получить более общий взгляд на изучаемый объект, обнаружить новые закономерности в его строении и функционировании. Несомненно, что в ближайшем будущем область применения научной визуализации будет расширяться, помогая исследователям совершать новые открытия.
Литература
- Lodish H., Berk A., Zipursky S.L. et al. Molecular cell biology (4th Edition). New York: W.H. Freeman, 2000;
- Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт;
- Молекулярная модель синаптической везикулы;
- B. G. Wilhelm, S. Mandad, S. Truckenbrodt, K. Krohnert, C. Schafer, et. al.. (2014). Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins. Science. 344, 1023-1028;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- R. Metzler, J.-H. Jeon, A.G. Cherstvy. (2016). Non-Brownian diffusion in lipid membranes: Experiments and simulations. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1858, 2451-2467.






