Sonic Hedgehog и его удивительная молекулярная семья Ёжиков (Hedgehog)
29 февраля 2024
Sonic Hedgehog и его удивительная молекулярная семья Ёжиков (Hedgehog)
- 1450
- 1
- 5
Рисунок в полном размере.
иллюстрация автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Что может быть увлекательнее, чем когда ученые называют открытые молекулы в честь любимых персонажей игры! В «Биомолекуле» уже обсуждались молекулы-«стрелочники» Wnt, но они не единственные в многоклеточных организмах, которые лучше других разбираются, как жить эту жизнь (в какие клетки делиться и какие ткани создавать). В этой статье пойдет речь еще об одном «умнике» — еже, который также командует и говорит клеткам, что им делать.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Вопросы о том, как из одной яйцеклетки появляется целый организм, волнуют человека давно. Предположение, что существуют какие-то молекулы, направляющие путь развития клеток при делении яйцеклетки, выдвинул еще в 1924 году ученый Шпеман Ханс. Впоследствии все больше ученых открывали и изучали всевозможные морфогены и индукторы, влияющие на путь развития клеток. К сегодняшнему дню мы уже знаем про захватывающие молекулярные пути, включая Notch, Wnt, TGF-β, BMP и Hedgehog. Они, как дирижеры клеточного балета, направляют развитие и формирование клеток и тканей нашего организма. Эти пути регулируют невероятное разнообразие биологических сценариев, например:
- Путь Notch регулирует развитие нервной системы, органов чувств и тканей кожи. Например, он определяет, какие клетки станут нейронами, а какие — глиальными клетками [1].
- Путь Wnt регулирует развитие эмбриона, рост и дифференцировку клеток. Например, он участвует в формировании головного мозга, сердца и костей [2].
- Путь TGF-β регулирует развитие тканей, иммунный ответ и воспаление. Например, он участвует в формировании костей, мышц и кровеносных сосудов [3].
- Путь Hedgehog выделяется особым образом, он влияет на развитие не только организма на стадии эмбриогенеза, но также участвует в поддержании стволовых клеток и может способствовать канцерогенезу.
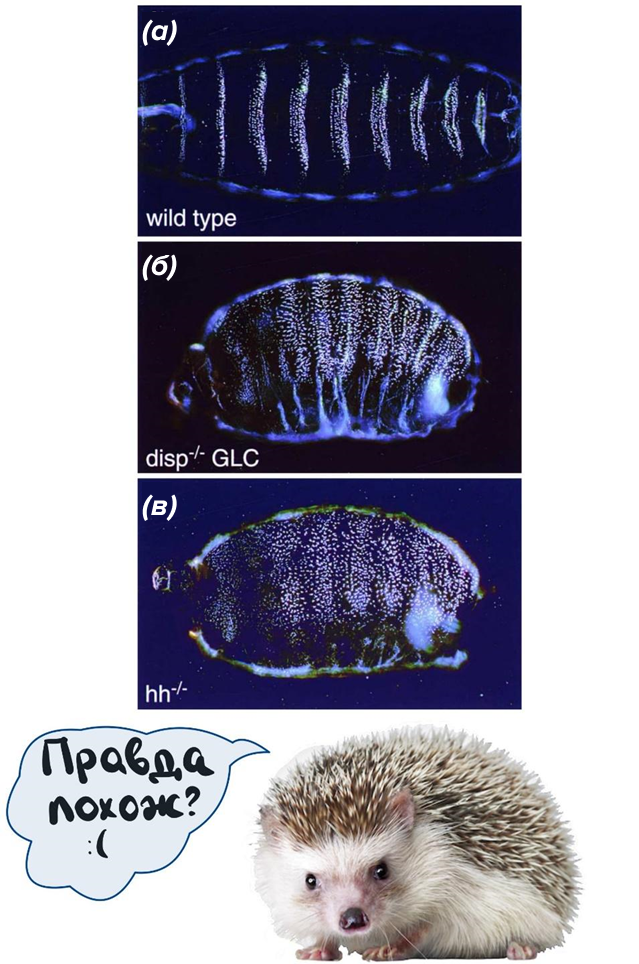
Рисунок 1. Препараты кутикулы эмбрионов мух поздней стадии. Вентральный вид. Эмбрионы ориентированы вперед влево.
(а) — эмбрион дикого типа — как он должен выглядеть в норме;
(б) — эмбрион disp-/-, полученный из мутантного клона зародышевой линии;
(в) — hhAC/AC гомозиготный мутантный эмбрион.
[5], рисунок адаптирован
Этот белок (и его ген), а также регулируемый им путь были открыты в 1980-х годах группой исследователей под руководством Христианы Нюслайн-Фольхард и Эрика Вишауса [4], когда исследователи работали с плодовой мухой Drosophila melanogaster. Они обнаружили, что мухи с мутацией в гене белка Hedgehog (hh) проявляют ряд аномалий в процессе развития, включая появление дополнительных конечностей, недоразвитие нервной системы, изменения в формировании сегментов тела и нарушения в развитии крыльев. Изменения в морфологии личинки мухи, такие как увеличение числа сегментов тела и уменьшение их длины, визуально напомнили ученым ежа. Именно по этой причине ген получил название Hedgehog, что в переводе с английского означает «еж» (рис. 1) [5].
В 1995 году Христиана Нюслайн-Фольхард, Эрик Вишаус и Эдвард Льюис получили Нобелевскую премию по физиологии и медицине за работу по изучению генетических мутаций в эмбриогенезе дрозофилы [6].
К настоящему дню Hh — это не просто один белок и его ген у мухи; это целое семейство белков Hedgehog (далее в тексте Hhs), которые встречаются у рыб, млекопитающих и т.д. Эти белки объединены общей эволюционной связью, что подчеркивает их важность и разнообразие функций в биологических процессах.
Строение Hedgehog
Все белки семейства Hhs состоят из двух отдельных доменов: аминоконцевого домена Hedge (HhN), выполняющего сигнальную функцию, и карбоксиконцевого домена Hog (HhC), выполняющего автопроцессинговую роль. Автопроцессинговая роль подразумевает внутренние белковые изменения, которые включают в себя разрезание белковой цепи на определенных участках (рис. 2). Чтобы «Еж» созрел и стал функциональной молекулой, он проходит через этап разрезания — белковый сплайсинг (подробнее о механизмах белкового сплайсинга рассказывается в статье «Белки против РНК — кто первым придумал сплайсинг?» [7]), который приводит к образованию двух фрагментов: N-концевого фрагмента и C-концевого фрагмента. Эти фрагменты затем подвергаются посттрансляционным модификациям. Со стороны сигнального С-концевого домена связывается холестерин, а к N-концевому участку присоединится пальмитиновая кислота. После модификации активированный белок высвобождается из секретирующих клеток [8].
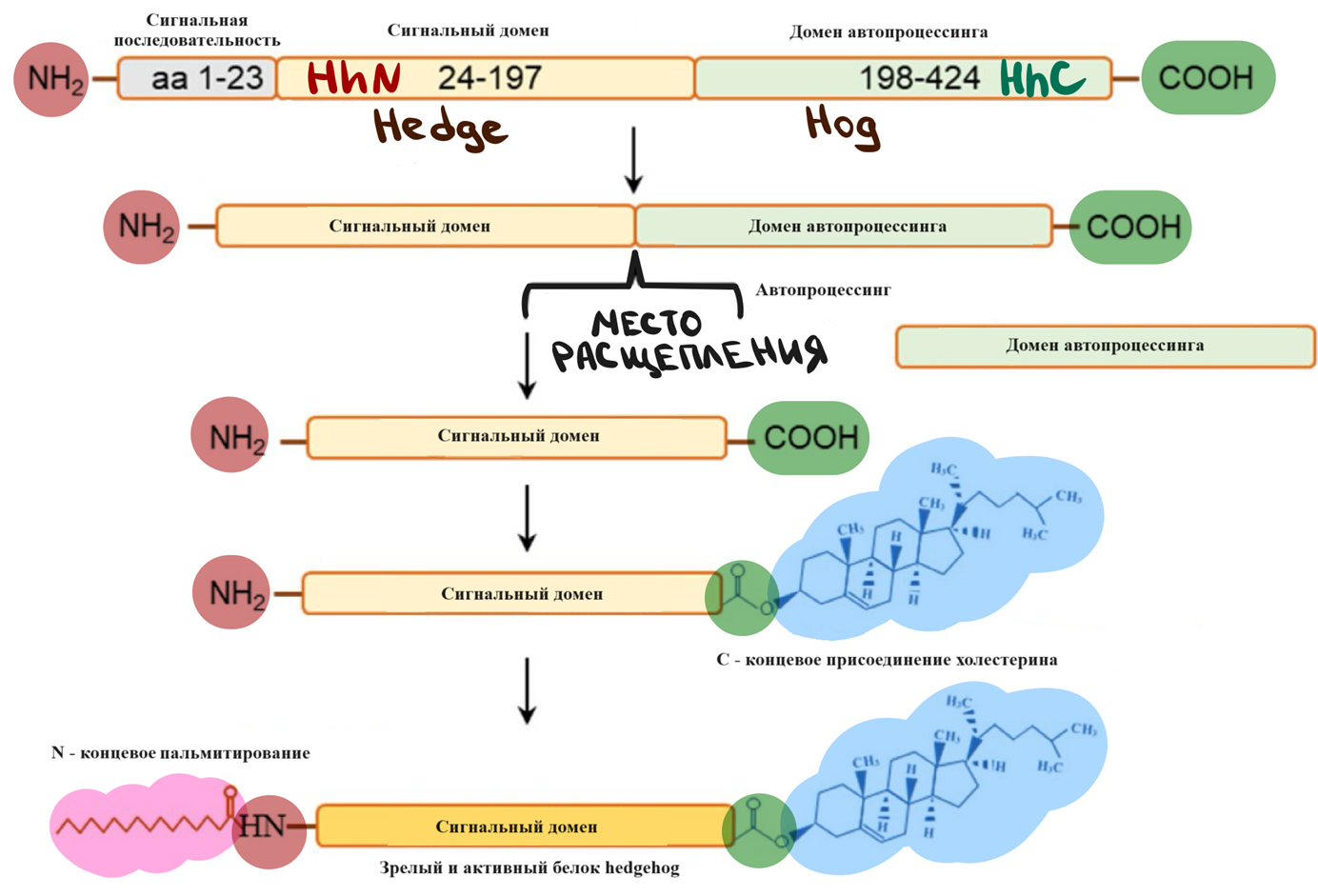
Рисунок 2. Посттрансляционная модификация белка Hh.
Сигнальная последовательность (серый) — полиA-сигнальный элемент. Это последовательность нуклеотидов, которая указывает на то, что конец иРНК должен быть полиаденилирован для экспорта белка.
Сигнальный домен (оранжевый) — это аминоконцевой сигнальный домен (HhN) белка, который взаимодействует с другими белками или молекулами, чтобы передать сигнал.
Домен автопроцессинга (зеленый) — это автокаталитический карбоксиконцевой домен (HhC) белка, который участвует в его собственном разрезании.
Домены HhN и HhC также обнаруживаются в белках, отличных от семейства Hh, и поэтому во всем мире их называют Hedge и Hog, соответственно.
Автопроцессинг — это процесс саморасщепления белка.
N-концевое пальмитирование — процесс присоединения жирной кислоты к N-концу белка.
C-концевое холестерилирование — это процесс присоединения холестерина к C-концу белка.
[8], рисунок адаптирован
Высвобождение ежика может происходить несколькими способами (рис. 3). Один из способов — это транспортировка белком-транспортером (Disp1). Белок-транспортер связывается с ежом и помогает ему выйти из клетки (рис. 3а). Еще один способ — это полимеризация ежика в мультимолекулу. Полимеризация — это процесс, при котором несколько молекул объединяются в одну большую молекулу. «МультиЕж» крупнее, чем одиночная молекула ежа, поэтому она легче диффундирует из клетки (рис. 3б). Ежик может быть перемещен на большие расстояния с помощью липопротеинов. Липопротеины — это молекулы, которые состоят из жира и белка. Это происходит при помощи белка Hspg, локализованного на секреторной клеточной мембране, который загружает ежа в липопротеин в качестве «пассажира» (рис. 3в). И существует сложный, но не менее важный процесс — отрицательная обратная связь. Отрицательная обратная связь работает как регулятор в системе: если белка становится слишком много, этот механизм начинает уменьшать его количество. Для этого у клетки, секретирующей белок, есть рецепторы к этому же белку, например, для Hhs это специальный рецептор Ptch1. Когда ежик связывается с Ptch1, это приводит к активации сигнального пути, снижающего высвобождение ежика из секретирующих клеток. Таким образом, отрицательная обратная связь помогает организму избежать избытка или недостатка белка Hhs, которые могут привести к аномалиям развития (рис. 3г) [9], [10].
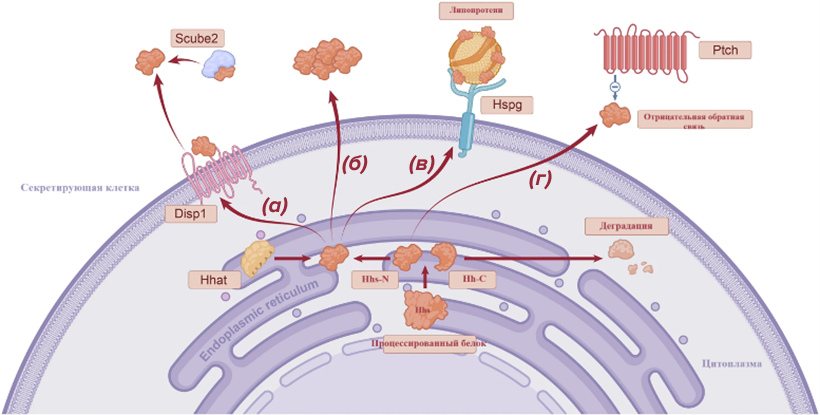
Рисунок 3. Механизмы высвобождения Hhs-N из секреторных клеток после активации. Процессированный белок расщепляется на две части: Hhs-N и Hh-C, которая деградирует. Hhs-Nсоединятеся с Hhat и далее транспортируется из клетки:
(а) — транспортировка из клетки белком-транспортером Disp1;
(б) — полимеризация ежика в мультимолекулу. Полимеризированный Hhs-N более стабилен и лучше проникает в клетки-мишени;
(в) — транспорт при помощи липопротеина. Загрузка белка в липопротеин происходит при помощи белка Hspg;
(г) — отрицательная обратная связь при помощи специального рецептора Ptch1.
[9], рисунок адаптирован
Передача сигналов Hedgehog и первичная ресничка
После секреции белка он будет связываться с клетками, если у них есть специальный рецептор, о котором уже было упомянуто выше, Ptch1. Но, чтобы более подробно разобраться в механизме этого сигнального пути, нужно пару слов сказать про первичную ресничку.
Первичная ресничка — это сенсорная органелла, которая присутствует на многих типах клеток эукариотических организмов. В отличие от подвижных ресничек, например, обнаруженных на клетках дыхательных путей, желудочков мозга и яйцевода, которые сокращаются, чтобы переместить вышележащую жидкость, первичные реснички неподвижны и специализируются на передаче сигналов. У млекопитающих она обнаружена на стволовых, эпителиальных, эндотелиальных, соединительных, мышечных и даже нейронных клетках. Она является неподвижной и выполняет функцию антенны. Представляет собой клеточный выступ на основе микротрубочек и имеет базальное тело, как и любая ресничка. По микротрубочкам двигаются белки кинезины и динеины, перемещающие белки от базального тела реснички вверх или вниз от верхушки реснички. Более подробную информацию о работе этих белков можно найти в статье «Белковые моторы: на службе у человека и нанотехнологий» [11]. Мембрана первичной реснички отличается от клеточной, но непрерывно связана с ней. На ней располагается большое количество различных рецепторов, ионных каналов и сигнальных белков, которые участвуют в принятии сигналов. Эти сигналы затем передаются в клетку, где они могут вызывать различные клеточные реакции (рис. 4) [12].
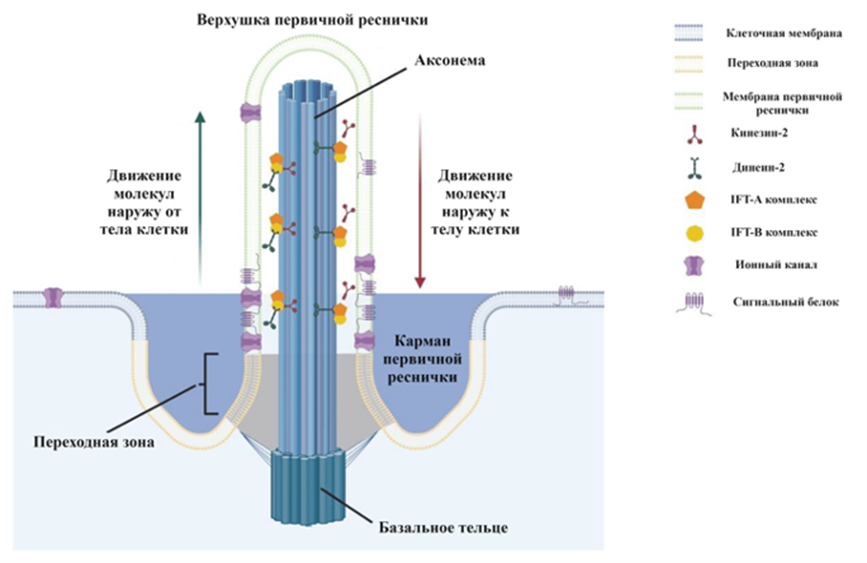
Рисунок 4. Строение первичной реснички. Первичная ресничка состоит из аксонемы и базального тельца.
Аксонема — это микротрубочковый комплекс, который обеспечивает жесткость и прочность реснички.
Базальное тельце — это структура, которая прикрепляет ресничку к клетке.
Карман первичной реснички представляет собой углубление в мембране, которое окружает основание реснички. Карман содержит ионные каналы, которые позволяют ионам проходить через мембрану.
Кинезины и динеины — это белки, которые участвуют в движении микротрубочек в аксонеме. Кинезины перемещают микротрубочки в направлении от основания реснички к кончику, а динеины перемещают их в противоположном направлении.
Мембрана реснички отличается от остальной мембраны клетки. Она содержит больше ионных каналов и других белков, которые участвуют в восприятии сигналов.
Ионные каналы чувствительны к различным сигналам, таким как гормональные сигналы, изменение скорости потока жидкости или электрические поля.
Сигнальный белок связывается с сигнальными молекулами из окружающей среды. Это связывание приводит к изменению конформации сигнального белка, что, в свою очередь, приводит к изменению активности других белков в клетке.
Интрафлагеллярный транспорт (IFT) — это процесс, при котором белки и другие молекулы перемещаются по аксонеме от базального тельца к кончику реснички. IFT необходим для сборки и поддержания структуры реснички.
[12], рисунок адаптирован
Первичная ресничка является ключевым компонентом сигнального пути Hedgehog, поскольку она обеспечивает начальное распознавание внешних сигналов и их передачу внутрь клетки для дальнейшей активации транскрипции нужных генов.
На рисунке 5 мы видим два варианта работы сигнального пути:
- OFF — работа сигнального пути при отсутствии Hhs,
- ON — работа сигнального пути в присутствии Hhs.
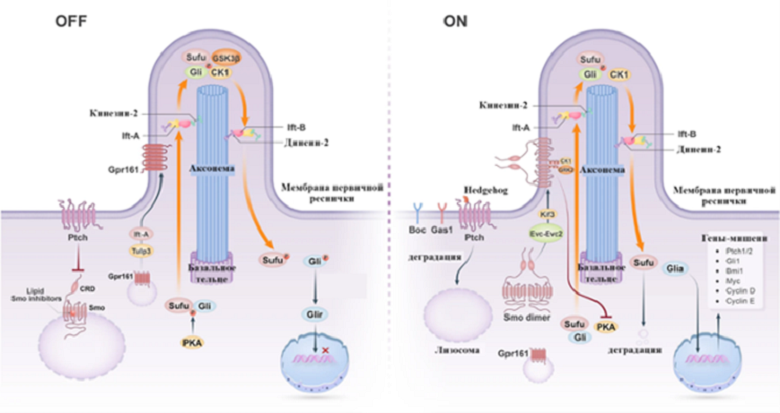
Рисунок 5. Передача сигналов Hedgehog. OFF — работа сигнального пути в отсутствие hedgehog, ON — работа сигнального пути в присутствии hedgehog. В сигнальном пути Hedgehog реснички играют ключевую роль. Они несут моторы с сигнальными компонентами Hhs, которые скользят по аксонеме. Кинезин-2 обеспечивает транспорт от основания реснички к кончику, а динеин-2 — от кончика к основанию реснички. В присутствии Hedgehog ингибирование Smo с помощью Ptch прекращается, и Ptch транспортируется в лизосому для деградации. Активированный Smo ингибирует активность PKA и способствует транскрипции генов-мишеней.
[9], рисунок адаптирован
Главная цель Hhs — это активировать сигнальный каскад, то есть включить его (перевести в ON-состояние). Для этого ему необходимо связаться с Ptch1, который, в свою очередь, ингибирует белок Smo. Smo — это сигнальный мембранный белок, который расположен на поверхности первичной реснички. В отсутствие Hhs Smo находится в неактивном состоянии. После активации белок Smo димеризуется (на рисунке — Smo dimer), а Ptch1 деградирует. При помощи кинезина-2 и других вспомогательных белков димер Smo белка транспортируется к базолатеральной части реснички, где фосфорилируется белками CK1 и GRK2, что приводит Smo к полной активации. Это нужно для активации другого важного белка — Gli, который сможет проникнуть в ядро клетки и запустить транскрипцию генов-мишеней, которые дальше будут влиять на судьбу клетки и происходящие в ней процессы. Чтобы активировать Gli, Smo ингибирует активность PKA. PKA является ферментом, который активирует комплекс Sufu/Gli. И снова при помощи кинезина-2 и других вспомогательных белков переносчиков Sufu/Gli транспортируется к верхушке первичной реснички, где CK1 фосфолирирует Gli. После активации Sufu деградирует, а Gli способна проникнуть в ядро и активировать транскрипцию нужных генов-мишеней (гены белков Ptch1/2, Bmi1, Gli1, Myc, Cyclin D и Циклин E) [9], [13].
Gli связывается с промоторами генов-мишеней и активирует их транскрипцию. Для этого Gli использует различные механизмы, включая:
- Фосфорилирование определенных аминокислотных остатков в белках, которые регулируют транскрипцию. Это приводит к активации или деактивации этих белков.
- Активацию транскрипционных факторов, которые связываются с промоторами генов и инициируют транскрипцию.
- Удаление репрессоров транскрипции, которые блокируют транскрипцию генов.
Семья Ежиков (Hedgehog)
Hedgehog — это эволюционно консервативный сигнальный каскад, который необходим для правильного формирования и развития тканей у многоклеточных организмов. Передача сигналов Hedgehog необходима для формирования эмбрионального паттерна и постнатальной физиологии у беспозвоночных и позвоночных. Выше мы уже говорили о Hedgehog у мухи дрозофилы hh; гомологичные ему белки есть у всех беспозвоночных, кольчатых червей и насекомых. У некоторых видов рыб и земноводных существует белок Xhh. У млекопитающих и многих позвоночных нашли гомологичные белки Shh, Dhh и Ihh. Исследования Hedgehog белков продолжаются, и возможно, что в будущем будут обнаружены новые виды этих белков [14].
На данный момент мы точно знаем о трех видах Hedgehog у млекопитающих, а значит, и у человека:
- Sonic Hedgehog (Shh) = Звуковой Еж;
- Desert Hedgehog (Dhh) = Пустынный Еж;
- Indian Hedgehog (Ihh) = Индийский Еж.
Если сравнивать Shh, Dhh и Ihh между собой, то все они участвуют в развитии тканей, регуляции этого процесса, но Dhh и Ihh обладают большей специфичностью, чем Shh (табл. 1) [15].
| Hedgehog (Hh) путь | Роль | Эффекты активации | Год открытия | Болезни при нарушении работы |
|---|---|---|---|---|
| Sonic Hedgehog (Shh) = Звуковой Еж | Регуляция развития нервной системы, костей, зубов, кожи, органов чувств, волос и других тканей | Пролиферация, дифференциация клеток нервной трубки, клеток эктодермы и клеток мезодермы и др. | 1993 | Голопрозенцефалия, голобифидия, нарушения скелета |
| Desert Hedgehog (Dhh) = Пустынный Еж | Влияние на развитие половых клеток и сперматогенез | Развитие половых клеток, сперматогенез | 1991 | Нарушения развития половых клеток, бесплодие |
| Indian Hedgehog (Ihh) = Индийский Еж | Регуляция развития скелета и других тканей | Развитие скелета и других тканей | 1993 | Ахондроплазия, бесплодие, нарушения развития скелета |
Белок Dhh играет важную роль в развитии гонадальной ткани, особенно в гранулезных клетках яичников, продуцирующих гормоны и вещества, необходимые для созревания яйцеклетки. Влияет на сперматогенез — процесс образования мужских половых клеток. Экспрессируемый клетками Сертоли, Dhh прямо влияет на пролиферацию и дифференцировку сперматогониев, предшественников сперматозоидов. У животных с дефицитом Dhh наблюдается аномальная дифференцировка мезенхимальных клеток яичек, которые образуют ткани яичек, и дефектная морфология перитубулярных клеток, окружающих семенные каналы, что приводит к бесплодию у самцов мышей.
Функция белка Ihh в основном связана с дифференцировкой хондроцитов в скелете — т.е. клеток, образующих хрящ. Ihh регулирует дифференцировку хондроцитов пластинки роста — области хряща, где происходит рост и дифференцировка клеток. Ihh также прямо контролирует пролиферацию хондроцитов и функцию остеобластов — клеток, образующих костную ткань [16].
Белок Shh играет важную роль в развитии нервной системы, особенно в дифференциации нервных структур. Он экспрессируется в нейронах и глиальных клетках, где напрямую влияет на пролиферацию и дифференциацию нейрональных предшественников. У животных с дефицитом Shh наблюдается аномальное формирование нервных структур и дефектная морфология нейронов. Это приводит к нарушениям в развитии нервной системы, а также к возможным нарушениям в поведении и когнитивных функциях [9].
Передача сигналов Hedgehog высококонсервативна у разных видов и играет важную роль в органогенезе во время эмбриональной жизни. Интересно, что Shh, Dhh и Ihh не всегда работают по-отдельности, — они взаимодействуют друг с другом, чтобы координировать развитие органов и тканей. На рисунке 6 показаны дни эмбрионального развития мыши. Название функций и пунктирные линии указывают продолжительность эмбриональных дней, когда Shh, Ihh и Dhh контролируют процессы развития. И Ihh, и Dhh играют важную роль в развитии гонад, тогда как Shh и Ihh способствуют васкулогенезу, развитию желудочно-кишечного тракта и развитию предстательной железы [8].
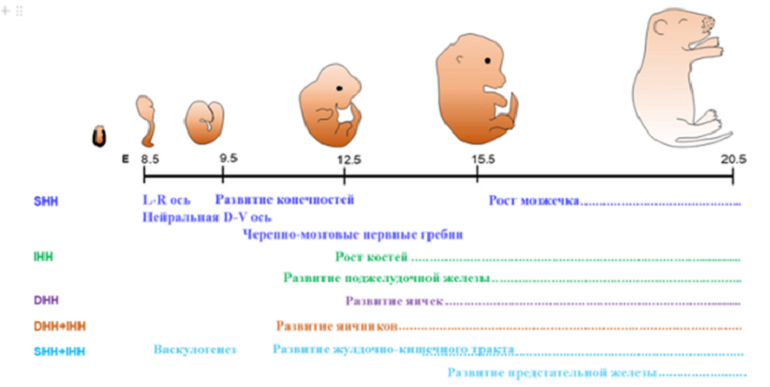
Рисунок 6. Роль передачи сигналов Hedgehog в органогенезе.
[8], рисунок адаптирован
Важно понимать, что для правильного развития организма часто необходимо комплексное сочетание факторов. Типичный пример такого взаимодействия — это формирование нервной трубки (рис. 7). Нервная трубка — это зачаток центральной нервной системы, который формируется на ранней стадии развития зародыша. Она имеет два полюса: нижний полюс — это пластинки дна нервной трубки (FP), верхняя часть — это пластинки крыши (RP) нервной трубки. Пластинка дна секретирует белок Shh, который способствует дифференцировке клеток-предшественников в нейроны. Пластинка крыши секретирует белок Wnt/BMP, который способствует дифференцировке клеток-предшественников в глиальные клетки. Дифференцировка клеток-предшественников в нейроны или глиальные клетки зависит от концентрации белков Shh и Wnt/BMP в окружающей среде. В области с высокой концентрацией белка Shh клетки-предшественники дифференцируются в нейроны, а в области с высокой концентрацией белка Wnt/BMP — в глиальные клетки.
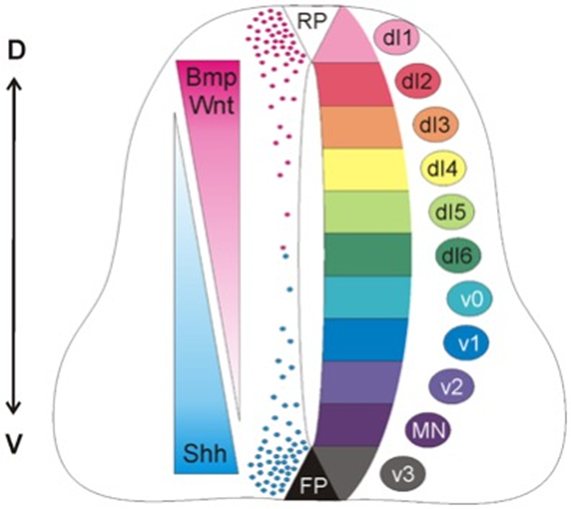
Рисунок 7. Противодействующие градиенты в нервной трубке. Градиент Shh, секретируется из пластинки дна нервной трубки (FP); Градиент Wnt/BMP секретируется из пластинки крыши (RP) нервной трубки. Дифференцировка клеток-предшественников зависит от концентрации белков в градиенте. Нейроны образуются в области с высокой концентрацией белка Shh; Глиальные клетки образуются в области с высокой концентрацией белков Wnt/BMP; D—V — дорсовентральная ось.
Этот градиент белков является важным для формирования нервной трубки. Он помогает определить, какие клетки-предшественники станут нейронами, а какие — глиальными клетками. Сигнальные пути Shh, Wnt и Bmp конкурируют друг с другом за регуляцию различных процессов при развитии нервной трубки, таких как пролиферация, дифференцировка и выживание клеток. Но они не только конкурируют, но и взаимодействуют друг с другом, чтобы обеспечить правильное развитие нервной трубки.
В то же время, взаимодействие между этими сигнальными путями также может привести к комплексному влиянию на дифференцировку клеток. Например, активация Wnt-сигнального пути может усилить активацию Shh сигнального пути, и наоборот [17].
Нарушения работы Hedgehog-путей могут приводить к разнообразным последствиям: проблемам развития эмбриона, нарушениям работы стволовых клеток и могут даже способствовать развитию определенных видов рака [18]. Рассмотрим подробнее:
- Дефекты в эмбриональном развитии. Пример: генетические мутации, влияющие на Hedgehog-путь в развитии эмбриона, могут вызвать аномалии в структуре тела. Например, мутации в Sonic Hedgehog (Shh) могут привести к голопрозенцефалии (недоразвитию передней части головного мозга).
- Нарушения в поддержании стволовых клеток. Пример: недостаток активации Hedgehog-пути может привести к снижению количества стволовых клеток, что может влиять на регенерацию тканей и нарушать функцию различных органов.
- Развитие определенных видов рака. Пример: гиперактивация Hedgehog-пути из-за мутации в Shh или Smoothened может провоцировать канцерогенез.
- Нарушения в образовании органов. Пример: неисправности в Hedgehog-пути могут вызвать аномалии в развитии органов. Например, Ihh участвует в формировании скелета, и его дефицит может привести к нарушениям в развитии костей.
- Негативное воздействие на регуляцию клеточного цикла. Пример: неконтролируемая активация Hedgehog-пути может нарушать регуляцию клеточного цикла и способствовать развитию рака. Так, гиперактивация Shh может быть связана с раком поджелудочной железы.
В целом, нарушения в Hedgehog-пути имеют тяжелые последствия для клеточной дифференциации, роста и развития организма. Исследования в этой области помогают искать новые методы лечения различных заболеваний, включая рак [18].
Литература
- Binghan Zhou, Wanling Lin, Yaling Long, Yunkai Yang, Huan Zhang, et. al.. (2022). Notch signaling pathway: architecture, disease, and therapeutics. Sig Transduct Target Ther. 7;
- Yuko Komiya, Raymond Habas. (2008). Wnt signal transduction pathways. Organogenesis. 4, 68-75;
- Tashiro Shigeki, Michiue Tatsuo, Higashijima Shin-ichi, Zenno Shuhei, Ishimaru Satoshi, et. al.. (1993). Structure and expression of Hedgehog, a Drosophila segment-polarity gene required for cell-cell communication. Gene. 124, 183-189;
- Christiane Nüsslein-Volhard, Eric Wieschaus. (1980). Mutations affecting segment number and polarity in Drosophila. Nature. 287, 795-801;
- Richard Burke, Denise Nellen, Manolo Bellotto, Ernst Hafen, Kirsten-André Senti, et. al.. (1999). Dispatched, a Novel Sterol-Sensing Domain Protein Dedicated to the Release of Cholesterol-Modified Hedgehog from Signaling Cells. Cell. 99, 803-815;
- Alberto M. Martelli, Francesca Paganelli, Serena Truocchio, Carla Palumbo, Francesca Chiarini, James A. McCubrey. (2023). Understanding the Roles of the Hedgehog Signaling Pathway during T-Cell Lymphopoiesis and in T-Cell Acute Lymphoblastic Leukemia (T-ALL). IJMS. 24, 2962;
- Белки против РНК — кто первым придумал сплайсинг?;
- Iman Dilower, Asef J. Niloy, Vishnu Kumar, Ayushi Kothari, Eun Bee Lee, M. A. Karim Rumi. (2023). Hedgehog Signaling in Gonadal Development and Function. Cells. 12, 358;
- Junjun Jing, Zhuoxuan Wu, Jiahe Wang, Guowen Luo, Hengyi Lin, et. al.. (2023). Hedgehog signaling in tissue homeostasis, cancers, and targeted therapies. Sig Transduct Target Ther. 8;
- Thomas R Bürglin. (2008). The Hedgehog protein family. Genome Biol. 9, 241;
- Белковые моторы: на службе у человека и нанотехнологий;
- Emily R. Moore. (2022). Primary Cilia: The New Face of Craniofacial Research. Biomolecules. 12, 1724;
- Harleen Khatra, Chandra Bose, Surajit Sinha. (2017). Discovery of Hedgehog Antagonists for Cancer Therapy. CMC. 24;
- Christopher W. Wilson, Pao-Tien Chuang. (2010). Mechanism and evolution of cytosolic Hedgehog signal transduction. Development. 137, 2079-2094;
- Shinsuke Ohba. (2020). Hedgehog Signaling in Skeletal Development: Roles of Indian Hedgehog and the Mode of Its Action. IJMS. 21, 6665;
- Suji Pathi, Sylvia Pagan-Westphal, Darren P Baker, Ellen A Garber, Paul Rayhorn, et. al.. (2001). Comparative biological responses to human Sonic, Indian, and Desert hedgehog. Mechanisms of Development. 106, 107-117;
- Evelyn C. Avilés, Nicole H. Wilson, Esther T. Stoeckli. (2013). Sonic hedgehog and Wnt: antagonists in morphogenesis but collaborators in axon guidance. Front. Cell. Neurosci.. 7;
- Noriaki Sasai, Michinori Toriyama, Toru Kondo. (2019). Hedgehog Signal and Genetic Disorders. Front. Genet.. 10;
- Важнейшие стрелочники клеток организма: белки Wnt.