
Т-лимфоциты: путешественники и домоседы
28 ноября 2015
Т-лимфоциты: путешественники и домоседы
- 15363
- 0
- 13
Вопреки классической парадигме, не все Т-клетки любят путешествовать: многие «сидят» на одном месте в течение всей жизни организма.
Рисунок в полном размере.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Клетки иммунной системы путешествуют по лимфе и кровотоку в поисках антигена, который можно распознать и начать защитную иммунную реакцию. Но значительная часть Т-лимфоцитов находится не в крови и не в лимфоузлах, а в органах, не относящихся к иммунной системе. Эта статья рассказывает, чем заняты резидентные Т-клетки тканей, как они туда попадают и какие преимущества для медицины может дать их изучение.
Конкурс «Био/Мол/Текст»-2015
 Эта работа заняла первое место в номинации «Лучшая статья по иммунологии» конкурса» конкурса «био/мол/текст»-2015.
Эта работа заняла первое место в номинации «Лучшая статья по иммунологии» конкурса» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Адекватная защитная реакция при заражении патогенным вирусом — уничтожить зараженные клетки, не допустив распространения инфекции по организму и гибели большего числа клеток. Зараженная вирусом клетка может заметить в себе вирус и начать аутофагию [1] либо апоптоз — или получить инструкцию для программируемой клеточной гибели от Т-киллера.
Цитотоксический Т-лимфоцит, или Т-киллер — вершина эволюции адаптивного иммунитета, ведь для распознавания фрагмента вируса (антигена) на зараженной клетке он использует Т-клеточный рецептор, случайно и независимо собирающийся на каждой Т-клетке в тимусе. Не имеющий аналогов вне адаптивной иммунной системы позвоночных механизм сборки Т-клеточного рецептора использует преимущества, полученные позвоночными при дупликациях генома в процессе эволюции и протекает с участием особых белков-рекомбиназ, когда-то заимствованных у ДНК-транспозонов (см. подробнее в статье Чудакова «Анализ индивидуальных репертуаров Т-клеточных рецепторов» [2]).
Классическая иммунология человека построена на изучении иммунных клеток крови просто в силу того, что анализ крови можно взять у любого пациента, исследовать в норме и в патологии. Именно на клетках крови была выстроена классификация Т-лимфоцитов: деление на Т-киллеры и Т-хелперы, которые проверяют антигенную специфичность Т-киллеров, выдают им «лицензию на убийство» и способны управлять всем ходом иммунного ответа через сигнальные растворимые молекулы — цитокины. А также более позднее выделение из ветви Т-хелперов группы регуляторных Т-клеток, подавляющих избыточный адаптивный иммунитет.
Но как нам напоминает реклама йогурта, значительная часть клеток иммунной системы сосредоточена вокруг слизистой оболочки пищеварительного тракта и в других тканях. В то время как в 5–6 литрах крови взрослого человека находится около 6–15 миллиардов лимфоцитов, то число Т-клеток, находящихся в эпидермисе и коже, оценивают в 20 млрд [3], в печени взрослого мужчины — еще 4 млрд [4]. Достаточно ли изучения клеток крови для полного описания функций Т-клеток, если в периферических органах Т-клеток больше, чем в кровотоке? И достаточно ли классических субпопуляций, чтобы описать все типы Т-клеток, находящихся в организме человека?
Жизненный цикл Т-лимфоцита
Каждая Т-клетка после сборки Т-клеточного рецептора проходит тестирование на функциональность случайно собранного рецептора (положительная селекция) и отсутствие специфичности к собственным антигенам организма (отрицательная селекция), то есть на отсутствие очевидной аутоиммунной угрозы. Этапы селекции происходят в вилочковой железе, тимусе; при этом более 90% клеток-предшественников погибает, не сумев правильно собрать рецептор либо пройти селективный отбор. Выжившие Т-клетки пролиферируют и выходят из тимуса в кровоток — это наивные Т-лимфоциты, не встречавшиеся с антигеном. Наивная Т-клетка циркулирует по крови и периодически заходит в лимфоузлы, где в Т-клеточной зоне контактирует со специализированными антигенпрезентирующими клетками.
После встречи с антигеном в лимфоузле Т-клетка приобретает способность снова делиться — становится предшественницей Т-клеток памяти (TSCM, stem cell memory T cells). Cреди клона ее потомков появляются клетки центральной памяти (TCM), короткоживущие эффекторные клетки, осуществляющие иммунную реакцию (SLEC или TEMRA-клетки), и эффекторные клетки-предшественники памяти TEM, в свою очередь при делении дающие TEMRA [5]. Все эти клетки выходят из лимфоузла и перемещаются по крови. Эффекторные клетки затем могут выйти из кровотока для осуществления иммунной реакции в периферической ткани органа, где находится патоген. Что потом — снова путешествие по крови и лимфоузлам?
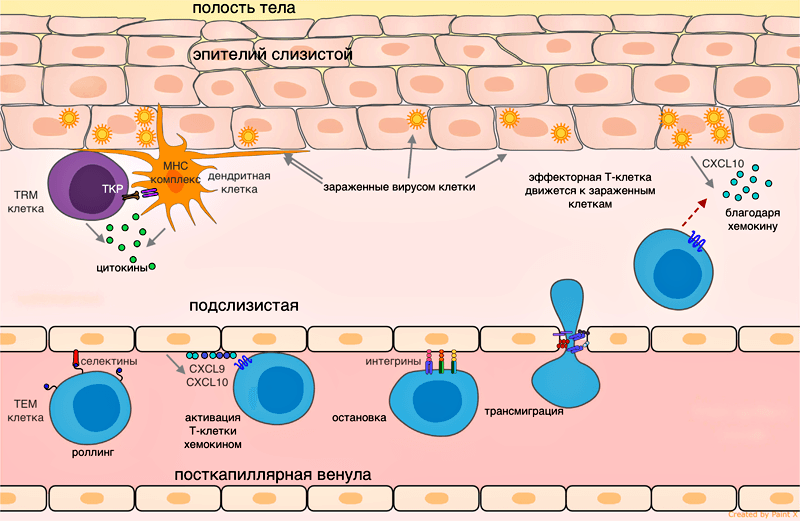
Рисунок 1. Эмиграция эффекторной Т-клетки в ткань при вирусной инфекции. Сигналы воспаления от зараженных эпителиальных клеток при участии резидентных клеток передаются эндотелию сосудов, клетки эндотелия привлекают эффекторные Т-клетки хемокинами CXCL9, CXCL10. Роллинг: при движении по посткапиллярной венуле в ткани эффекторная клетка замедляется, образуя временные контакты между Е-селектинами и P-селектинами на клетках эндотелия. Остановка: эффекторная клетка плотно прикрепляется к эндотелию при взаимодействии LFA-1 и других альфа-интегринов с ICAM-1/VCAM-1/MAdCAM-1 (на эндотелии). Трансмиграция: эффекторная Т-клетка связывает эндотелиальный JAM-1 молекулами PECAM, CD99, LFA-1 и проникает через клетки эндотелия в подслизистую.
Видео 1. Процесс трансмиграции лейкоцита.
Клетки стромы, то есть основы лимфоузла, выделяют сигнальные вещества для того, чтобы позвать Т-клетку в лимфоузел — хемокины. Распознают хемокины лимфоузлов рецепторы хоуминга CCR7 и CD62L. Но на эффекторных клетках отсутствуют оба этих рецептора. Из-за этого долгое время было загадкой, как эффекторные клетки могут попасть из периферической ткани обратно во вторичные лимфоидные органы — селезенку и лимфоузлы.
В то же время стали накапливаться данные о различиях в репертуарах мембранных маркеров и профилях транскрипции между Т-клетками памяти в крови (TEM) и Т-клетками памяти в других органах, которые никак не укладывались в концепцию постоянной миграции Т-клеток между тканями и кровью. Решено было выделить новую субпопуляцию: резидентные клетки памяти, которые населяют определенный орган и не рециркулируют — TRM-клетки [6], [7].
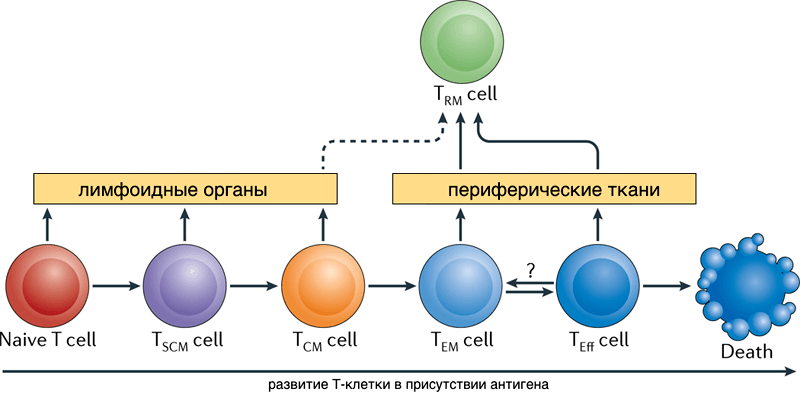
Рисунок 2. Схема перехода потомков активированных Т-лимфоцитов между популяциями.
Происхождение резидентных Т-клеток тканей
Откуда впервые появляются резидентные клетки ткани? Это потомки эффекторных клеток, которые потеряли способность рециркулировать. Некоторые периферические для иммунной системы ткани, например, слизистая тонкого кишечника, брюшная полость, — позволяют эффекторным Т-лимфоцитам проникать внутрь свободно; другие — очень ограниченно, большой поток эффекторных Т-клеток в эти ткани наблюдается только при реакции воспаления. К тканям второго типа относятся отделенные барьером от иммунной системы, к примеру, головной и спинной мозг, а также многие другие: периферические ганглии, слизистые половых органов, легкие, эпидермис, глаза. Разница между двумя типами тканей — в экспрессии дополнительных молекул хоуминга для эффекторных Т-клеток, например, молекулы адгезии для проникновения в эпителий MadCAM-1 [5].
Рисунок 3. To home or not to home? — сложный выбор эффекторной клетки. To home — процесс хоминга, или миграции Т-клеток, например, в наиболее привычное для наивных клеток место — лимфоузел. Альтернатива — не отправляться в путешествие по организму и превратиться в резидентную клетку ткани.
Резидентные Т-клетки в старении тканей человека
Карта соотношений присутствия отдельных субпопуляций Т-клеток в разных органах человека, как ни странно, была составлена только в 2014 году. Команда Донны Фарбер из медицинского центра Колумбийского Университета Нью-Йорка провела сравнение фенотипов Т-клеток, выделенных из крови и тканей доноров органов всех возрастных групп от 3 до 73 лет, всего по 56 донорам [8]. Анализ субпопуляций Т-клеток при помощи проточной цитофлуориметрии подтвердил многие данные, полученные методами с меньшим разрешением и меньшей статистикой, и некоторые черты описания иммунной системы, перенесенные с иммунологии мыши на человека, к примеру, снижение содержания наивных Т-лимфоцитов при старении во всех органах.
Уменьшение числа наивных Т-клеток с возрастом связано с быстрым старением тимуса (вилочковой железы), в котором будущие Т-клетки проходят этапы сборки Т-клеточного рецептора, проверку работоспособности рецептора и селекцию на отсутствие аутоиммунного потенциала. Важно не только снижение абсолютной численности наивных Т-клеток, но и уменьшение разнообразия репертуара Т-клеточных рецепторов, а значит, и возможности сформировать адаптивный иммунный ответ на ранее незнакомую инфекцию [9]. Для наивных Т-киллеров подтвердилось прогрессирующее падение численности в крови и лимфоузлах, хотя для наивных Т-хелперов отрицательная корреляция численности с возрастом в данном исследовании оказалась значительной только во вторичных лимфоидных органах, но не в крови.
Выделение Т-лимфоцитов памяти, эффекторных клеток памяти и короткоживущих эффекторных клеток из слизистых легких, тонкого и толстого кишечника, паховых и мезентериальных лимфоузлов доноров органов позволило впервые оценить динамику данных популяций в тканях человека при старении. Доля центральных клеток памяти ожидаемо растет с течением жизни, в соответствии с ростом числа инфекций, которые успели встретиться организму и попасть в библиотеку памяти иммунной системы. Растет и процент терминально дифференцированных эффекторных Т-киллеров (TEMRA), но только в лимфоузлах и в селезенке; в нелимфоидных тканях численность TEMRA падает. Эффекторные клетки памяти TEM стремительно заполняют нишу для Т-клеток в тканях ребенка, быстро, примерно к 12 годам вытесняя наивные Т-клетки. Короткоживущие терминально дифференцированные Т-киллеры чаще всего встречаются в крови, селезенке и слизистых легких в любом возрасте, а вот среди Т-хелперов эта субпопуляция представлена исчезающе малым числом клеток. Аналогично мало центральных клеток памяти среди Т-киллеров, преимущественно они находятся в слизистых двух барьерных тканей: легких и кишечника.
Широкими мазками карту распределения Т-лимфоцитов человека можно обрисовать так: наивные Т-клетки путешествуют по крови и периодически заходят во вторичные лимфоидные органы, киллеры-TEMRA находятся в крови, селезенке и легких. Для центральных клеток памяти, судя по всему, характерно более индивидуальное распределение по тканям, чем для других субпопуляций: во всяком случае, закономерностей динамики при старении разных тканей выявить не удалось. Эффекторные клетки памяти, включающие в себя и TRM субпопуляцию, доминируют среди Т-клеток слизистых барьерных тканей. В целом, при старении Т-клеточного иммунитета нелимфоидные ткани большую возрастную динамику типов Т-клеток [8]. Стабильность тканевых клеток проще объяснить, если разобраться, какие из эффекторных клеток TEM остаются в ткани, становятся резидентными TRM, и из каких событий состоит их жизнь после отказа от путешествий по организму [10].
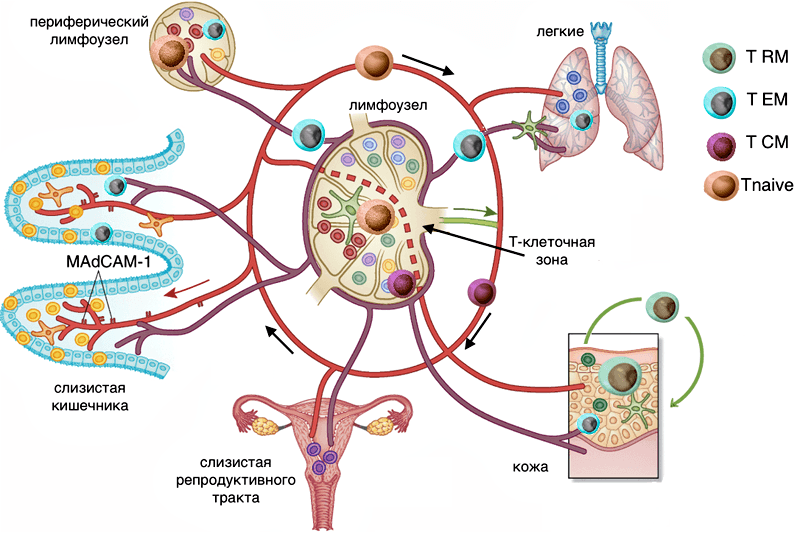
Рисунок 4. Пути циркуляции Т-лимфоцитов различных субпопуляций. Tnaive — наивные Т-клетки, вместе с субпопуляцией TCM перемещаются по крови и заходят в Т-клеточную зону различных лимфоузлов, в капиллярах тканей встречаются, но в ткань не выходят (красная траектория). Эффекторные Т-клетки (голубой цвет) перемещаются по лимфе и кровотоку, при попадании в лимфоузел не заходят в Т-клеточные зоны (центр лимфоузла) — траектория лилового цвета. Резидентные Т-клетки тканей (показаны зеленым в коже и различными цветами в слизистых) перемещаются только внутри ткани — траектория зеленого цвета.
[10], с изменениями
Как отличить резидентные клетки тканей от примесей клеток крови?
Резидентные Т-клетки корректно, но неудобно каждый раз определять по способности индивидуальной клетки мигрировать в лимфоузлы, поэтому необходимо составить список характерных признаков, по которым можно определить принадлежность к этой субпопуляции. Резидентные Т-лимфоциты в тканях-естественных барьерах организма (например, в легких и слизистой тонкого кишечника) немного похожи на классические эффекторные клетки крови: экспрессируют маркер активированных клеток CD69, причем экспрессия стабильна в течении жизни при взрослении и старении и характерна для всех нелимфоидных тканей. Но вдобавок CD69 колокализуется с маркером CD103, который обозначает группу молекул адгезии — интегринов, способствующих прикреплению резидентной Т-клетки к эпителию и к фибробластам в подслизистой выбранного органа. Для эффекторных Т-клеток во вторичных лимфоидных органах экспрессия CD103-интегринов совершенно нехарактерна: TEM клетки постоянно сохраняют подвижный фенотип.
У карты, составленной коллективом Донны Фарбер, есть крупный недочет: неясно, насколько чисто удается выделить Т-лимфоциты из органа, какую долю анализируемых клеток на самом деле составляют Т-лимфоциты крови из капилляров внутри органа.
Особенно остро вопрос загрязнения клетками крови стоит для легких, не случайно субпопуляционный состав Т-клеток легких неожиданно похож на Т-клетки крови и лимфоузлов. Вопрос загрязнения клетками крови был изящно решен для Т-лимфоцитов мыши: подопытных мышей заражали вирусом лимфоцитарного хориоменингита после пересадки трансгенного клона Т-клеток P14, специфичного к данному вирусу. В результате при инфекции большая часть циркулирующих клеток была представлена вирус-специфичным клоном P14, и его присутствие в тканях можно было отследить иммунофлуоресценцией по P14-специфичному антителу. Перед тем, как мышей убивали, им в кровь вводили антитело к маркеру Т-киллерных клеток анти-CD8, оно быстро распространялось по кровотоку и связывалось со всеми Т-киллерами в крови (но не в тканях). При микроскопии срезов органов легко было отличить резидентные киллерные TRM от только недавно вышедших из крови в орган клеток, помеченных анти-CD8 антителом [11]. Численность резидентных клеток, подсчитанная этим методом, превышала в 70 раз определенные методом проточной цитометрии числа; разница меньше, чем в два раза, наблюдалась только для резидентных клеток лимфоузлов и селезенки: получается, стандартные методики выделения лимфоцитов из органов плохо подходят для анализа киллерных резидентных клеток и существенно занижают размеры популяции.
Работа резидентных Т-клеток: не стоит путать туризм с эмиграцией
Мышиные резидентные клетки тканей в нормальной ситуации почти не перемещаются внутри нелимфоидной ткани и достаточно прочно прикреплены молекулами адгезии к строме органа. Когда резидентные макрофаги той же ткани секрецией цитокинов инициируют реакцию воспаления, ТRM приобретают большую подвижность и патрулируют близлежащий эпителий в поисках зараженных клеток.
Если воспалительная реакция усиливается, то клетки понимают это как сигнал о подкреплении: к работе патрульных TRM подключаются вновь прибывающие из крови TCM и TEM -клетки. Эти клетки крови куда более подвижны и лучше перемещаются в эпителии: значит ли это, что именно в крови находятся готовые действовать Т-киллеры среди TEM , а CD8+ TRM выполняют в ткани хелперные и регуляторные функции?
C одной стороны, Т-хелперы по спектру Т-клеточных рецепторов более тканеспецифичны, то есть пересечений между репертуарами Т-клеточных рецепторов клеток, взятых из разных тканей, совсем мало, тогда как клетки одного клона Т-киллера встречаются в разных тканях среди TEM [8]. Спектр функций и репертуар антигенной специфичности TRM еще предстоит исследовать, но способности к уничтожению зараженных клеток тканей у TRM -киллеров точно есть. Более того, афинность вирус-специфичных Т-клеточных рецепторов (ТКР) резидентных киллерных клеток выше, чем у вирус-специфичных клеток центральной памяти в модели мышиной инфекции полиомавирусом, протекающей в ткани головного мозга [12].
Однако размер популяции Т-клеток зависит не только от специфичности Т-клеточных рецепторов к инфекциям, которые раньше протекали в данном органе, но и от гомеостатической пролиферации Т-клеток — размножения более удачливых клеток для заполнения емкости органа по числу Т-лимфоцитов. По маркерам CD28 и CD127 на поверхности клеток можно отличить недавно и давно активированные через Т-клеточный рецептор клетки от тех, которые получили только гомеостатический сигнал к пролиферации от фактора роста IL-7. При старении ткани гомеостатическое размножение клеток начинает преобладать над пролиферацией активированных через ТКР клеток.
Независимо от Т-клеточных рецепторов часто функционируют NKT-клетки, крупный тип резидентных клеток печени, встречающиеся и в других тканях. Они могут быть активированы NK-клеточными рецепторами через распознавание не индивидуальных антигенов, а общих молекулярных паттернов опасности и тканевого стресса. При активации CD8+ NKT-клетки выделяют цитотоксические гранулы и лизируют подозрительные клетки ткани, к примеру, единичные опухолевые клетки и зараженные вирусами клетки, экспрессирующие и выставляющие на внешней мембране MHC-подобные стрессорные молекулы. При старении тенденция TRM к активации без Т-клеточного рецептора через NK-клеточные рецепторы или цитокиновые сигналы может приводить к ошибочному лизису клеток ткани, недостаточному контролю над хронически зараженными или перерождающимися участками эпителия.
Патологические проявления, связанные с работой резидентных Т-клеток включают в себя органоспецифичные аутоиммунные синдромы и синдромы хронического воспаления в ткани. Примеры хронического воспаления, поддерживаемого резидентными Т-лимфоцитами — контактный дерматит и псориаз, а механизмом служит выделение воспалительных факторов IL-17 резидентными Т-киллерами и IL-22 резидентными Т-хелперами дермы. CD8+ эффекторные Т-киллеры, находящиеся в головном мозге, похожи по совокупности мембранных молекул-маркеров на TRM кожи, кишечника и легких и способны подталкивать развитие перемежающегося рассеянного склероза при периодических выбросах воспалительных цитокинов; неясно, однако, есть ли в норме в головном мозге TRM популяция или же это Т-лимфоциты, оставшиеся в ткани после нейротропной вирусной инфекции [10].
Функции резидентных клеток памяти в норме, при отсутствии инфекции или хронического воспаления, могут включать в себя cross-talk (взаимную регуляцию преимущественно через секрецию цитокинов и костимуляторные молекулы) с неклассическими малоизученными лимфоидными клетками, такими как ассоциированные со слизистыми гамма/дельта Т-клетки, несущие альтернативный вариант сборки Т-клеточного рецептора; или лимфоидные клетки врожденного иммунитета (innate lymphoid cells, ILC), которые делят с Т-и В-лимфоцитами общие черты эпигенетического ландштафта, но не имеют Т-/В- или NK-клеточных рецепторов [13], [14].
TRM клетки контактируют с антигенпрезентирующими клетками тканей — это дендритные клетки кожи и резидентные макрофаги тканей. Резидентные миелоидные клетки в разных тканях дифференцированы и слабо похожи друг на друга. К примеру, макрофаги маргинальной зоны селезенки, макрофаги печени и микроглия (макрофаги мозга) будут сильно отличаться и по морфологии, и по спектру функций. Кроме обнаружения антигенов в ткани, резидентные макрофаги заняты регуляцией процессов старения и самообновления тканей, в частности, выделяют факторы роста и цитокины, стимулирующие деление стволовых клеток тканей. В жировой ткани, к примеру, макрофаги стимулируют дифференцировку новых жировых клеток, но при переходе в активированное M1-состояние, запускают воспаление и вместо дифференцировки заставляют увеличиваться и набухать имеющиеся жировые клетки. Сопутствующие изменения метаболизма жировой ткани приводят к накоплению жировой массы и в последние годы связываются с механизмами развития ожирения и диабета II типа. В коже цитокины, выделяемые макрофагами и резидентными гамма/дельта Т-клетками стимулируют деление стволовых клеток при регенерации эпидермиса и стволовых клеток волосяных фолликулов [15], [16]. Можно предположить, что хелперные TRM клетки при патрулировании эпителия и образовании контактов с тканевыми макрофагами могут модулировать спектр и объем выделяемых последними факторов роста для стволовых клеток, воспалительных цитокинов и факторов ремоделирования эпителия, и тем самым участвовать в обновлении тканей.
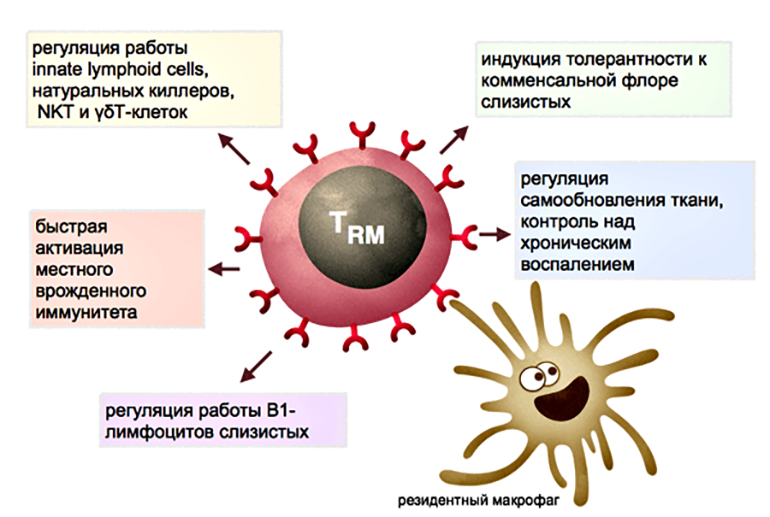
Рисунок 5. Функции резидентных Т-лимфоцитов тканей. Часть функций может выполняться во взаимодействии с резидентными макрофагами (см. пояснения в тексте).
Что изучение Trm может дать медицине?
Понимание принципов работы резидентных Т-клеток абсолютно необходимо для борьбы с инфекциями, которые не поступают сразу в кровь, а проникают в организм через барьерные ткани — то есть, для подавляющего большинства инфекций. Рациональный дизайн вакцин для защиты от этой группы инфекций может быть направлен именно на усиление первого этапа защиты с помощью резидентных клеток: ситуация, при которой оптимально активированные специфичные к антигену клетки элиминируют патоген в барьерной ткани куда выгоднее, чем запуск острого воспаления для вызова Т-лимфоцитов из крови, поскольку меньше повреждается ткань.
Репертуар Т-клеточных рецепторов клеток, ассоциированных со слизистыми барьерных тканей, считается частично вырожденным и публичным, то есть идентичным для многих людей в популяции. Тем не менее, искажения при выделении Т-клеток из органов, перекос данных в результате отбора только определенных европеиодных доноров в когорты и общее небольшое количество накопленных данных секвенирования не дают уверенности в публичности репертуаров Т-клеточных рецепторов TRM-клеток. Хотя это было бы удобно, дизайн вакцин мог бы сводиться к поиску и модификации наиболее аффинных и иммуногенных пептидов из патогена, взаимодействующих с одним из публичных вариантов ТКР в барьерной для этого патогена ткани.
Конечно, представления о том, какие Т-клеточные рецепторы несут на своей поверхности TRM-клетки недостаточно для того, чтобы эффективно манипулировать иммунными реакциями в ткани. Предстоит детально изучить факторы, влияющие на заселение тканей определенными клонами Т-клеток и разобраться в механизмах активации местного тканевого иммунитета и индукции толерантности TRM. Как заселяются ниши Т-лимфоцитов в слизистых у ребенка до встречи с большим числом патогенов и, соответственно, до формирования значительного пула эффекторных Т-клеток памяти — предшественников резидентных клеток и клеток центральной памяти? Почему и как вместо классической активации лимфоцитов формируется игнорирование, реакция толерантности к микробам непатогенной флоры слизистых? Эти вопросы стоят на повестке дня в изучении резидентных клеток иммунной системы.
Определение закономерностей хоуминга Т-лимфоцитов в определенные ткани может дать преимущество в клеточной иммунотерапии опухолевых заболеваний. Теоретически, киллерные Т-клетки нужной специфичности к опухолевому антигену, активированные in vitro, должны убивать опухолевые клетки пациента. На практике подобная иммунотерапия осложняется тем, что опухолевые клетки способны подавлять иммунные реакции и приводить в неактивное состояние анергии приближающиеся к опухоли Т-киллеры. Зачастую в массе растущей опухоли и вокруг нее накапливаются анергичные Т-лимфоциты, в первую очередь, TRM данной ткани. Из множества инъецированных пациенту активных опухолеспецифичных Т-клеток до цели дойдут немногие, и даже они могут оказаться практически бесполезными в иммуносупрессивном микроокружении опухоли.
Расшифровка механизмов, которые обеспечивают попадание конкретных клонов Т-клеток в определенные ткани, может позволить более эффективно направлять к опухоли сконструированные в лаборатории Т-лимфоциты и приблизить эру доступной персонализированной иммунотерапии.
Литература
- Аутофагия, протофагия и остальные;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Rachael A. Clark. (2010). Skin-Resident T Cells: The Ups and Downs of On Site Immunity. Journal of Investigative Dermatology. 130, 362-370;
- Муж и жена — одна сатана?;
- Norifumi Iijima, Akiko Iwasaki. (2015). Tissue instruction for migration and retention of TRM cells. Trends in Immunology. 36, 556-564;
- Jason M. Schenkel, David Masopust. (2014). Tissue-Resident Memory T Cells. Immunity. 41, 886-897;
- Donna L. Farber, Naomi A. Yudanin, Nicholas P. Restifo. (2014). Human memory T cells: generation, compartmentalization and homeostasis. Nat Rev Immunol. 14, 24-35;
- Joseph J.C. Thome, Naomi Yudanin, Yoshiaki Ohmura, Masaru Kubota, Boris Grinshpun, et. al.. (2014). Spatial Map of Human T Cell Compartmentalization and Maintenance over Decades of Life. Cell. 159, 814-828;
- Откуда пошло зрение;
- Chang Ook Park, Thomas S Kupper. (2015). The emerging role of resident memory T cells in protective immunity and inflammatory disease. Nat Med. 21, 688-697;
- Elizabeth M. Steinert, Jason M. Schenkel, Kathryn A. Fraser, Lalit K. Beura, Luke S. Manlove, et. al.. (2015). Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell. 161, 737-749;
- Elizabeth L. Frost, Anna E. Kersh, Brian D. Evavold, Aron E. Lukacher. (2015). Cutting Edge: Resident Memory CD8 T Cells Express High-Affinity TCRs. The Journal of Immunology. 195, 3520-3524;
- Schluns K.S., Klonowski K. Diverse functions of mucosal resident memory T cells. E-book, 2015;
- Dale I Godfrey, Adam P Uldrich, James McCluskey, Jamie Rossjohn, D Branch Moody. (2015). The burgeoning family of unconventional T cells. Nat Immunol. 16, 1114-1123;
- Donatello Castellana, Ralf Paus, Mirna Perez-Moreno. (2014). Macrophages Contribute to the Cyclic Activation of Adult Hair Follicle Stem Cells. PLoS Biol. 12, e1002002;
- Rodero M.P., Khosrotehrani K. (2010). Skin wound healing modulation by macrophages. Int. J. Clin. Exp. Pathol. 3, 643–653.







