Тестостероновая недостаточность. Нужен ли женщинам главный «мужской» половой гормон?
09 января 2025
Тестостероновая недостаточность. Нужен ли женщинам главный «мужской» половой гормон?
- 9433
- 0
- 1
Ироничное изображение того, как тестостерон влияет на женский организм. Все ли так страшно на самом деле?
Рисунок в полном размере.
коллаж автора
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: У каждого человека независимо от биологического пола есть как мужские, так и женские половые гормоны. За мужской фенотип отвечают андрогены (в частности, тестостерон), а за женский — эстрогены. Для чего же женщинам нужны «мужские» половые гормоны? Есть ли у них состояния, которые сопровождаются недостатком тестостерона? Можем ли мы сделать что-то в этих ситуациях? На эти вопросы постараемся ответить в данной статье.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Какие андрогены есть в организме женщины?
В женском организме «мужскими» половыми гормонами являются дегидроэпиандростерон сульфат (ДГЭАС), дегидроэпиандростерон (ДГЭА), андростендион (А), тестостерон и дигидротестостерон (ДГТ) [1]. Все вышеперечисленные гормоны указаны в порядке убывания их концентрации в сыворотке крови, при этом ДГЭАС и ДГЭА могут превращаться в тестостерон, а ДТГ является основным активным метаболитом тестостерона. Вырабатываются они различными органами и тканями, но преимущественно надпочечниками и яичниками, и оказывают свое влияние на клетки через специфические андрогенные рецепторы. Активные формы гормонов также образуются в результате периферического превращения их предшественников [2].
Концентрация тестостерона впервые начинает увеличиваться у девочек в возрасте около 6–8 лет. В это время происходит окончательное формирование сетчатой зоны надпочечников, что приводит к усилению продукции ДГЭА и ДГЭАС. Циклическая выработка тестостерона яичниками возникает одновременно с процессом появления овуляций (продукция яичниками зрелых яйцеклеток) [3]. Максимальные концентрации андрогенов достигаются на третьем и четвертом десятилетиях жизни женщины, после чего их количество в сыворотке начинает постепенно снижаться [4].
Почти весь циркулирующий тестостерон связан с белками: глобулином, связывающим половые гормоны (ГСПГ), и альбумином [5]. Поэтому любое воздействие на их концентрацию (например, увеличение ГСПГ при приеме эстрогенсодержащих препаратов) влияет на концентрацию свободного/активного тестостерона. Довольно интересно, что из тестостерона может синтезироваться эстрадиол (основной «женский» половой гормон). Такое превращение происходит в яичниках и других тканях, причем внегонадные (т.е. такие, которые не относятся к репродуктивной системе) ткани становятся основным источником выработки эстрогенов после наступления менопаузы (периода в жизни женщины, когда прекращаются менструации и завершается репродуктивный потенциал) [6].
Тестостерон в периферических тканях превращается в ДГТ с помощью фермента 5α-редуктаза (рис. 1). ДГТ в значительной степени является внутриклеточным андрогеном, следовательно, именно он из всех андрогенов имеет наибольшее сродство к андрогеновому рецептору и обладает повышенной биологической активностью [7].
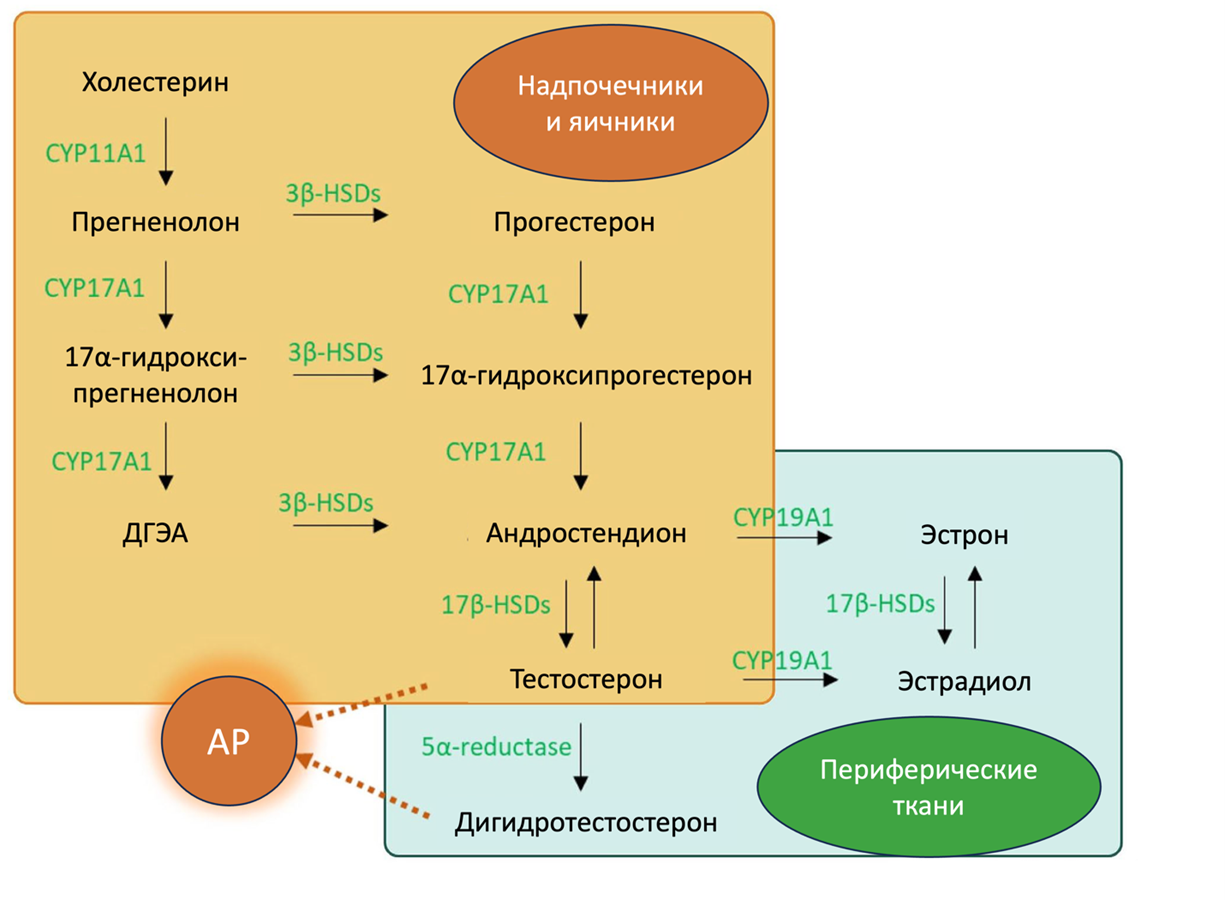
Рисунок 1. Схематическое изображение синтеза андрогенов в женском организме. Зеленом цветом указаны ферменты, участвующие в биохимических реакциях. АР — андрогеновый рецептор, ДГЭА — дегидроэпиандростерон.
схема адаптирована из [8]
Какие функции выполняют андрогены в организме женщины?
Андрогеновые рецепторы, помимо репродуктивных органов, также обнаруживаются и во многих других тканях и органах, включая сердечно-сосудистую систему, мозг, кожу, мышцы, жировую ткань, кости [2]. Это позволяет предположить, что тестостерон и другие андрогены играют важную роль в правильной работе организма женщины и выполняют множество функций. Давайте же обсудим их подробнее.
Молочная железа и женские половые органы
Динамическое равновесие между андрогенами и эстрогенами обеспечивает правильное развитие эпителиальной ткани молочной железы в разные периоды жизни женщины. Данные о раке груди и эффектах тестостерона очень противоречивые. Больше, конечно же, информации о том, что избыток андрогенов может стимулировать развитие опухоли молочных желез. Это может происходить в результате превращения тестостерона в эстрадиол (по механизму, описанному выше) или за счет прямой активации андрогеновых рецепторов в тканях молочной железы [9]. Но в то же время существуют и абсолютно противоположные взгляды. Так, авторы статьи заявляют, что терапия тестостероном в комбинации с гормонотерапией снижала риск развития рака молочной железы на 39% в течение десяти лет [10]. В некоторых исследованиях на клеточных линиях также оказалось, что тестостерон может снижать риск определенных типов рака молочной железы [2].
Рецепторы андрогенов присутствуют в слизистой влагалища, эндометрия, яичниках, молочной железе, гладкой мускулатуре уретры и мочевого пузыря [11]. Во влагалище тестостерон регулирует выработку вагинального секрета в эпителиальных клетках, улучшает кровоток за счет увеличения оксида азота. Также показана положительная корреляция между концентрациями андрогенов и объемом вагинальной ткани. При снижении экспрессии андрогеновых рецепторов возникает атрофия или истончение покровного эпителия влагалища, а также происходит уменьшение количества гладкой мускулатуры, коллагена и эластина [12]. Такой эффект может быть связан с тем, что локально тестостерон превращается с помощью фермента-ароматазы в эстрадиол [13].
Фермент ароматаза присутствует и в других органах в организме женщин: яичниках, матке, молочной железе. Можно предположить, что препараты тестостерона будут способствовать росту этих тканей и провоцировать развитие опухолей [14].
Андрогены регулируют и правильное функционирование репродуктивной системы женщины. Было установлено, что их физиологические уровни способствуют нормальному развитию яйцеклеток в яичнике [15]. Показано, что назначение андрогенов может значительно увеличивать количество ооцитов, успешных оплодотворений и частоту наступления беременности [16].
Например, у женщин с высоким риском бесплодия предварительное лечение тестостероном может увеличивать процент деторождения до четырех раз по сравнению с плацебо [17]. Однако уровни андрогенов в плазме после стимуляции яичников никак не коррелировали с частотой зачатия и показателями рождаемости у молодых женщин с уже имеющимся необъяснимым бесплодием [18]. Данные по поводу взаимосвязи андрогенов и рака яичников также в настоящий момент остаются противоречивыми [19], [20].
Одно из важных действий андрогенов заключается в восстановлении целостности эндометрия после менструального цикла и беременности [21]. Однако повышенная концентрация андрогенов, например, у женщин с СПКЯ, коррелирует с более продолжительными и обильными менструальными кровотечениями [2].
Актуальным остается изучение связи активации андрогенных рецепторов и риска развития рака эндометрия.
Становится понятно, что, несмотря на многие вышеуказанные позитивные моменты, данных, которые бы свидетельствовали о долгосрочной безопасности применения препаратов андрогенов при разных видах гинекологических заболеваний, пока, к сожалению, нет.
Состояние кожи и волос
За состояние кожи и волос в основном ответственен ДГТ, наиболее активный из всех андрогенов. Его избыточные концентрации способствуют уменьшению размера волосяных фолликулов и сокращению скорости роста волос в области скальпа. Возникает алопеция (облысение по мужскому типу) [22].
Дополнительно в коже «мужские» гормоны стимулируют секреторную функцию сальных желез и потовых желез. Это приводит к увеличению выработки кожного сала и повышенному потоотделению (возможно возникновение акне и неприятного запаха) [23].
Изменение состояния кожи и рост волос — это не полезное свойство, а скорее неприятный симптом, который может являться признаком избытка «мужских» половых гормонов как в результате некоторых заболеваний, так и назначения препаратов, содержащих андрогены.
Андрогены могут играть роль в женской сексуальной функции
К сожалению, в биомедицинской литературе вопросам женского сексуального здоровья довольно долго уделялось недостаточно внимания, из-за чего количество информации по этой теме ограничено. Степень участия мужских половых гормонов в поддержании женской сексуальной функции на самом деле не очень ясна. Было показано, что у женщин с низким либидо в пременопаузе и менопаузе количество андрогенов ниже по сравнению со здоровыми женщинами [24]. В некоторых исследованиях было обнаружено, что у женщин с заболеваниями, которые сопровождаются снижением образования андрогенов, при добавлении препаратов тестостерона наблюдалось улучшение общего самочувствия и либидо [25].
Говорить о том, что существует однозначная корреляция между уровнями «мужских» половых гормонов и сексуальной функцией у женщин, довольно трудно. Необходимо учитывать и дополнительные факторы, такие как возраст, наступление менопаузы и психологическое состояние женщины [26]. Это подтверждается тем, что, когда, наоборот, наблюдается избыток андрогенов, повышения либидо может и не наблюдаться вовсе [27].
В настоящее время для женщин доступно ограниченное количество андрогенной терапии, и доказательства ее эффективности и безопасности в вопросе сексуального здоровья по-прежнему недостаточны.
Влияние на сердечно-сосудистую систему
Во многих клинических исследованиях заболевания, сопровождающиеся избыточными уровнями андрогенов у женщин, сочетаются с неблагоприятными сердечно-сосудистыми событиями [28]. Скорее всего, это связано с тем, что андрогены могут снижать концентрацию липопротеинов высокой плотности (ЛПВП, так называемый «полезный» холестерин) в сыворотке крови, т.е. они повышают вероятность образования атеросклероза [29] (дополнительно об обмене холестерина можно почитать в статье «Биомолекулы» [30]).
Но низкий уровень тестостерона также был связан с неблагоприятными сердечно-сосудистыми исходами. По-видимому, когда тестостерон находится в пределах нормальных физиологических значений, он усиливает выработку оксида азота, который приводит к расширению сосудов и улучшает кровоток сердечной мышцы [31], [32].
Влияние препаратов тестостерона на сердечно-сосудистую систему женщин было изучено в нескольких рандомизированных контролируемых исследованиях. Большинство из них не показали увеличения неблагоприятных сердечно-сосудистых событий при терапии тестостероном (особенно при его назначении в виде накожных кремов и гелей), именно в тех случаях, когда уровень тестостерона оставался в пределах нормальных физиологических значений [33]. К сожалению, все исследования, как правило, были небольшими по количеству участников и продолжительности, поэтому требуются дополнительные доказательства в этой области.
Костный и мышечный метаболизм
У женщин основным половым гормоном, который участвует в регуляции состояния костей, является эстроген. Но в некоторых исследованиях обнаружено, что снижение концентрации андрогенов в сыворотке крови связано с более низкой минеральной плотностью костей и увеличением риска переломов [34].
Что касается состава тела, то было обнаружено большее увеличение мышечной массы и снижение процента жировой ткани у женщин в постменопаузе, которым давали комбинированный препарат эстрогена с тестостероном, по сравнению с одним эстрогеном [35]. Такой эффект может оказаться потенциальным преимуществом для женщин, которые отмечают набор массы тела и возникновение усталости после наступления менопаузы.
Можно сказать, что, хотя данные литературы и свидетельствуют о том, что тестостерон играет важную роль в физиологии мышц и костей, влияние такой терапии на состояние опорно-двигательного аппарата и риск переломов у женщин остается неопределенным из-за недостаточного количества проводимых исследований.
Настроение и когнитивные способности
Результаты исследований показывают, что тестостерон, наряду с эстрогенами [36], является нейропротекторным (т.е. таким, который защищают нервную систему) гормоном и оказывает противовоспалительное действие на мозг, а также напрямую влияет на познавательные способности и память [37].
Всего в нескольких исследованиях оценивалось влияние тестостерона на когнитивные функции мозга, и все они опять же ограничены небольшим количеством участников, а в некоторых применялась еще и сопутствующая терапия эстрогенами. Тем не менее, имеющиеся данные не предполагают каких-либо отрицательных эффектов тестостерона на когнитивные способности в постменопаузе. В некоторых же даже обнаружились положительные эффекты такой терапии на обучение и память [33], что может быть особенно благоприятным у пациентов с болезнью Паркинсона и Альцгеймера [2].
Тестостерон способен влиять на настроение, общее состояние и самочувствие, и, к сожалению, вероятно, не только в положительном ключе. Так в одном из исследований у женщин с биполярным расстройством более высокий уровень тестостерона коррелировал с риском самоубийства и депрессивным расстройством в прошлом [38]. Были и другие попытки связать депрессивное расстройство с концентрациями андрогенов у женщин, но какой-либо четкой связи установить пока что не удалось [39], [40].
Есть ли такой диагноз, как «недостаточность андрогенов» у женщин?
Иногда женщины обращаются к врачу с довольно неспецифическими жалобами, например, снижение сексуальной активности и либидо, хроническая усталость, подавленное настроение. В такие моменты очень важно проводить дифференциальную диагностику между заболеваниями, которые могут характеризоваться такими симптомами (например, депрессия) (рис. 2).
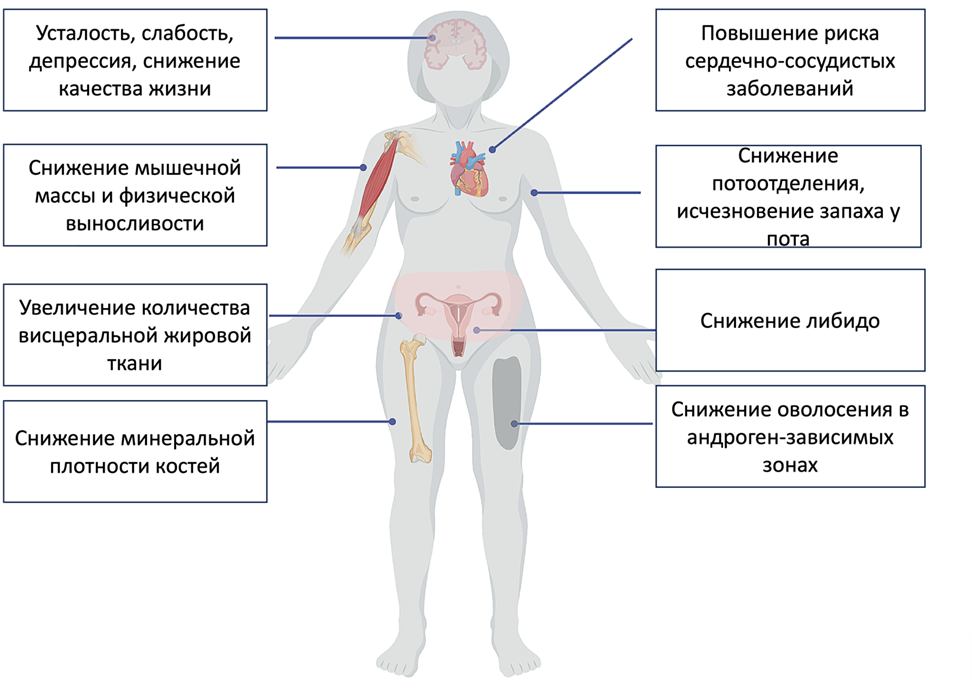
Рисунок 2. Симптомы дефицита андрогенов. Выше уже были упомянуты некоторые признаки, которые бы могли свидетельствовать о дефиците андрогенов в организме женщины. Наиболее характерным является такой симптом, как снижение или полное отсутствие либидо. Другие же (беспокойство, депрессия, снижение внимания, снижение физической работоспособности и ухудшение общего самочувствия и качества жизни) — менее специфичны и также могут быть признаками целого ряда других состояний. При осмотре врачу возможно удастся дополнительно заметить снижение оволосения в «андрогенных» зонах, а также увеличение массы висцерального жира, снижение мышечной массы и снижение мышечной силы (все это довольно субъективно).
адаптировано из [8]
На сегодняшний день ни одним эндокринологическим обществом мира не рекомендуется ставить женщинам такой диагноз, как «недостаточность андрогенов». Дело в том, что пока нет определенных симптомов-критериев, а также четко установленных возрастных значений тестостерона в сыворотке крови для женщин, на которые врачи могли бы опираться. И самое интересное, что выраженность симптомов никак не соотносится со степенью снижения уровня тестостерона [33].
Накоплено большое количество информации о случаях, которые сопровождаются избыточной продукцией андрогенов у женщин. А вот о том, что касается их недостаточности, известно гораздо меньше (таблица 1).
| Причины | Краткое описание | Другие проявления | Лечение |
|---|---|---|---|
| Хирургическая менопауза | Наступает после удаления яичников | Приливы, прекращение менструаций, бессонница, тревожность, депрессия, сухость во влагалище, болезненный половой акт | Заместительная гормональная терапия препаратами эстрогенов (могут быть противопоказания) |
| Гипопитуитаризм | Состояние, сопровождающееся снижением концентрации гормонов гипофиза (половых — ФСГ и ЛГ; гормона, стимулирующего надпочечники — АКТГ, а также других гормонов: ТТГ, СТГ, АДГ, пролактина, окситоцина). Может быть как врожденным, так и приобретенным (операция, опухоль) | Зависят от степени поражения гипофиза и от того, дефицит каких гормонов возникает | Заместительная терапия дефицитных гормонов |
| Первичная надпочечниковая недостаточность | Поражение сразу двух надпочечников (аутоиммунная причина, инфекционные заболевания, опухоли, оперативное удаление, врожденные синдромы) | Слабость, снижение артериального давления, тошнота, рвота, диарея, снижение уровня глюкозы в крови, тяга к соленому, гиперпигментация кожи и слизистых | Заместительная терапия глюкокортикостероидами |
| Назначение некоторых препаратов | Назначение препаратов эстрогенов, а также глюкокортикостероидов приводит к компенсаторному снижению продукции андрогенов | — | Снижение дозы или отмена препаратов (зачастую такие опции невозможны) |
| Некоторые другие заболевания | У ВИЧ-инфицированных женщин, а также у женщин, страдающих нервной анорексией, в некоторых исследованиях отмечалось снижение уровней андрогенов | Очень разнообразные, зависят от основного заболевания | Лечение основного заболевания |
Мы видим, что при всех состояниях, указанных в таблице выше, можно ожидать снижение уровней андрогенов. Закономерно возникает вопрос: стоит ли в этих ситуациях дополнительно назначать гормональные препараты? К сожалению, в настоящий момент можно дать лишь уклончивый ответ: скорее нет, чем да... Дело в том, что недостаточность тестостерона у некоторых женщин может вообще никак не проявляться: по лабораторным анализам определяются низкие показатели гормона, но общее самочувствие при этом никак не страдает. Препараты тестостерона стоит применять только в тех случаях, когда, несмотря на назначенную в полном объеме терапию, сохраняются неспецифические жалобы, которые существенно ухудшают качество жизни пациента.
Давайте обсудим именно те ситуации, когда, по имеющимся у нас данным, заместительная терапия андрогенами может быть рассмотрена и иметь благоприятные эффекты для здоровья женщин.
Гипопитуитаризм и вторичная надпочечниковая недостаточность
Гипопитуитаризм — это состояние, характеризующееся тем, что гипофиз перестает вырабатывать свои гормоны, в том числе половые (ФСГ и ЛГ), которые отвечают за нормальное образование эстрогена и тестостерона в яичниках. Одновременно снижается и уровень АКТГ, который стимулирует работу надпочечников, являющихся одним из основных источников андрогенов у женщин [41].
Так, по результатам исследования у 24 женщин с гипопитуитаризмом, которым год дополнительно к терапии назначался трансдермальный тестостерон, наблюдалось увеличение минеральной плотности бедра и лучевой кости. Дополнительно было отмечено повышение мышечной массы тела, улучшение настроения, сексуальной функции и качества жизни по данным анкетирования [42].
ДГЭАС — основной андроген надпочечников, соответственно, при гипопитуитаризме, а также при первичной проблеме в самих надпочечниках (первичной надпочечниковой недостаточность) довольно разумно попробовать именно этот гормон для заместительной терапии. В двух исследованиях пероральный прием ДГЭА оказывал положительное влияние на общее самочувствие и сексуальную функцию у женщин с поражениями гипофиза [41].
Несмотря на краткосрочные позитивные результаты (если не обращать внимание на возможные косметические неблагоприятные последствия), в данный момент все еще не до конца понятно, стоит ли при гипопитуитаризме применять андрогены в качестве длительной терапии.
Первичная надпочечниковая недостаточность
В таблице выше было упомянуто, что при первичной надпочечниковой недостаточности происходит снижение уровня ДГЭА и ДГЭАС. Снижается ли утомляемость, происходит ли улучшение настроения или либидо у женщин при назначении ДГЭА? Ответы пока что неоднозначные. Хотя многие исследования и показали довольно позитивные в этом вопросе результаты, но долгосрочные эффекты от такого лечения остаются неизученными [43].
Клинические рекомендации разных стран (в том числе и российские) рекомендуют попробовать назначение ДГЭА в течение шести месяцев у женщин с первичной надпочечниковой недостаточностью (off-label терапия), у которых наблюдаются значительные симптомы депрессии или тревожности, низкие либидо, энергия или жалобы на снижение общего самочувствия, несмотря на оптимальную заместительную терапию гормонами надпочечников [44].
Если после шести месяцев лечения не наблюдается явного и устойчивого улучшения состояния, терапию ДГЭА прекращают. При достижении клинических эффектов и возникновении андрогенных побочных эффектов дозу ДГЭА следует уменьшить (рис. 3).
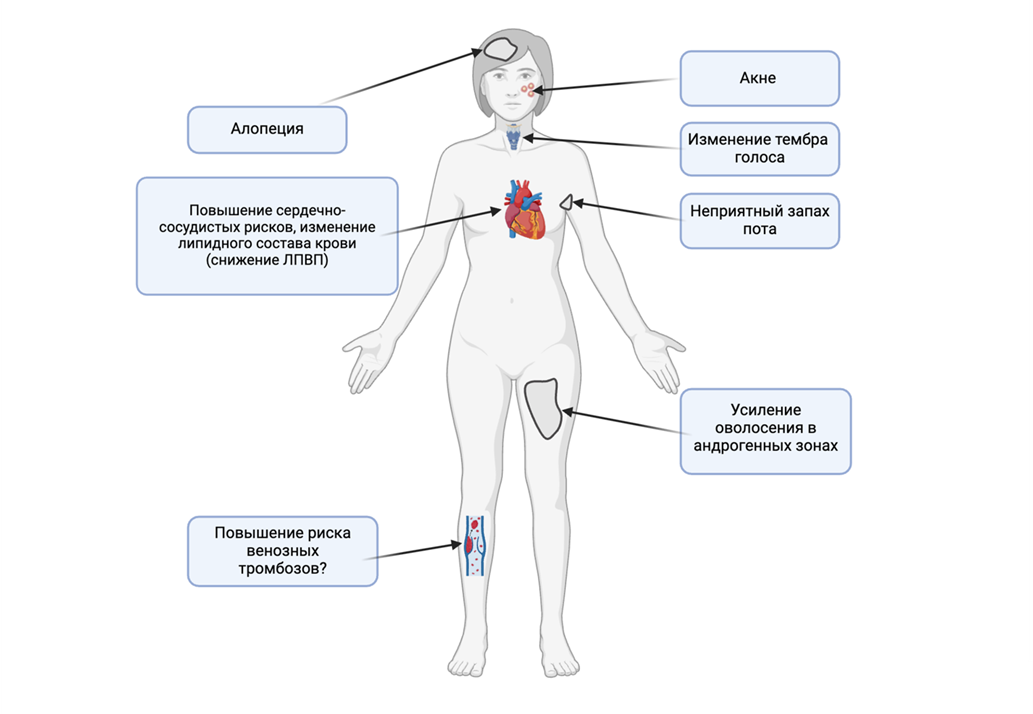
Рисунок 3. Побочные эффекты терапии тестостероном. . Повышение риска венозных тромбозов под вопросом, потому что данное побочное явление было отмечено только у мужчин.
авторский рисунок с помощью Biorender
Решение о начале и продолжении заместительной терапии андрогенами у пациентов с первичной надпочечниковой недостаточностью должно быть индивидуальным, поскольку последствия дефицита андрогенов и реакция на заместительную терапию значительно различаются у разных людей. Во многих странах ДГЭА доступен только в качестве биологической активной добавки (БАД), а не полноценного гормонального препарата. Это создает потенциальные проблемы для правильного подбора заместительной дозы андрогенов.
Гипоактивное расстройство полового влечения (ГРПВ)
Данное состояние характеризуется выраженным снижением либидо, сексуального влечения и удовлетворения, которое возникает эпизодически или постоянно в течение как минимум нескольких месяцев и приводит к существенному снижению качества жизни. Перед постановкой этого диагноза необходимо провести тщательную психологическую оценку с помощью специальных опросников (cкрининговый опросник снижения полового влечения). ГРПВ является относительно распространенным, но недостаточно диагностируемым состоянием среди женщин всех возрастов [45].
В 2014 впервые были опубликованы клинические рекомендации по андрогенной терапии у женщин [33]. С тех пор и по настоящий момент только ГРПВ является единственным обоснованным показанием для терапии тестостероном у женщин в постменопаузе (как естественной, так и хирургической вследствие удаления яичников). Поскольку во многих странах нет одобренных препаратов тестостерона для женщин, то пока что трудно говорить о долгосрочной безопасности его применения в этой области.
Тестостерон при ГРПВ в любом случае следует считать «пробным» вариантом, поскольку невозможно однозначно предсказать: сработает он или нет. Если через шесть месяцев после назначения терапии не наблюдается улучшение самочувствия, то лечение следует прекратить. Также рекомендуется регулярный осмотр врача и наблюдение за биохимическими и гормональными показателями крови каждые 6–12 месяцев [33].
Что же касается женщин репродуктивного возраста, то имеется недостаточно данных, которые бы позволяли говорить об эффективности препаратов тестостерона для лечения расстройств сексуального спектра у данной группы.
Несмотря на доказательства потенциальной пользы, в большинстве стран так и не был создан ни один препарат тестостерона именно для женщин. Но в 2020 году в Австралии 1%-ный крем, содержащий тестостерон, был официально одобрен для использования женщинами с симптомами ГРПВ в постменопаузе.
Генитоуринарный менопаузальный синдром (ГУМС)
В период менопаузы могут наблюдаться симптомы атрофии вагинального эпителия (сухость, болезненный половой акт и др.). Данное состояния чаще всего лечится местными препаратами, содержащими эстрогены (свечи, гели). Но в некоторых случаях их использование может быть противопоказано — это касается, например, гормон-чувствительного рака молочной железы [46]. В небольших исследованиях попробовали использовать другой, уже известный нам гормон — тестостерон. Его местное применение увеличивает пролиферацию вагинального эпителия и уменьшает связанные с атрофией симптомы у женщин в постменопаузе гораздо эффективнее по сравнению с плацебо [47].
В настоящее время управление по контролю за продуктами и лекарствами США (FDA) одобрило вагинальные свечи, содержащие ДГЭА, для уменьшения болевых ощущений, которые могут возникать во время полового акта после менопаузы.
Заключение
На сегодняшний день об эффектах андрогенов в женском организме известно крайне мало. Пока нет весомых данных о том, что у женщин вообще присутствует андрогенный дефицит как таковой. Опасность назначения препаратов тестостерона связана с тем, что пока не до конца понятны последствия такой терапии. Тем не менее, согласно некоторым данным, при некоторых заболеваниях применение андрогенов может быть эффективным и значительно улучшить качество жизни. Врачи должны взвешивать потенциальные риски и преимущества у каждой конкретной пациентки. Необходимо проводить больше исследований в этой области, чтобы в ближайшем будущем как можно больше женщин, нуждающихся в терапии андрогенами, смогли получить качественную и квалифицированную медицинскую помощь.
Литература
- Henry G Burger. (2002). Androgen production in women. Fertility and Sterility. 77, 3-5;
- Vittorio E. Bianchi, Elena Bresciani, Ramona Meanti, Laura Rizzi, Robert J. Omeljaniuk, Antonio Torsello. (2021). The role of androgens in women's health and wellbeing. Pharmacological Research. 171, 105758;
- Susan R. Davis, Mary Panjari, Frank Z. Stanczyk. (2011). DHEA Replacement for Postmenopausal Women. The Journal of Clinical Endocrinology & Metabolism. 96, 1642-1653;
- S. L. Davison, R. Bell, S. Donath, J. G. Montalto, S. R. Davis. (2005). Androgen Levels in Adult Females: Changes with Age, Menopause, and Oophorectomy. The Journal of Clinical Endocrinology & Metabolism. 90, 3847-3853;
- Anna L Goldman, Shalender Bhasin, Frederick C W Wu, Meenakshi Krishna, Alvin M Matsumoto, Ravi Jasuja. (2017). A Reappraisal of Testosterone’s Binding in Circulation: Physiological and Clinical Implications. Endocrine Reviews. 38, 302-324;
- HOWARD L. JUDD, GEORGE E. JUDD, WILLIAM E. LUCAS, SAMUEL S. C. YEN. (1974). Endocrine Function of the Postmenopausal Ovary: Concentration of Androgens and Estrogens in Ovarian and Peripheral Vein Blood. The Journal of Clinical Endocrinology & Metabolism. 39, 1020-1024;
- W. Chen, C.C. Zouboulis, C.E. Orfanos. (1996). The 5α-Recluctase System and Its Inhibitors. Dermatology. 193, 177-184;
- Daniela Esposito, Åsa Tivesten, Catharina Olivius, Oskar Ragnarsson, Gudmundur Johannsson. (2024). Androgen deficiency in hypopituitary women: its consequences and management. Rev Endocr Metab Disord. 25, 479-488;
- Giorgio Secreto, Alessandro Girombelli, Vittorio Krogh. (2019). Androgen excess in breast cancer development: implications for prevention and treatment. Endocrine-Related Cancer. 26, R81-R94;
- Rebecca L. Glaser, Anne E. York, Constantine Dimitrakakis. (2019). Incidence of invasive breast cancer in women treated with testosterone implants: a prospective 10-year cohort study. BMC Cancer. 19;
- M Baldassarre, A M Perrone, F A Giannone, F Armillotta, C Battaglia, et. al.. (2013). Androgen receptor expression in the human vagina under different physiological and treatment conditions. Int J Impot Res. 25, 7-11;
- Abdulmaged M. Traish, Linda Vignozzi, James A. Simon, Irwin Goldstein, Noel N. Kim. (2018). Role of Androgens in Female Genitourinary Tissue Structure and Function: Implications in the Genitourinary Syndrome of Menopause. Sexual Medicine Reviews. 6, 558-571;
- Jennifer R. Berman, Fernando G. Almeida, Julie Jolin, Shlomo Raz, Gautam Chaudhuri, Nestor F. Gonzalez-Cadavid. (2003). Correlation of androgen receptors, aromatase, and 5-α reductase in the human vagina with menopausal status. Fertility and Sterility. 79, 925-931;
- Susan R Davis, Rodney Baber, Nicholas Panay, Johannes Bitzer, Sonia Cerdas Perez, et. al.. (2019). Global Consensus Position Statement on the Use of Testosterone Therapy for Women. The Journal of Clinical Endocrinology & Metabolism. 104, 4660-4666;
- L.O.B. Costa, M.C. Mendes, R.A. Ferriani, M.D. Moura, R.M. Reis, M.F. Silva de Sá. (2004). Estradiol and testosterone concentrations in follicular fluid as criteria to discriminate between mature and immature oocytes. Braz J Med Biol Res. 37, 1747-1755;
- Meixiang Zhang, Wenbin Niu, Yu Wang, Jiawei Xu, Xiao Bao, et. al.. (2016). Dehydroepiandrosterone treatment in women with poor ovarian response undergoing IVF or ICSI: a systematic review and meta-analysis. J Assist Reprod Genet. 33, 981-991;
- Sandeep Naik, Sam Lepine, Helen E Nagels, Charalampos S Siristatidis, Ben Kroon, Simon John McDowell. (2024). Androgens (dehydroepiandrosterone or testosterone) for women undergoing assisted reproduction. Cochrane Database of Systematic Reviews. 2024;
- Erica T. Wang, Michael P. Diamond, Ruben Alvero, Peter Casson, Gregory M. Christman, et. al.. (2020). Androgenicity and fertility treatment in women with unexplained infertility. Fertility and Sterility. 113, 636-641;
- Jennifer Ose, Elizabeth M. Poole, Helena Schock, Matti Lehtinen, Alan A. Arslan, et. al.. (2017). Androgens Are Differentially Associated with Ovarian Cancer Subtypes in the Ovarian Cancer Cohort Consortium. Cancer Research. 77, 3951-3960;
- Jennifer Ose, Renée T. Fortner, Sabina Rinaldi, Helena Schock, Kim Overvad, et. al.. (2015). Endogenous androgens and risk of epithelial invasive ovarian cancer by tumor characteristics in the European Prospective Investigation into Cancer and Nutrition. Int. J. Cancer. 136, 399-410;
- Fiona L. Cousins, Phoebe M. Kirkwood, Alison A. Murray, Frances Collins, Douglas A. Gibson, Philippa T. K. Saunders. (2016). Androgens regulate scarless repair of the endometrial “wound” in a mouse model of menstruation. FASEB j.. 30, 2802-2811;
- Keith D Kaufman. (2002). Androgens and alopecia. Molecular and Cellular Endocrinology. 198, 89-95;
- Leanne Cussen, Tara McDonnell, Gillian Bennett, Christopher J. Thompson, Mark Sherlock, Michael W. O'Reilly. (2022). Approach to androgen excess in women: Clinical and biochemical insights. Clinical Endocrinology. 97, 174-186;
- B Turna, E Apaydin, B Semerci, B Altay, N Cikili, O Nazli. (2005). Women with low libido: correlation of decreased androgen levels with female sexual function index. Int J Impot Res. 17, 148-153;
- Rakibul M Islam, Robin J Bell, Sally Green, Matthew J Page, Susan R Davis. (2019). Safety and efficacy of testosterone for women: a systematic review and meta-analysis of randomised controlled trial data. The Lancet Diabetes & Endocrinology. 7, 754-766;
- Elisa Maseroli, Linda Vignozzi. (2022). Are Endogenous Androgens Linked to Female Sexual Function? A Systemic Review and Meta-Analysis. The Journal of Sexual Medicine. 19, 553-568;
- Hester Pastoor, Aya Mousa, Hanneke Bolt, Wichor Bramer, Tania S Burgert, et. al.. (2024). Sexual function in women with polycystic ovary syndrome: a systematic review and meta-analysis. Human Reproduction Update. 30, 323-340;
- Angelica Lindén Hirschberg. (2024). Hyperandrogenism and Cardiometabolic Risk in Pre- and Postmenopausal Women—What Is the Evidence?. The Journal of Clinical Endocrinology & Metabolism. 109, 1202-1213;
- H.H. Goh, D.F.M. Loke, S.S. Ratnam. (1995). The impact of long-term testosterone replacement therapy on lipid and lipoprotein profiles in women. Maturitas. 21, 65-70;
- Лечебный аферез против аферы холестерина и его подельников;
- RD Jones, T Hugh Jones, KS Channer. (2004). The influence of testosterone upon vascular reactivity. European Journal of Endocrinology. 29-37;
- I. Spoletini, C. Vitale, F. Pelliccia, C. Fossati, G. M. C. Rosano. (2014). Androgens and cardiovascular disease in postmenopausal women: a systematic review. Climacteric. 17, 625-634;
- Margaret E. Wierman, Wiebke Arlt, Rosemary Basson, Susan R. Davis, Karen K. Miller, et. al.. (2014). Androgen Therapy in Women: A Reappraisal: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism. 99, 3489-3510;
- Chevon M. Rariy, Sarah J. Ratcliffe, Rachel Weinstein, Shalender Bhasin, Marc R. Blackman, et. al.. (2011). Higher Serum Free Testosterone Concentration in Older Women Is Associated with Greater Bone Mineral Density, Lean Body Mass, and Total Fat Mass: The Cardiovascular Health Study. The Journal of Clinical Endocrinology & Metabolism. 96, 989-996;
- Susan R. Davis, Karen Z. Walker, Boyd J. G. Strauss. (2000). Effects of estradiol with and without testosterone on body composition and relationships with lipids in postmenopausal women. Menopause. 7, 395-401;
- Фармакология на службе красоты;
- Christian J. Pike, Jenna C. Carroll, Emily R. Rosario, Anna M. Barron. (2009). Protective actions of sex steroid hormones in Alzheimer’s disease. Frontiers in Neuroendocrinology. 30, 239-258;
- Leo Sher, Michael F. Grunebaum, Gregory M. Sullivan, Ainsley K. Burke, Thomas B. Cooper, et. al.. (2014). Association of testosterone levels and future suicide attempts in females with bipolar disorder. Journal of Affective Disorders. 166, 98-102;
- Anouk E. de Wit, Erik J. Giltay, Marrit K. de Boer, Fokko J. Bosker, Aviva Y. Cohn, et. al.. (2021). Plasma androgens and the presence and course of depression in a large cohort of women. Transl Psychiatry. 11;
- Dhruba Tara Maharjan, Ali Alamdar Shah Syed, Guan Ning Lin, Weihai Ying. (2021). Testosterone in Female Depression: A Meta-Analysis and Mendelian Randomization Study. Biomolecules. 11, 409;
- Karen K. Miller, Gemma Sesmilo, Aileen Schiller, David Schoenfeld, Senta Burton, Anne Klibanski. (2001). Androgen Deficiency in Women with Hypopituitarism1. The Journal of Clinical Endocrinology & Metabolism. 86, 561-567;
- K. K. Miller, B. M. K. Biller, C. Beauregard, J. G. Lipman, J. Jones, et. al.. (2006). Effects of Testosterone Replacement in Androgen-Deficient Women with Hypopituitarism: A Randomized, Double-Blind, Placebo-Controlled Study. The Journal of Clinical Endocrinology & Metabolism. 91, 1683-1690;
- Aziz A. Alkatib, Mihaela Cosma, Mohamed B. Elamin, Dana Erickson, Brian A. Swiglo, et. al.. (2009). A Systematic Review and Meta-Analysis of Randomized Placebo-Controlled Trials of DHEA Treatment Effects on Quality of Life in Women with Adrenal Insufficiency. The Journal of Clinical Endocrinology & Metabolism. 94, 3676-3681;
- Stefan R. Bornstein, Bruno Allolio, Wiebke Arlt, Andreas Barthel, Andrew Don-Wauchope, et. al.. (2016). Diagnosis and Treatment of Primary Adrenal Insufficiency: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism. 101, 364-389;
- Kath Whitton, Rodney Baber. (2024). Androgen-based therapies in women. Best Practice & Research Clinical Endocrinology & Metabolism. 38, 101783;
- Sabrina Witherby, Julia Johnson, Laurence Demers, Sharon Mount, Benjamin Littenberg, et. al.. (2011). Topical Testosterone for Breast Cancer Patients with Vaginal Atrophy Related to Aromatase Inhibitors: A Phase I/II Study. The Oncologist. 16, 424-431;
- Michelle E. Melisko, Mindy E. Goldman, Jimmy Hwang, Amy De Luca, Sally Fang, et. al.. (2017). Vaginal Testosterone Cream vs Estradiol Vaginal Ring for Vaginal Dryness or Decreased Libido in Women Receiving Aromatase Inhibitors for Early-Stage Breast Cancer. JAMA Oncol. 3, 313.