Лечебный аферез против аферы холестерина и его подельников
29 декабря 2021
Лечебный аферез против аферы холестерина и его подельников
- 3766
- 2
- 3
Лечебный аферез — способ очистить кровь от опасных для организма соединений. Во второй статье спецпроекта аферез защищает сосуды и сердце от излишка холестерина и других опасных липидов.
Рисунок в оригинальном разрешении.
-
Автор
-
Редакторы
-
Иллюстратор
Как предотвратить или вылечить атеросклероз без лекарств? Очистить кровь от вредного для здоровья холестерина с помощью афереза. Этот же метод позволяет отфильтровать из крови более опасные, чем холестерин, липиды, от которых пока нет лекарств. Эта статья спецпроекта по терапевтическому аферезу — история о белках-переносчиках холестерина и более пагубных липидах, об их вкладе в сердечную недостаточность и атеросклероз, которые приводят к тромбозам и инфарктам. В конце истории, конечно, ждет развязка — сравнение ответа разных типов лечения и терапии аферезом на старые и новые угрозы.

Аферез

Партнер спецпроекта — научно-производственная фирма «ПОКАРД», которая занимается разработкой и производством сорбционных колонок, а также внедрением в клиническую практику технологий терапевтического афереза.
В ходе разных болезней опасные молекулы распространяются по организму, заполоняя собой кровь. Избыток транспортных частиц с холестерином, белки-провокаторы иммуной системы, токсины патогенных бактерий... Против одних препараты есть, но подходят не всем, против других — ещё не выведены на рынок. Третьи — важное звено в развитии многих болезней, против которых нет специальных средств борьбы. В любом из этих случаев очищение крови от опасных соединений может сократить ущерб здоровью до минимума: спасти жизнь или значительно ее продлить.
Аферез — именно такой способ извлечь из крови только один тип биомолекул. В медицине с помощью терапевтического афереза из крови пациентов удаляют опасные для здоровья элементы, сохраняя все остальное. Очищают кровь, точнее, плазму крови, очень по-разному: с помощью антител к опасным молекулам, фильтруя через пористые мембраны, разделяя компоненты на центрифуге... Каким он только не бывает!
В спецпроекте мы расскажем, какие сложные проблемы решает терапевтический аферез: простой, но незаменимый во многих ситуациях.
Знакомство
Липиды — это разные по составу жиры и жироподобные вещества с одним общим свойством: они нерастворимы в воде, или гидрофобны [1]. Одни липиды — триглицериды — запасают для организма энергию. Другие — сфингомиелины — изолируют электрические импульсы нейронов. Третьи — фосфолипиды — формируют мембраны, которые разграничивают рабочие «отсеки» клетки, содержимое клетки и ее окружение. На мембранах остановимся подробнее.
Фосфолипиды Фосфолипиды собираются в мембрану, потому что выставляют гидрофильные головки навстречу жидкости, а гидрофобные хвосты прячут внутрь мембраны (рис. 1А, В) . Холестерин объединяет белки мембраны с похожими задачами в «рабочие островки», или рафты [2]. Это упрощает транспорт веществ через мембрану, поэтому холестерин нужен каждой клетке. В организме человека холестерин незаменим в синтезе стероидных гормонов, витамина D и желчных кислот.
Кроме мембран, или бислоев, фосфолипиды объединяются в другие формы. Больше — в статье «Физическая водобоязнь» [1].
Живым клеткам нужны регулярные поставки липидов, в том числе — холестерина. Они путешествуют через кровь и лимфу. Но как гидрофобным веществам перемещаться в кровотоке, основу которого составляет вода? Попав в кровь, липиды объединятся друг с другом, выставив наружу гидрофильные головки — как капли жира в супе, — и закупорят сосуды. Поэтому их доставляют специальные транспортные белки. Транспортеры управляют липидами и взаимодействуют с клеточными рецепторами, которые запускают поглощение транспортных частиц с липидами.
Транспортные белки объединяются с липидами в структуры под названием липопротеины . Сами белки называют аполипопротеинами, потому что они снаружи транспортных частиц.
В русском языке наравне с термином «липопротеин» существуют «липопротеид» и другие производные протеидов. Они равноправны и взаимозаменяемы, поэтому мы ограничились одним из двух вариантов.
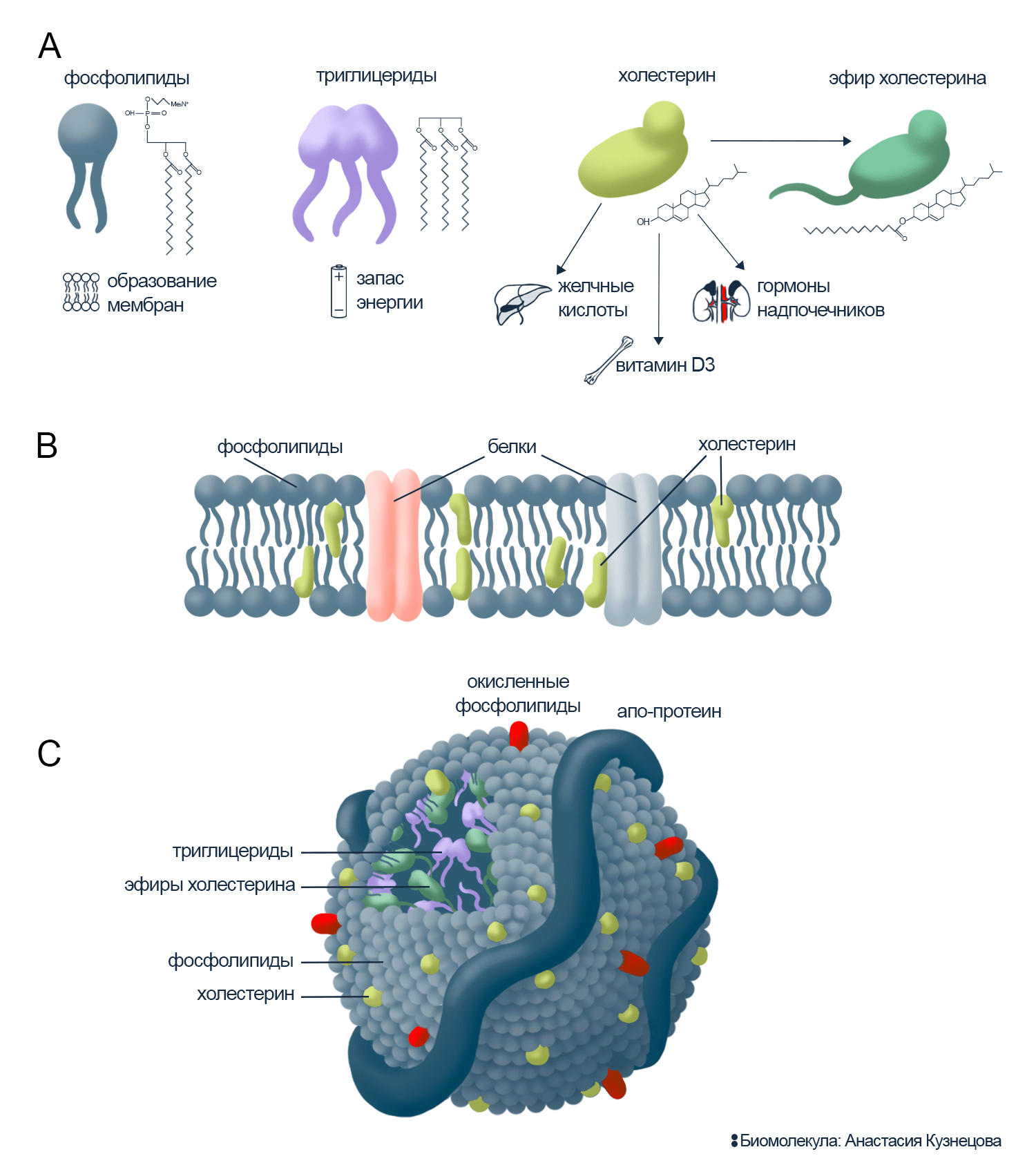
Рисунок 1. Липиды и их переносчики.
А. Молекулы липидов. Фосфолипиды содержат два гидрофобных хвоста (остатки жирных кислот) и гидрофильную головку на базе фосфорилированного глицерина и, например, холина. Триглицериды (или жиры): с тремя остатками жирных кислот, в которых запасена энергия. Полностью гидрофобны, поэтому скрыты внутри транспортных частиц. Холестерин: почти вся молекула гидрофобна. Может объединяться в эфиры, например, с жирными кислотами.
В. Биологическая мембрана. Фосфолипиды собирают мембрану, оставляя головку на поверхности и убирая хвосты внутрь. Гидрофобная сердцевина мембраны не пропускает растворимые молекулы. Холестерин стабилизирует движение молекул в мембране и формирует рафты, куда объединяются для слаженной работы белки. Пока липиды в основном строят мембрану, белки работают в ней: переносят молекулы, передают сигналы, взаимодействуют с чем-то как рецепторы. Рецепторы распознают белки липопротеинов и захватывают нужные внутрь клетки.
С. Общая схема липопротеина. Апопротеин собирает транспортную частицу и сообщает, что он переносит. У каждого типа липопротеина есть уникальные апопротеины. Липопротеиновые частицы внутри содержат триглицериды и эфиры холестерина, а их поверхность выстлана фосфолипидами и их окисленными формами.
иллюстрация Анастасии Кузнецовой
Из-за нарушений работы липопротеинов в крови может накапливаться холестерин. Так он становится опасным для сосудов и сердца. Поэтому нужно ликвидировать сломанные липопротеины лекарствами или как-то иначе. Давайте разберемся, кто виноват и как это исправить. Начнем с нормального обмена липидов и того, как возникают неполадки.
Мирная жизнь холестерина, других липидов и их транспортных белков
Организм получает липиды из пищи: еда расщепляется в тонком кишечнике, оттуда липиды попадают в печень. В ней липиды перестраиваются, а затем направляются к органам в составе липопротеинов. По завершении миссии отработанные транспортные частицы либо возвращаются в печень, либо начинают криминальный путь — участвуют в развитии атеросклероза. Для простоты разделим транспорт липидов на три направления: из кишечника в печень, из печени в ткани и из тканей обратно в печень [3]. Печень перестраивает и синтезирует липиды, поэтому все пути начинаются или заканчиваются в ней.
Забирают расщепленные липиды из кишечника хиломикроны — самые большие липопротеины. Эти тяжеловозы передают жиры в разные органы и направляются в печень для переработки. Хиломикроны обычно не вступают на криминальную тропу.
Пересылают липиды из печени в органы липопротеины очень низкой плотности (ЛОНП). В основном ЛОНП переносят триглицериды. Именно из-за тройных хвостов триглицеридов плотность ЛОНП ниже, чем у плазмы крови.
По мере отдачи груза ЛОНП становятся липопротеинами низкой плотности (ЛНП) и копят холестерин. Главный транспортный белок всех липопротеинов низкой плотности — аполипопротеин B100 (апоB100). Гидрофобные части апоB100 связывают липиды, гидрофильные — взаимодействуют с другими транспортерами и рецепторами клеток.
В идеале, после отдачи липидов ЛНП возвращаются в печень. Но нередко они проникают через клетки эндотелия — ткани, выстилающей сосуд изнутри, — в стенку сосуда, где липиды в ЛНП могут окислиться (рис. 2) [4]. Окисленные ЛНП (окЛНП), которые находятся в крови, также попадают в стенку сосуда [5–7]. Транспортные частицы с окисленными липидами, в том числе с эфирами холестерина, нарушают работу других биомолекул. Поэтому в стенке сосуда макрофаги — иммунные клетки, которые переваривают всё подозрительное, — поглощают окЛНП. Переработав их, макрофаги возвращают холестерин в нормальный обмен [5]. Так они защищают сосуды и организм в целом.
Однако если окЛНП слишком много, холестерин и окисленные липиды копятся внутри макрофагов. Это стимулирует поглощение окЛНП, и макрофаги накапливают всё больше липидов. Так они превращаются в пенистые клетки, которые призваны изолировать угрозу внутри себя, но на самом деле создают ее (рис. 2). В ходе трансформации макрофаги выделяют активные формы кислорода (АФК) — оружие против патогенов и вообще живых клеток. Поскольку патогенов рядом нет, АФК не помогают, а усугубляют ситуацию: окисляют ЛНП вокруг и стимулируют воспаление. Одновременно макрофаги вырабатывают молекулы, которые нарушают баланс поглощения и выделения липидов у коллег рядом с ними. На всех стадиях выделяются цитокины и хемокины — сигналы SOS для иммунных клеток. Развивается воспаление, которое привлекает из крови моноциты: пройдя через эндотелий, они станут макрофагами, начнут так же поглощать окЛНП и копить холестерин. Скопления пенистых клеток вкупе с другими нарушениями сформируют атеросклеротическую бляшку.
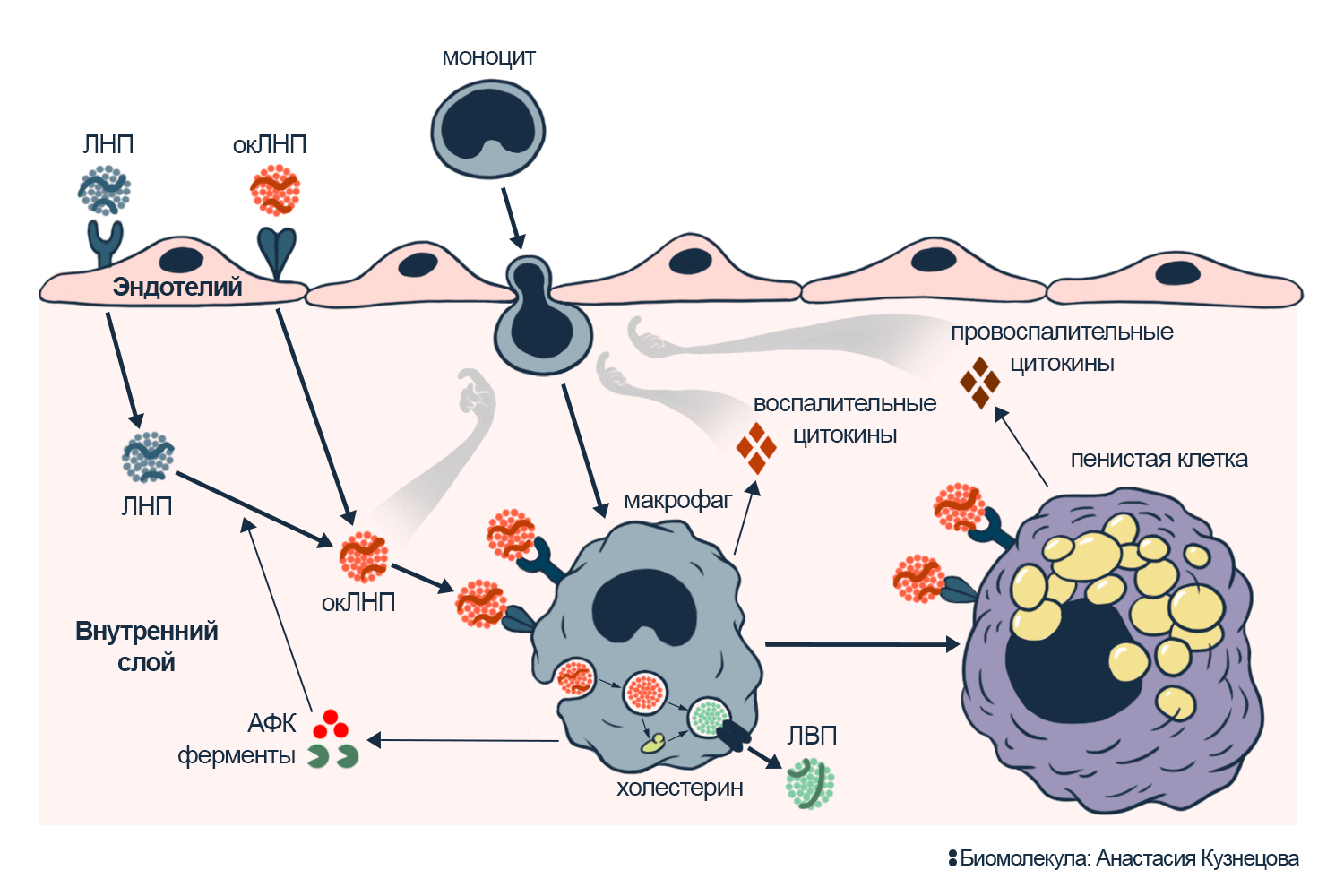
Рисунок 2. Превращение макрофага в пенистую клетку. Клетки эндотелия захватывают ЛНП и окЛНП и переносят во внутренний слой стенки сосуда. Моноциты крови, ориентируясь по сигналам цитокинов, протискиваются через эндотелий стенки сосуда и превращаются в макрофаги. Макрофаг поглощает липопротеины и обезвреживает окЛНП. Внутри макрофага холестерин отделяется от других липидов, эфиры холестерина расщепляются. Макрофаг накапливает его и передает в ЛВП, которые эвакуируют холестерин в печень. Так макрофаг защищает сосуды и весь организм от холестерина и окЛНП. Но если окЛНП чересчур много, макрофаг перегружается липидами, теряет защитную способность и накапливает холестерин, превращаясь в пенистую клетку. Ему остается посылать сигналы бедствия — цитокины — и уничтожать всё вокруг с помощью АФК и ферментов. Процессы зацикливаются в воспаление, которое привлекает новые иммунные клетки и окисляет новые ЛНП.
иллюстрация Анастасии Кузнецовой
Забирают холестерин из сомнительных мест вроде макрофагов липопротеины высокой плотности (ЛВП) — самые маленькие участники липидного обмена. Связанные с ЛВП белки собирают молекулы холестерина и передают их другим липопротеинам или эвакуируют в печень. Именно ЛВП забирают холестерин у макрофагов в стенках сосудов (рис. 3).
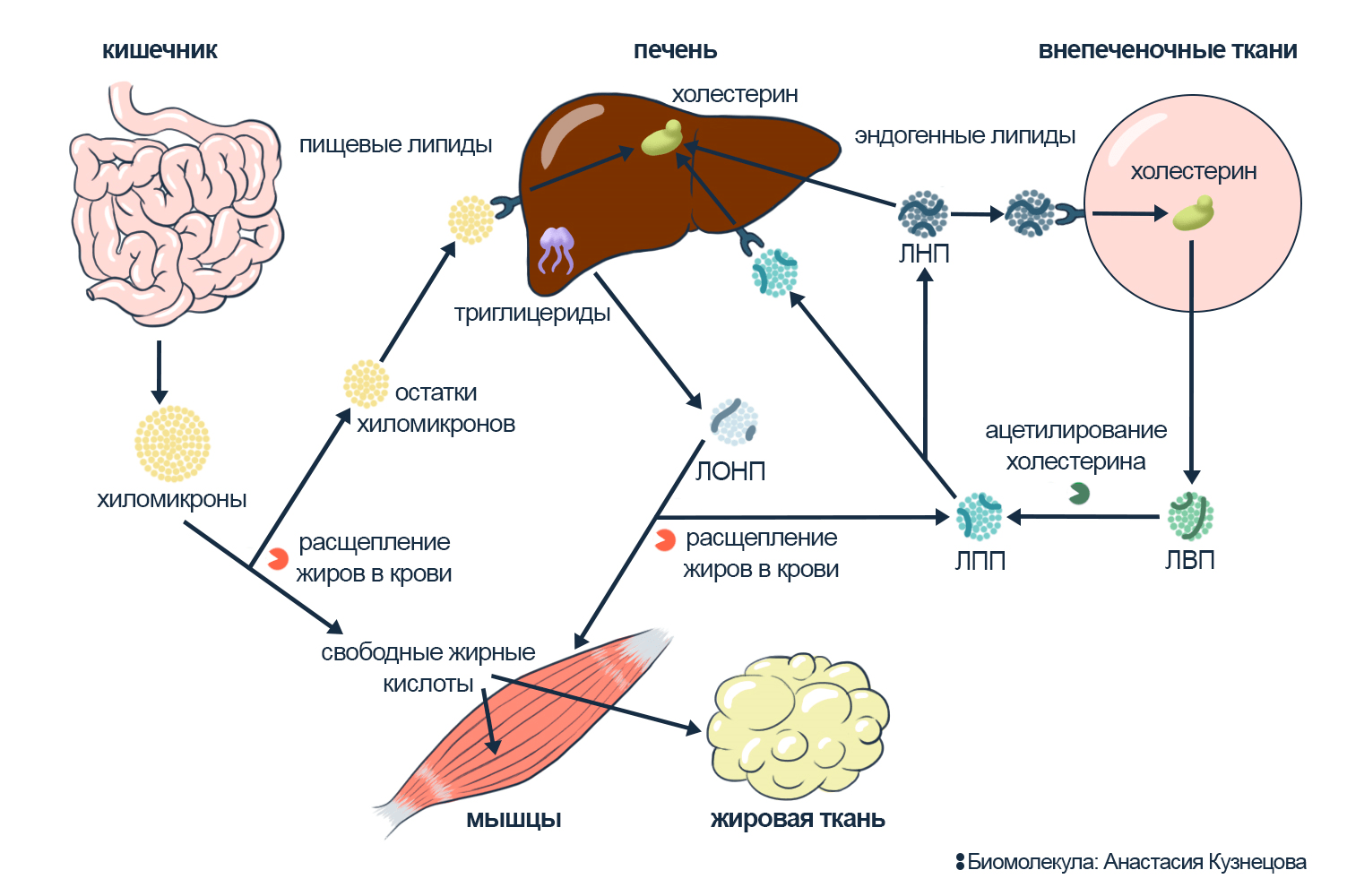
Рисунок 3. Обмен липидов.
ЛОНП — липопротеины очень низкой плотности, ЛНП — липопротеины низкой плотности, ЛПП — липопротеины промежуточной плотности, ЛВП — липопротеины высокой плотности.
иллюстрация Анастасии Кузнецовой
Как видите, обмен липидов и холестерина в том числе — сложная и сбалансированная система. Достаточно одной неполадки, чтобы липиды начали работать против организма.
Старый обвиняемый: «плохой» холестерин
Кто бы мог подумать, что ЛНП окажется злодеем и убийцей? Достаточно его концентрации в плазме крови выйти за пределы нормы — и накопление холестерина в стенках кровеносных органов станет фатальным. Воспаление, захватывая еще больше холестерина и убивая всё вокруг, запустит бомбу замедленного действия — растущую атеросклеротическую бляшку (рис. 4). По этой причине холестерин, попавший в очаг патологии в составе ЛНП, обозвали «плохим» [8]. На самом деле, причина не в нем.
Из-за мутации в гене рецептора, забирающего ЛНП из крови, миллионы людей рождаются с семейной гиперхолестеринемией (СГХC). С рождения они живут с опасным избытком ЛНП, который накапливает холестерин в крови. По крайней мере одному из 300 людей по наследству передается СГХC некоторой тяжести [9], [10]. Возможно, это самое распространенное среди людей генетическое заболевание, которое в большинстве случаев не выявляют вовремя [11]. Оно развивается незаметно, а когда появляются симптомы, становится слишком поздно. Как правило, пациенты с СГХС без лечения не доживают до 30 лет. В 1938 г. стало ясно, что люди с СГХC страдают от сердечно-сосудистых заболеваний (ССЗ) уже с раннего возраста. Дело в том, что из-за высокого уровня ЛНП в плазме эти частицы чаще задерживаются в стенке сосуда, оставляя там массу холестерина. Так растет атеросклеротическая бляшка (рис. 4).
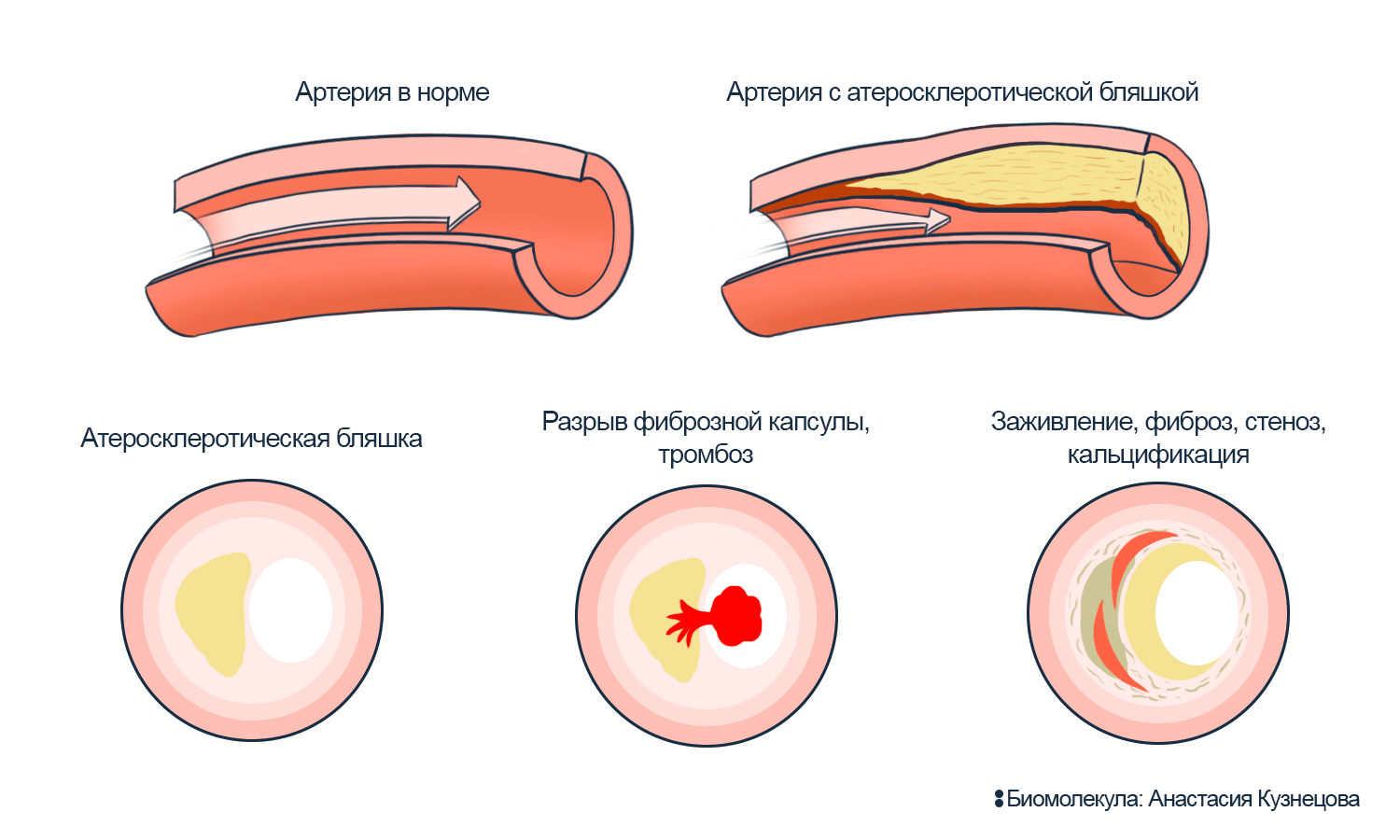
Рисунок 4. Атеросклеротическая бляшка в стенке сосуда.
Бляшка мешает току крови: утолщает и разрушает стенку сосуда, может собирать на себе тромбы. Бляшку формирует холестерин, масса умерших клеток и волокон. Ее окружает капсула из коллагена, способная изолировать бляшку от другой ткани. Но капсула может слабеть и разрываться (см. рис. 5). Разрыв, когда внутренность бляшки попадает в кровоток, провоцирует тромбоз — кровь переполняется частицами, которые закупоривают сосуды. Тромбы могут отрезать от кровоснабжения ногу или часть сердца. Если разрыв зарастает, то бляшка становится еще больше; сужение сосуда тормозит ток крови (стеноз), стенка сосуда уплотняется (фиброз) и отвердевает (кальцификация). Сосуд работает еще хуже и становится уязвим для перепадов давления крови.
иллюстрация Анастасии Кузнецовой
Человек без наследственных проблем с обменом холестерина также имеет возможность заработать себе гиперхолестеринемию и ее осложнения. Основные факторы риска — табакокурение, повышенное кровяное давление и сахарный диабет [12]. Дело в том, что обычно накопление холестерина в стенке сосуда начинается с ее повреждения...
Уничтожение сосудов: ход развития атеросклероза
Повреждение эндотелия запускает воспаление (рис. 5). Часть клеток в стенке сосуда умирает, а остальные изменяют свою работу и выделяют цитокины, которые привлекают иммунные клетки. В результате развивается окислительный стресс: он окисляет ЛНП и натравливает на них макрофагов. ЛНП с окисленными липидами в стенке сосуда становится все больше, потому что воспаление увеличивает проницаемость эндотелия. Именно в этот момент гиперхолестеринемия в крови сводит макрофагов с ума: они поглощают массу липидов и тоже начинают умирать. Так круг замыкается: чем больше продуктов клеточной смерти, тем сильнее воспаление (рис. 5).
Постепенно в стенке сосуда накапливается и кристаллизуется холестерин. В место воспаления из нижних слоев сосуда мигрируют гладкомышечные клетки. Они начинают синтезировать коллаген, который призван «окружить» участок с умершими клетками и холестерином — изолировать его [13], [14].
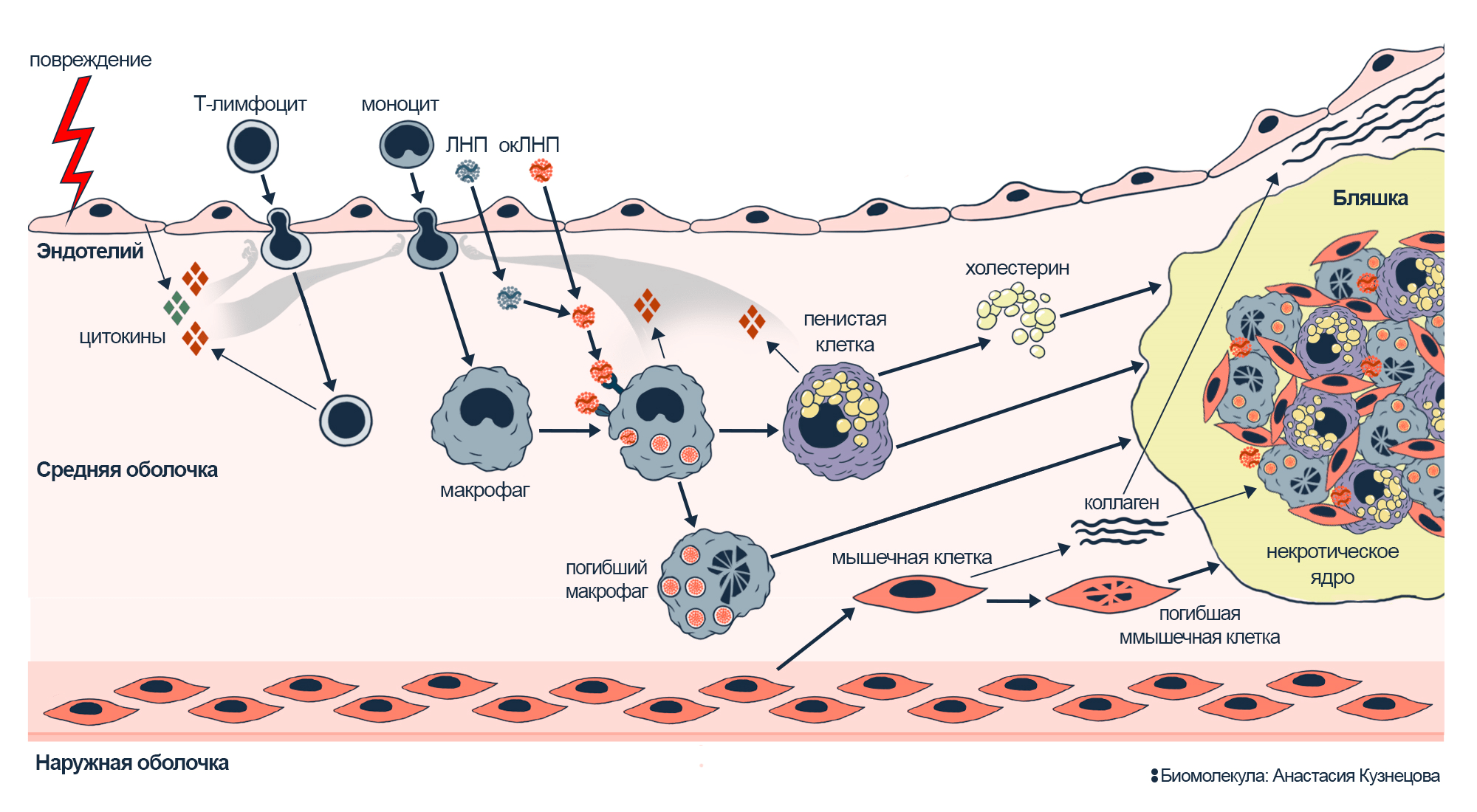
Рисунок 5. Развитие атеросклероза в стенке сосуда.
Воспаление привлекает иммунные клетки (Т-лимфоциты и моноциты), проникающие через слой эндотелия и еще сильнее активирующие процесс. В стенку сосуда попадают липопротеины низкой плотности и окисляются там. Макрофаги поглощают окЛНП и трансформируются в пенистые клетки, выделяющие цитокины, которые привлекают всё новых участников из числа клеток иммунитета. Клетки гладких мышц мигрируют из средней оболочки сосуда и синтезируют коллаген, волокна которого окружают бляшку и утолщают стенку сосуда. Коллагеновая капсула способна сдерживать рост бляшки, изолируя ее от всего живого вокруг; но макрофаги выделяют белки, расщепляющие коллаген, что истончает капсулу и приводит к разрывам бляшки (см. рис. 4).
иллюстрация Анастасии Кузнецовой
Воспаление, связанное с разрушением сосудистой стенки, подстегивает образование сгустков крови — тромбов, которые нарушают кровообращение во всем организме. В стенке сосуда растет атеросклеротическая бляшка: из-за нее сужается просвет сосуда, нарушается ток крови (рис. 4). Бляшка в стенке сосуда сердца со временем перекроет кровоток в какой-то его части. Как результат, ишемия — нарушение работы части сердца из-за недостатка кровоснабжения. Разрыв капсулы вокруг бляшки вызовет острый тромбоз сосудов сердца и может кончиться инфарктом миокарда. Тромбы могут закупорить сосуды нижних конечностей и лишить пациента части ноги [12].
В процессе развития остановить атеросклероз почти невозможно. Поэтому для людей с гиперхолестеринемией важно снижать уровень ЛНП в плазме еще до начала болезни.
Удаление «плохого» холестерина из крови
Решить проблему гиперхолестеринемии попытались немецкие ученые Вильгельм Штофель и Гельмут Борберг. Они попробовали очищать кровь пациентов от избытка ЛНП вне тела — экстракорпорально. Отделив плазму от форменных элементов и пропустив ее через сорбент к человеческому ЛНП, ученые извлекли из плазмы ⅔ связанного с ЛНП холестерина. При этом нормальные белки плазмы остались нетронутыми. Штофель и Борберг опубликовали свою работу в 1981 г., положив начало лечебному (терапевтическому) аферезу — методу удаления из крови опасных для здоровья компонентов [15–17].
В ходе первого лечебного афереза антитела к ЛНП адсорбировали липопротеины из плазмы пациента (рис. 6). Антитела для афереза закрепляли в сорбционных колонках и затем пропускали через них плазму. Антитела были нацелены на апоB100, поэтому действовали избирательнее других сорбентов, которые разрабатывались параллельно. Подробнее о развитии терапевтического афереза читайте во врезке.
До и после первого афереза
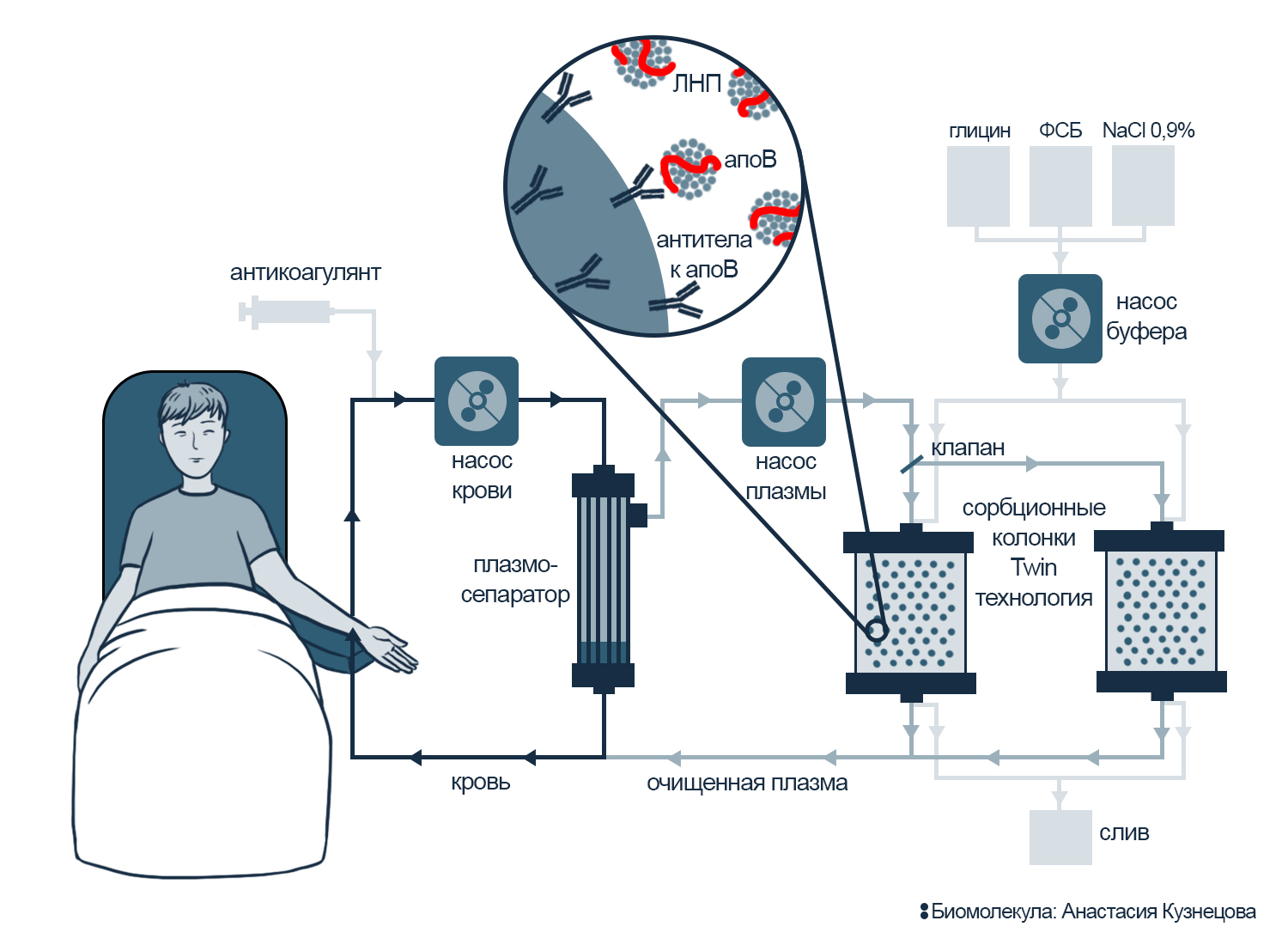
Рисунок 6. Схема афереза ЛНП.
Насос прокачивает плазму через одну сорбционную колонку; когда же ее сорбент заполняется липопротеинами, поток плазмы переключается на вторую. В это время первую колонку очищают от липопротеинов, промывая буферным раствором (глицин, фосфатно-солевой буфер и физраствор). После такой регенерации колонку используют снова, пока ее близнец очищается. Из-за двух колонок схему назвали Twin-технологией, от англ. twin — близнец.
иллюстрация Анастасии Кузнецовой
Шло время. Медикаментозное лечение гиперхолестеринемии развивалось — и заменяло собой аферез. Особенно популярными стали статины — препараты, тормозящие производство ЛНП в клетках печени. Но до сих пор много случаев, в которых лекарства бессильны — тогда на помощь вновь приходит аферез ЛНП. Например, людям с тяжелой формой СГХC (когда совсем не работает белок-захватчик ЛНП) или с устойчивой к препаратам СГХC. Аферез также помогает, когда противопоказаны другие методы лечения [14], [16]. Аферез для таких пациентов — как диализ для людей с почечной недостаточностью. После процедуры ЛНП снова накапливаются в крови, а потому аферез проводят регулярно: раз в 1–2 недели. В результате средний уровень ЛНП в крови снижается и становится менее опасным. Еще терапевтический аферез могут назначать по окончании операционных вмешательств (например, после шунтирования сосудов сердца), когда резкое повышение концентрации ЛНП опасно для сосудов.
Новый обвиняемый: липопротеин(а)
Липопротеин (а), Лп(а) стал известен науке в 1963 г. как один из видов липопротеинов низкой плотности — Лп(а) очень похож на них по составу [25]. Поначалу Лп(а) заподозрили как сообщника ЛНП: у людей с ишемической болезнью сердца фиксировали повышенный уровень Лп(а) [26]. Но вскоре из-за проблем с измерением концентрации Лп(а) и хранением плазмы пациентов ученые сбились со следа, и его вычеркнули из списка подозреваемых. Только в 2009 г. несколько исследований установили, что обвиняемый участвует в воспалении и формировании бляшек. Причем действует он независимо от нерасторопного старшего брата ЛНП и иных факторов риска [27–29]. Только позже вскрылось, что Лп(а) — серийный убийца, который держит на прицеле более миллиарда людей по всему миру.
Устройство липопротеина (а)
Белковой основой липопротеина (а), как и ЛНП, является апоB100. С ним связана уникальная часть Лп(а) — аполипопротеин (а), апо(а). Он состоит из доменов, которые выполняют разные задачи: например, домен KIV9 прочно связывается с апоВ100 (рис. 7).
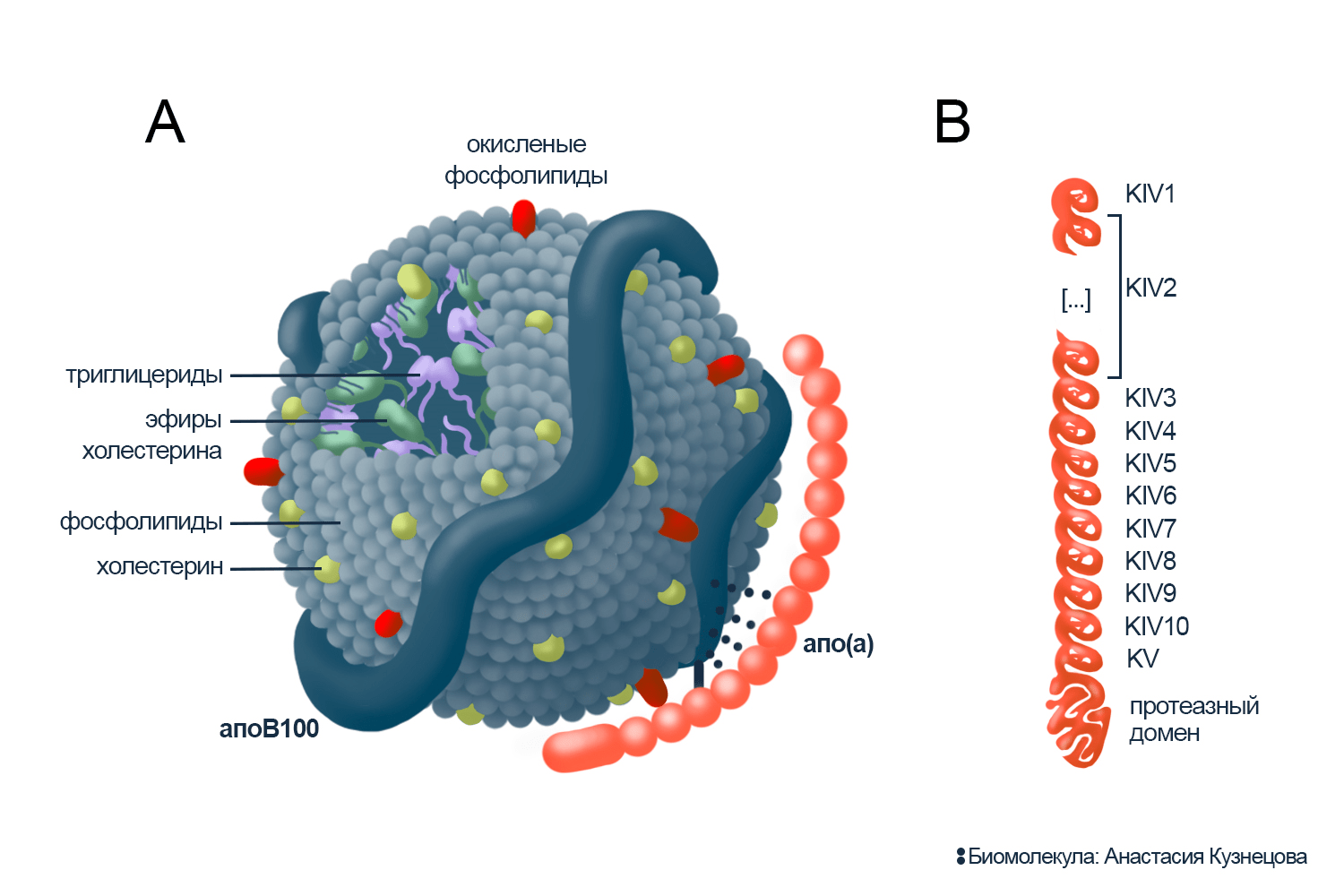
Рисунок 7. Строение липопротеина (а).
А. Состав Лп(а). Липиды Лп(а): фосфолипиды, холестерин, окисленные фосфолипиды, триглицериды, эфиры холестерина. Белки Лп(а): апо(а) — аполипопротеин (а), апоB100 — аполипопротеин B100.
В. Доменное устройство аполипопротеина (а). Поскольку последовательность Апо(а) совпадает с IV и V доменами белка плазминогена, то названы домены Апо(а) по аналогии: KIV и KV («K» от англ. kringle — белковая петля, похожая на крендель). Часть апо(а) названа неактивной протеазой, потому что ее аналог в плазминогене выполняет такую работу, хотя апо(а) не проявляет протеазной активности. Количество повторений KIV2 варьируется в зависимости от варианта гена LPA. Домены KIV5—KIV8 слабо связываются с апоB100 — играют роль стабилизаторов. Через домен KIV9 апо(а) сшит с апоB100 дисульфидной связью. KIV10 — место взаимодействия апо(а) с ОФЛ.
иллюстрация Анастасии Кузнецовой
Аполипопротеин (а) необычен тем, что его длина различается у разных людей [30]. Домен KIV2 может повторяться от 1 до 40+ раз в зависимости от числа копий, кодирующих KIV2 последовательности ДНК в варианте гена LPA. Это не только делает апо(а) одним из самых вариативных белков человека, но и неизвестным образом задает его концентрацию в плазме крови человека. Чем короче апо(а), тем выше уровень Лп(а) в плазме [31]. Именно эта обратная зависимость и изменчивость апо(а) по длине помешали исследователям XX века точно измерить его уровень в плазме пациентов и расследовать преступления Лп(а), о которых мы расскажем дальше [32].
Липопротеин (а) — виновник атеросклероза и сердечной недостаточности. Раскрываем его сообщников
Чем больше Лп(а) в плазме крови, тем выше риск инфаркта миокарда и вероятность смерти от коронарной болезни сердца (рис. 8) [27], [29]. Эта предрасположенность к сердечно-сосудистым заболеваниям зашита на уровне генов: количество Лп(а) на 80–90% определяется длиной LPA. Избыток липопротеина (а) — буквально врожденный фактор риска, который не меняется в течение жизни [33]. Варианты LPA, кодирующие короткие апо(а), повышают риск патологий сердца, его аортального клапана и сосудов, а также сосудов по всему телу [28], [34–46]. Причем влияние Лп(а) на риск ССЗ не связано с другими факторами риска (например, повышенным уровнем ЛНП). Статины также не действуют на Лп(а) [47], [48].
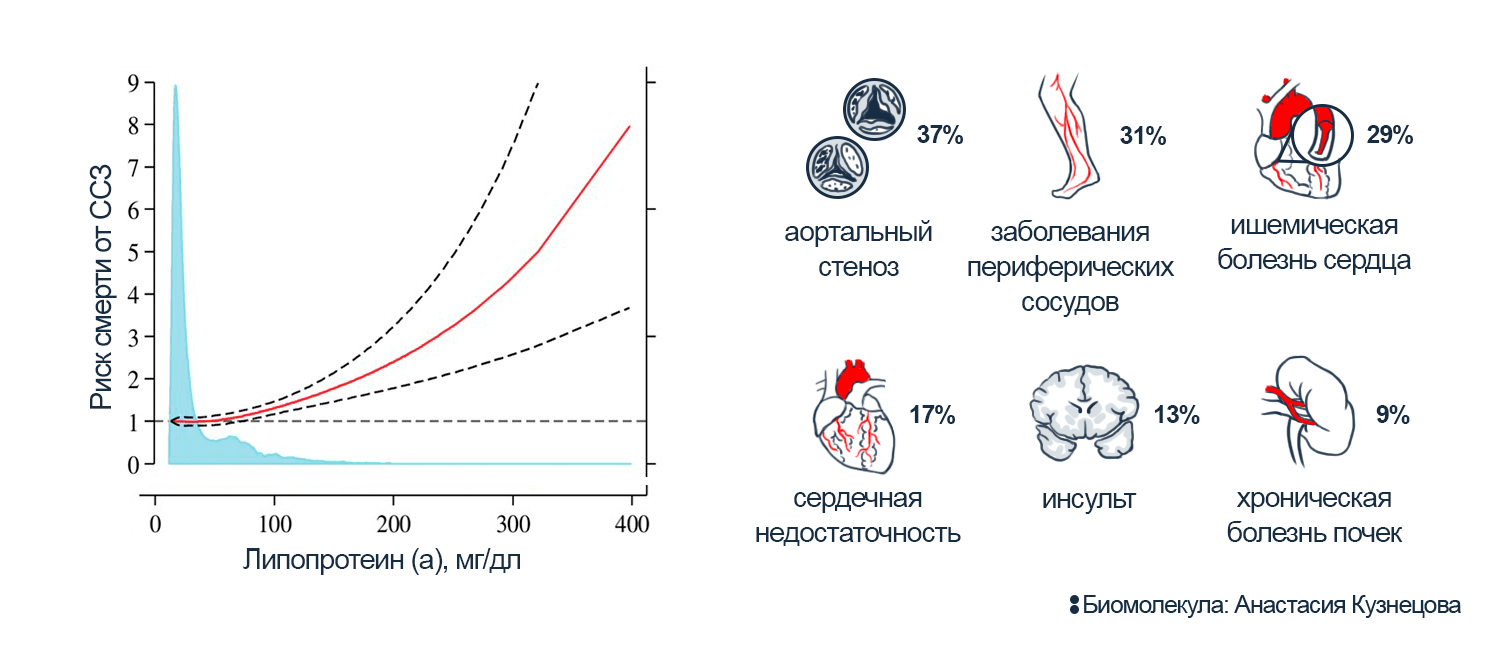
Рисунок 8. Вклад Лп(а) в риск развития сердечно-сосудистых заболеваний.
Слева: смертность от ССЗ у людей с разным уровнем Лп(а). Красная линия показывает средний рост риска; пунктир — 95%-ный доверительный интервал, 95% данных, наиболее близких к тенденции. Голубая гистограмма показывает, как много людей в популяции с разными показателями Лп(а).
Справа: увеличение риска шести болезней (в %) при повышении уровня Лп(а) на ~35 мг/дл.
иллюстрация Анастасии Кузнецовой
Откуда возникает особое влияние избытка Лп(а) (>50 мг/дл) на сердечно-сосудистые заболевания? Дело в том, что липопротеин (а) накапливает окисленные фосфолипиды (ОФЛ) — молекулы, которые стимулируют воспалительные реакции. Обычно ОФЛ образуются из-за окислительного стресса и могут накапливаться в мембранах клеток с какими-то нарушениями: опухолевых, старых или зараженных патогеном [49], [50]. Там ОФЛ реагируют с белками и липидами, в результате чего образуются нехарактерные для организма молекулы (см. врезку про ОФЛ). Рецепторы врожденного иммунитета распознают эти молекулы вместе с ОФЛ как чужеродные (а значит, опасные) и запускают воспаление [49–51]. Это к лучшему: фосфолипиды в окисленном состоянии не выполняют свою работу и становятся вредны — например, ОФЛ могут реагировать с белками и другими липидами, нарушая их функции. Надо ли говорить, что исследователи связывают высокий уровень ОФЛ с сердечно-сосудистыми заболеваниями?
Липопротеин (а) заточен на сбор ОФЛ по всему организму. Даже в лаборатории при 4о С и без помощи каких-либо ферментов Лп(а) акцептируют ОФЛ из ЛНП прямо в пробирке [50]. Неудивительно, что Лп(а) переносят больше 85% ОФЛ в крови [50], [52]. Ведь в домене KIV10 есть отдельное место связывания ОФЛ (см. рис. 7) [51–53]. К слову, почти у всех изученных приматов этот участок Лп(а) немного изменен и не способен связывать ОФЛ — повезло только человеку [54].
Короче говоря, Лп(а) человека — отличный способ собирать и обезвреживать ОФЛ. В комплексе с Лп(а) работает липопротеин-ассоциированная фосфолипаза А2 (Лп-ФЛА2), которая деактивирует окисленные фосфолипиды [55]. В том числе благодаря ей Лп(а) в норме спокойно выполняют роль ЛНП, разнося липиды к разным органам от печени. Представляете, как рискованно это становится в случае поломки какого-то компонента системы? При повышении уровня Лп(а) они собирают слишком много ОФЛ, из-за чего становятся опасными для организма. Можно сказать, что при избытке липопротеинов (а) все они становятся такими же вредными, как окЛНП. Пришло время раскрыть, на какие этапы развития патологии они влияют.
Липопротеин (а) уничтожает клапаны сердца изнутри
Окисленные фосфолипиды участвуют в разрушении ткани аортального клапана сердца кристаллами фосфата кальция. В целом кальцификация клапана развивается по схожей с атеросклерозом схеме (рис. 10). Когда сердце выбрасывает кровь в аорту, она расширяется и начинает сдавливать кровь, поэтому клапан закрывает обратный путь в сердце. Так что на аортальный клапан приходится особенно сильное давление. Оно повреждает эндотелий, запускает воспаление и клеточную смерть. В ходе воспаления выделяются кальций и ряд белков, которые кристаллизуют фосфат кальция (фосфата в плазме крови всегда хватает). Межклеточное вещество минерализуется, клапан утолщается и перестает работать, это нарушает движение крови. Чтобы компенсировать проблему, аорта вокруг сужается — и сужение начинает мешать выбросу крови из сердца. Так пациент сталкивается с диагнозом «стеноз аорты» [56–59].
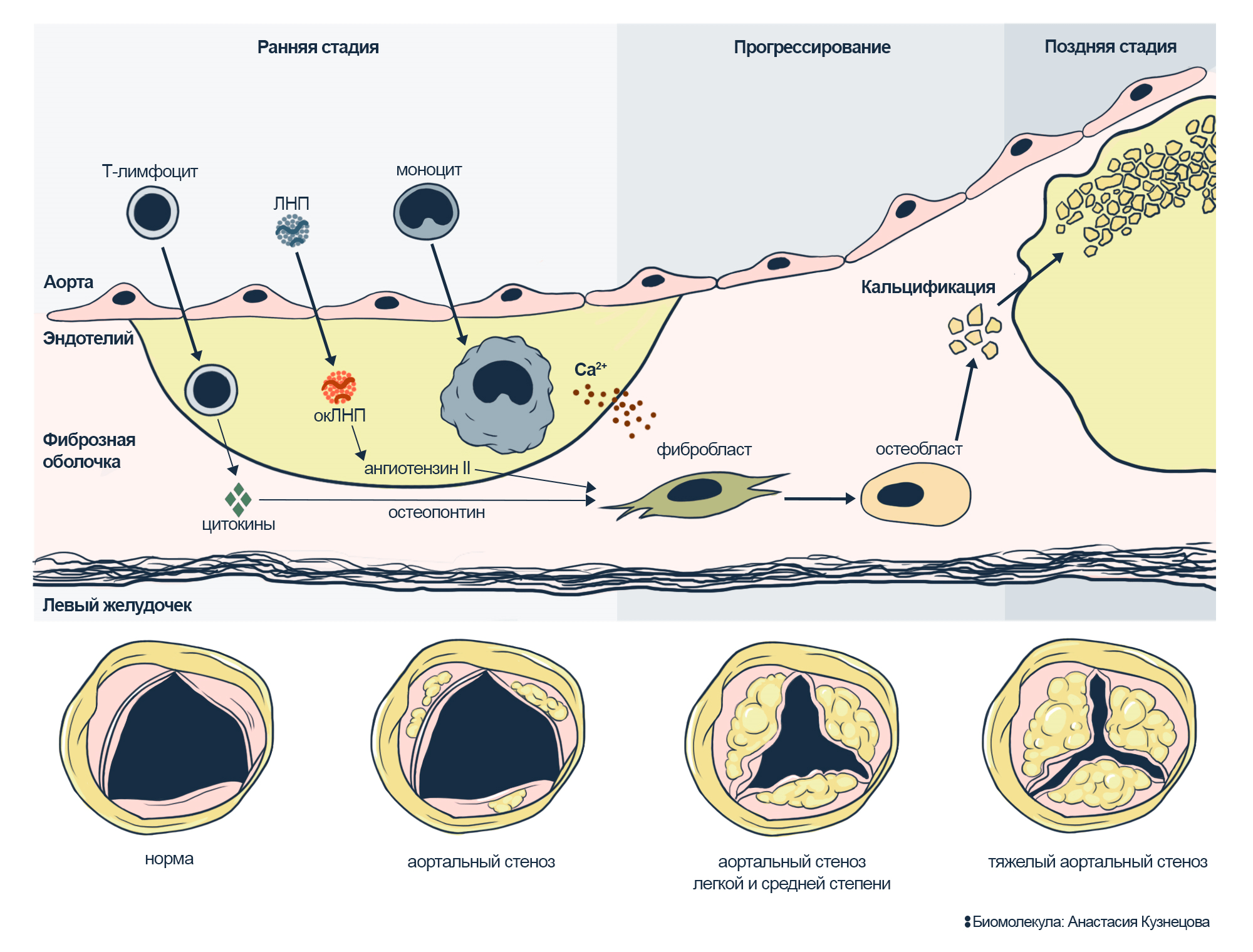
Рисунок 10. Кальцификация аортального клапана. Клапан разделяет аорту и левый желудочек сердца. Кровь, выходя из желудочка, раскрывает створки в сторону аорты и прижимает их к краям сосуда.
Сверху: ход кальцификации. Под эндотелием накапливаются окЛНП, включаются Т-лимфоциты и макрофаги; они выделяют цитокины, ангиотензин II, которые опосредуют воспаление и кальцификацию. Остеопонтин, как и в кости, связывает и стабилизирует кристаллы фосфата кальция. Фибробласт — клетка-производитель соединительной ткани — превращается в остеобласт — клетку-производителя костного вещества. Остеобласт участвует в кальцификации клапана.
Снизу: так выглядит аортальный клапан со стороны аорты. В норме три створки клапана легко открываются и закрываются. Но кальцификация делает их жесткими и толстыми, мешает закрываться. Аорта вокруг сжимается, чтобы задерживать ток крови обратно в сердце. В результате сужение аорты и утолщение клапанов препятствует выбросу крови из сердца в аорты.
иллюстрация Анастасии Кузнецовой
В свою очередь, избыточный Лп(а) приносит в поврежденный клапан ОФЛ — и участвует в преступлении сразу несколькими путями.
Во-первых, поглотившие ОФЛ пенистые клетки быстро гибнут из-за окислительного стресса. Это ускоряет разложение ткани клапана, из-за чего растет его уязвимость: воспаление привлекает новые макрофаги и Лп(а) с ОФЛ для них [60]. Сами по себе окисленные фосфолипиды также активируют воспаление. В результате клапаны людей с избытком Лп(а) воспаляются всё сильнее, а иммунные клетки становятся гораздо чувствительнее к воспалению [61], [62].
Во-вторых, из-за человеческого апо(а) перестраивается цитоскелет эндотелиальных клеток, перестройка повышает проницаемость эндотелия [63], [64]. Изменяя работу связанных со стрессом генов, Лп(а) активирует синтез простагландина Е2 (ПГЕ2) — главного посредника воспаления [64], [65].
Всё это позволяет Лп(а) наравне с другими липопротеинами легче проникать в аортальный клапан. Так в месте повреждений и бляшек подстегивается накопление холестерина и кальцификация.
Вдобавок большое количество Лп(а) и ОФЛ помогает ферменту аутотаксину. Он производит сигнальную молекулу, активирующую уплотнение ткани клапана и минерализацию. Синтезирует ее аутотаксин из продукта, в который Лп-ФЛА2 превращает ОФЛ (см. выше реакцию 4 во врезке про ОФЛ). Выходит, когда Лп(а) попадают в очаг минерализации, то принесенные ими ОФЛ активируют разрушение аортального клапана. К тому же, по мнению исследователей, изучавших аутотаксин, Лп(а) могут также приносить его на себе [66].
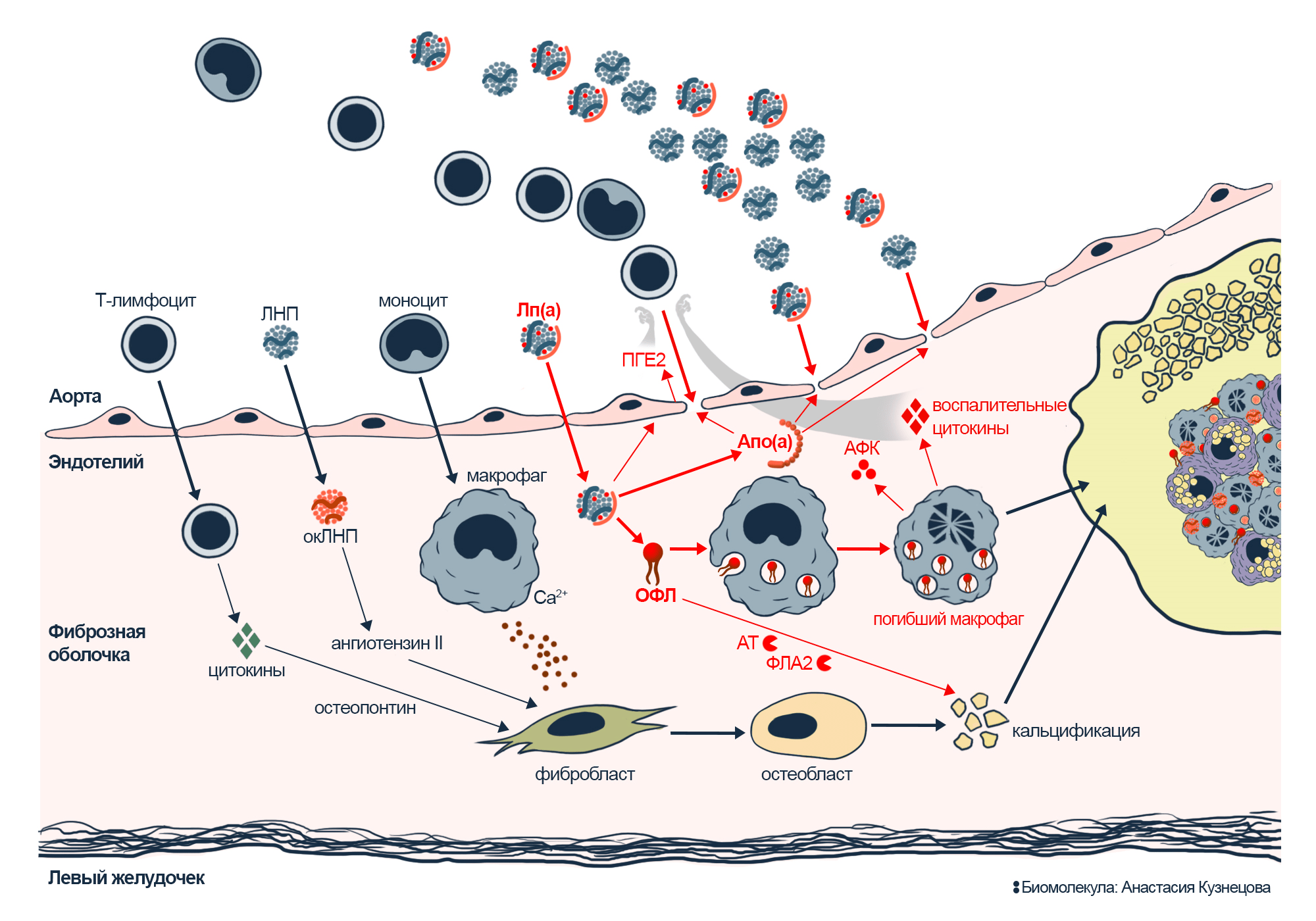
Рисунок 11. Вклад липопротеина (а) в кальцификацию клапана. Попадание Лп(а) в ткань клапана запускает несколько процессов, ускоряющих кальцификацию.
(1) Лп(а) приносит ОФЛ, макрофаги поглощают их, не справляются с окислительной нагрузкой и умирают.
(2) Лп(а) приносит белок апо(а), он запускает перестройки клеток эндотелия, что повышает его проницаемость, и из крови приходит масса новых липопротеинов.
(3) В ответ на Лп(а) клетки эндотелия синтезируют ПГЕ2; это стимулирует воспаление и привлекает новые иммунные клетки.
(4) Лп(а) приносит фосфолипазу Лп-ФЛА2 и аутотаксин (АТ); они превращают ОФЛ в сигнальное соединение, которое стимулирует минерализацию.
иллюстрация Анастасии Кузнецовой
Эксперименты с клетками сердечного клапана подтверждают вклад Лп(а) в работу аутотаксина и минерализацию [64]. Так, добавление Лп(а) к образцу здоровой ткани запускало ее перестройку, смерть клеток и другие процессы, ведущие к кальцификации. В уже минерализованных клапанах от умерших пациентов исследователи также находили улики: скопления Лп(а) и ОФЛ. То, что избыток Лп(а) и ОФЛ в крови — важный фактор риска кальцинированного аортального стеноза из-за их «помощи» аутотоксину, подтверждается и клинически [67].
Окисленные фосфолипиды, аутотаксин, Лп-ФЛА2... С Лп(а) связан ряд факторов риска развития ССЗ [68], [69]. Но особенно перспективной целью лечения кажется сам липопротеин (а): он объединяет много опасностей вместе, но действует независимо от других липопротеинов, то есть требует индивидуального подхода.
Разработка лекарств против избытка липопротеина (а)
У ученых по крайней мере две веские причины разрабатывать способы борьбы с избытком Лп(а). Во-первых, 20% людей — более 1,4 млрд — страдают от избытка Лп(а) [70–72]. Во-вторых, болезни сердца и сосудов, связанные с Лп(а), возможно пресечь на раннем этапе. Теоретический подсчет показывает: снижение Лп(а) на 50 мг/дл за 5 лет предотвращает около 20% серьезных ССЗ, снижение на 99 мг/дл — 40% [73]. Однако ни один из существующих препаратов не действует на Лп(а). Лечение статинами не снижает уровень холестерина и ОФЛ, связанных с Лп(а), а порой немного повышает [48], [74].
Снизить количество Лп(а) может остановка его выработки. Компания Ionis Pharmaceuticals разрабатывает молекулы, которые ломают синтез аполипопротеина (а) с мРНК гена LPA в клетках печени.
Препарат IONIS-APO(a)Rx и модифицированный вариант IONIS-APO(a)-LRx действуют по принципу антисенс-терапии. Оба средства уже прошли I и II фазы клинических испытаний , разработчики проверили действие разных доз олигонуклеотидов [70], [77], [78]. Оказалось, что у людей с избытком Лп(а) лечение за 30 дней снижает уровень липопротеина (а) в плазме на 92% при максимальной дозе лекарства [70]. В процессе терапия снижала чувствительность иммунных клеток участников к воспалению [79]. Результат держался в течение нескольких недель, а затем понемногу сходил нет. Второй препарат, IONIS-APO(a)-LRx, не вызывал никаких побочных эффектов, даже в месте инъекции.
«Биомолекула» уже рассказывала, как разработанные лекарства перед выпуском на рынок тестируют на людях, в спецпроекте по клиническим исследованиям.
Пока антисмысловая терапия кажется единственным способом лечить избыток Лп(а) в будущем. Новые подходы трудно разрабатывать и назначать. Ведь точные анализы уровня Лп(а) малодоступны, при этом не все медики знают про обособленность нового фактора риска от других [80]. В конце концов, препараты, о которых мы рассказали, еще несколько лет будут изучать и оставлять недоступными для потребителя. Даже если их в итоге разрешат, до этого момента важно поддерживать здоровье пациентов с избыточным Лп(а) доступными методами. Да, аферез снова поднимается на сцену.
Аферез липопротеина (а)
Терапию аферезом Лп(а) рекомендуют пациентам в США, Германии, Великобритании, России и многих других странах как единственный действенный на сегодняшний день способ очищения крови от избыточного липопротеина (а) [81–83]. Терапевтический аферез может снижать уровень Лп(а) на 70% — если сравнивать с тем уровнем, который был у пациента до процедуры. Правда, в течение одной—двух недель, которые пройдут до следующего афереза, Лп(а) снова накапливается, поэтому регулярные процедуры поддерживают его уровень на 20–40% ниже исходного [84]. Но и это дает мощный эффект: задерживается развитие атеросклероза и других ССЗ, что в шестилетней перспективе снижает риск опасных для жизни нарушений работы сердца и сосудов на 80%, а частоту инфарктов миокарда — на 97% [85–87].
Сорбционные колонки, которые используют для афереза Лп(а), обычно действуют и на ЛНП [85], [88], [89]. Такие комбинированные варианты хороши для людей, у которых, например, СГХС сочетается с повышенным уровнем Лп(а): они ликвидируют оба фактора риска [71]. Но 20% людей имеет только избыток липопротеина(а), и им необходимы колонки для специфического афереза Лп(а).
Сегодня лишь один вариант работает только против Лп(а) — сорбционная колонка «Лп(а) Липопак» научно-производственной фирмы «ПОКАРД» (см. врезку). Адсорбент колонки — специфические антитела к человеческому апо(а), которые извлекают из плазмы только частицы липопротеина (а). Проспективное когортное исследование показало, что «Лп(а) Липопак» извлекает из плазмы избыточный Лп(а) эффективнее любых других колонок — и даже адсорбирует небольшую часть ЛНП, когда его много [84], [87], [90–94]. В результате такого афереза за 18 месяцев уровень Лп(а) снижался в среднем на 75%, максимум на 88% — это наивысшая эффективность среди конкурентов. Изменение такое значительное, потому что испытание проводилось на пациентах с очень высоким уровнем Лп(а) (>100 мг/дл), тогда как колонки часто проверяют на людях с Лп(а) на уровне 80–90 мг/дл [85], [88], [89]. Но это подходящая «Лп(а) Липопак» выборка, так как колонка заточена на апо(а): по окончании афереза средний уровень Лп(а) опускался ниже 30 мг/дл, что также лучше, чем результат других колонок. Надо ли говорить, что терапия Лп(а) аферезом улучшает состояние сердца и сосудов пациентов [92], [95].
В заключение важно сказать, что угроза избытка липопротеинов здоровью людей — не «где-то далеко и не с нами», а прямо здесь и сейчас. В России у более чем 13% женщин и 15% мужчин концентрация Лп(а) в плазме крови выше 50 мг/дл [10]. На 173 россиян приходится один человек с семейной гиперхолестеринемией [9]. Такие нарушения работы липопротеинов действуют незаметно и обрекают человека на тяжелую болезнь. Однако часто люди просто не знают о своем диагнозе, хотя, будь они осведомлены, были бы и вооружены. Ведь даже тем пациентам, для которых нет эффективного лекарства, аферез может сберечь здоровье и продлить жизнь.
Литература
- Физическая водобоязнь;
- Липидный фундамент жизни;
- Peter O Kwiterovich. (2000). The metabolic pathways of high-density lipoprotein, low-density lipoprotein, and triglycerides: a current review. The American Journal of Cardiology. 86, 5-10;
- Linzhang Huang, Ken L. Chambliss, Xiaofei Gao, Ivan S. Yuhanna, Erica Behling-Kelly, et. al.. (2019). SR-B1 drives endothelial cell LDL transcytosis via DOCK4 to promote atherosclerosis. Nature. 569, 565-569;
- Dimitry A. Chistiakov, Alexandra A. Melnichenko, Veronika A. Myasoedova, Andrey V. Grechko, Alexander N. Orekhov. (2017). Mechanisms of foam cell formation in atherosclerosis. J Mol Med. 95, 1153-1165;
- Eithne M. Maguire, Stuart W.A. Pearce, Qingzhong Xiao. (2019). Foam cell formation: A new target for fighting atherosclerosis and cardiovascular disease. Vascular Pharmacology. 112, 54-71;
- Francesca Luchetti, Rita Crinelli, Maria Gemma Nasoni, Serena Benedetti, Francesco Palma, et. al.. (2021). LDL receptors, caveolae and cholesterol in endothelial dysfunction: oxLDLs accomplices or victims?. Br J Pharmacol. 178, 3104-3114;
- Хороший, плохой, злой холестерин;
- Alexey Meshkov, Alexandra Ershova, Anna Kiseleva, Svetlana Shalnova, Oxana Drapkina, et. al.. (2021). The Prevalence of Heterozygous Familial Hypercholesterolemia in Selected Regions of the Russian Federation: The FH-ESSE-RF Study. JPM. 11, 464;
- Marat Ezhov, Svetlana Shalnova, Elena Elena B. Yarovaya, Vladimir Kutsenko, Svetlana Evstifeeva, et. al.. (2021). Lipoprotein(a) in an adult sample from the Russian population: distribution and association with atherosclerotic cardiovascular diseases. Arch Med Sci;
- Joep C. Defesche, Samuel S. Gidding, Mariko Harada-Shiba, Robert A. Hegele, Raul D. Santos, Anthony S. Wierzbicki. (2017). Familial hypercholesterolaemia. Nat Rev Dis Primers. 3;
- Peter Libby, Julie E. Buring, Lina Badimon, Göran K. Hansson, John Deanfield, et. al.. (2019). Atherosclerosis. Nat Rev Dis Primers. 5;
- Anton Gisterå, Göran K. Hansson. (2017). The immunology of atherosclerosis. Nat Rev Nephrol. 13, 368-380;
- Milan Bláha, Melanie Cermanová, Vladimír Bláha, Martin Blažek, Jaroslav Malý, et. al.. (2007). Safety and Tolerability of Long Lasting LDL-apheresis in Familial Hyperlipoproteinemia. Therapher Dial. 11, 9-15;
- W. Stoffel, H. Borberg, V. Greve. (1981). APPLICATION OF SPECIFIC EXTRACORPOREAL REMOVAL OF LOW DENSITY LIPOPROTEIN IN FAMILIAL HYPERCHOLESTEROLAEMIA. The Lancet. 318, 1005-1007;
- Rolf Bambauer, Ralf Schiel, Reinhard Latza. (2003). Low-density Lipoprotein Apheresis: An Overview. Therapher Dial. 7, 382-390;
- H. Borberg. (2009). 26 Years of LDL – Apheresis: A review of experience. Transfusion and Apheresis Science. 41, 49-59;
- Терапевтический аферез. Как и для чего очищают кровь вне тела пациента;
- Терапевтические моноклональные антитела;
- Моноклональные антитела;
- Открытие моноклональных антител;
- Beate Roxane Jaeger. (2003). The HELP System for the Treatment of Atherothrombotic Disorders: A Review. Therapher Dial. 7, 391-396;
- V.J.J. Schettler, C. Peter, T. Zimmermann, U. Julius, E. Roeseler, et. al.. (2021). The German Lipoprotein Apheresis Registry (GLAR) – more than 7 years on. Atherosclerosis. 331, e21;
- V. J. J. Schettler, Scientific Board of GLAR for the German Apheresis Working Group, C. L. Neumann, C. Peter, T. Zimmermann, et. al.. (2017). The German Lipoprotein Apheresis Registry (GLAR) – almost 5 years on. Clin Res Cardiol Suppl. 12, 44-49;
- Kåre Berg. (2009). A NEW SERUM TYPE SYSTEM IN MAN-THE Lp SYSTEM. Acta Pathologica Microbiologica Scandinavica. 59, 369-382;
- Karam M. Kostner, Gert M. Kostner. (2017). Lipoprotein (a): a historical appraisal. Journal of Lipid Research. 58, 1-14;
- Emerging Risk Factors Collaboration. (2009). Lipoprotein(a) Concentration and the Risk of Coronary Heart Disease, Stroke, and Nonvascular Mortality. JAMA. 302, 412;
- Robert Clarke, John F. Peden, Jemma C. Hopewell, Theodosios Kyriakou, Anuj Goel, et. al.. (2009). Genetic Variants Associated with Lp(a) Lipoprotein Level and Coronary Disease. N Engl J Med. 361, 2518-2528;
- Pia R. Kamstrup. (2009). Genetically Elevated Lipoprotein(a) and Increased Risk of Myocardial Infarction. JAMA. 301, 2331;
- Carolin Lackner, Jonathan C. Cohen, Helen H. Hobbs. (1993). Molecular definition of the extreme size polymorphism in apolipoprotein(a). Hum Mol Genet. 2, 933-940;
- Ytje Y. van der Hoek, Marianne E. Wittekoek, Ulrike Beisiegel, John J.P. Kastelein, MarlysL. Koschinsky. (1993). The apolipoprotein(a) kringle IV repeats which differ from the major repeat kringle are present in variably-sized isoforms. Hum Mol Genet. 2, 361-366;
- Santica M. Marcovina, John J. Albers. (2016). Lipoprotein (a) measurements for clinical application. Journal of Lipid Research. 57, 526-537;
- Don P. Wilson, Terry A. Jacobson, Peter H. Jones, Marlys L. Koschinsky, Catherine J. McNeal, et. al.. (2019). Use of Lipoprotein(a) in clinical practice: A biomarker whose time has come. A scientific statement from the National Lipid Association. Journal of Clinical Lipidology. 13, 374-392;
- George Thanassoulis, Catherine Y. Campbell, David S. Owens, J. Gustav Smith, Albert V. Smith, et. al.. (2013). Genetic Associations with Valvular Calcification and Aortic Stenosis. N Engl J Med. 368, 503-512;
- Pia R. Kamstrup, Anne Tybjærg-Hansen, Børge G. Nordestgaard. (2014). Elevated Lipoprotein(a) and Risk of Aortic Valve Stenosis in the General Population. Journal of the American College of Cardiology. 63, 470-477;
- Pia R. Kamstrup, Børge G. Nordestgaard. (2016). Elevated Lipoprotein(a) Levels, LPA Risk Genotypes, and Increased Risk of Heart Failure in the General Population. JACC: Heart Failure. 4, 78-87;
- Danish Saleheen, Philip C Haycock, Wei Zhao, Asif Rasheed, Adam Taleb, et. al.. (2017). Apolipoprotein(a) isoform size, lipoprotein(a) concentration, and coronary artery disease: a mendelian randomisation analysis. The Lancet Diabetes & Endocrinology. 5, 524-533;
- Pia R. Kamstrup, Anne Tybjærg-Hansen, Børge G. Nordestgaard. (2012). Genetic Evidence That Lipoprotein(a) Associates With Atherosclerotic Stenosis Rather Than Venous Thrombosis. ATVB. 32, 1732-1741;
- Anna Helgadottir, Solveig Gretarsdottir, Gudmar Thorleifsson, Hilma Holm, Riyaz S. Patel, et. al.. (2012). Apolipoprotein(a) Genetic Sequence Variants Associated With Systemic Atherosclerosis and Coronary Atherosclerotic Burden But Not With Venous Thromboembolism. Journal of the American College of Cardiology. 60, 722-729;
- Jemma C. Hopewell, Robert Clarke, Sarah Parish, Jane Armitage, Mark Lathrop, et. al.. (2011). Lipoprotein(a) Genetic Variants Associated With Coronary and Peripheral Vascular Disease but Not With Stroke Risk in the Heart Protection Study. Circ Cardiovasc Genet. 4, 68-73;
- Connor A. Emdin, Amit V. Khera, Pradeep Natarajan, Derek Klarin, Hong-Hee Won, et. al.. (2016). Phenotypic Characterization of Genetically Lowered Human Lipoprotein(a) Levels. Journal of the American College of Cardiology. 68, 2761-2772;
- Mehdi Afshar, Pia R. Kamstrup, Ken Williams, Allan D. Sniderman, Børge G. Nordestgaard, George Thanassoulis. (2016). Estimating the Population Impact of Lp(a) Lowering on the Incidence of Myocardial Infarction and Aortic Stenosis—Brief Report. ATVB. 36, 2421-2423;
- Mark Trinder, Md Mesbah Uddin, Phoebe Finneran, Krishna G. Aragam, Pradeep Natarajan. (2021). Clinical Utility of Lipoprotein(a) and LPA Genetic Risk Score in Risk Prediction of Incident Atherosclerotic Cardiovascular Disease. JAMA Cardiol. 6, 287;
- Anurag Mehta, Salim S. Virani, Colby R. Ayers, Wensheng Sun, Ron C. Hoogeveen, et. al.. (2020). Lipoprotein(a) and Family History Predict Cardiovascular Disease Risk. Journal of the American College of Cardiology. 76, 781-793;
- Anne Langsted, Pia R Kamstrup, Børge G Nordestgaard. (2019). High lipoprotein(a) and high risk of mortality. European Heart Journal. 40, 2760-2770;
- Daniel F. Gudbjartsson, Gudmundur Thorgeirsson, Patrick Sulem, Anna Helgadottir, Arnaldur Gylfason, et. al.. (2019). Lipoprotein(a) Concentration and Risks of Cardiovascular Disease and Diabetes. Journal of the American College of Cardiology. 74, 2982-2994;
- Guillaume Paré, Artuela Çaku, Matthew McQueen, Sonia S. Anand, Enas Enas, et. al.. (2019). Lipoprotein(a) Levels and the Risk of Myocardial Infarction Among 7 Ethnic Groups. Circulation. 139, 1472-1482;
- Peter Willeit, Paul M Ridker, Paul J Nestel, John Simes, Andrew M Tonkin, et. al.. (2018). Baseline and on-statin treatment lipoprotein(a) levels for prediction of cardiovascular events: individual patient-data meta-analysis of statin outcome trials. The Lancet. 392, 1311-1320;
- Valery N. Bochkov, Olga V. Oskolkova, Konstantin G. Birukov, Anna-Liisa Levonen, Christoph J. Binder, Johannes Stöckl. (2010). Generation and Biological Activities of Oxidized Phospholipids. Antioxidants & Redox Signaling. 12, 1009-1059;
- Dania Zhivaki, Jonathan C. Kagan. (2021). Innate immune detection of lipid oxidation as a threat assessment strategy. Nat Rev Immunol;
- Corey A. Scipione, Sera E. Sayegh, Rocco Romagnuolo, Sotirios Tsimikas, Santica M. Marcovina, et. al.. (2015). Mechanistic insights into Lp(a)-induced IL-8 expression: a role for oxidized phospholipid modification of apo(a). Journal of Lipid Research. 56, 2273-2285;
- Sotirios Tsimikas, Herbert K. Lau, Kyoo-Rok Han, Brian Shortal, Elizabeth R. Miller, et. al.. (2004). Percutaneous Coronary Intervention Results in Acute Increases in Oxidized Phospholipids and Lipoprotein(a). Circulation. 109, 3164-3170;
- N W Boonmark, X J Lou, Z J Yang, K Schwartz, J L Zhang, et. al.. (1997). Modification of apolipoprotein(a) lysine binding site reduces atherosclerosis in transgenic mice.. J. Clin. Invest.. 100, 558-564;
- Gregor Leibundgut, Corey Scipione, Huiyong Yin, Matthias Schneider, Michael B. Boffa, et. al.. (2013). Determinants of binding of oxidized phospholipids on apolipoprotein (a) and lipoprotein (a). Journal of Lipid Research. 54, 2815-2830;
- J Biomed Res. 32; Journal of Biomedical Research;
- Michael B. Boffa, Marlys L. Koschinsky. (2019). Oxidized phospholipids as a unifying theory for lipoprotein(a) and cardiovascular disease. Nat Rev Cardiol. 16, 305-318;
- George Thanassoulis. (2016). Lipoprotein (a) in calcific aortic valve disease: from genomics to novel drug target for aortic stenosis. Journal of Lipid Research. 57, 917-924;
- Patrick Mathieu, Benoit J. Arsenault, Marie-Chloé Boulanger, Yohan Bossé, Marlys L. Koschinsky. (2017). Pathobiology of Lp(a) in calcific aortic valve disease. Expert Review of Cardiovascular Therapy. 15, 797-807;
- Catherine M. Otto. (2008). Calcific Aortic Stenosis — Time to Look More Closely at the Valve. N Engl J Med. 359, 1395-1398;
- Tracie A. Seimon, Marissa J. Nadolski, Xianghai Liao, Jorge Magallon, Matthew Nguyen, et. al.. (2010). Atherogenic Lipids and Lipoproteins Trigger CD36-TLR2-Dependent Apoptosis in Macrophages Undergoing Endoplasmic Reticulum Stress. Cell Metabolism. 12, 467-482;
- Fleur M. van der Valk, Siroon Bekkering, Jeffrey Kroon, Calvin Yeang, Jan Van den Bossche, et. al.. (2016). Oxidized Phospholipids on Lipoprotein(a) Elicit Arterial Wall Inflammation and an Inflammatory Monocyte Response in Humans. Circulation. 134, 611-624;
- Olga I. Afanasieva, Anastasya Yu. Filatova, Tatiana I. Arefieva, Elena A. Klesareva, Alexandra V. Tyurina, et. al.. (2021). The Association of Lipoprotein(a) and Circulating Monocyte Subsets with Severe Coronary Atherosclerosis. JCDD. 8, 63;
- Taewoo Cho, Yoojin Jung, Marlys L. Koschinsky. (2008). Apolipoprotein(a), through Its Strong Lysine-binding Site in KIV10, Mediates Increased Endothelial Cell Contraction and Permeability via a Rho/Rho Kinase/MYPT1-dependent Pathway. Journal of Biological Chemistry. 283, 30503-30512;
- Bin Yu, Anouar Hafiane, George Thanassoulis, Leah Ott, Nial Filwood, et. al.. (2017). Lipoprotein(a) Induces Human Aortic Valve Interstitial Cell Calcification. JACC: Basic to Translational Science. 2, 358-371;
- Taewoo Cho, Rocco Romagnuolo, Corey Scipione, Michael B. Boffa, Marlys L. Koschinsky. (2013). Apolipoprotein(a) stimulates nuclear translocation of β-catenin: a novel pathogenic mechanism for lipoprotein(a). MBoC. 24, 210-221;
- Rihab Bouchareb, Ablajan Mahmut, Mohamed Jalloul Nsaibia, Marie-Chloé Boulanger, Abdellaziz Dahou, et. al.. (2015). Autotaxin Derived From Lipoprotein(a) and Valve Interstitial Cells Promotes Inflammation and Mineralization of the Aortic Valve. Circulation. 132, 677-690;
- M. J. Nsaibia, A. Mahmut, M.-C. Boulanger, B. J. Arsenault, R. Bouchareb, et. al.. (2016). Autotaxin interacts with lipoprotein(a) and oxidized phospholipids in predicting the risk of calcific aortic valve stenosis in patients with coronary artery disease. J Intern Med. 280, 509-517;
- Yin Tintut, Jeffrey J. Hsu, Linda L. Demer. (2018). Lipoproteins in Cardiovascular Calcification: Potential Targets and Challenges. Front. Cardiovasc. Med.. 5;
- Fubao Huang, Kai Wang, Jianhua Shen. (2020). Lipoprotein‐associated phospholipase A2: The story continues. Med Res Rev. 40, 79-134;
- Nicholas J Viney, Julian C van Capelleveen, Richard S Geary, Shuting Xia, Joseph A Tami, et. al.. (2016). Antisense oligonucleotides targeting apolipoprotein(a) in people with raised lipoprotein(a): two randomised, double-blind, placebo-controlled, dose-ranging trials. The Lancet. 388, 2239-2253;
- A. Vuorio, G. F. Watts, W. J. Schneider, S. Tsimikas, P. T. Kovanen. (2020). Familial hypercholesterolemia and elevated lipoprotein(a): double heritable risk and new therapeutic opportunities. J Intern Med. 287, 2-18;
- Sotirios Tsimikas, Sergio Fazio, Keith C. Ferdinand, Henry N. Ginsberg, Marlys L. Koschinsky, et. al.. (2018). NHLBI Working Group Recommendations to Reduce Lipoprotein(a)-Mediated Risk of Cardiovascular Disease and Aortic Stenosis. Journal of the American College of Cardiology. 71, 177-192;
- Christian M. Madsen, Pia R. Kamstrup, Anne Langsted, Anette Varbo, Børge G. Nordestgaard. (2020). Lipoprotein(a)-Lowering by 50 mg/dL (105 nmol/L) May Be Needed to Reduce Cardiovascular Disease 20% in Secondary Prevention. ATVB. 40, 255-266;
- Sotirios Tsimikas, Philip L S M Gordts, Chelsea Nora, Calvin Yeang, Joseph L Witztum. (2020). Statin therapy increases lipoprotein(a) levels. European Heart Journal. 41, 2275-2284;
- Stanley T. Crooke, Brenda F. Baker, Rosanne M. Crooke, Xue-hai Liang. (2021). Antisense technology: an overview and prospectus. Nat Rev Drug Discov. 20, 427-453;
- Есть ли смысл в антисенсах?;
- Sotirios Tsimikas, Nicholas J Viney, Steven G Hughes, Walter Singleton, Mark J Graham, et. al.. (2015). Antisense therapy targeting apolipoprotein(a): a randomised, double-blind, placebo-controlled phase 1 study. The Lancet. 386, 1472-1483;
- Sotirios Tsimikas, Ewa Karwatowska-Prokopczuk, Ioanna Gouni-Berthold, Jean-Claude Tardif, Seth J. Baum, et. al.. (2020). Lipoprotein(a) Reduction in Persons with Cardiovascular Disease. N Engl J Med. 382, 244-255;
- Lotte C A Stiekema, Koen H M Prange, Renate M Hoogeveen, Simone L Verweij, Jeffrey Kroon, et. al.. (2020). Potent lipoprotein(a) lowering following apolipoprotein(a) antisense treatment reduces the pro-inflammatory activation of circulating monocytes in patients with elevated lipoprotein(a). European Heart Journal. 41, 2262-2271;
- Michael B. Boffa, Marlys L. Koschinsky. (2018). The journey towards understanding lipoprotein(a) and cardiovascular disease risk. Current Opinion in Lipidology. 29, 259-267;
- Børge G. Nordestgaard, M. John Chapman, Kausik Ray, Jan Borén, Felicita Andreotti, et. al.. (2010). Lipoprotein(a) as a cardiovascular risk factor: current status. European Heart Journal. 31, 2844-2853;
- Jaimini Cegla, R.Dermot G. Neely, Michael France, Gordon Ferns, Chris D. Byrne, et. al.. (2019). HEART UK consensus statement on Lipoprotein(a): A call to action. Atherosclerosis. 291, 62-70;
- Anand Padmanabhan, Laura Connelly‐Smith, Nicole Aqui, Rasheed A. Balogun, Reinhard Klingel, et. al.. (2019). Guidelines on the Use of Therapeutic Apheresis in Clinical Practice – Evidence‐Based Approach from the Writing Committee of the American Society for Apheresis: The Eighth Special Issue. J Clin Apher. 34, 171-354;
- Elisa Waldmann, Klaus G. Parhofer. (2016). Lipoprotein apheresis to treat elevated lipoprotein (a). Journal of Lipid Research. 57, 1751-1757;
- Maria Francesca Greco, Cesare R. Sirtori, Alberto Corsini, Marat Ezhov, Tiziana Sampietro, Massimiliano Ruscica. (2020). Lipoprotein(a) Lowering—From Lipoprotein Apheresis to Antisense Oligonucleotide Approach. JCM. 9, 2103;
- Franz Heigl, Reinhard Hettich, Norbert Lotz, Harduin Reeg, Tobias Pflederer, et. al.. (2015). Efficacy, safety, and tolerability of long-term lipoprotein apheresis in patients with LDL- or Lp(a) hyperlipoproteinemia: Findings gathered from more than 36,000 treatments at one center in Germany. Atherosclerosis Supplements. 18, 154-162;
- G.R. Thompson, V.M.G. Maher, Y. Kitano, C. Neuwirth, V.M.G. Maher, et. al.. (1995). Familial Hypercholesterolaemia Regression Study: a randomised trial of low-density-lipoprotein apheresis. The Lancet. 345, 811-816;
- T. Bosch, A. Lennertz, D. Schenzle, J. Dräger, for the DALI Study Group. (2002). Direct adsorption of low-density lipoprotein and lipoprotein(a) from whole blood: Results of the first clinical long-term multicenter study using DALI apheresis. J. Clin. Apheresis. 17, 161-169;
- Carsten Otto, Peter Kern, Rolf Bambauer, Stefan Kallert, Peter Schwandt, Klaus G. Parhofer. (2003). Efficacy and Safety of a New Whole-blood Low-density Lipoprotein Apheresis System (Liposorber D) in Severe Hypercholesterolemia. Artificial Organs. 27, 1116-1122;
- Sergei N. Pokrovsky, Olga I. Afanasieva, Marat V. Ezhov. (2016). Lipoprotein(a) apheresis. Current Opinion in Lipidology. 27, 351-358;
- Maya S. Safarova, Marat V. Ezhov, Olga I. Afanasieva, Yuriy G. Matchin, Ruslan V. Atanesyan, et. al.. (2013). Effect of specific lipoprotein(a) apheresis on coronary atherosclerosis regression assessed by quantitative coronary angiography. Atherosclerosis Supplements. 14, 93-99;
- Beate R Jaeger, , for the Group of Clinical Investigators, Yvonne Richter, Dorothea Nagel, Franz Heigl, et. al.. (2009). Longitudinal cohort study on the effectiveness of lipid apheresis treatment to reduce high lipoprotein(a) levels and prevent major adverse coronary events. Nat Rev Cardiol. 6, 229-239;
- Adrian Rosada, Ursula Kassner, Anja Vogt, Michael Willhauck, Klaus Parhofer, Elisabeth Steinhagen-Thiessen. (2014). Does Regular Lipid Apheresis in Patients With Isolated Elevated Lipoprotein(a) Levels Reduce the Incidence of Cardiovascular Events?. Artificial Organs. 38, 135-141;
- Josef Leebmann, Eberhard Roeseler, Ulrich Julius, Franz Heigl, Ralf Spitthoever, et. al.. (2013). Lipoprotein Apheresis in Patients With Maximally Tolerated Lipid-Lowering Therapy, Lipoprotein(a)-Hyperlipoproteinemia, and Progressive Cardiovascular Disease. Circulation. 128, 2567-2576;
- S.N. Pokrovsky, O.I. Afanasieva, M.S. Safarova, T.V. Balakhonova, Yu.G. Matchin, et. al.. (2017). Specific Lp(a) apheresis: A tool to prove lipoprotein(a) atherogenicity. Atherosclerosis Supplements. 30, 166-173.