Циклины и их помощники — регуляторы клеточного цикла
24 октября 2023
Циклины и их помощники — регуляторы клеточного цикла
- 3942
- 2
- 11
Деление клетки.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Тело человека состоит из более ста триллионов живых клеток. Для сравнения: в пачке гречки 50 тысяч зернышек, а на дереве 200 тысяч листьев. Большая часть из наших клеток постоянно делится. От роста волос и ногтей до заживления царапины — в основе всех этих процессов лежит деление клеток. С другой стороны, некоторые клетки совсем не делятся. И вот, в начале XXI века были открыты новые регуляторные молекулы — циклины и циклинзависимые киназы. Но несмотря на то, что тема циклинов достаточно молода, она в то же время и достаточно актуальна, как в медицине, так и в клеточной биологии. Только за последние пять лет (с 2018 по 2023 годы) про циклины написано около 20 000 статей! И это нормально. Человека всегда интересует что-нибудь, с чем он никогда не сталкивался. Ведь Нобелевскую премию за открытие циклинов вручили совсем недавно — в 2001 году. Самое удивительное, что эти молекулы регулируют большинство процессов в клетке. Деление, окисление глюкозы, дифференцировка клетки (приобретение «профессии»), ее движение в пространстве и так далее — на все эти процессы так или иначе влияют циклины. Но давайте обо всем по порядку.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Сперва немного теории
А раз мы решили «по порядку», то, прежде чем изучать, какую роль циклины играют в клетке, нужно разобраться в том, что такое циклины, циклинзависимые киназы, ингибиторы циклинзависимых киназ. Словом, небольшой теоретический экскурс.
Вначале был... митоз
Начнем с небольшой истории вопроса. Хоть эта статья и посвящена циклинам, первопричиной всех этих исследований стало открытие Вальтером Флеммингом в 1880-х — 1890-х годах митоза (о видах деления клеток поговорим чуть позже). Однако молекулярные механизмы клеточного цикла были неизвестны вплоть до начала 1970-х годов. Деление клетки (как его описал Флемминг) воспринимали как данность, так как не могли изучить этот процесс более детально. Многим казалось, что все просто — клетки делятся пополам, и все, но нет! Некоторые клетки ни с того ни с сего перестают делиться (выходят в фазу покоя), а другие и вовсе погибают в середине цикла. Помимо этого, ученые открыли, что периодически клетки «останавливаются» (замедляют абсолютно все процессы) и «проверяют», все ли в порядке у них внутри. Если есть какие-то ошибки, их устраняют специальные белки, но если клетка не может «починиться», то она запускает механизм самоликвидации. Это и интересовало биологов — как клетки контролируют сами себя?
Подбираться к циклинам люди начали еще в XX веке. Но лишь трое ученых ухватили циклины «за хвост» и тем самым смогли найти ответы на интересующие многих вопросы о биологии клеток. В 2001 году сразу трем ученым присудили Нобелевскую премию по физиологии и медицине. Эти люди совершили поистине фундаментальное открытие — описали факторы, регулирующие протекание всего клеточного цикла. Лауреатами премии стали (рис. 1):
- Лиланд Хартуэлл, президент и директор Центра по исследованию рака имени Фреда Хатчинсона в Сиэтле; открыл специфический класс генов, которые контролируют клеточный цикл.
- Пол Нерс, генеральный директор Фонда по исследованию рака (ICRF) в Лондоне; обнаружил и охарактеризовал один из ключевых регуляторов клеточного цикла — фермент циклинзависимую киназу.
- Тимоти Хант, сотрудник ICRF; награжден за открытие циклинов — белков, которые регулируют функции циклинзависимых киназ.

Рисунок 1. Нобелевские лауреаты, открывшие циклины. Слева направо — Лиланд Хартуэлл, Пол Нерс, Тимоти Хант.
Пионером в исследовании клеточного цикла на молекулярном уровне стал Лиланд Хартуэлл. Он выделил группу генов (около ста) в обычных пекарских дрожжах (Saccharomyces cerevisiae), которые были активны в разные периоды клеточного цикла. Он предположил, что эти участки ДНК кодируют какие-то белки, которые и регулируют эти фазы. Оказалось, что в начале каждого цикла активировался определенный ген (СВС-28). Он, как человек на старте гоночного трека, взмахивал фагом и давал клетке команду начать копирование ДНК для нового деления.
Лиланд Хартуэлл также обратил внимание на однонаправленность клеточного цикла: последующая стадия никогда не начинается, пока не завершена предшествующая. Изучив вопрос, он разработал теорию контрольных точек (checkpoint). Дело в том, что деление эукариотической клетки — это сложный и динамичный процесс, за которым необходимо постоянно следить. Поэтому эукариоты развили у себя систему регуляторных белков для контроля клеточного цикла. Эта система определяет, сколько времени клетка должна находиться в той или иной фазе. Помимо этого, система контроля реагирует на информацию о внешней среде и о процессах внутри клетки. Так вот, чекпоинты находятся на границах фаз (вообще их, конечно, больше, но основными считаются эти). Они проверяют «правильность» протекания процессов в клетке, и, если что-то пошло не так, останавливают клеточный цикл и дают клетке время на исправление ошибок. Лиланд Хартуэлл совершил это открытие, изучая чувствительность дрожжей к облучению и выяснил, что периодически клеточный цикл приостанавливается. Он связал это с повреждением ДНК из-за облучения и сделал предположение — клетка останавливается для того, чтобы восстановить порядок.
Параллельно эксперименты с дрожжами проводил другой ученый — Пол Нерс. Он использовал другую разновидность этих грибов — Schizosaccharomyces pombe (а не Saccharomyces cerevisiae, как Хартуэлл). Они — отдаленные родственники пекарских дрожжей. Применяя генетический подход, разработанный Хартуэллом, Нерс установил, что ген, выполняющий функцию стартового, кодирует фермент из семейства циклинзависимых киназ (Cdk) — так их назовут позже. Этот фермент как бы ведет клетку по клеточному циклу, стимулируя химическую модификацию других белков. В 1987 году Нерс выделил соответствующий белок в клетках человека.
Но все-таки существовал вопрос — как контролируются эти ферменты? Ответом стал результат работы Тима Ханта, а именно — открытие циклинов, нового класса белков. В интервью для The Life Scientific (эфир от 13.12.2011), которое вел Джим Аль-Халили, профессор Хант объяснил, что название «циклин» было первоначально придумано в честь его увлечения велоспортом. Только после присвоения названия выяснилось, что концентрация белков циклически меняется в клетке, по мере течения клеточного цикла, поэтому название прижилось.
Кстати, название cyclin, которое я придумал, на самом деле было шуткой, потому что в то время мне очень нравилось ездить на велосипеде ...
Название «циклин» закрепилось потому, что концентрация этих веществ периодически изменяется в зависимости от стадии клеточного цикла, в частности, падает перед началом деления клетки и возрастает после. Хант обнаружил первый циклин в начале 1980-х годов, во время опытов с икрой лягушек и морских ежей. Позднее циклины были найдены и в других живых существах, и оказалось, что эти белки мало изменились в ходе эволюции. Циклины регулируют активность Cdk, которые непосредственно участвуют в химических реакциях, ускоряя или замедляя их. Циклины же включают или выключают сами Cdk. Циклины и Cdk можно сравнить с оператором и панелью тумблеров. Операторы (циклины) переключают тумблеры (Cdk) на пульте управления, направляя клетку в нужное русло клеточного цикла.
Клеточный цикл — карусель жизни...
Клеточный цикл (рис. 2) — это промежуток времени между двумя последовательными делениями [1]. Его традиционно разделяют на четыре периода, которые называются до банальности просто:
- G1-фаза (пресинтетическая). Клетка только что поделилась и теперь «распаковывает» генетический материал и готовится к работе. Интенсивно собираются новые белки, клетка растет и копит питательные вещества.
- S-фаза (синтетическая). Эта фаза так называется, потому что в ней клетка синтезирует вторую ДНК. Этот процесс называется репликацией, или удвоением.
- G2-фаза (постсинтетическая). Клетка постепенно «сворачивает производство» и готовится к новому «переезду» (делению).
Иногда три первые фазы (G1, S и G2) называют одним словом — интерфаза. - M (деление). Здесь стоит обговорить лишь тот момент, что существует два вида деления: митоз и мейоз. Митоз еще называют нередукционным делением, так как в ходе него не уменьшается количество генетической информации в дочерних клетках. Другими словами, из одной клетки, где есть 46 хромосом, получится две клетки с точно такими же количеством хромосом.
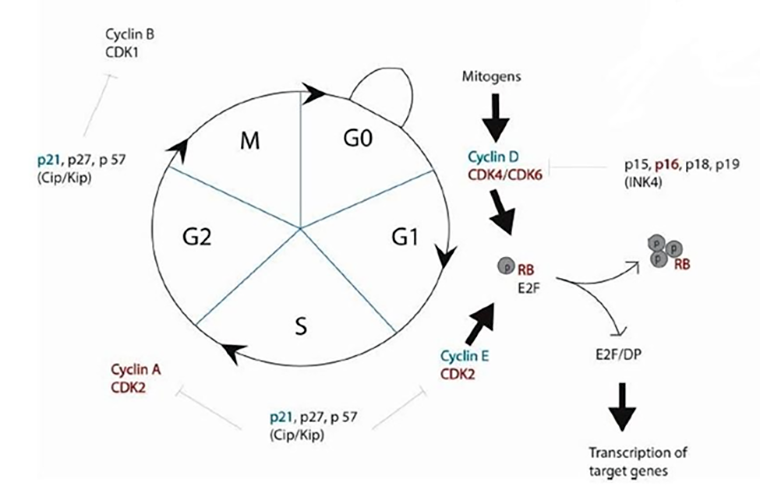
Рисунок 2. Схема клеточного цикла и регуляторных молекул.
Мейоз — это редукционное деление. Как вы, уже, вероятно, догадались, здесь ситуация совсем другая. В результате деления получается не две, а четыре клетки, но и генетической информации в них в два раза меньше: из одной клетки с 46 хромосомами получится четыре по 23 хромосомы в каждой.
В этой статье сам процесс деления детально рассматриваться не будет, так как все-таки основная ее тема — это циклины. Более подробно деление разобрано в другой статье на «Биомолекуле» [2].
Помимо этого, выделяют еще пятую фазу — G0 (покоя). В фазу покоя в клетке не происходит процессов, классических для клеточного цикла (удвоение ДНК и так далее). Клетка просто живет, окисляет вещества, получает энергию, синтезирует необходимые белки. Но не делится. В этой фазе находятся дифференцированные клетки организма. Например, нейроны или лимфоциты, или реснитчатые клетки слизистой оболочки дыхательных путей. Они уже получили «профессию», и у них уже «нет времени» на деление. Они выполняют свой «долг» на благо всего организма.
Циклин
Все существующие циклины отличаются друг от друга. Впрочем, не совсем. Есть один участок молекулы, который назвали блоком циклина. Этот блок состоит примерно из 100 аминокислот, и их последовательность идентична у циклинов одного семейства. Интересно, что блок циклина присутствует и в других молекулах, таких как белок ретинобластомы и фактор транскрипции TF-II-B, которые не активируют циклинзависимые киназы.
Семейство циклинов включает в себя 29 белков, содержащихся в человеческом организме. Эти белки разделены на 16 подсемейств, а те, в свою очередь, на три большие группы:
- Группа 1 — (группа циклина B — A-, B-, D-, E-, F-, G-, J-, I- и O-).
- Группа 2 — (группа циклина Y — взаимодействующие с Cdk 5).
- Группа 3 — (группа циклина C — C-, H-, K-, L- и T- — взаимодействующие с транскрипционными Cdk) [3], [4].
Можно классифицировать и по-другому — по функциям:
- G1/S циклины — контролируют переход из пресинтетической фазы в синтетическую:
- циклин D;
- циклин E;
- S циклины — контролируют удвоение ДНК в синтетической фазе:
- циклин A.
- G2 циклины — отвечают за постсинтетическую фазу и подготовку клетки к делению:
- циклин A;
- циклин E.
- M циклины — присматривают за клеткой непосредственно в момент деления:
- циклин E.
Такую классификацию используют, когда говорят исключительно про клеточный цикл, так как сюда не входят циклины, участвующие в других процессах.
Более подробно про каждый тип циклинов мы поговорим ниже. Сейчас стоит сказать лишь то, что сами циклины не обладают каталитической активностью. Они только «включают» циклинзависимые киназы (Cdk — Cyclin-depended kinase), присоединяясь к ним.
Циклинзависимая киназа
Киназы — это отдельный вид ферментов. Они переносят фосфор с одной молекулы (обычно это АТФ, но может быть и другой источник, например, фосфорная кислота (H2PO4) и др.) на другую. Этот процесс называется фосфорилированием (рис. 3).
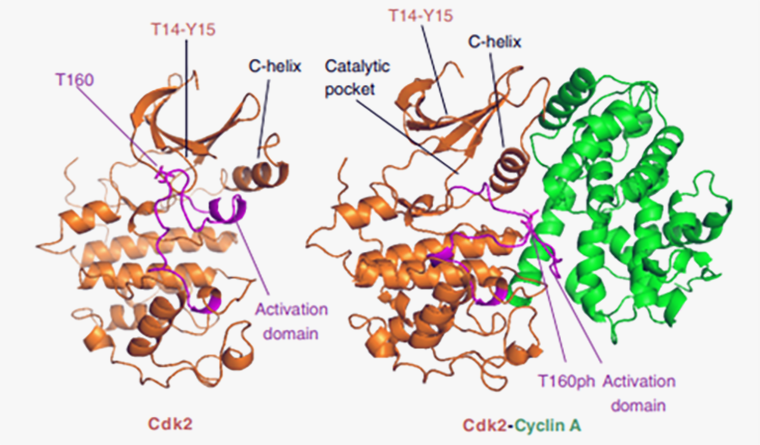
Рисунок 3. Трехмерная структура циклинзависимой киназы и ее активация.
Название «циклинзависимые» указывает на то, что эти киназы не «таскают» фосфор туда-сюда постоянно. Они зависят от циклинов, которые либо включают, либо выключают эти ферменты.
Cdk — это белки с молекулярной массой примерно 34–40 кДа. В них, как и во многих белковых ферментах, выделяют активный центр (место, куда прикрепляется субстрат и источник фосфора, АТФ) и аллостерический центр — место связывания Cdk с циклином. Без циклина Cdk обладает низкой киназной активностью или вовсе не проявляет таковой. С циклином же эти киназы фосфорилируют целевые субстраты по треонину и серину (иными словами — являются серин-треонин киназами) (рис. 4).
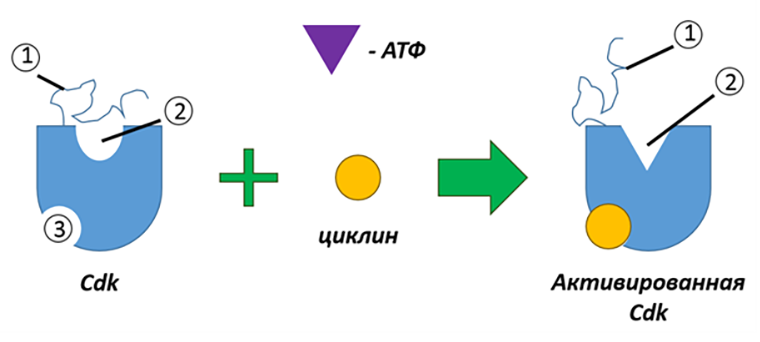
Рисунок 4. Схема активации Cdk циклином.
(1) — T-петля;
(2) — АТФ-связывающий сайт;
(3) — аллостерический центр.
рисунок автора
Комплекс Cdk–циклин
Как и циклины, циклинзависимые киназы разделили на семейства. Их названия столь же просты — арабские цифры от 1 до 13. Каждая Cdk связывается только с определенными циклинами. Существуют киназы, связывающиеся только с одним семейством циклинов, а есть те, которые могут соединиться с циклинами из двух семейств или более. Подробно пары Cdk–циклин представлены на схеме ниже (рис. 5).
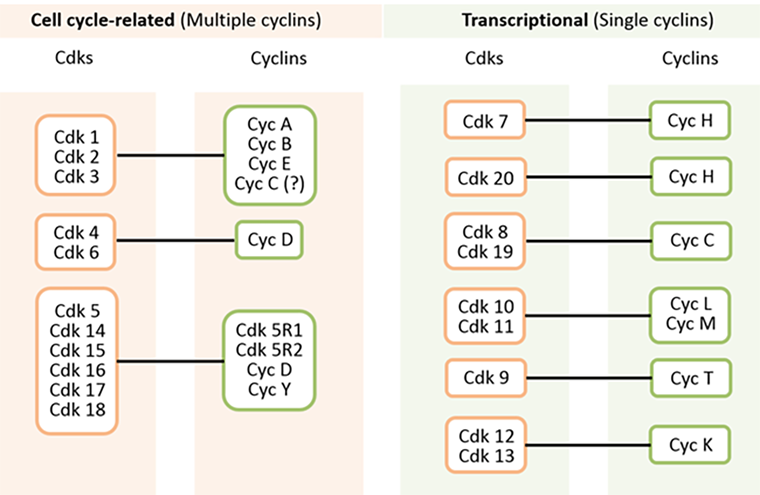
Рисунок 5. Пары циклинов и циклинзависимых киназ человека.
Каким же образом циклины регулируют активность циклинзависимых киназ? Дело в том, что активный центр всех Cdk представляет собой щель между маленькой амино-концевой и большой карбокси-концевой частями, в которую «загружается» АТФ. Эта щель называется АТФ-связывающим сайтом. И без циклина этот сайт буквально закрыт гибким участком самого фермента — T-петлей (или петлей активации). Помимо этого, сам АТФ-связывающий сайт обладает низким сродством к АТФ. Эти два ключевых участка регулируются двумя α-спиралями. После связывания с циклином эти две спирали меняют свое положение, перестраивая фермент. Одна α-спираль находится непосредственно перед Т-петлей и помогает перестроить гибкий участок, чтобы он больше не блокировал центр связывания АТФ. Вторая α-спираль изменяет сам активный центр, повышая его сродство с АТФ. Несмотря на то, что без циклина по объективным причинам невозможно протекание киназных реакций с участием Cdk, присоединение циклина не активирует фермент полностью. Чтобы до конца активировать этот фермент, его нужно профосфорилировать по треонину, который прилегает к активному сайту. За это отвечает Cdk-активирующая киназа (САК), о которой речь пойдет ниже [3], [5].
Ингибиторы циклинзависимых киназ
Помимо циклинов, на циклинзависимые киназы влияет еще одна группа белков — их ингибиторы (рис. 6) [6]. Их так и называют — ингибиторы циклинзависимых киназ, или (CKI — Cyclin-dependent Kinase Inhibitor). Их тоже делят на два семейства: INK4 и Cip/Kip. Семейство INK4 включает в себя белки p15, p16 и p19. Эта группа ингибиторов связывается с циклинзависимыми киназами 4 и 6 и снижает их сродство к циклинам D-семейства.
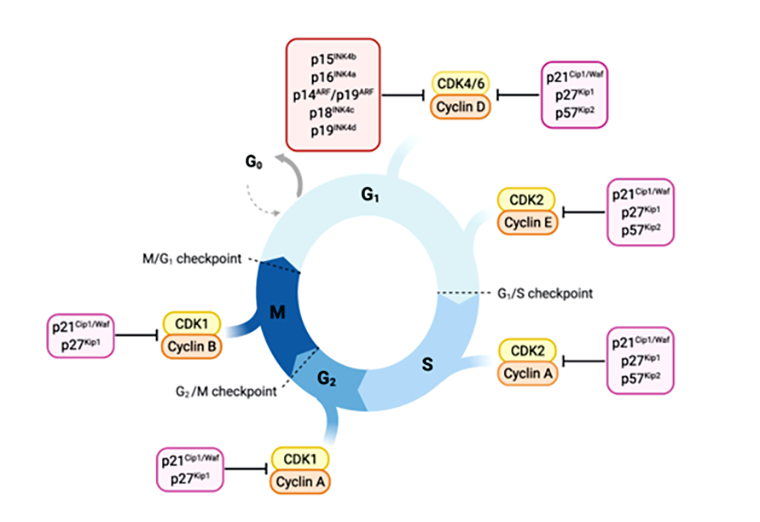
Рисунок 6. Обзор регуляторов клеточного цикла (циклинов, Cdk, ингибиторов и чекпоинтов).
В семейство Cip/Kip входят белки p21, p27 и p57, но действуют они несколько по-разному. Белок p21 предпочтительнее связывается с комплексом Cdk 4/6–циклин D, но при высоких концентрациях в клетке также подавляет активность пар Cdk с циклинами A, B и E. Как вы уже видите, p21 ингибирует основные пары клеточного цикла, что вызывает его остановку на любой фазе. p27 работает иначе. Он связывается с блоком циклина или с активным центром киназы, предотвращая образование комплекса Cdk–циклин или связывание фермента с АТФ. В отношении ингибиторов семейства Cip/Kip существует любопытная особенность. В фосфорилированном состоянии они способны не ингибировать, а активировать циклинзависимую киназу 4 [1], [6].
Зачем же может потребоваться замедлять клеточный цикл — или даже останавливать его? Это необходимо по нескольким причинам. Как вы уже знаете, в клеточном цикле существуют контрольные точки, во время которых замедляются все метаболические процессы, и в клетке происходит «проверка»: все ли в порядке, нет ли ошибок или разрывов в ДНК, соответствует ли состояние клетки фазе, в которой она сейчас находится? Если проверка пройдена успешно, клеточный цикл продолжается, а если найдены ошибки, то специальная система пытается их устранить. При худшем сценарии, в котором ошибку устранить не удалось, в клетке запускается процесс самоликвидации, и она погибает. К слову, система чекпоинтов, наряду с другими механизмами, защищает нас от образования опухолей. Некоторые исследования указывают на положительный эффект от введения этих самых ингибиторов Cdk в опухолевые клетки; их рост замедляется и даже останавливается, что потенциально дает возможность полного излечения [6].
Функции циклинов и Cdk в клетке
Теперь, после всей этой теории, пришло время поговорить наконец о том, как циклины и циклинзависимые киназы работают в клетке, какую роль они играют в формировании слаженного механизма клеточного цикла. Удобнее всего будет рассмотреть каждую пару Cdk—циклин отдельно. Так и сделаем. Но прежде я познакомлю вас с большой схемой (рис. 7). Она покажется вам страшной, но не пугайтесь. Она — лишь иллюстрация к тому, о чем я буду рассказывать ниже. Вы можете сразу пропустить ее и потом возвращаться и смотреть на нее каждый раз, когда вам захочется. Либо изучить ее сразу и полностью.
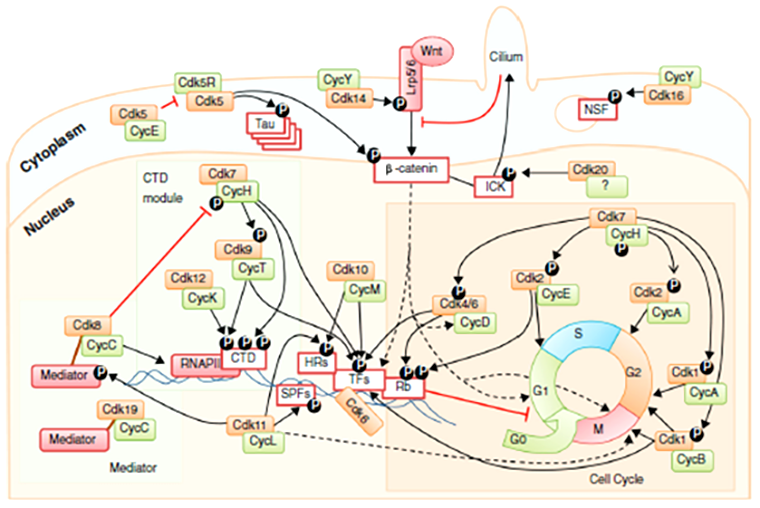
Рисунок 7. Схема функций и взаимодействия циклинов, циклинзависимых киназ и CKI в клетке.
Служащие клеточного цикла
Начнем с пары Cdk 4/6 — циклин D, так как именно с нее и начинается клеточный цикл в ответ на митогенный стимул. Основной субстрат циклинзависимых киназ 4/6 — белок ретинобластомы (pRb). Он подавляет активность фактора транскрипции E2F, который активирует ряд генов, необходимых для входа клетки в G1 фазу. Пока pRb удерживает на себе E2F, клетка находится в фазе покоя. Когда же приходит митогенный сигнал, комплекс Cdk 4/6 — циклин D фосфорилирует pRb, и от него отделяется E2F, который запускает необходимые гены. Так и начинается клеточный цикл.
Далее главная роль переходит к Cdk 2, которая взаимодействует с двумя основными партнерами: циклином A и циклином E. После инактивации белка ретинобластомы включаются гены, ответственные за клеточный цикл. Один из них — ген циклина Е. Произведенный циклин Е активирует циклинзависимую киназу 2, и этот комплекс подключается к фосфорилированию pRb. Это способствует высвобождению и активации все большего количества E2F. В конце концов, максимальное высвобождение фактора транскрипции E2F способствует переходу клетки в синтетическую фазу. Как вы, вероятно, помните из школы, основное событие синтетической фазы — это репликация ДНК. Этот процесс и регулируется комплексом Cdk 2, но уже с циклином А.
Как только завершилось удвоение ДНК, на первый план выходит Cdk 1. Она активируется циклинами А и В и регулирует основные процессы постсинтетической фазы: созревание и расхождение центромер, конденсацию хромосом, разрушение ядерной мембраны и начало митоза.
Однако эта схема взаимодействия циклинов и циклинзависимых киназ очень хрупка (рис. 8). Существуют исследования, способные ее полностью разрушить. Например, при отсутствии Cdk 4 и 6 их функции может выполнить Cdk 2, связавшись с циклином D (что для нее, напомню, не характерно). В отсутствие Cdk 2 связаться с циклином D или E и A может даже Cdk 1. Единственная незаменимая для клеточного цикла Cdk — первая (Cdk 1). Совсем недавно, в 2020 году, было проведено исследование, согласно которому мышиные эмбрионы нормально росли и развивались без Cdk 2, 3, 4 и 6, но, если удаляли Cdk 1, то они погибали.
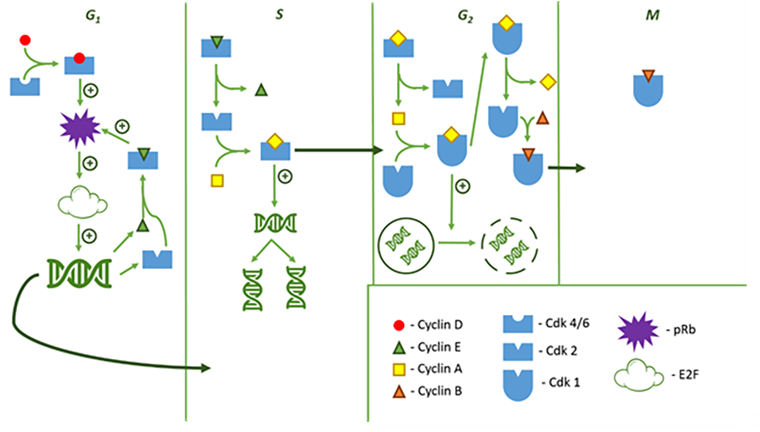
Рисунок 8. Схема взаимодействия регуляторных молекул между собой на протяжении клеточного цикла.
рисунок автора
Отдельно стоит отметить роль циклина H и Cdk 7 (рис. 9). Этот комплекс назван Cdk-активирующим комплексом (CAK), и неспроста. Его функция, как вы уже, вероятно, догадались — фосфорилирование самих циклинзависимых киназ. Поэтому, в отличие от других Cdk или циклинов, имеющих отношение к клеточному циклу, концентрации циклина H и Cdk 7 практически неизменны на протяжении всего цикла [3], [7], [8].
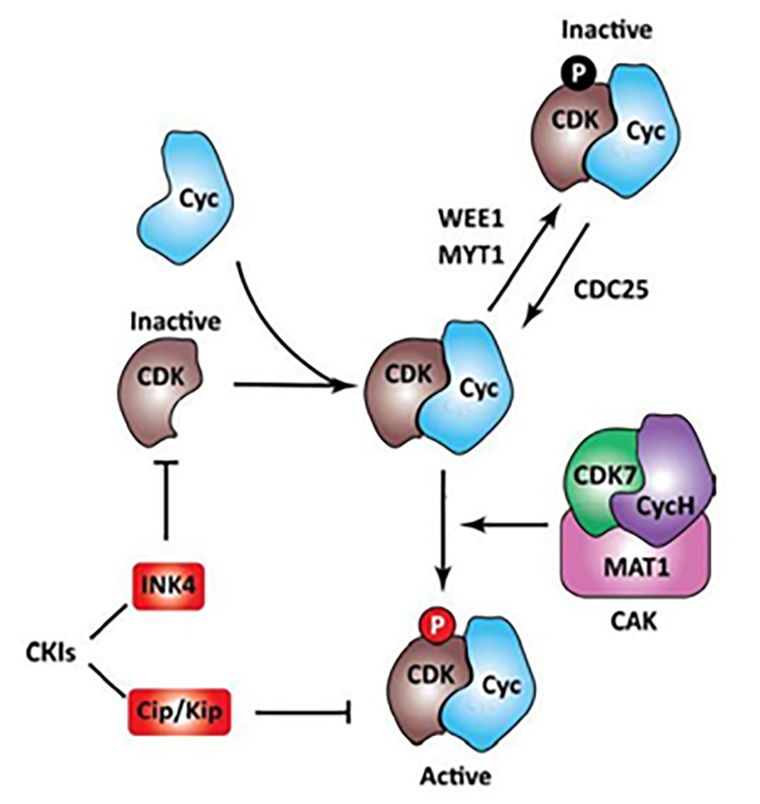
Рисунок 9. Схема работы циклинзависимых киназ. CDK — циклинзависимая киназа, CYC — циклин, CKIs — ингибиторы киназ, CAK — Cdk-активирующая киназа.
Транскрипционные Cdk — регуляторы «печатного станка» клетки
Основной задачей транскрипционных Cdk является обратимое фосфорилирование РНК полимеразы II. Фосфорилируют они не всю молекулу, а только так называемый C-терминальный домен (CTD). Он представляет собой некий «хвост» из повторяющихся аминокислот (Тир-Сер-Про-Тре-Сер-Про-Сер, и такой блок повторяется у млекопитающих около 52 раз). CTD — это такой «тумблер», который позволяет циклинам и Cdk «переключать» РНК полимеразу II между гипофосфорилированной формой (способной прикрепляться к преинициаторному комплексу для начала транскрипции) и гиперфосфорилированной формой (способной удлинять создаваемую молекулу РНК). CTD фосфорилируют Cdk 9 — циклин Т (этот комплекс активируется уже знакомым нам CAK) и Cdk 12 — циклин K. При этом комплекс Cdk 7–циклин H не только активирует Cdk 9, но и сам участвует в фосфорилировании CTD.
Работа РНК полимеразы II зависит не только от Cdk, но и от множества других факторов транскрипции. Cdk 8 и его «родственник» — Cdk 19 — образуют с циклином C часть большого мультисубъединичного медиаторного комплекса [9]. Медиатор как раз и связывает ген-специфичные активаторы с механизмом РНК полимеразы II. Он координирует почти все процессы транскрипции (перевода ДНК в РНК) между собой, а также с изменениями организации хроматина [3].
Митохондриальные Cdk
Митохондрии — это маленькие энергетические станции внутри клетки. Они имеют две мембраны (в то время как большинство других органоидов имеет только одну) и собственную маленькую ДНК. Некоторые ученые даже предполагают, что митохондрии раньше были отдельными бактериями, но однажды они, вместе с ядерной клеткой, решили жить вместе, помогая друг другу [10]. Эволюционно сложилось так, что ядерная ДНК главнее митохондриальной. В ядерную перебралась большая часть генов митохондрии. Вот смотрите, митохондрия может самостоятельно синтезировать себе только 13 белков. Это составляет около 1% от общей потребности митохондрии. Где же гены всех остальных белков? Правильно, в ядре. Но это нисколько не зависимость. Клетка «упрощает» жизнь митохондрии, снабжая ее необходимыми белками, а взамен та синтезирует большую часть энергии АТФ.
Но, чтобы работа была слаженной, партнеры должны знать о потребностях друг друга. Ядру необходима информация о том, какие белки и в каком количестве нужны митохондрии. А митохондрия — сколько энергии требуется клетке. Поэтому существует целая система «общения» между этим органоидом и клеткой. Существует целый ряд «языков», на которых митохондрия «общается» с ядром: активные формы кислорода, метаболиты цикла Кребса (это такой цикл, который завершает окисление глюкозы), протеостаз (баланс между распадом и синтезом белков) и так далее [11]. В том числе и циклины. В ходе многочисленных исследований выяснилось, что к митохондрии имеют отношение два комплекса: Cdk 1—циклин B и Cdk 4–циклин D.
Циклинзависимая киназа 4 регулирует деятельность марганец-зависимой супероксиддисмутазы (MnSOD). Сейчас все объясню. Супероксиддисмутаза — это такой фермент, который присутствует почти в каждой клетке, и его задача — нейтрализация активных форм кислорода (АФК). Дело в том, что митохондрия в ходе образования АТФ работает с кислородом и электронами. Иногда кислород с электроном «убегает» от митохондрии. Кислород с лишним электроном — это очень сильный окислитель и очень опасный атом для клетки. Он может пойти куда не надо и окислить то, что не надо (например, ДНК или клеточную мембрану, или что-то еще). Вот такие «сбежавшие» активные формы кислорода и обезвреживает супероксиддисмутаза. Она «забирает» у них электрон на какой-нибудь металл. Обычно это либо железо, либо медь, либо цинк, либо, как в этом случае — марганец.
Так вот, комплекс Cdk4–циклин D и регулирует работу этого фермента (точнее — активирует его). Как именно, пока до конца не понятно. Но, когда клетки специально облучали радиацией, искусственно повышая количество АФК, то наблюдалось и увеличение числа молекул циклинзависимой киназы 4 и циклина D. С другой стороны, в клетках с поврежденным геном циклина D или Cdk 4 после облучения обнаруживали большое количество митохондриальных супероксидов и сниженный митохондриальный потенциал (большинство электронов «убегало» с кислородом) [12].
Другой важный комплекс для митохондрии — Cdk1–циклин B. Он помогает митохондрии координировать процессы деления и слияния. Раз у митохондрии, скорее всего, бактериальное прошлое, у нее есть своя ДНК и вторая мембрана, то и делится она сама, немного отдельно от всей клетки. Митохондрии способны к самостоятельному бинарному делению (как и бактерии). И делают они это вне зависимости от фазы клеточного цикла. С другой стороны, митохондрии способны и сливаться, образуя из двух маленьких одну большую органеллу. Поддержание оптимального баланса между делением и слиянием имеет решающее значение для поддержания динамики митохондриальных мембран, стабильности синтеза энергии АТФ и для различных клеточных функций. События слияния осуществляются митохондриальной трансмембранной ГТФазой, известной как митофузин (Mfn), тогда как динамин-родственный белок 1 (DRP1) отвечает за события деления митохондрий. Вы спросите, а где же здесь циклины? Они регулируют активность DRP1. Этот белок имеет целых пять мест, в которых его можно фосфорилировать. За два из них отвечает комплекс Cdk1–циклин B. При фосфорилировании DRP1 направляется из цитоплазмы к мембране митохондрии и взаимодействует там с рецептором, который называется митохондриальным фактором деления (MFF). Этот рецептор запускает в органелле каскад реакций, в результате которых она делится на две. Что касается процессов объединения, то здесь циклины участвуют лишь опосредованно. Активный DRP1 (фактор разделения) подавляет Mfn (фактор объединения). Иными словами, всегда, когда не происходит деления, митохондрии стремятся слиться.
Помимо этого, комплекс Cdk1–циклин B участвует в двух других, не менее важных процессах. Во-первых, апоптоз. Как вы, вероятно, знаете, апоптоз — это один из путей запрограммированной гибели клетки. Она может запуститься по разным причинам, и в этом процессе могут участвовать разные органоиды. Митохондрии участвуют в одном из путей реализации апоптоза. В результате каскада реакций в мембране митохондрии формируются поры, из которых выходит содержимое органоида — ферменты окислительной цепи, метаболиты цикла Кребса, активные формы кислорода. Так вот, многие исследования сообщают, что Cdk1–циклин B способны подавить этот процесс. Они фосфорилируют про- и антиапоптические белки, ингибируя тем самым первые и активируя вторые. Напомню, что основная функция апоптоза в человеческом организме — это защита от образования опухолей. Во многих видах раковых образований ученые обнаруживают повышенную концентрацию циклина B и гиперактивной Cdk1 (рис. 10) [13].
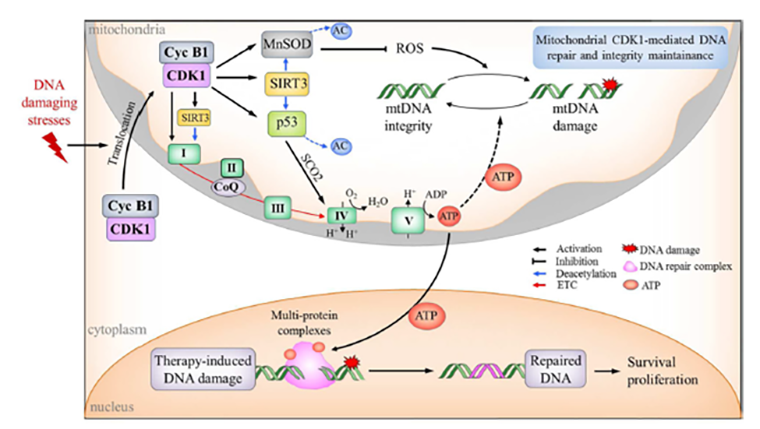
Рисунок 10. Взаимодействие митохондрии и ядра при репарации ДНК с помощью комплекса Cdk 1–циклин B.
Второе явление, в котором непосредственное участие принимает комплекс циклинзависимой киназы 1 с циклином B — это репарация (починка) ДНК. Это очень энергозатратный механизм, который не требует отлагательств. Если в клетке повреждена ДНК, то ее либо чинят в кратчайшие сроки, либо запускается апоптоз. Но как «сообщить» митохондрии, что требуется внеочередная большая «порция» энергии? Тоже с помощью циклинов. В митохондрию направляется ряд белков, реагирующих на стресс: Cdk1–циклин B, Cdk4—циклин D и сурвивин. Как мы уже знаем, комплекс с циклином D необходим для активации MnSOD, чтобы оперативно удалить все активные формы кислорода. А пара Cdk1–циклин B, как оказалось, нужна, чтобы «подстегнуть» образование АТФ. Она активирует белок C-I [13]. Дыхательная цепь митохондрии, на которой образуется АТФ, состоит из четырех белков: С-I–C-IV. Так вот C-I и запускает электрон в транспортную цепь. В норме именно он регулирует скорость образования АТФ. И циклинзависимая киназа фосфорилирует те белки, которые сейчас не работают, «включая» их и запуская новые и новые цепи переноса электронов для образования АТФ.
«Белые вороны в толпе», или атипичные Cdk
Не все Cdk в клетке взаимодействуют с циклинами. Существуют так называемые атипичные Cdk, которые активируются какими-то другими белками. Прототипом таких ферментов является Cdk5 (рис. 11). Эта киназа активируется нециклиновыми белками Cdk5R1 (p35) или Cdk5R2 (p39), и для ее активации не требуется фосфорилирование в Т-петле. Несмотря на свою «атипичность», циклинзависимая киназа 5 присутствует во многих тканях и клетках человеческого организма, регулируя там различные функции. Подавление выделения инсулина в β-клетках поджелудочной железы, снижение подвижности клеток в мышцах, стимулирование образования нейрофиламентов в нейронах, регуляция роста нейронов (активация или подавление конуса роста), образование лимфатических сосудов и т.д. [14].
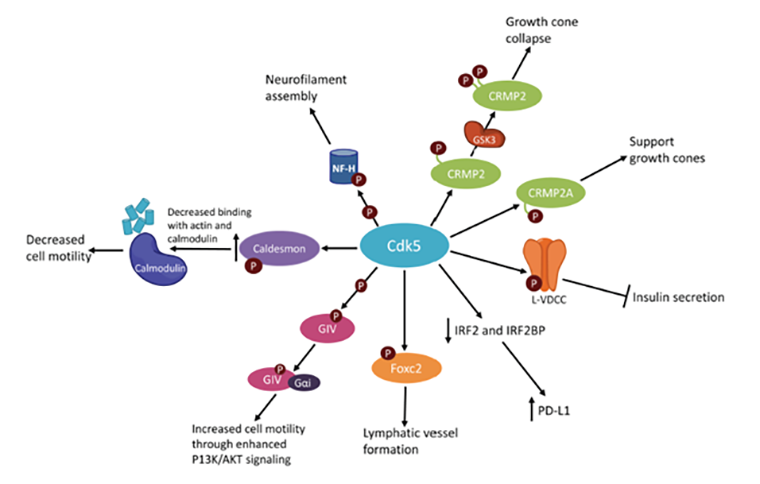
Рисунок 14. Схема функций Cdk 5 в клетке.
Заключение
Итак, в этой статье мы с вами рассмотрели молекулы, регулирующие клеточный цикл (и не только). Циклины, циклинзависимые киназы, ингибиторы Cdk — они выполняют множество функций и регулируют большинство процессов в клетке. Деление, дифференцировка, синтез белков, защита от окисления, репарация ДНК, защита от образования опухолей. Можно перечислять долго. Неудивительно, что эта тема популярна среди биологов и медиков всего мира. Столь большой список функций наталкивает на мысль: «А может, эти молекулы, можно использовать, чтобы искусственно влиять на некоторые процессы в клетке?» Да, это верно. Множество исследований сейчас говорит об эффективности применения циклинов или, что гораздо чаще, CKI для лечения в разных областях медицины. Неврология, онкология, травматология — это лишь верхушка айсберга возможностей применения циклинов (или Cdk, или CKI).
Литература
- Alisha Shaikh, Austin A. Wesner, Mohanad Abuhattab, Raman G. Kutty, Priyatha Premnath. (2023). Cell cycle regulators and bone: development and regeneration. Cell Biosci. 13;
- Процессы и эпигеном;
- Marcos Malumbres. (2014). Cyclin-dependent kinases. Genome Biol. 15, 122;
- Zhaowu Ma, Yuliang Wu, Jialu Jin, Jun Yan, Shuzhen Kuang, et. al.. (2013). Phylogenetic analysis reveals the evolution and diversification of cyclins in eukaryotes. Molecular Phylogenetics and Evolution. 66, 1002-1010;
- T. Takaki, A. Echalier, N. R. Brown, T. Hunt, J. A. Endicott, M. E. M. Noble. (2009). The structure of CDK4/cyclin D3 has implications for models of CDK activation. Proc. Natl. Acad. Sci. U.S.A.. 106, 4171-4176;
- Alessia Schirripa, Veronika Sexl, Karoline Kollmann. (2022). Cyclin-dependent kinase inhibitors in malignant hematopoiesis. Front. Oncol.. 12;
- Elisa Ventura, Antonio Giordano. (2019). Cell Cycle. Reference Module in Life Sciences;
- Joseph Y. Ong, Jorge Z. Torres. (2019). Dissecting the mechanisms of cell division. Journal of Biological Chemistry. 294, 11382-11390;
- Jonas O.P. Carlsten, Xuefeng Zhu, Claes M. Gustafsson. (2013). The multitalented Mediator complex. Trends in Biochemical Sciences. 38, 531-537;
- Как появились митохондрии (рассказ, похожий на сказку);
- Молодость в энергии;
- Cuihong Jin, Lili Qin, Yan Shi, Demet Candas, Ming Fan, et. al.. (2015). CDK4-mediated MnSOD activation and mitochondrial homeostasis in radioadaptive protection. Free Radical Biology and Medicine. 81, 77-87;
- Zhaoqing Wang, Ming Fan, Demet Candas, Tie-Qiao Zhang, Lili Qin, et. al.. (2014). Cyclin B1/Cdk1 Coordinates Mitochondrial Respiration for Cell-Cycle G2/M Progression. Developmental Cell. 29, 217-232;
- Alison Shupp, Mathew C. Casimiro, Richard G. Pestell. (2017). Biological functions of CDK5 and potential CDK5 targeted clinical treatments. Oncotarget. 8, 17373-17382.