Вирусы-платформы: яд во благо
05 октября 2012
Вирусы-платформы: яд во благо
- 8893
- 1
- 5
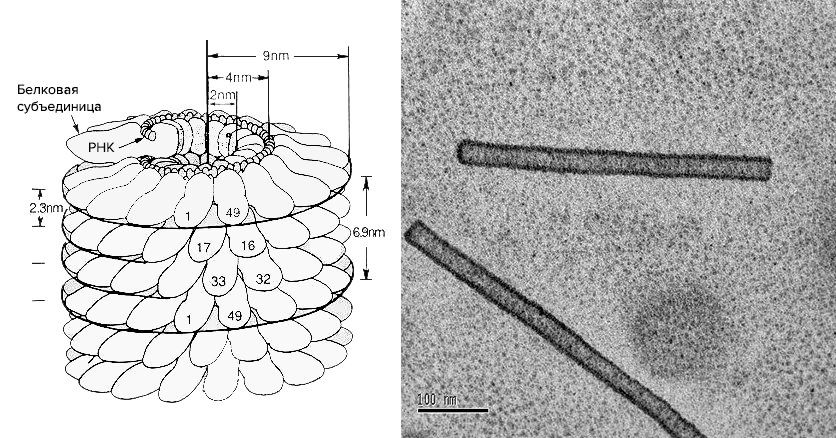
Вирус гриппа с подковообразными палладиевыми наночастицами (ПНЧ) на гемагглютинине. (Не обольщайтесь — это первоапрельская шутка китайских ученых).
«Нанометр»
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Термин «вирус» в переводе с латинского означает «яд». Достаточно одного упоминания этого слова, чтобы напугать неискушенного в биологии человека. Действительно, эти крошечные создания каждый день будоражат сознание многих жителей нашей планеты. И не зря: от разных форм вируса гриппа в мире ежегодно умирает более 250 тысяч, а от СПИДа — более миллиона человек. К сожалению, подобный стереотип боязни вирусов сложился у населения Земли давно и вряд ли когда-либо пропадет. Данная статья призвана доказать, что «не так страшен вирус, как его малюют». Причем акцент сделан на конкретном аспекте этой проблемы: использовании вирусов как матриц (платформ) для создания принципиально новых материалов. Иными словами, речь пойдет о вирусной нанотехнологии.
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
О нанотехнологии (в качестве введения)
Большинство современных (и не очень) книг, обзоров, статей и даже новостей, в которых упоминается слово «нанотехнология», начинается с толкования (которых, вообще говоря, вагон и маленькая тележка) и истории этого термина. Не буду отступать от этого принципа и скажу пару слов об этой области науки.
Несмотря на то, что рождение этого термина обычно связывают с именем знаменитого физика Ричарда Фейнмана (имевшего также пристрастие к биологическим исследованиям), а именно с его речью There’s Plenty of Room at The Bottom: An Invitation to Enter a New Field of Physics («Там внизу много места: приглашение в новый мир физики») на рождественском обеде Американского физического общества 29 декабря 1959 года, на самом деле, впервые это слово употребил японский физик Норио Танигути в 1974 году применительно к субмикронным структурам (т.е. с размерами в доли микрона и меньше) [1]:
„Нанотехнология“ — это производственная высокоточная технология получения структур с очень маленькими размерами, т.е. в основе этой технологии лежат высокая точность и размеры порядка 1 нм (нанометр, 10−9 м) в длину... „Нанотехнология“ главным образом включает в себя процессы разделения, соединения и деформации материалов атом за атомом или молекула за молекулой.
Нанотехнология — от греческих слов νανος (карлик), τεχνη (искусство) и λογος (учение) — создание и использование материалов, устройств и систем, структура которых реализуется в нанометровом диапазоне (от долей нанометра до 100 нм). Следует отметить, что один нанометр, равный 10−9 метра, практически сопоставим с диаметром атома водорода — примерно 1 Å (1 ангстрем = 10−10 метра). То есть, нанотехнологи оперируют фактически с атомными и молекулярными структурами. На рис. 1 представлена размерная иерархия, из которой видно, насколько небольшим кажется нам, макроскопическим существам, этот нанодиапазон, несмотря на его богатство и красоту.
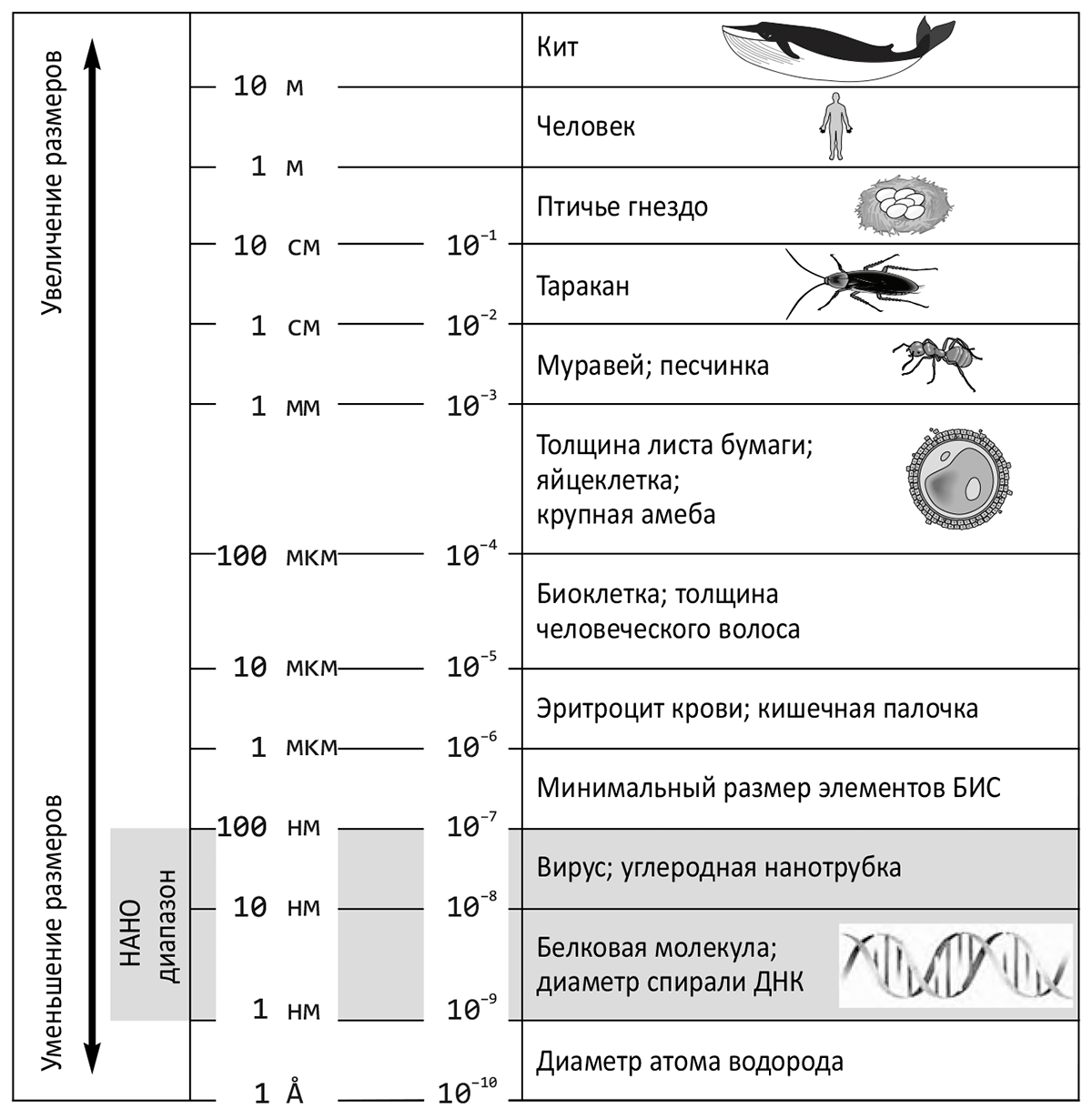
Рисунок 1. Место наноразмерных объектов в окружающем нас мире
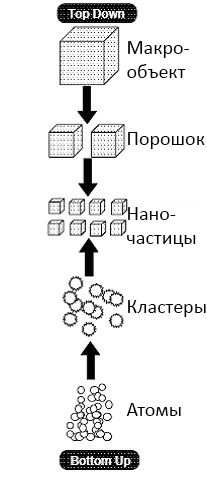
Рисунок 2. Схема построения наноструктур «сверху вниз» и «снизу вверх»
Suneel S.D. Nanotechnology
Приставки «нано-» и «био-» неразрывно связаны между собой, особенно если дело касается молекулярной и клеточной биологии, вирусологии, генетики, биохимии и т.п. Биомолекулы, вирусы, клеточные органеллы и другие надмолекулярные биоструктуры можно считать, таким образом, объектами нанотехнологии [3].
В нанотехнологии существует два основных подхода к созданию наноматериалов и наноструктур: сверху вниз (top–down) и снизу вверх (bottom–up) (рис. 2). Первая группа методов ставит своей целью расщепление или последовательное разрезание (диспергирование) исходного материала для получения наноразмерных частиц из него. Второй подход призван, наоборот, «возводить» наноструктуры последовательно, как здание, начиная с фундамента: атом за атомом, молекула за молекулой, кластер за кластером.
Впервые на стратегию снизу вверх обратил внимание известный американский нанотехнолог Эрик Дрекслер, выпустивший в 1986 году свою первую книгу «Машины создания: пришествие эры нанотехнологии». В отличие от традиционного технологического подхода сверху вниз, Дрекслер подчеркивал важность принципа снизу вверх, имея в виду атомную и молекулярную сборку.
Опять же, возвращаясь к биологии, нужно упомянуть о таких важных свойствах биополимеров и надмолекулярных структур, как способность при определенных условиях самопроизвольно и обратимо собираться в молекулярные комплексы (самосборка). Вирусные частицы также способны к самосборке. То есть, бионаночастицы при разных обстоятельствах могут формироваться как по принципу сверху вниз, так и по принципу снизу вверх. Но в природе, в отличие от человеческой технологии, метод «от малого к большому» более естественен и традиционен. Сборка биоструктур основана чаще не на исходных молекулярных матрицах, а на процессах самоорганизации.
«Нанобио-» и «бионано-» — почувствуй разницу!
Теперь, когда путь от нанотехнологии к нанобиологии намечен, следует обсудить некоторые терминологические нюансы в этой сфере нанотехнологии. Многие современные биологи часто употребляют слова «нанобиотехнология» и «бионанотехнология». Между тем, разница между ними в последнее время становится все более ощутимой.
Под нанобиотехнологией стоит понимать применение нанотехнологических приемов для развития и улучшения биотехнологических методов и продуктов. К этой области можно отнести, например, наносенсоры [4], работающие в реальном времени, наноразмерные матрицы для контроля над производством лекарств, тканевую инженерию и репарацию тканей, нанороботов.
Бионанотехнология — это использование биологических строительных блоков, а также биологических специфичности и активности в развивающейся нанотехнологии. В будущем бионанотехнология позволит, к примеру, модифицировать ДНК, белки и т.д. для нужд наноэлектроники и наноэлектрохимии.
Иными словами, нанобиотехнология — это использование нанонаук для решения биологических задач, а бионанотехнология подразумевает применение биологических сборок для решения разнообразных проблем (рис. 3).
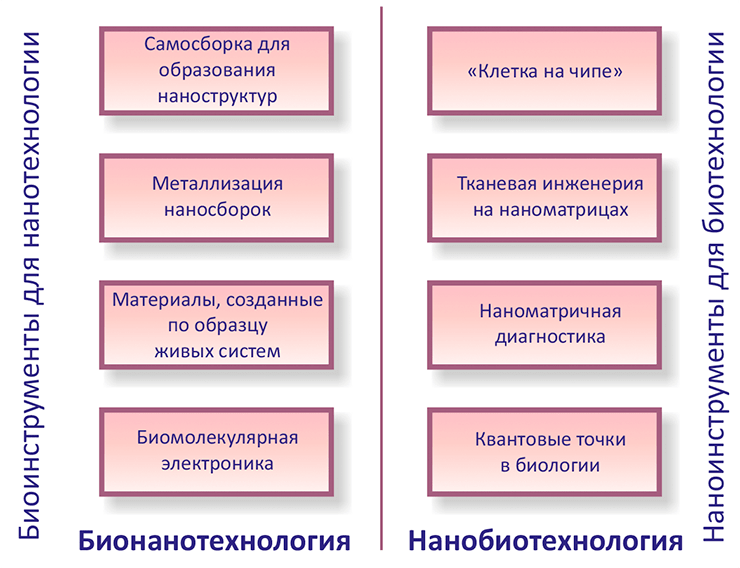
Рисунок 3. Вот для чего нужны нанобио- и бионанотехнологии
Гость из наномира: мал, да удал!
Пришло время поговорить о вирусах. Сейчас слово «вирус» у всех на слуху, но ассоциации разные: инфекция, грипп, реклама «Арбидола», СПИД, Антивирус Касперского, «неужели я заболел!!!», неклеточная форма жизни... Не много, я думаю, можно встретить на улице людей, у которых бы термин «вирус» вызывал позитивные эмоции. Однако я постараюсь убедить как можно больше людей в том, что не так страшен вирус и что он может стать верным союзником в борьбе с огромным числом людских проблем, в том числе и медицинских. Но об этом позже. Сейчас — небольшая справка об этих созданиях (о процессе инфицирования я говорить не буду, т.к. про него очень подробно написано во многих учебниках и в интернете).
Вирусы — это субмикроскопические (20–400+ нм в диаметре) неклеточные объекты, геномы которых состоят из нуклеиновой кислоты и которые реплицируются в живых клетках. Используя их (клеток) синтетический аппарат, они вызывают синтез специализированных структур, способных переносить вирусный геном в другие клетки.
Несмотря на «неклеточность», существование вирусов не противоречит постулату клеточной теории (который до сих пор актуален) «Вне клетки жизни нет», поскольку они не могут размножаться, не проникнув в живую клетку.
Вирусы обладают всем разнообразием нуклеиновых кислот. Этот факт заложен в классификацию, впервые предложенную американским биологом, лауреатом Нобелевской премии Дэвидом Балтимором в 1971 году. В центре этой классификации — вирусная информационная, или матричная, РНК (мРНК), которой Балтимор приписал позитивную (+) полярность. Также к позитивным нуклеиновым кислотам относятся РНК и ДНК с полярностью мРНК. Цепи, комплементарные мРНК, имеют негативную полярность (−). В результате Балтимор разделил вирусы на шесть классов. Позднее, в 1974 году, данная система была модифицирована Вадимом Израилевичем Аголом, профессором кафедры вирусологии биологического факультета МГУ [6]. Главным «нововведением» в классификацию Балтимора являются ДНК-вирусы со стадией синтеза ДНК на матрице РНК в своем цикле (ретроидные вирусы, или параретровирусы, в том числе знаменитый вирус гепатита B). И вот что получилось (рис. 4).

Рисунок 4. Классификация вирусов по В.И. Аголу. Серые стрелки — репликация, розовые — транскрипция, серо-черные — обратная транскрипция ретро- и ретроидных вирусов; розовый шрифт — интермедиаты (промежуточные вещества), черный шрифт в рамке — вирусные геномы; онДНК — однонитевая ДНК.
В конечном итоге, в Википедии можно найти современную классификацию вирусов с точки зрения генома, которая названа «классификацией вирусов по Балтимору», хотя это ее модифицированный вариант:
- Вирусы, содержащие двуцепочечную ДНК и не имеющие РНК-стадии.
- Вирусы, содержащие двуцепочечную РНК.
- Вирусы, содержащие одноцепочечную молекулу ДНК.
- Вирусы, содержащие одноцепочечную молекулу РНК положительной полярности.
- Вирусы, содержащие одноцепочечную молекулу РНК негативной или двойной полярности.
- Вирусы, содержащие одноцепочечную молекулу РНК и имеющие в своем жизненном цикле стадию синтеза ДНК на матрице РНК, ретровирусы.
- Вирусы, содержащие двуцепочечную ДНК и имеющие в своём жизненном цикле стадию синтеза ДНК на матрице РНК, ретроидные вирусы.
Интересно то, что это еще не все. Дело осложняется тем, что геном вирусов может быть сегментированным и несегментированным, нуклеиновые кислоты могут быть как кольцевыми, так и линейными, с разрывами в одной из цепей или без них. Более того, кольцевая двуцепочечная ДНК вирусов может иметь т.н. суперспиральные витки, как, например, у вируса мозаики цветной капусты.
Но и это еще не все. Вирусные частицы — вирионы — имеют капсид (от лат. capsa — ящик), т.е. белковую оболочку, обеспечивающую защиту генетического материала и его проникновение в клетку (у безоболочечных вирусов преимущественно). Другими словами, вирус — особый вид нуклеопротеида, т.е. комплекс нуклеиновой кислоты и белка. Структурными единицами капсида являются белковые субъединицы (протомеры), каждая из которых является одной или несколькими полипептидными молекулами одного или нескольких видов. Капсид + нуклеиновая кислота (НК) = нуклеокапсид. НК может быть окружен кором (от англ. core — ядро) — внутренней белковой оболочкой, примыкающей к НК. Форма капсидов разнообразна, но по сути своей все это многообразие сводится к четырем типам симметрии:
- Спиральная симметрия.
- Кубическая (икосаэдрическая, квазисферическая) симметрия.
- Смешанный тип симметрии.
- Без определенной симметрии.
У первого типа субъединицы расположены в виде спирали, нуклеиновая кислота (чаще РНК) имеет вид пружины, располагаясь между витками белковых молекул. Классическим примером такого вируса является вирус табачной мозаики (ВТМ), о котором впоследствии будет не раз упомянуто. Вирусы с подобной симметрией «голые», т.е. не имеют дополнительного внешнего белкового чехла, что обусловлено большой длиной вируса (палочко- или нитевидного) (рис. 5). А это требует много белка, который для вирусов на дороге не валяется.
У вирусов с икосаэдрической симметрии субъединицы расположены в виде правильного икосаэдра вокруг ДНК или РНК, скрученной в клубок. Простейший икосаэдрический капсид можно встретить, скажем, у сателлитного вируса некроза табака [8]. (Слово «сателлит» означает, что вирус не может строить свой капсид без поддержки вируса некроза табака, обеспечивающего репликацию, которую СВНТ в клетке не осуществляет.) Каждая его «грань» состоит из трех субъединиц.
Помимо простейшего икосаэдра в основе формы капсида может лежать какой-либо сложный икосаэдр с 20T гранями и 60T протомерами, где T — триангуляционный номер (рис. 6). Белковые субъединицы (капсомеры) больших икосаэдрических вирусов для сохранения формы сгруппированы в морфологические (т.е. по внешнему строению) группы, различимые с помощью электронного микроскопа: пентоны в вершинах (5 субъединиц) и гексоны на гранях (6 субъединиц) (рис. 6).
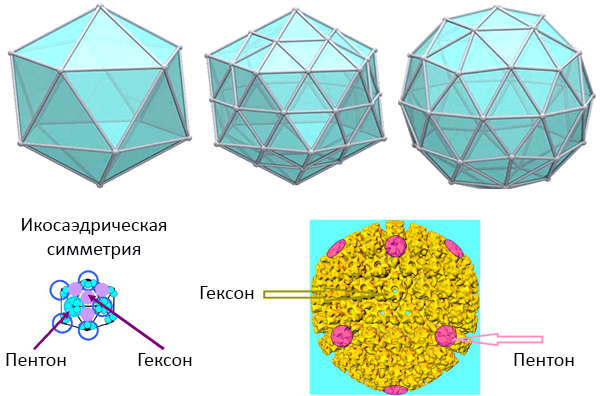
Рисунок 6. Икосаэдрическая симметрия. Сверху: Икосаэдрические многогранники. Снизу слева: капсомеры простейшего икосаэдрического вируса. Снизу справа: нуклеокапсид вируса герпеса.
К третьему типу симметрии можно отнести всем известный со школы Т-четный бактериофаг Т4 (рис. 7). Его головка представляет из себя икосаэдр с ДНК (которая, как иногда говорят, «инкапсидирована» в головке), полый внутри хвост имеет спиральную симметрию (и может сокращаться при взаимодействии с клеткой-хозяином — это является главным отличием Т-четных фагов от нечетных). У основания имеется базальная пластинка (с выступами) и хвостовые белковые отростки (фибриллы). В районе т.н. шейки находится воротничок из «усиков» — фибрилл, необходимых для крепления к ним хвостовых нитей в покое. (И воротничок, и шейка имеют гексагональную симметрию.)
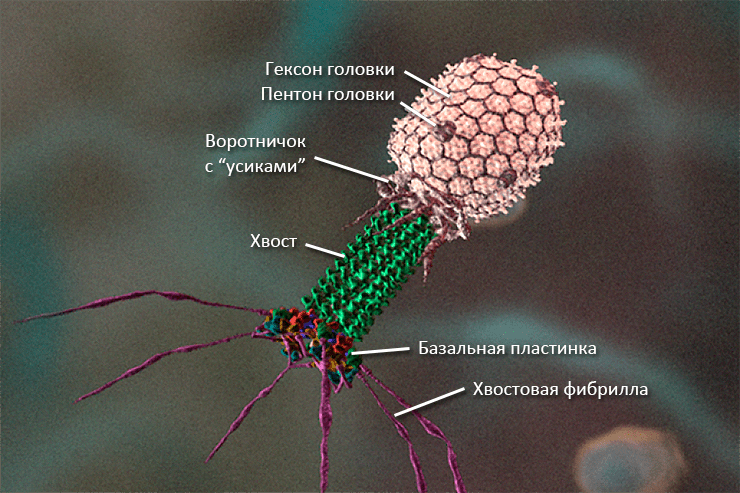
Рисунок 7. Электронная микрофотография фага Т4
Вирус осповакцины (рис. 8) относится к последнему типу. Центральная часть называется сердцевиной, она имеет вид двояковогнутой линзы и окружена гладкой мембраной. Вогнутость ей придают латеральные (боковые) тела, содержащие разнообразные ферменты для вирусной репликации. Вирион окружен липопротеиновой оболочкой, которую одни ученые считают двумя близко расположенными бислойными липидными мембранами, а другие — одной мембраной. В любом случае, на поверхности этой мембраны видны вирусоспецифические белки и белковые комплексы.
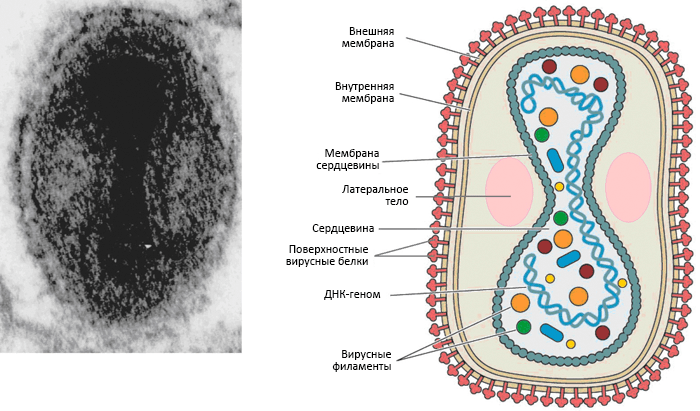
Рисунок 8. Вирус осповакцины. Слева: электронная фотография вируса. Справа: его строение.
Сложные (оболочковые) вирусы имеют дополнительную оболочку — суперкапсид, или пеплос (так иногда называют наружную часть суперкапсида), образованную бислойной липидной мембраной клеточного происхождения и специфическими вирусными белками (точнее, гликопротеинами). Гликопротеиновые шипы — пепломеры (от греч. πεπλος — накидка) — являются морфологическими белковыми субъединицами суперкапсида (рис. 9).
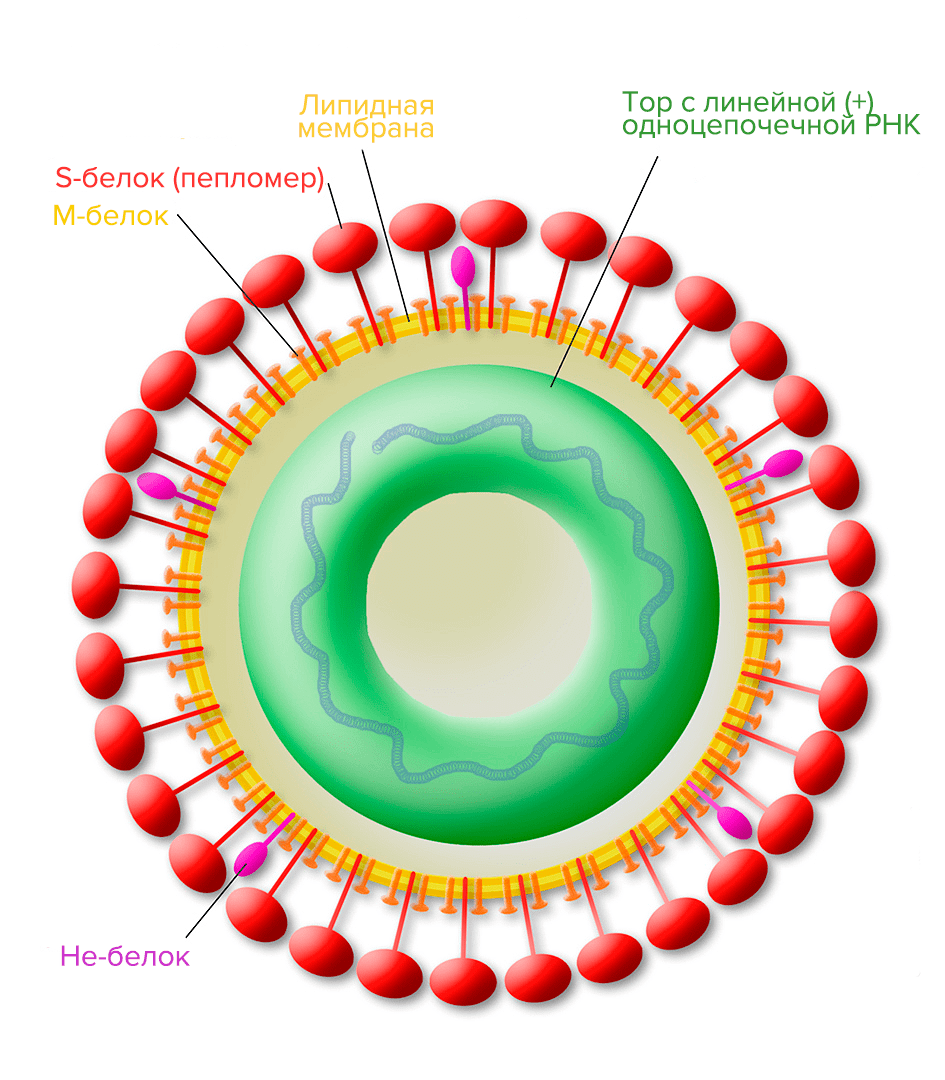
Рисунок 9. Строение торовируса (может вызвать гастроэнтерит — воспаление желудка и кишечника). М-белок — мембранный белок; S-белок — гликопротеиновый шип; He-белок — белковый комплекс гемагглютининэстераза, участвующий в слиянии вируса с клеткой и подавлении иммунных реакций.
Строение и многообразие вирусов можно еще долго обсуждать, но пора переходить к непосредственной теме обзора. Однако напоследок — немножко об одной из главных загадок современной биологии — о происхождении вирусов.
Существует три основные гипотезы (даже группы гипотез) возникновения вирусов [9]:
- Гипотеза «virus-first» говорит о том, что вирусы имеют доклеточное происхождение (доклеточные генетические элементы), и позднее они эволюционировали вместе с клетками-хозяевами. Но тот факт, что без клетки вирус не может размножаться, ставит эту теорию под вопрос.
- Согласно гипотезе «escape», вирусы были частью клеточной машинерии и обособились от нее — то есть, это «сбежавшие» гены.
- Гипотеза «reduction» отождествляет вирусы с РНК-содержащими клетками, перешедшими к паразитизму на своих собратьях-клетках, став своеобразными эндосимбионтами (микроорганизмы, живущие внутри хозяина, принося ему пользу). Позднее они потеряли способность к самостоятельной трансляции, превратившись в РНК-вирусы. Причем это событие происходило отдельно для каждого надсемейства вирусов.
В настоящее время количество подобных моделей и их комбинаций увеличилось. В самом общем виде структура эволюционного процесса вирусов отражена на рис. 10. Она объясняет появление вирусов с точки зрения теории «мира РНК», согласно которой «разделение труда» между ДНК (хранение генетической информации) и белком (в первую очередь катализ) произошло позднее, чем считалось ранее [10]. Первоначально возникали короткие самореплицирующиеся молекулы РНК, приобретшие способность катализировать синтез полипептидов. Их называют рибозимы. РНК в паре с пептидом стали более эффективной репликационной системой, катализируя друг друга. Затем на матрице РНК возникла комплементарная ей ДНК, взяв на себя нынешнюю функцию. РНК—белковой стадии соответствует появление РНК-вирусов, использующих свой РНК-геном для синтеза вирусных белков. Позднее появился вышеупомянутый процесс обратной транскрипции и вместе с ним ретровирусы. Согласно этой схеме, ДНК-вирусы являются последней стадией. Следует оговориться, что ретроидные вирусы, видимо, появились на предпоследней стадии — мир РНК и ретро-ДНК.
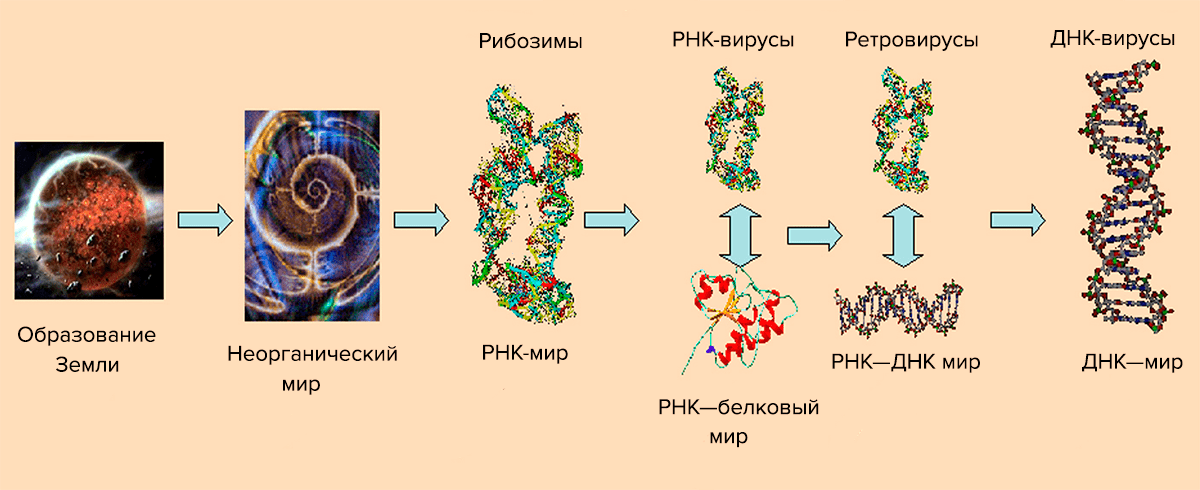
Рисунок 10. Схема эволюции вирусов
Изложенные выше сведения о домене Вирусы позволяют, наконец, перейти к связи этих существ с нанотехнологиями.
Вирус-самобранка, или нанотехнология in vivo
Самосборка вирусных частиц — одно из первых свойств вируса, используемое бионанотехнологами. Самосборка, точнее супрамолекулярная самосборка — это спонтанная ассоциация молекулярных «кирпичиков» посредством межмолекулярных нековалентных взаимодействий (т.е. слабых взаимодействий, не связанных с прямым перекрыванием электронных оболочек атомов). Это обратимое явление, что позволяет «выбирать» наиболее устойчивую структуру и исправлять ошибки в упаковке [11]. В биологических системах это приобретает особенно важный смысл (рис. 11).

Рисунок 11. Модульность и конвергентность биосамосборки. Под модульностью подразумевается возможность структурных единиц объединятся в функционально активные модули, а конвергентность синтеза подразумевает получение конечного вещества из единиц, полученных отдельно по цепочкам последовательных химических превращений.
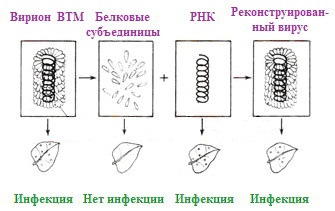
Рисунок 12. Эксперимент Френкеля-Конрата и его коллег, подтверждающий самоорганизацию ВТМ и инфекционную способность вирусной РНК (хоть и меньшую, чем у целого вируса)
Впервые самоорганизация вирусов была продемонстрирована in vitro («в пробирке») на примере ВТМ в 1955 году вирусологами Хайнцем Френкелем-Конратом и Робли Вильямсом, которые открыли самопроизвольную сборку вирионов из инкубируемых очищенных вирусных белков и РНК, а также описали (через 2 года) инфекционность вирусной РНК (рис. 12). Позже работы по восстановлению ВТМ и других спиральных вирусов из препаратов вирусных белка и нативной НК проводились неоднократно.
Конечная структура образуется самопроизвольно, поскольку она выгодна с точки зрения термодинамики, а процесс сборки имеет высокую константу равновесия. Другими словами самосборка - высокоаффинный процесс. Модулями для сборки являются диски из двух белковых слоев (рис. 13). При прохождении петли РНК через отверстие диска он превращается в два витка спирали, на которую «нанизываются» последующие модули. Плюсом такой модульной сборки из идентичных «кирпичиков» является уменьшение генетической информации, необходимой для кодирования этого процесса, т.к. нет необходимости кодировать каждый диск отдельно. Слабость сил, удерживающих всю конструкцию, способствует упомянутой выше обратимости самосборки.
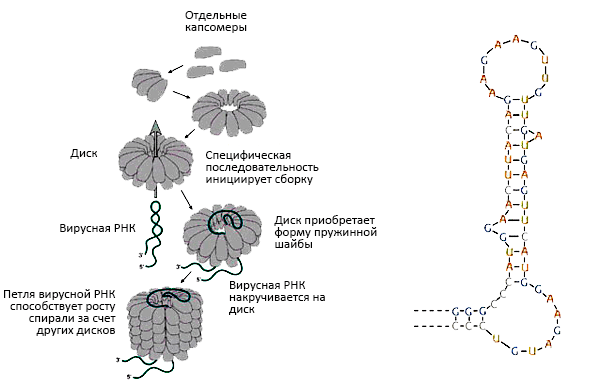
Рисунок 13. Сборка спирального вируса табачной мозаики по типу «путешествующей петли» вирусной РНК. Петля проникает между двумя слоями дисков, обвивается вокруг одного из его витков и продолжает «путешествовать» между слоями спирали, вынуждая другие диски достраиваться на свое место. Справа: петля РНК, инициирующая сборку наночастиц вируса.
Кстати, вышеупомянутый вирусолог Френкель-Конрат и его коллеги по лаборатории поставили также эксперимент по созданию вирусного гибрида, состоявшего из РНК вируса табачной мозаики и белковой «одежки» вируса мозаики подорожника (ВМП) (подорожникового вируса Холмса). Исследователи заразили полученным вирусом табак, из-за чего на его листьях появились характерные повреждения. Они были характерны для РНК-донора, т.е. для ВТМ, а извлеченные из них вирусы имели структуру ВТМ (рис. 14). Мораль сего опыта такова: во-первых, РНК определяет структуру вируса, кодируя его белки, а во-вторых, вирус табачной мозаики является перспективным объектом генноинженерной бионанотехнологии.
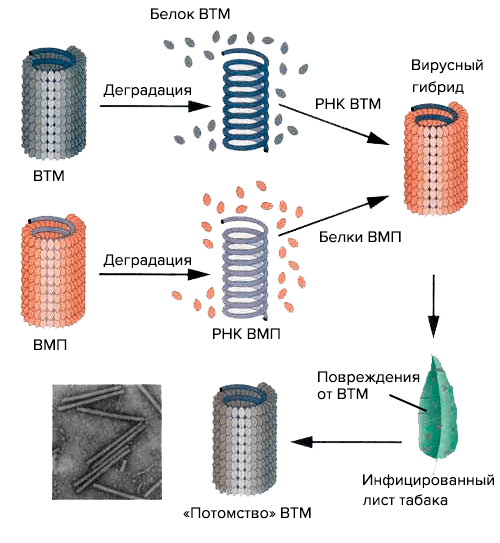
Рисунок 14. Эксперимент Френкеля-Конрата и Сингера по реконструкции вируса-гибрида из компонентов вирусов ВТМ и ВМП
сайт Bio-Siva
Этот классический эксперимент был повторен неоднократно, в том числе и нашими вирусологами с кафедры вирусологии Биологического факультета МГУ во главе с Иосифом Григорьевичем Атабековым. Например, в 2011 году группа профессора И.Г. Атабекова совместно с Группой сканирующей зондовой микроскопии МГУ получили вирусные рибонуклеопротеиды (вРНП) на основе белка оболочки X-вируса картофеля (XВК) и гетерологичных (не нативных) РНК из: потексвирусов (4 вида), тобамовируса (ВТМ) и бромовируса (вирус мозаики костра) [14].
Белки оболочки могут реполимеризоваться (самособираться) и без РНК до спиральных вирусоподобных частиц (ВПЧ) любой длины. Следует учитывать влияние таких факторов, как pH (кислотно-щелочной баланс) и ионная сила раствора, в котором инкубируются строительные компоненты вируса (рис. 15). Хотя условия самосборки считаются мягкими, от их вариаций зависит та или иная стадия этого процесса [15].

Рисунок 15. Влияние pH и ионной силы на агрегацию A-белка. A-белок — небольшие полипептидные агрегаты, на которые распадается оболочка от слабой щелочи.
Стоит упомянуть и о сборке другого типа вирусов — бактериофагов. Рассмотрим его на классическом примере — фаг Т4. Как мы уже знаем, он имеет смешанную спирально-икосаэдрическую симметрию, что сводится к образованию сначала белковых субагрегатов на основании 54 типов белков, а затем и вириона из них. Каков же ход этого процесса (рис. 16) [16], [17]?
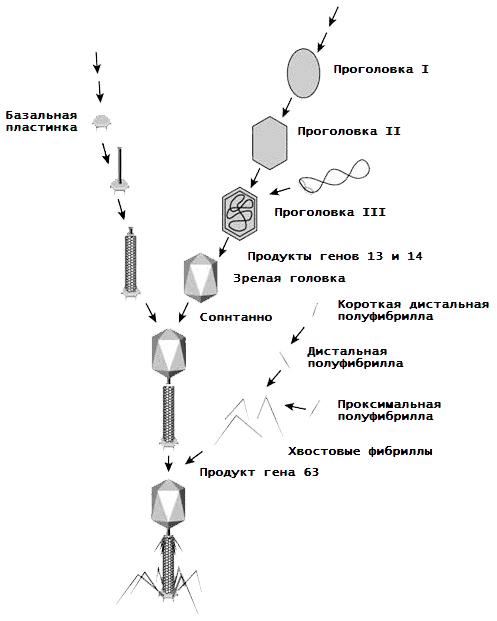
Рисунок 16. Сборка бактериофага T4
- Базальная пластинка (БП) строится из 15 белков, а также из нескольких молекул ферментов и фолиевой кислоты.
- БП служит затравкой к сборке стрежня хвоста вируса, вокруг которого строится спиральный чехол (продукт гена 18).
- Головке бактериофага предшествует проголовка (прокапсид, ДНК- несодержащий предшественник). Она «вырастает» на инициирующем белковом комплексе (портальный белок, коннектор) — додекамере из 12 субъединиц, кодируемых геном 20. Этот комплекс прикреплен к внутренней поверхности цитоплазматической мембраны клетки-хозяина посредством мембранного каркасного белка, и на нем вырастает белковое ядро, служащее «строительными лесами» для прокапсида II. Далее вокруг этой белковой сердцевины группируются пентоны и гексоны из белков gp24 и gp23 (от англ. gene product — продукт гена), сердцевина разрушается, белки gp24 и gp23 модифицируются до gp24* и gp23*, капсид увеличивается и прокапсид II отрывается от мембраны вместе с коннектором.
- Через портальное отверстие белки gp16 и gp17 при участии коннектора и энергетических молекул АТФ упаковывают ДНК в прокапсид. ДНК обрезается в нужном месте, и этот «ящик Пандоры» для бактерий закупоривается пробкой из продуктов генов 13 и 14.
- Головка бактериофага (точнее gp23*) «инкрустируется» сеткой белков HOC и SOC.
- Каждая хвостовая нить соединяется из двух половинок — дистальной (удалена от вириона и длиннее) и проксимальной (ближе к вириону и покороче).
- Голова и хвост вируса самопроизвольно соединяются.
- Хвостовые и воротничковые фибриллы крепятся на свои места (причем хвостовые удерживаются воротничковыми как и положено).
Видео. Анимация, сделанная в лаборатории вирусолога Михаэля Россманна
Находка для Чубайса
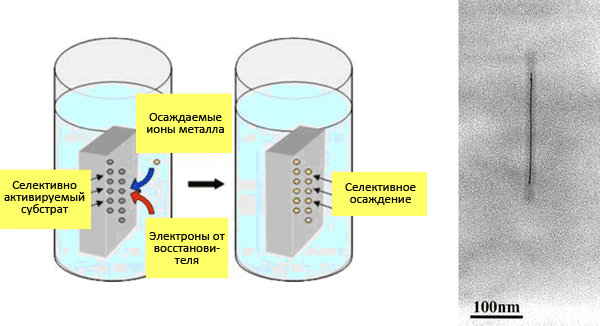
Наночастицы ВТМ похожи на неорганические наноструктуры из различных соединений. Это позволяет рассматривать вирусы как объект неорганического материаловедения. Вирионы используются как матрицы для иммобилизации на них наночастиц металла (например, золота) или металлсодержащих соединений [18]. Одной из первых в этом направлении является работа химика-нанотехнолога Мато Кнеза с коллегами из Института физики микроструктур (Общество имени Макса Планка, ФРГ) по металлизации наночастиц ВТМ для получения «3 нм нанопроволоки» [19]. Подобный синтез, при котором шаблоном для конечного материала является биоструктура, называется биотемплатным (от англ. template — шаблон). Технология осаждения металлов методом химического восстановления используется в промышленности для создания металлических покрытий толщиной микрометры. Непроводящие (ток) поверхности предварительно активируют — покрывают тонким слоем металла (палладия Pd(II) или олова Sn(II)); затем их погружают в осадительную ванну, содержащую ионы металла и восстановитель (который бескорыстно отдает электроны). Активированные поверхности и нарастающий слой металла катализируют осаждение. Вот схема Pd-активации (с автокатализом палладием) осаждения никеля (Ni(II)) с адсорбцией палладия на поверхности (Pd2+адсорб.):

Вирионы инкубировали с солями тетрахлорпалладиевой (PdCl42−) или тетрахлоплатиновой (PtCl42−) кислоты. Наличие диметиламинборана гарантирует образование Pd(II)- или Pt(II)-кластеров. Далее вирионы (вернее белковые агрегаты) следует «искупать» в ванне из восстановителя (диметиламинборана) и кобальта (никеля). Результат — нанопроволоки из вирионов ВТМ диаметром ≈3 нм и длиной микрометры с металлизированным осевым каналом. На рис. 17 показана суть метода и фотография кобальтовой ВТМ-нанопроволоки.
В нынешнем, 2012 году, была опубликована подобная статья, в которой в полость вируса ввели «сплав» кобальта или никеля с железом [20]. Алгоритм тот же, за исключением того, что для металлизации используется водный раствор с ионами Co(II), Fe(II), Ni(II). Более того, ученым было известно, что очистка от фосфатов позволяет ионам более селективно проникать именно в канал ВТМ. В результате, уже в ванне никель добавляется к кобальту, железу и к CoFe, давая нужные соединения (рис. 18). Выяснено, что нанопроволоки с никелем имеют большую устойчивость к коррозии.
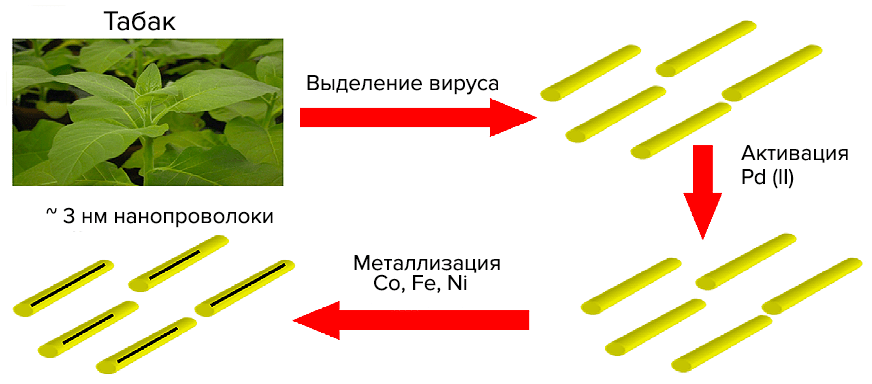
Рисунок 18. Синтез нанопроволок со смешанным «сердечником»
Думаю, ни у кого нет сомнений, что можно металлизировать (или даже можно сказать «магнетизировать») вирус и снаружи. Для доказательства стоит упомянуть работу немецких нанотехнологов (в т.ч. и Мато Кнеза) [21]. В ней ученые приводят целую серию опытов по металлизации вешних стенок и внутреннего канала ВТМ:
- связывание ВТМ уранлил-ионов (UO22+) и ионов рутения (Ru(III)) для визуализации наночастиц при электронной микроскопии;
- декорирование внешней поверхности палладиевыми кластерами и
- электрохимическое осаждение кобальта, никеля и золота на внутренней и внешней поверхностях.
Причем селективное осаждение снаружи объясняется, главным образом, наличием небольшого количества фосфат-ионов, адсорбирующихся на положительно заряженном снаружи вирионе. Следует сказать, что при осаждении золота процессы активации и электрохимического осаждения можно заменить одной стадией — тетрахлороаурат-аскорбиновая ванна (соль золотохлористоводородной кислоты H[AuCl4] + аскорбиновая кислота). Но золото на наночастице ВТМ оседает весьма малоселективно.
Следующим этапом в развитии вирусной наноэлектроники являются микробатарейные электроды [22]. Микробатарея (рис. 19) включает в себя два электрода, разделенные электролитической полостью (электролит — раствор гидроксида калия), ограниченной слоем фоторезиста SU-8 и полученной посредством его облучения через фотошаблон. (Фоторезист — материал, изменяющий свои свойства при облучении светом (УФ в данном случае).) Катод состоит из наночастиц ВТМ, покрытых никелем и скомпонованных на золотом токоприемнике (для создания электрического контакта); анод — цинковая пластинка, полученная методами макро- (не микро-!) техники. Их связывает друг с другом два слоя SU-8. Отверстия в аноде нужны для введения электролита.
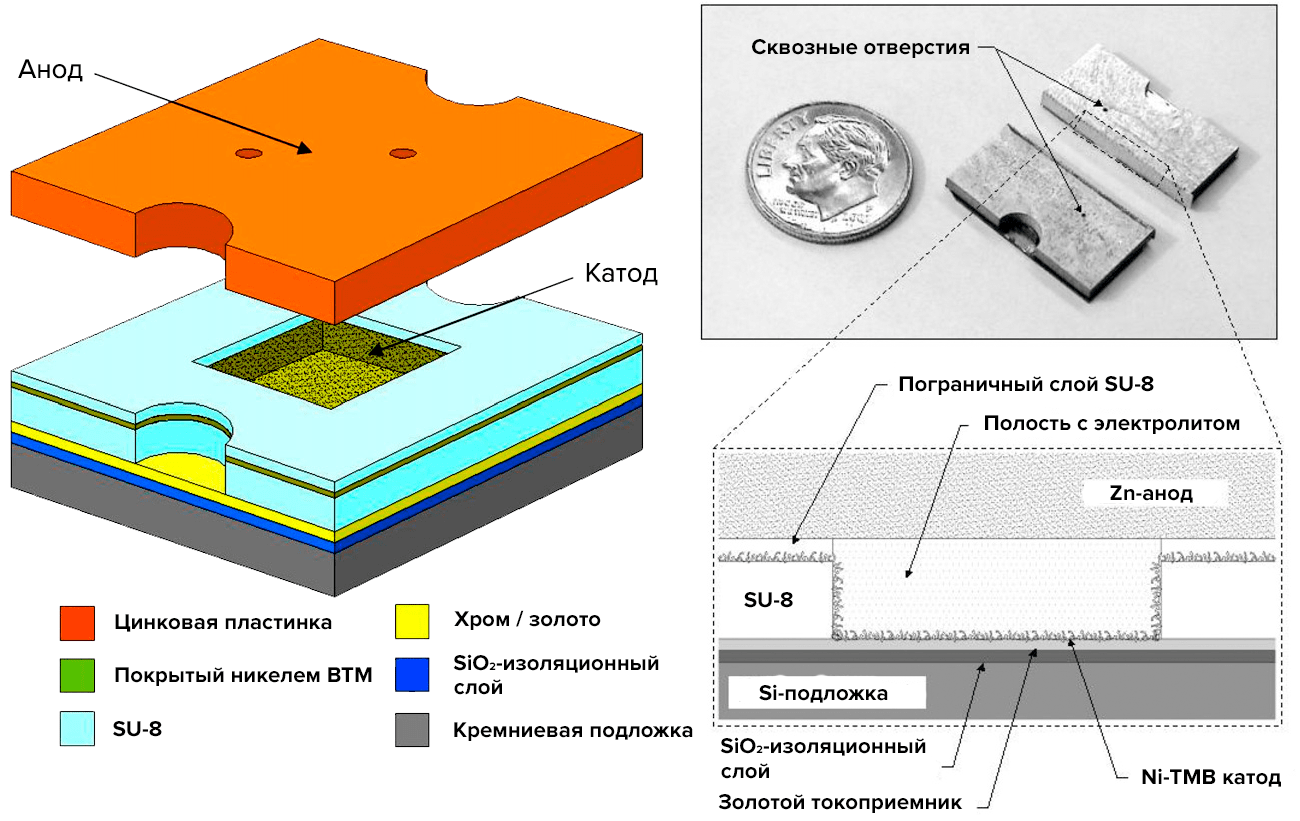
Рисунок 19. Микробатарея. Слева: схема слоев микробатареи. Справа: батарея в разрезе.
Сначала проводят осаждение диэлектрического диоксида кремния SiO2 при пониженном давлении, чтобы оградить катод от кремневого субстрата («вафли»). Хром с золотом покрывают диэлектрик при испарении под действием пучка электронов (электронно-лучевое испарение). Хром является адгезионным слоем, осуществляет слипание слоев, а золото — токоприемник и основа для сборки ВТМ. После литографии SU-8 кремневая подложка прилегает к катоду, и начинается сборка ВТМ-электродов на золоте (рис. 20). Табачный вирус был выбран не простой, а генно-инженерный, с остатком цистеина (цис—SH) на каждой субъединице — ВТМ-1-цис. В заключении катод и анод крепятся к фоторезисту с одинаковой ориентацией.
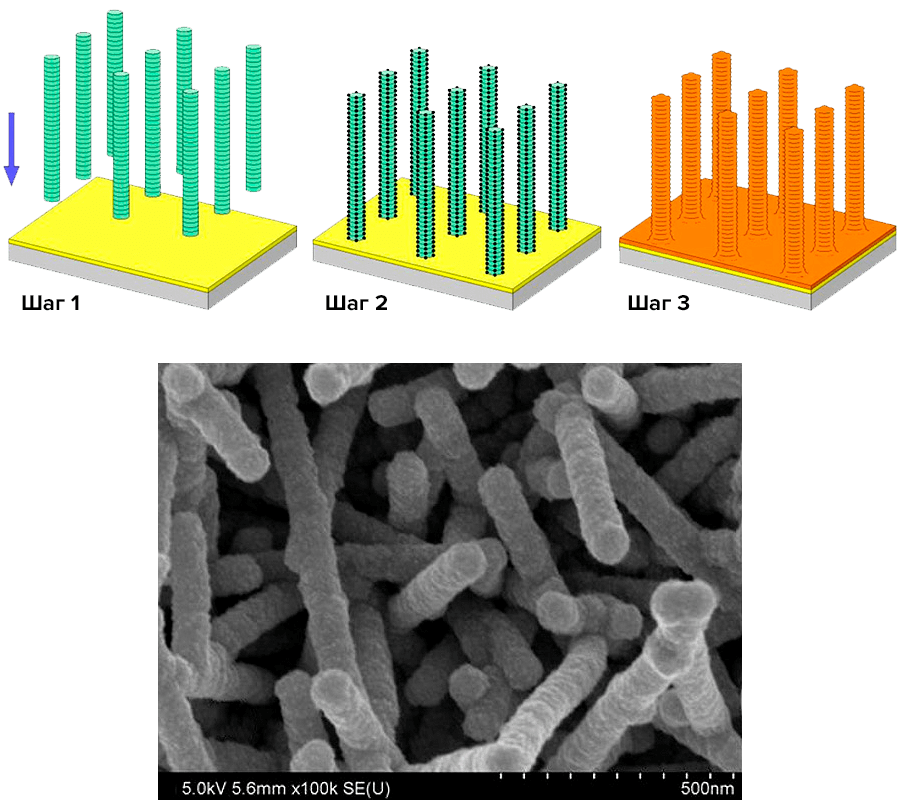
Рисунок 20. Сборка наноэлектродов на основе ВТМ. Сверху: ход модификации ВТМ. 1 — ВТМ из раствора собирается на золотой поверхности, 2 — поверхность вирионов активируются палладиевым катализатором и 3 — осаждение никеля. Снизу: электронная микрофотография полученных электродов при большом увеличении.
Но какие же преимущества может дать табачный вирус в случае батарейки? Авторы сравнили батареи с и без вирусных наночастиц и показали, что емкость бионанобатареек больше в шесть раз в сравнении с «обычными» нанобатарейками. А при уменьшении расстояния между электродами емкость вырастает еще в разы. Простота вирусной самоорганизации и процесса металлизации подтверждают возможность производства более компактных накопителей энергии.
Ученые из Мэриленда нашли применение вирусу табачной мозаики и для анодов, но уже литий-ионных аккумуляторов (ЛИА), произведших настоящий бум в современной энергетике и электронике [23]. Но, как и вышеупомянутые микробатарейки, они нуждаются в увеличении емкости при малых размерах. Уже в 2007 году группа китайского материаловеда-нанотехнолога Йи Кю в Стэнфордском университете изобрела т.н. нанопроводниковые аккумуляторы — ЛИА с кремневыми анодами [24]. Такой анод — это пластина из нержавеющей стали (токосъемник), покрытая нанопроволоками состава ВТМ-1-цис/Ni/Si. Казалось бы, почему бы анод просто не покрыть кремнием? Дело в объемной деформации таких сплошных покрытий, разбухающих после цикла зарядки-разрядки, в ходе которого ионы лития переходят от одного электрода к другому и наоборот (рис. 21).
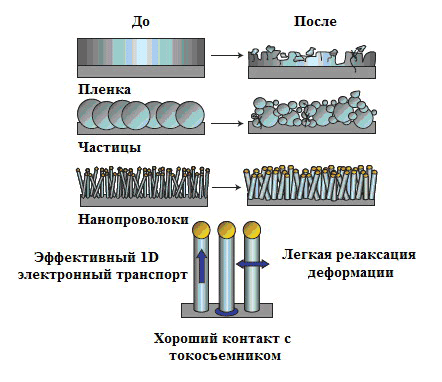
Рисунок 21. Морфологические изменения кремния после электрохимического цикла. Нанопроволоки, выращенные на токосъемнике, не распадаются и не разрушаются. Релаксация деформации (деформация, остающаяся после устранения деформирующей силы, но медленно исчезающая с течением времени) протекает легко, позволяя проволокам лишь увеличиваться в размерах при работе аккумулятора. Электронный транспорт по таким 1D структурам очень эффективен.
Мэрилендские ученые нашли способ сделать нанопроволоки из кремния еще более эффективными и менее изнашиваемыми, чем у Йи Кю. По их методике, анод можно получить за четыре шага:
- Самосборка ВТМ-1-цис и одновременное погружение дисков из нержавеющей стали в раствор с вирусом для прикрепления вирионов к ним.
- Активация ВТМ-1-цис каталитическими палладиевыми кластерами посредством восстановления Pd2+ до Pd0 с помощью гипофосфита.
- Электрохимическое осаждение никеля на поверхности вирусных частиц в ванне из NiCl2 и восстановителя диметиламинборана.
- После испарения влаги в вакуумной печи производится напыление кремния его конденсацией из пара.
На основании электронных микрофотографий (рис. 22) можно утверждать, что такие трехслойные проволоки организуются на стальных дисках преимущественно вертикально. После 75 циклов толщина кремниевого слоя (с севшим на него литием) увеличилась на 112 нм — сравнительно не намного (в том числе, благодаря релаксации деформации). Новые ЛИА демонстрируют высокую емкость (почти 10-кратное увеличение в сравнении с графитовыми электродами), превосходную стабильность к перезарядкам (низкое падение емкости) и большую износостойкость.

Рисунок 22. Нанобиопроволоки на основе ВТМ-1-цис/Ni/Si. Слева: структура одиночной проволочки. В центре: нанопроволоки ВТМ-1-цис/Ni/Si после осаждения кремния. Справа: они же, после 75 циклов зарядки/разрядки аккумулятора.
Подобные технологии во весь голос говорят о появлении новой стратегии в развитии недорогих и универсальных синтетических технологий для аккумулирования электрической энергии.
В качестве постскриптума: Возвращаясь к базовым нанотехнологическим понятиям, можно уверенно говорить, что темплатный синтез, с которым мы столкнулись, является примером жидкофазного метода снизу вверх, позволяющим собирать многоярусные (или многослойные) конструкции из исходных блоков (рис. 23).
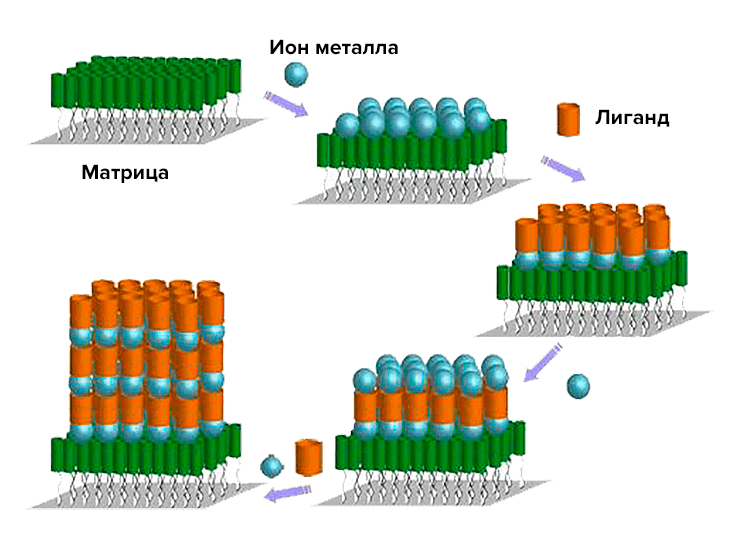
Рисунок 23. Темплатная сборка
лекция профессора Чжигана Ву
Курение вредит вашему здоровью!.. А табачный вирус может его защитить
Как уже, наверное, понятно, вирус табачной мозаики вредит табаку (на самом деле, он инфицирует представителей девяти семейств растений). Однако люди нашли ему многочисленные применения. И не только в технике (об это говорилось в предыдущем разделе), но и в медицине. Речь пойдет о поистине волшебной нановакцине, разработанной на кафедре вирусологии МГУ группой профессора И.Г. Атабекова.
Вакцина — средство для создания или улучшения иммунитета (т.н. приобретенный активный иммунитет). В данном случае вакцина создается на основе антигенов (чужеродных молекул, на присутствие которых реагирует иммунная система). Суть метода заключается в создании носителя (платформы) для антигена/эпитопов (участков белковых антигенов, способных связываться с антителом), в качестве которой применены сферические вирусные частицы ВТМ и других спиральных фитовирусов (и их фрагментов).
Вирусные сферические наночастицы
Вышеупомянутые наноплатформы для антигенов можно получить путем термической денатурации белка оболочки вируса (например, ВТМ). В 1956 году вирусолог Роджер Харт показал, что термическая обработка частиц ВТМ при температуре 80–98 °C в течение 10 секунд ведут к набуханию вирионов из-за денатурации белков и преобразования их в шарообразные частицы [25]. Российские вирусологи выяснили, что размер сферических частиц варьирует в диапазоне 50–800+ нм. Для получения сферических наночастиц (СНЧ) они использовали собственно вирус табачной мозаики и его белковую оболочку [26]. Посредством электронной микроскопии было выявлено две стадии термической трансформации нативного вируса (рис. 24):
- Нагревание до 90 °C — набухание частиц с одного или с двух концов и формирование несферических частиц различных размеров и форм.
- Дальнейшее нагревание до 94 °C — зрелые СНЧ.

Рисунок 24. Двухстадийная модификация ВТМ в СНЧ. Слева: первая стадия, температура 90 °C. Справа: дальнейшее нагревание, температура 94 °C.
Нагревание палочковидных ВТМ при 94–98 °C дает 100% выход СНЧ, объем которых не обязательно соответствует объему «палочек» ВТМ (радиус около 52 нм). Все СНЧ нерастворимы в воде и могут существовать в виде коллоидного раствора или стойкой суспензии. Что интересно, СНЧ получаются из любых фрагментов оболочки ВТМ, вплоть до А-белков (но при более низких температурах из-за меньшей стабильности, чем целостный ВТМ) (рис. 25).
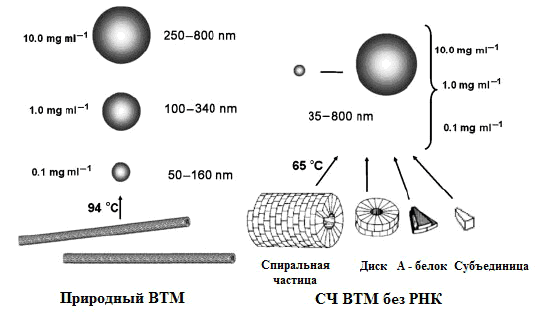
Рисунок 25. Схема синтеза СНЧ из нативного ВТМ (слева) и белковых агрегатов ВТМ (справа). Указаны концентрации исходных структур и размеры СНЧ.
Преимущество использования ВТМ без РНК в том, что при нагревании они не переходят в несферические частицы, а также в независимости размера СНЧ от концентрации белка. Таким образом, конверсия белка оболочки в СНЧ — одностадийный процесс. Основными достоинствами такого типа носителя для антигена являются:
- Эти СНЧ безопасны для человека и других животных, т.к. получены из растительных вирусов и при высокой температуре (стерилизованные препараты), а также благодаря отсутствию РНК.
- Исключена генетическая изменчивость антигенов, иммобилизованных на поверхности СНЧ благодаря генетической инертности частиц.
- Фитовирусы из родов тобамовирус, потексвирус и гордеивирус легко выделить из зараженных листьев.
- Быстро адсорбируют на своей поверхности самые разные белки (в т.ч. с высокой биологической и иммуногенной активностью).
- Возможность быстро получать частицы необходимого размера.
- Высокая устойчивость к замораживанию (до −20 °C), повторному нагреванию (до 98 °C) и к хранению более 6 месяцев (при 4 °C).
- Для формирования ансамблей с пептидами и пептидными комплексами не требуется генетическое изменение структуры белковых субъединиц.
Вакцина
Теперь стоит перейти собственно к вакцине. В работе Атабекова исследовались разнообразные иммуногенные (способные вызывать продукцию антител) ансамбли на основе вирусных СНЧ-носителей и антигенов (или эпитопов). Ранее уже были найдены другие вирусные агенты, способные к презентации антигенов (т.е. представлению антигена Т-лимфоцитам, уничтожающим чужеродные белки) — аффинно-конъюгированные антигенные системы (АКАС). Они представляют из себя вирусы, белок оболочки которых генетически или химически модифицирован и имеет участки связывания разных чужеродных структур белковой природы.
Например, в США в 2010 году были запатентованы АКАС на основе вируса мозаики папайи и из вирусоподобных частиц на основе его оболочки, содержащих аффинные компоненты (АК) — молекулы или соединения, способные специфически связываться с нужными антигенами и белком оболочки вируса [25]. К АК можно отнести антитела и их фрагменты, белок стрептавидин (соединяется с биотином, меченым антигеном), природные лиганды и их связывающие домены, пептиды и их части. Конъюгированные антигены могут при необходимости присоединять и антигены к самим себе. Вирусный белок, в свою очередь, нуждается в модификации; например, можно генетическими методами удалить аминокислоты на N- или/и C-концах белковой цепи или/и заменить какие-нибудь аминокислоты. Но у АКАС есть и ряд недостатков, в частности невысокая биоактивность, сложная процедура получения, генетическая нестабильность, строгая специфичность компонентов и небольшая сорбционная емкость в отношении антигенов.
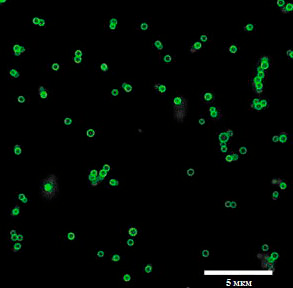
Рисунок 26. Флуоресцентно-меченные комплексы СНЧ–ЗФБ. СНЧ, полученные из нативных вирионов ВТМ, инкубировали с ЗФБ в воде при комнатной температуре. Комплексы стабилизированы 0,05%-раствором формальдегида.
Соединение СНЧ с белками начали исследовать с получения комплексов СНЧ—флуоресцентный белок. В частности, вирусологи соединяли с СНЧ зеленый флуоресцентный белок (ЗФБ) (рис. 26) [26].
Также удалось прикрепить к СНЧ белки оболочки X-вируса картофеля, флуоресцентно меченные флуоресцеинизотиоцианатом (ФИТЦ). При этом ничего особенного не делалось: простая инкубация СНЧ и целевого белка с последующей стабилизацией формальдегидом; взаимодействия между СНЧ и антигеном/эпитопом до ковалентной стабилизации можно отнести к электростатическим и/или гидрофобным. В конце концов, исследователи додумались до еще более изощренных «сэндвичевых» структур: СНЧ à ЗФБ (антиген) à первичные антитела (мышиные) à вторичные противомышиные антитела (куриные) с флуорофором Alexa (зеленый) или СНЧ à смешанный продукт из N-делетированного белка оболочки XВК и антигенной детерминанты (=эпитопа) вируса оспы сливы (ВОС) à первичные кроличьи антитела против вируса оспы сливы à вторичные противокроличьи антитела с флуорофором Alexa (красный) (рис. 27) [28].

Рисунок 27. Флуоресцирующие комплексы СНЧ с антителами
Но все вышеприведенные антигены — либо растительные (XВК, ВОС), либо из медузы (ЗФБ), но не человеческие. Наши ученые решили и эту проблему, связав с СНЧ ряд антигенов, вредных для человека: полиэпитоп A вируса краснухи (тандем антигенных детерминант гликопротеина E1), дигидрофолат редуктаза (ДГФР) с M2e эпитопом вируса гриппа A человека, тетраэпитоп гемагглютинина (4 моноэпитопа) H5 вируса гриппа A человека [28]. Упомянутые комплексы (а также комплекс, содержащий XВК и эпитоп ВОС) содержали His6-метку для облегчения хроматографической очистки рекомбинантных белков (рис. 28) [28].
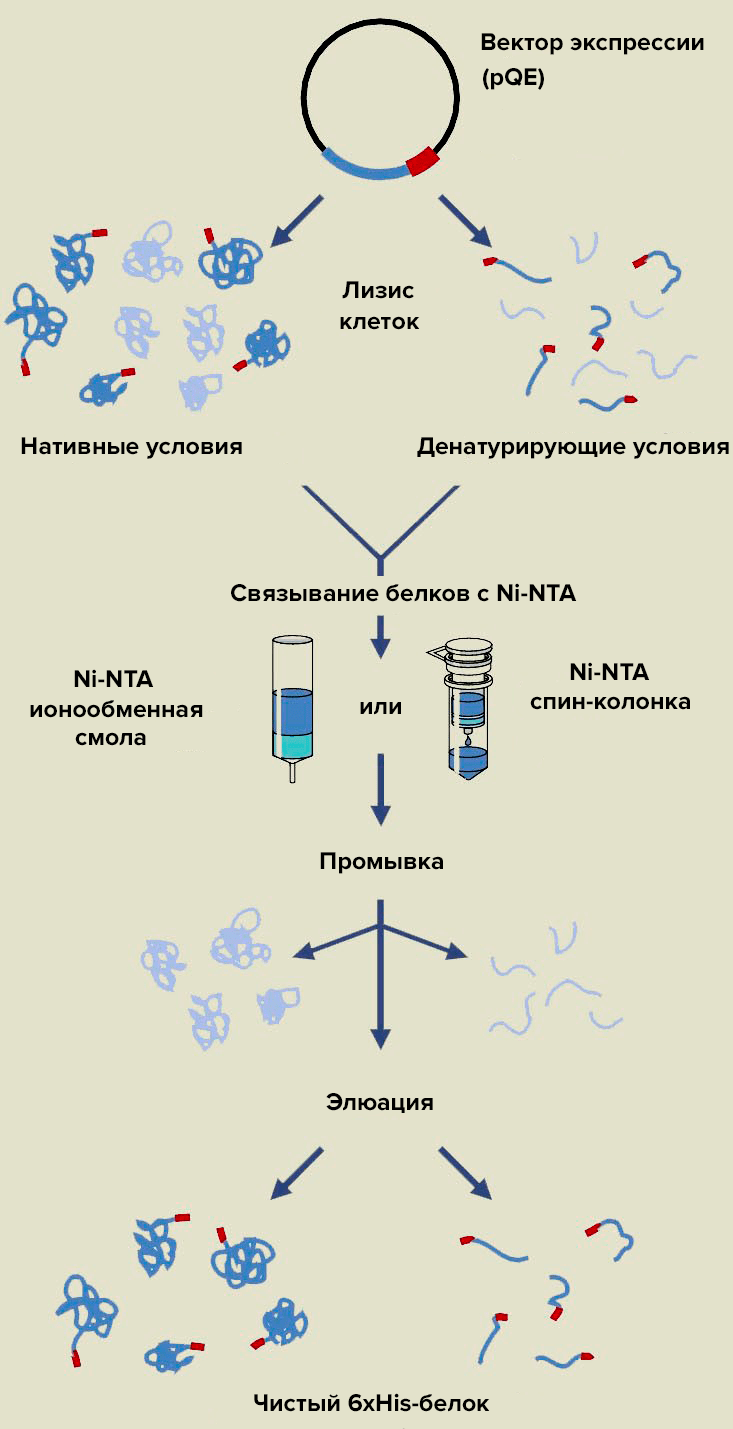
Рисунок 28. Аффинная хроматография рекомбинантных белков на сорбенте Ni-НТА агароза. Группа Атабекова в своих работах использует денатурирующие условия (т.к. белок нерастворим) и Ni-НТА в виде хроматографической смолы (спин-колонка — полипропиленовая трубочка с адсорбентом для очистки биомолекул путем центрифугирования). Промывка подразумевает отделение примесных компонентов, не закрепившихся на адсорбенте, а аффинная элюация — удаление белков из колонки за счет молекулярного узнавания.
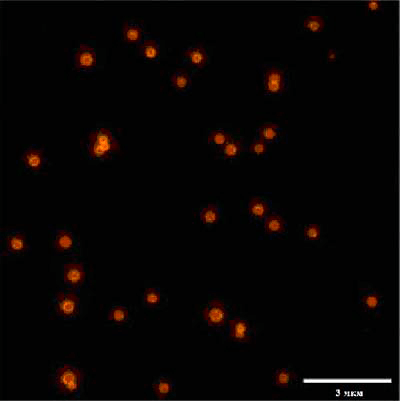
Рисунок 29. Электронная микрофотография наночастиц СНЧ → полиэпитоп гемагглютинина H5 вируса гриппа A человека → первичные антитела → вторичные антитела → флуорофор.
Полученные вакцинные «шарики» во всех случаях выглядят почти одинаково на электрономикрофотографиях препаратов, полученных методами иммунофлуоресцентного или иммунозолотого (вместо флуорофора — наночастица коллоидного золота) мечения. На рис. 29 представлена фотография нановакцины СНЧ — полиэпитоп гемагглютинина H5 вируса гриппа A человека [28].
Иммуногенность антигенов в сочетании с СНЧ была подтверждена серией экспериментов на мышах. К примеру, сравнивая активность стабилизированных формальдегидом комплексов СНЧ—белок оболочки XВК (или смеси этих компонентов) и отдельно БО XВК, было обнаружено, что титр антисыворотки (количественный параметр, характеризующий взаимодействие антител с антигеном) в первом случае в 10 раз выше. Это свидетельствует в пользу того, что СНЧ обладают иммуностимулирующей активностью, увеличивающей гуморальный иммунный ответ, вырабатывающий антитела по принципу «один антиген — одно антитело». Если в данном случае разница между комплексом СНЧ—антиген и их смесью по активности невелика, то для вакцины, содержащей ВОС и XВК, эта разница весьма существенна. Таким образом, на иммуногенность вакцины оказывает влияние и сам антиген [28].
Подводя итог, можно смело утверждать о начале нового витка в развитии современной медицины, связанного с появлением уникальной, биологически стабильной, безопасной нановакцины на основе растительных вирусов. Остается лишь ждать, чтобы этап клинических испытаний поскорее сменил лабораторные исследования, дав начало широкому применению этого чуда нанобиотехнологии.
Радость магната
За прошедшие 10 лет возможность получения водорода из этанола для использования в топливных элементах сулит реальное улучшение работы транспортных средств и автономных генераторов энергии. Ученые-материаловеды из Массачусетского Технологического Института разработали нанокристаллический катализатор, позволяющий осуществлять риформинг этанола с хорошими выходами водорода (рис. 30) [29].
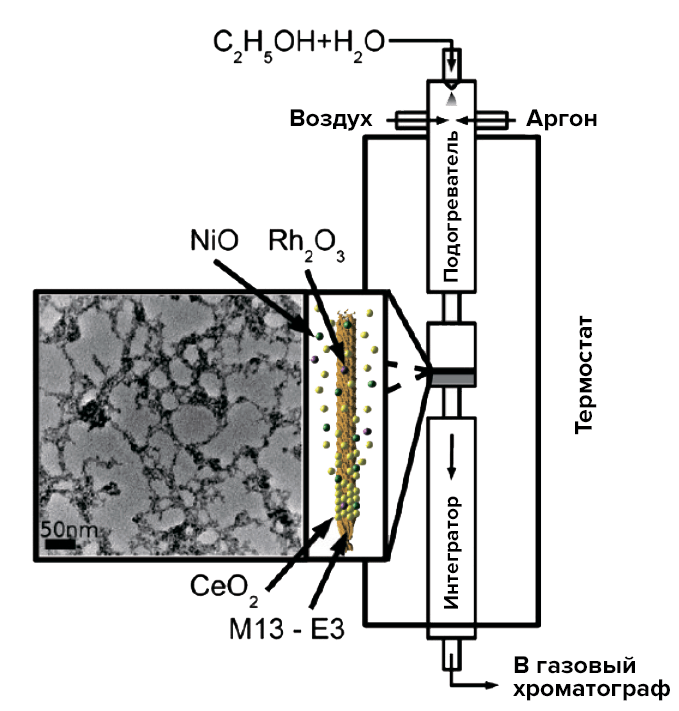
Рисунок 30. Принципиальная схема анализа активности полученных катализаторов. Стоит пояснить, что интегратор выполняет здесь аналитическую (идентификационную) роль. На фотографии слева изображена наноструктура поверхности вирусного катализатора.
В настоящее время в водородной энергетике применяют метод каталитической окислительной паровой конверсии водно-этанольных смесей, в частности с применением родий-цериевого катализатора Rh@CeO2 при температуре 650 °C. По сути этот процесс описывается реакцией C2H5OH + 2H2O + 1/2O2 → 2CO2 + 5H2, протекающей с небольшим выделением теплоты (слабо экзотермическая реакция). Катализаторы должны активизировать молекулы и этанола, и воды для полного окисления всех углеродных фрагментов, и не должны обладать сильными кислотностью и гидрирующей активностью (способностью присоединять водород к реагентам), чтобы предотвратить образование этилена (C2H4) и метана (CH4). Металлонанесенные катализаторы на основе диоксида церия превосходно подходят, т.к. способны отрывать от воды кислород при относительно низких температурах. Комбинируя родий катализатора с никелем Rh—Ni@CeO2, можно увеличить «работоспособность» катализатора при риформинге, особенно при пониженных температурах. Под «работоспособностью» следует понимать эффективность разрушения этанола на меньшие молекулы посредством разрыва связи углерод—углерод.
Бактериофаг M13 — нитевидный вирус (рис. 31), из которого можно получить самоорганизующиеся нанопровода путем биоинженерной модификации поверхностных белков для присоединения к ним требуемых материалов. Цель данного исследования — показать возможность получения из M13 катализатора с прекрасной дисперсностью, высокой термостабильностью, хорошей порозностью поверхности.
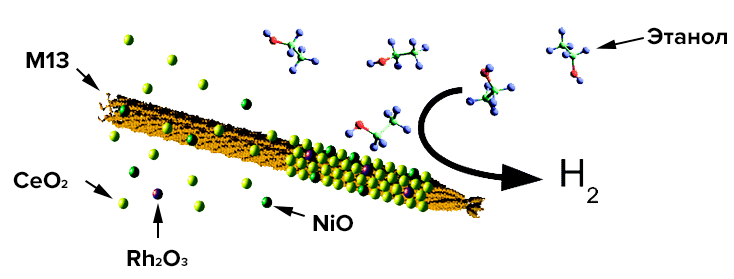
Рисунок 31. Бактериофаг M13 связывает церий, никель и родий, создавая нанокристаллический катализатор риформинга этанола в водород
В результате генноинженерных манипуляций с главным белком вируса pVIII ученые получили т.н. глутамат-насыщенный фаг (E1) (с тремя добавочными остатками глутаминовой кислоты). Его поверхность при нейтральном pH заряжена сильно отрицательно, что делает возможным оседание ионов металла и образование вышеупомянутых нанопроволок.
Подобный катализатор создается путем внесения гибридного вируса в раствор с хлоридами никеля, церия и родия. После обработки солей металлов перекисью водорода и гидроксидом натрия (в нужных концентрациях, чтобы препятствовать разрушению бактериофага) образовались соответствующие кислородные соединения. Очищается катализатор от вирусных частиц путем нагревания до 400 °C. Пористость биотемплатного катализатора (а значит и активность) действительно поражает — при диаметре пор менее 4,5 нм их довольно много. Использование вирусов позволяет увеличить активную поверхность катализатора, что в сочетании с распределением пор дает высокую селективность нового катализатора.
После синтеза катализатор был протестирован: для этого в специальной установке через него пропустили смесь этанола и воды, а вещества на выходе попадали в газовый хроматограф для идентификации. Желаемый результат был достигнут — катализ конверсии происходит и водород выделяется. Также тестировался безродиевый катализатор 10% Ni@CeO2. В этом случае был достигнут почти 100 % реформинг этанола при сравнительно невысокой температуре — 400 °C.
Таким образом, мы имеем еще один пример технологии, полученной с помощью биотемплатного синтеза на матрице вирусов — катализатор для водородной энергетики (даже в определенном смысле биоэнергетики), существенными достоинствами которого являются улучшенная долговременная стабильность, низкая чувствительность к дезактивации поверхности, небольшие поры примерно равного размера.
В качестве заключения...
Любой, кто занимается просветительской деятельностью и уж тем более написанием научных статей, хочет побольше рассказать о том, что ему самому интересно. Но как всегда, нужно знать меру. Именно поэтому напоследок хочется сказать лишь несколько слов об общих подходах к использованию вирусов и вирусоподобных частиц в современной технологии (рис. 32).
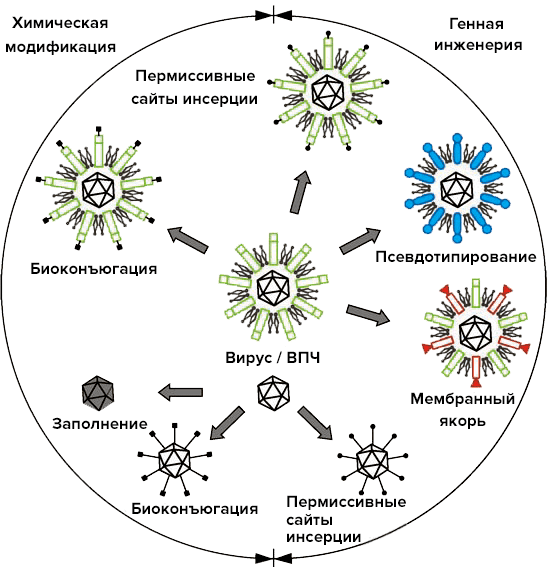
Рисунок 32. Основные современные типы возможных модификаций вирусных поверхностей для целей нанотехнологии. На схеме представлены как вирусы с внешней оболочкой, так и безоболочечные вирусы.
Обратимся к схеме. Глобально все изображенные манипуляции с вирусами подразделяют на химические и генно-инженерные. Интересно то, что в обеих группах схожие результаты могут осуществляться принципиально разными методами.
В материаловедении вирусные частицы используются как матрицы для химического синтеза. При этом требуемые молекулы крепятся к поверхности вируса посредством т.н. химической биоконъюгации. Образуется наночастица с необходимым числом молекул на поверхности и необходимым паттерном распределения. Подобные «химические» примеры уже были упомянуты: металлизация/магнетизация вирусов, сборка/разборка при изменении среды и т.д. Благодаря изменению pH можно регулировать самосборку ВПЧ и применять их, например, для инкапсулирования лекарств.
Современных методов вирусной биоинженерии великое множество. Особенно это касается вирусов с внешней оболочкой (своеобразной квазиплазматической мембраной). Но, как всегда, есть те, к которым сводятся остальные [30]:
- Оболочечные вирусы проникают в клетку путем слияния клеточной мембраны и мембраны вирусной оболочки, причем в клетку попадает лишь нуклеокапсид. Слияние происходит после взаимодействия вируса с рецептором за счет так называемых белков слияния (БС). Некоторые БС имеют т.н. пермиссивные сайты инсерции для вставки чужеродных пептидных последовательностей (под пермиссивностью подразумевается то, что при вставке существенно не меняется активность мембранного белка). Кстати сказать, инфекционность вируса после модификации сохраняется, но она уменьшается, если вставить длинный полипептид, вызывающий стерические проблемы слияния мембран. В результате пептидной инсерции можно, например, получить вирионы/ВПЧ для создания аффинно-конъюгированных антигенных систем.
- Псевдотипирование — упаковка вирусного генома в гетерологичную вирусную оболочку. Эта процедура осуществляется посредством одновременного инфицирования клетки двумя разными оболочечными вирусами, с образованием химерных вирусов. Эти объекты можно с успехом применять в генной терапии. Ретровирусные векторы, например, не всегда встраиваются в геном нужных клеток. Но эта проблема разрешается путем инсерции мембранных чужеродных белков (какой-нибудь генноинженерный белок слияния) для корректировки движения вектора.
- В качестве мембранных якорей можно использовать цитоплазматические и трансмембранные домены укороченных белков слияния. Подобное «заякоривание» применяется для определения локализации тех или иных белков, к которым якорь и прикрепляется.
Подводя итоги, вполне разумно сказать, что описанная в этом обзоре область современной биологии не ограничивается упомянутыми примерами. Ведь основная цель статьи — показать основные принципы и методические приемы, с которыми приходится сталкиваться ученым, пришедшим в область нанобиотехнологии (и бионанотехнологии) и решившим заняться иммобилизацией «всякой химико-биологической всячины» на поверхность вирусов. Работы в этой сфере публикуются в научных журналах едва ли не каждый месяц — но обо всех не упомянешь. К сожалению, не во всем мире эти достижения вышли за пределы научных лабораторий. Остается надеяться на большое будущее этих технологий.
Литература
- Taniguchi N. (1974). On the Basic Concept of “Nanotechnology”. Proc. Intl. Conf. Prod. Eng. Tokyo. Part II, 18–23;
- Кобаяси Н. Введение в нанотехнологию (2 изд.). М.: «БИНОМ. Лаборатория знаний», 2008. — 134 с.;
- Невидимая граница: где сталкиваются «нано» и «био»;
- Нано-pH-метр;
- Газит Э. Нанобиотехнология: необъятные перспективы развития. М.: «Научный мир», 2011. — 152 с.;
- Агол В.И. (2009). Вирусы: корневая система древа жизни? «Природа». 9, 3–11;
- Baron S. et al. Medical Microbiology (4th Edition). Galveston (TX): University of Texas Medical Branch at Galveston, 1996;
- Dimmock N.J., Easton A.J., Leppard K.N. Introduction to modern virology (6th Edition). Blackwell Publishers, 2007. — 516 p.;
- Makadiya N. Consequences of Genetic Variation and Selection in Viruses. Student Perspectives on Contemporary Virology, 2007;
- Нельсон Д. и Кокс М. Основы биохимии Ленинджера (т. 1). М.: «БИНОМ. Лаборатория знаний», 2012. — 696 с.;
- Стид Д.В. и Этвуд Д.Л. Супрамолекулярная химия (т. 1). М.: «Академкнига», 2007. — 480 с.;
- Douglas Philp, J. Fraser Stoddart. (1996). Self-Assembly in Natural and Unnatural Systems. Angew. Chem. Int. Ed. Engl.. 35, 1154-1196;
- Wagner E.K. et al. Basic virology (3th Edition). Blackwell Publishers, 2007. — 584 p.;
- Архипенко М.В., Петрова Е.К., Никитин Н.А., Протопопова А.Д., Дубровин Е.В., Яминский И.В. и др. (2011). Искусственные вирусоподобные частицы, полученные in vitro из белка оболочки Х-вируса картофеля и чужеродных вирусных РНК. Acta naturae. 3 (10), 42–48;
- Cann A.J. Principles Of Molecular Virology (4th Edition). Elsevier Academic Press, 2005. — 332 p.;
- A. Fokine, P. R. Chipman, P. G. Leiman, V. V. Mesyanzhinov, V. B. Rao, M. G. Rossmann. (2004). Molecular architecture of the prolate head of bacteriophage T4. Proceedings of the National Academy of Sciences. 101, 6003-6008;
- Лурия С., Дарнелл Дж., Балтимор Д., Кэмпбелл Э. Общая вирусология. М.: «Мир», 1981. — 680 с.;
- Атабеков И. Г. (2008). Применение вирусных структур в качестве инструментов нанотехнологий. «Российские нанотехнологии». 3 (1—2), 130–139;
- Mato Knez, Alexander M. Bittner, Fabian Boes, Christina Wege, Holger Jeske, et. al.. (2003). Biotemplate Synthesis of 3-nm Nickel and Cobalt Nanowires. Nano Lett.. 3, 1079-1082;
- Sinan Balci, Kersten Hahn, Peter Kopold, Anan Kadri, Christina Wege, et. al.. (2012). Electroless synthesis of 3 nm wide alloy nanowires insideTobacco mosaic virus. Nanotechnology. 23, 045603;
- M. Knez, M. Sumser, A. M. Bittner, C. Wege, H. Jeske, et. al.. (2004). Spatially Selective Nucleation of Metal Clusters on the Tobacco Mosaic Virus. Adv. Funct. Mater.. 14, 116-124;
- Konstantinos Gerasopoulos, Matthew McCarthy, Elizabeth Royston, James N Culver, Reza Ghodssi. (2008). Nanostructured nickel electrodes using theTobacco mosaic virusfor microbattery applications. J. Micromech. Microeng.. 18, 104003;
- Xilin Chen, Konstantinos Gerasopoulos, Juchen Guo, Adam Brown, Chunsheng Wang, et. al.. (2010). Virus-Enabled Silicon Anode for Lithium-Ion Batteries. ACS Nano. 4, 5366-5372;
- Candace K. Chan, Hailin Peng, Gao Liu, Kevin McIlwrath, Xiao Feng Zhang, et. al.. (2008). High-performance lithium battery anodes using silicon nanowires. Nature Nanotech. 3, 31-35;
- Hart R.G. (1956). Morphological changes accompanying thermal denaturation of Tobacco mosaic virus. Biochim. Biophys. Acta. 20, 388–389;
- J. Atabekov, N. Nikitin, M. Arkhipenko, S. Chirkov, O. Karpova. (2011). Thermal transition of native tobacco mosaic virus and RNA-free viral proteins into spherical nanoparticles. Journal of General Virology. 92, 453-456;
- Leclerc D. (2010). Immunogenic affinity-conjugated antigen systems based on Papaya mosaic virus and used thereof. US Patent Application Publication 2010/0047264 A1;
- O. Karpova, N. Nikitin, S. Chirkov, E. Trifonova, A. Sheveleva, et. al.. (2012). Immunogenic compositions assembled from tobacco mosaic virus-generated spherical particle platforms and foreign antigens. Journal of General Virology. 93, 400-407;
- Brian Neltner, Brian Peddie, Alex Xu, William Doenlen, Keith Durand, et. al.. (2010). Production of Hydrogen Using Nanocrystalline Protein-Templated Catalysts on M13 Phage. ACS Nano. 4, 3227-3235;
- Martin Fischlechner, Edwin Donath. (2007). Viruses as Building Blocks for Materials and Devices. Angew. Chem. Int. Ed.. 46, 3184-3193;
- S. C. Harrison, B. Alberts, E. Ehrenfeld, L. Enquist, H. Fineberg, et. al.. (2004). Perspective: Discovery of antivirals against smallpox. Proceedings of the National Academy of Sciences. 101, 11178-11192.