Волшебные пузырьки — липосомы цифелина
26 октября 2011
Волшебные пузырьки — липосомы цифелина
- 4431
- 3
- 6
Один из перспективных способов лечения опухолей — липосомы, «заряженные» лекарством: усиление роста сосудов и увеличение проницаемости сосудистой стенки в опухолях приводит к тому, что здесь накапливаются липосомы, и действие лекарства может быть наиболее эффективным.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Злокачественные опухоли — одно из самых коварных заболеваний. Для большинства из них до сих пор не предложено эффективных схем терапевтического воздействия. Недостатки существующих методов лекарственной терапии — высокая стоимость препаратов, невысокая эффективность, выраженные побочные эффекты. Вместе с тем, колоссальные усилия ученых и врачей привели к выработке новых эффективных методов противодействия онкологии. Один из таких подходов — использование липосом в качестве носителей противоопухолевых веществ, в частности алкилирующего агента цифелина. На липосомную лекарственную форму цифелина возлагаются большие надежды, поскольку инъекционный путь введения позволяет многократно увеличить биодоступность препарата, что необходимо для увеличения терапевтического воздействия малых доз практически нерастворимого лекарственного вещества.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Своя работа».
Диагноз «рак» стал приговором для многих миллионов людей: он занимает второе место по распространенности после сердечно-сосудистых заболеваний. А ведь еще несколько десятилетий назад этого не было. Опухоли, саркомы, лейкозы еще в начале века встречались в единичных количествах. С каждым годом ситуация значительно ухудшается: за десятилетие к 2002 г. в России выявлено на 10,7% больше новых случаев злокачественных заболеваний, чем в 1993 г., а за год (с 2003 по 2004) прирост составил 2,8%.
Сложность лечения рака заключается в структурной и функциональной схожести опухолевых и здоровых клеток. В норме происходит контролируемое организмом деление клеток в соответствующих количествах вместо погибших, и строго в пределах определенных органов и тканей. В тех случаях, когда структура клеток меняется под воздействием различных факторов, они вместо гибели начинают неконтролируемо расти, делиться и теряют способность распознавать свои клетки, становясь раковыми, что способствует формированию опухоли и проникновению в другие органы и ткани с нарушением функционирования последних. Действие большинства лекарственных препаратов направлено на блокирование механизмов жизнедеятельности злокачественных клеток, но из-за одинаковых ферментных систем оно не является избирательным по отношению к ним и приводит к повреждению здоровых тканей.
Эффективность борьбы с раковыми заболеваниями во многом зависит от лекарственной терапии онкологических больных. Наряду с хирургическими и лучевыми методами терапии, широкое распространение получила химиотерапия злокачественных опухолей. Как отдельный метод лечения, она способна излечивать некоторые виды злокачественных опухолей: хорионэпителиому матки, острый лимфобластный лейкоз у детей, рак кожи без метастазов, лимфогранулематоз, рак яичка. Но в большинстве случаев химеотерапия оказывается недостаточно эффективной, вызывая лишь временную регрессию опухоли, и почти всегда применяется совместно с лучевой терапией и хирургическим лечением [1].
Для химиотерапевтического лечения злокачественных опухолей в клинике используют противоопухолевые препараты четырёх основных классов: цитотоксические, гормональные, ферментные препараты и цитокины. Цитотоксические препараты составляют самую большую группу препаратов и включают в себя четыре основные подгруппы: алкилирующие средства, антиметаболиты, противоопухолевые антибиотики и вещества растительного происхождения.
Первые крупные успехи химиотерапии онкологических заболеваний были достигнуты в 1940-х, когда во время Второй мировой войны стали подробно изучать влияние на организм боевых отравляющих веществ. Так вскоре был синтезирован ряд широко применяемых препаратов, производных бис-(β-хлорэтил)-амина, которым наряду с высокой клинической эффективностью присуща высокая токсичность. Фармакологическое действие цитотоксичных лекарственных препаратов (ЛП) основано на неизбирательном повреждении структуры ДНК, в связи с чем они нарушают жизнедеятельность не только опухолевых клеток, но также поражают быстро делящиеся здоровые клетки костного мозга, эпителия желудочно-кишечного тракта, сердечной мышцы, половых желез [2]. Помимо этого ряд физиологических факторов серьезно ограничивает транспорт ЛП к мишени, нейтрализуя их действие.
Для предотвращения агрессивного воздействия противоопухолевых препаратов популярным направлением становится использование наноразмерных носителей: фуллеренов, липосом, полиакрилатных частиц, мицелл и др. В последнее время создание искусственных мембранных везикул — липосом — находит всё большее признание в мире в качестве перспективных систем доставки лекарственных веществ, благодаря положительным результатам многочисленных клинических испытаний [3], [4–6]. Поэтому целью эксперимента стала разработка липосомной лекарственной формы противоопухолевого вещества.
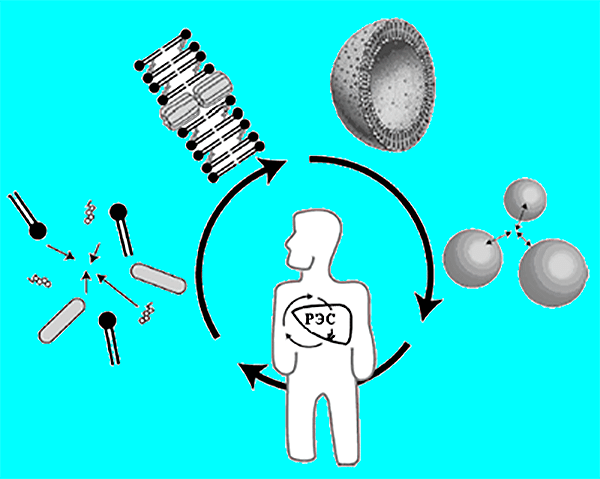
Рисунок 1. «В ближайшее время практическое применение найдут не менее 15 новых курсов терапии, основанных на липосомной технологии, а продажа липосом на мировом рынке составит 20–25% средств доставки лекарственных препаратов». Марк Дж. Остро, вице-президент Liposome Company, USA (2007).
Вот в чем залог успеха!
Целенаправленная доставка в пораженный орган позволяет значительно увеличить терапевтический эффект препарата. Наиболее перспективным представляется транспорт лекарственного вещества с помощью липосом. Так, инкапсулирование в «наноконтейнер» позволяет создавать инъекционные препараты пролонгированного действия, характерная особенность которых — накопление липосом в зоне опухоли.
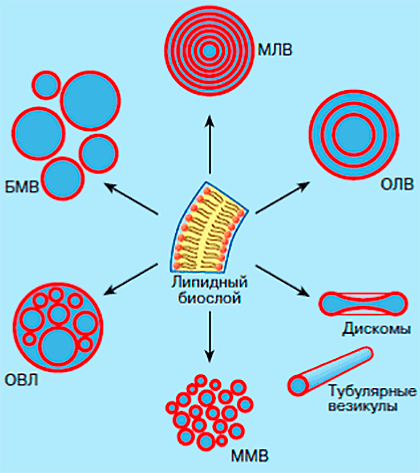
Рисунок 2. Различные виды липосом: мультиламеллярные везикулы (МЛВ), большие моноламеллярные везикулы (БМЛ), олиголамеллярные везикулы (ОЛВ), олиговезикулярные липосомы (ОВЛ), малые моноламеллярные везикулы (ММВ), дискомы — дискообразные липосомы, тубулярные трубчатые везикулы.
Липосомы представляют собой микроскопические сферические частицы, заполненные жидкостью. Водорастворимые (гидрофильные) лекарственные вещества могут быть заключены во внутреннее водное пространство везикул, а жирорастворимые (гидрофобные) включаются в бислойную липидную мембрану.
Липосомы отличаются между собой по типам и размерам (рис. 2). Так, мультиламеллярные везикулы (МЛВ) состоят из нескольких десятков липидных бислоев, разделенных водными промежутками, и имеют довольно крупные размеры (до 50 мкм). Самые маленькие везикулы (около 20 нм), образованные одним липидным бислоем, окружающим гидрофильное ядро, называются малыми одно- или моноламеллярными везикулами (МОВ или ММВ). Внешне липосомы не всегда выглядят как глобулярные частицы. Иногда они принимают уплощенную дискообразную форму (так называемые дискомы) или имеют вид очень длинных и тонких трубок, которые называют тубулярными липосомами.
Достоинства липосомных препаратов очевидны:
- полученные из природных фосфолипидов липосомы, в отличие от полимерных систем доставки лекарственных веществ, полностью биодеградируемы и биосовместимы;
- пригодны для включения широкого круга фармакологических агентов, в том числе ферментов, гормонов, витаминов, антибиотиков, иммуномодуляторов, цитостатиков;
- защищают клетки организма от токсического действия ЛВ;
- пролонгируют действие введенного в организм лекарственного вещества;
- защищают лекарственное вещество от деградации под влиянием повреждающих воздействий внешних условий, в частности от разрушения в желудочно-кишечном тракте и кровяном русле;
- способствуют проявлению нацеленной специфичности за счет селективного проникновения из крови в ткани;
- изменяют фармакокинетику лекарственных препаратов, повышая их фармакологическую эффективность;
- позволяют создать водорастворимую форму ряда ЛВ, увеличивая тем самым их биодоступность [1], [7], [8].
«Скафандр» для цифелина
Одним из важных классов «носителей» химической группы бис-(β-хлорэтил)-амина, обеспечивающих известную селективность действия препаратов на ДНК раковых клеток, являются аминокислоты и пептиды. Известно, что они проходят через мембраны опухолевых клеток в 4–5 раз легче, чем через мембраны нормальных клеток, в связи с чем они могут накапливаться в раковой клетке. Используя эту идею Л.Ф. Ларионова, были синтезированы сарколизин и его энантиомеры на основе L- и D-фенилаланина — мелфалан и медфалан, обладающие высокой противоопухолевой активностью. При этом было выяснено, что терапевтический эффект мелфалана и сарколизина сопряжен с рядом побочных реакций, среди которых анорексия, тошнота, рвота, лейкопения, тромбоцитопения и анемия. С целью создания менее токсичного препарата были получены пептидные производные сарколизина: асалин, асалей, астирон и асамет. Несмотря на сходный механизм алкилирующего действия, препараты различаются между собой как по силе и спектру терапевтического действия, так и по токсическим проявлениям.
Среди этих пептидов наименее токсичным и перспективным производным оказался цифелин (асалин) — оригинальный отечественный препарат, синтезированный и изученный в РОНЦ им. Н.Н. Блохина РАМН (рис. 3). Он проявляет высокую противоопухолевую активность при тех же заболеваниях, что и сарколизин: миеломная болезнь, саркома Юинга, семинома яичка, костная ретикулосаркома, рак яичников, лимфоэпителиальная опухоль Шминке. Первое время применялся в виде сухой рассыпки под названием асалин [9]. Позже была создана новая лекарственная форма — таблетки цифелина, но снизить высокую суточную дозу (1–3 г) и уменьшить гематотоксичность так и не удалось [10].
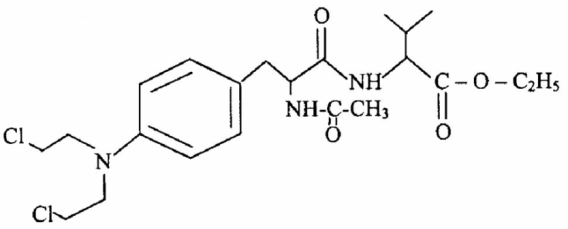
Рисунок 3. Структурная формула цифелина. По химической номенклатуре, он носит название этиловый эфир N-{N′-ацетил-4-[ди-(β-хлорэтил)-амино]-D′,L′-фенилаланил}-D′,L′-валина.
Для устранения побочных эффектов, возможности внутривенного введения гидрофобного лекарственного вещества (ЛВ), сокращения вводимых доз и повышения биодоступности была предпринята попытка создания липосомной лекарственной формы (ЛФ) цифелина.
Цифелин, представляющий собой практически нерастворимое в воде лекарственное вещество, включали в состав липидной мембраны, состоящей из фосфатидилхолина, холестерина и полиэтиленгликоль-2000-дистеароилфосфатидилэтаноламина.
Основными строительными компонентами липосом являются полярные или амфифильные липиды, являющиеся основной составляющей клеточных мембран. Для производства липосом гораздо чаще используются фосфолипиды, чем гликолипиды.
В водных растворах липиды, в силу своей амфифильной природы, формируют многомолекулярные агрегаты различной структуры. При этом полярные головки липидных мембран ориентированы в сторону водной фазы, тогда как неполярные углеводородные цепи образуют гидрофобное ядро, изолированное от водного окружения. Состояние липидных агрегатов в воде зависит не только от их структуры, но и от концентрации. При большом избытке воды
- фосфолипиды с 4 и менее углеродными атомами существуют в виде мономеров;
- содержащие 6–8 углеродных атомов образуют преимущественно мицеллы;
- липиды с более длинными цепями при осторожном встряхивании с водой образуют многослойные липидные сферические формы (мультиламеллярные везикулы или многослойные липосомы, МСЛ) с диаметром 0,1–10 мкм.
Но использование МСЛ в качестве переносчиков лекарственных препаратов ограничено небольшим объемом внутренней водной фазы (0,2–4 мкл на 1 мкмоль фосфолипидов). Липидным компонентом липосомной мембраны для лекарственной формы цифелина выбран фосфолипид фосфатидилхолин, преимуществом которого является высокая физиологическая активность, биосовместимость и биодеградируемость.
Для придания жесткости оболочке везикул добавляли холестерин, уплотняющий структуру бислоя, снижающий вытекание жидкости внутренней среды и соответственно сохраняющий структуру липосом.
Наряду с положительными свойствами обычных липосом, появляется нежелательный эффект — взаимодействие липосом с белками плазмы, в результате которого полученные комплексы захватываются из кровотока макрофагами ретикуло-эндотелиальной системы (РЭС) [1]. Чтобы лекарственный препарат, вводимый внутривенно, достиг клеток-мишеней в организме, предлагаются различные способы уменьшения опсонизации: введение в состав липосомной мембраны липидов с высокой температурой фазового перехода или получение везикул с размером не более 100 нм. Но наиболее эффективным методом оказалась модификация поверхности липосом гликолипидами, например, моносиалоганглиозидами, фосфатидилинозитолом, цереброзида сульфатом и липидными производными полиэтиленгликоля (ПЭГ). Наибольшую популярность, благодаря дешевизне и простоте синтеза, получили гидрофильные полимеры ПЭГ, обладающие низкой иммуногенностью и длительным временем циркуляции в кровотоке [11], [12]. В проведенном эксперименте использовали ПЭГ-2000-ДСФЭ.
Из-за способности блокировать механизмы поглощения липосом клетками РЭС, за счет создания избыточного осмотического давления в примембранной области везикулы, содержащие производные ПЭГ, стали называть стелс- (stealth) или стерически стабилизированными липосомами (рис. 4) [12]. Период полувыведения таких липосом достигает 24 часов у мышей и крыс и до двух дней в организме человека. Данное явление способствует локализации лекарственного препарата в опухоли или других поврежденных тканях с повышенной проницаемостью сосудов. Прошли клинические испытания и одобрены FDA лекарственные препараты на основе стелс-липосом — Caelix (Европа) и Doxil (США, противоопухолевые) [1], [8], AmBisome (США) и Amphocil (Бельгия, противогрибковые) [8]; проходят II фазу клинических испытаний Vinca-Home и VSLI onco TCS (противоопухолевые) [13]; изучается возможность получения липосомной формы албендазола (противогельминтный препарат) [14].
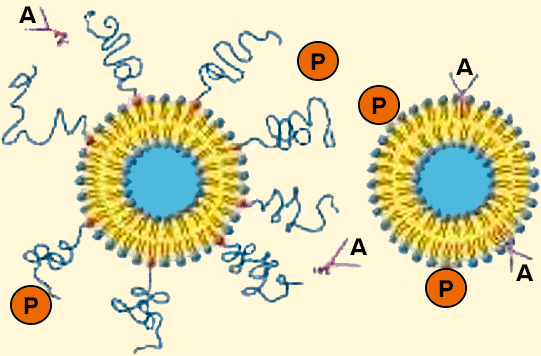
Рисунок 4. Липосомы-«невидимки» (слева) и обычные липосомы (справа). Сильно гидратированная полимерная «шуба» затрудняет адсорбцию антител (А) и других защитных белков (Р) на поверхности ПЭГ-илированных липосом.
С целью снижения лабильности к факторам окружающей среды и для повышения срока годности лекарственного препарата дисперсию однослойных липосом цифелина стабилизировали лиофилизацией (Амбизом — первый лиофильно высушенный липосомный препарат, разрешенный к медицинскому применению в 1991 г. в Великобритании) [7], [15]. Процесс лиофильного высушивания включает несколько этапов, а именно: замораживание, сублимация (первичная сушка) и досушивание. Однако замораживание негативно сказывается на стабильности бислойной мембраны везикул, где повреждающими факторами выступают: обезвоживание липосом, переход липидов из жидкокристаллического в гелеобразное состояние, активация свободно-радикального перекисного окисления [16], [17]. В результате воздействия температурного фактора, приводящего к разрывам в липосомной мембране с последующей агрегацией и слиянием липидных частиц, становится невозможным восстановление исходной структуры везикул.
Существует два пути решения данной проблемы: разработка режимов лиофилизации и подбор криопротектора. Основным подходом к сохранению везикул от укрупнения и слияния их содержимого является добавление криопротекторов — веществ, снижающих количество вымораживаемой в виде чистого льда воды и способствующих переохлаждению внутренней среды липосом, тем самым предотвращая кристаллизацию. Среди множества классов криопротекторов — спирты (глицерин, маннит), амиды (диметилацетамид) и оксиды (диметилсульфоксид) — наиболее эффективными и часто используемыми в производстве липосом являются углеводы (манноза, фруктоза, лактоза, глюкоза, сахароза, трегалоза) [16], [17].
Удар в больное место
После разработки композиции лиофилизированной липосомной лекарственной формы цифелина начинается самый интересный и ответственный момент. Выясняется спектр противоопухолевой активности ЛФ, представляющей бислойную замкнутую мембрану, содержащую цифелин, фосфатидилхолин, холестерин и ПЭГ-2000-ДСФЭ.
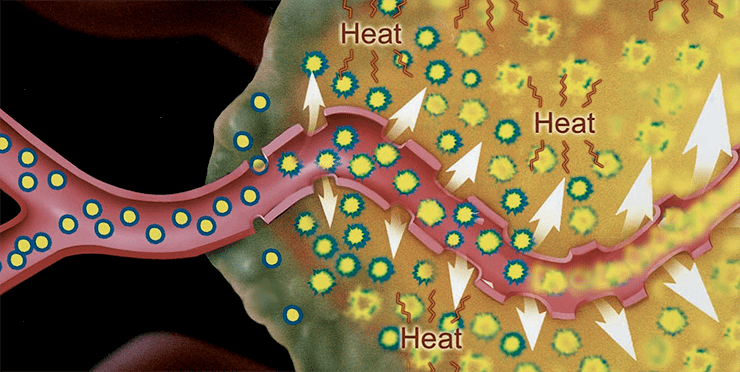
Прежде чем узнать результаты доклинических исследований, остановимся на механизме избирательного накопления липосомных форм цитостатиков в опухолевой ткани. Физиология твердых опухолей отличается от физиологии нормальных тканей целым рядом существенных аспектов [3], [18], причиной большинства которых являются различия в васкуляризации. В отличие от регулярной, упорядоченной васкуляризации нормальных тканей, сосуды опухолей часто представляют собой аномальные, деформированные капилляры с проницаемыми стенками и замедленным кровотоком (рис. 5).
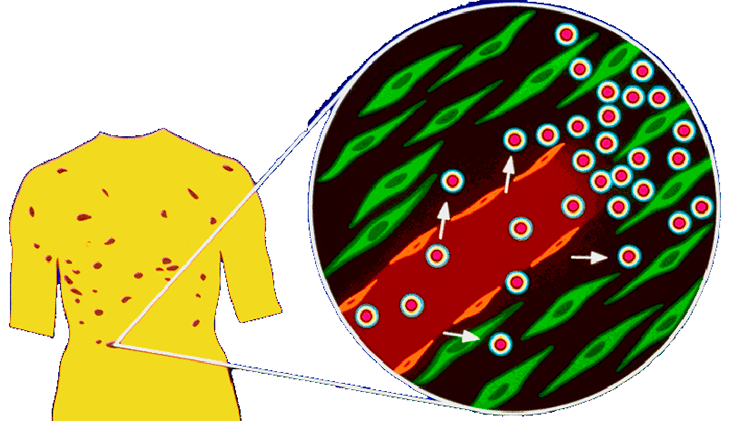
Рисунок 5. Увеличение пор капилляров в твердых опухолях и очагах воспаления
Рост опухоли требует и непрерывного прорастания новых сосудов, т.е. ангиогенеза. Эти различия в физиологии могут создать проблемы при лечении рака: например, гипоксия в твердых опухолях вызывает резистентность к лучевой терапии и к некоторым противоопухолевым препаратам. Однако эти различия могут быть использованы для селективного лечения рака, а именно: проницаемые кровеносные сосуды опухоли могут быть использованы для применения липосом различного состава, в том числе и стерически стабилизированных.
В большинстве нормальных тканей проникновение частиц ограничивается беспрерывной эндотелиальной выстилкой сосудов. Крупные частицы и липосомы диаметром более 250 нм практически не проникают сквозь капилляры даже в случаях, где межклеточные контакты и поры в эндотелии достаточно велики. Плотные межклеточные контакты (2–6 нм) между эндотелиальными клетками и большинством нормальных тканей препятствуют экстравазации даже очень мелких липосомных частиц (до 30 нм в диаметре). Многие первичные и метастатические опухоли имеют прерывистую и высокопроницаемую систему сосудов, достаточную для выхода мелких частиц, включая и липосомные. Таким образом, физиология сосудов определяет повышенный уровень поглощения в печени, селезенке и опухолевых тканях. Именно этот факт и может приблизить нас к пониманию избирательного накопления в опухоли цитостатиков, введенных в липосомах.
Как оказалось, локализация липосом в опухоли является результатом повышенной проницаемости капилляров опухолей в сочетании с нарушением лимфатического дренажа [19]. Специфическая структура кровеносных сосудов в опухоли и небольшой размер липосом приводят к устойчивому накоплению липосомного ЛП в опухоли, обеспечивая этим пассивную направленную доставку и повышение терапевтической эффективности препаратов. В морфологических исследованиях твердых и асцитных опухолей показано, что присутствие ПЭГ-липосом ограничивается в основном внеклеточной жидкостью опухоли, и они постепенно высвобождают лекарственное вещество в зоне опухоли [11], [18].
При изучении спектра специфического действия ЛФ цифелина на ряде перевиваемых опухолей мышей показано, что ЛФ превосходит субстанцию (пероральное введение в крахмальном клейстере) по противоопухолевому действию:
- на модели лимфоцитарной лейкемии Р-388 (увеличение продолжительности жизни (УПЖ) 83%, для субстанции 13%);
- аденокарциномы молочной железы (торможение роста опухоли 84% и 26%, УПЖ 25% и 9% для субстанции, соответственно);
- введение липосомного цифелина беспородным крысам с перевиваемой карциносаркомой Уокера вызывало излечение 89% животных (для субстанции 13%) при пероральном и 100% — при внутривенном введении [3], [7].
Таким образом, главная цель использования липосом в качестве носителей лекарственных препаратов заключается в селективном накоплении действующих веществ в патологических очагах (опухолях, воспаленных тканях). Кроме того, для достижения необходимого терапевтического эффекта инкапсулированный в везикулы препарат должен быть доступным для клеток-мишеней. В этом отношении липосомы отличаются от других контролируемых систем доставки, высвобождающих биологически активные соединения либо в плазме, либо непосредственно в месте введения. Захваченный препарат способен избирательно накапливаться в пораженном участке за счет пассивного или активного нацеливания.
Пассивное нацеливание — процесс, при котором липосомы благодаря своим физическим свойствам взаимодействуют с анатомическими структурами сосудов ткани-мишени и обеспечивают селективное накопление веществ. Для активного нацеливания на поверхности везикул должен находиться направляющий вектор (антитело, рецептор и т.д.), чтобы они смогли распознать «больные» клетки и связаться с ними. Далее липосомы интернализуются клетками-мишенями или разрушаются различными способами (ферментативным гидролизом либо воздействием извне, например, ультразвуком, температурой) возле поверхности клеток с последующим высвобождением препарата и его захватом этими клетками.
На примере ЛФ цифелина видно, что использование липосомного носителя позволяет значительно повысить относительную биодоступность, причем терапевтическая доза ЛП оказалась, по крайней мере, в 10 раз меньше, чем при приеме таблеток.
Вероятно, рано делать вывод о воздействии ЛФ цифелина на человеческий организм, но уже сейчас можно предположить положительный исход не только доклинических, но и клинических испытаний. С уверенностью можно сказать, что для цифелина с получением растворимой в воде ЛФ откроется «новая жизнь». Одним из определяющих моментов этого является возможность внутривенного введения, которое, в отличие от перорального, способствует полному поступлению вещества в кровяное русло, минуя действие на желудочно-кишечный тракт и разрушающее действия ферментов. А противостоять повреждающим липосомы факторам в кровяном русле научились изготовлением везикул определенного размера и добавлением липидных производных полиэтиленгликоля, что и применили в данном исследовании.
Несмотря на все преимущества и недостатки, рассматриваемые специалистами по поводу инкапсулирования цитостатиков в липосомы, на сегодняшний день такой подход является одним из перспективных направлений целенаправленной доставки препарата. И полагаю, уже сегодня можно выразить благодарности А. Бенгхэму за открытие липосом (которые он первое время называл сферулами) и Г. Грегориадису, ровно 40 лет назад впервые применившему эту структуру в лечебных целях.
Литература
- Gabizon A.A. Liposomal drug carriers in cancer therapy. In: Nanoparticulates as drug carriers / ed. by Torchilin V.P. London: Imperial College Press, 2006. P. 437–462;
- Машковский М.Д. Лекарственные средства (в 2-х томах). М.: ООО «Издательство Новая Волна», 2002. — 608 с.;
- Каплун А.П., ЛеБанг Ш., Краснопольский Ю.М., Швец В.И. (1999). Липосомы и другие наночастицы как средство доставки лекарственных веществ. «Вопросы мед. химии». 45 (1), 3–12;
- Наномедицина будущего: трансдермальная доставка с использованием наночастиц;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Невидимая граница: где сталкиваются «нано» и «био»;
- Краснопольский Ю.М., Степанов А.Е., Швец В.И. (1999). Некоторые аспекты технологии получения липосомальных форм лекарственных препаратов. «Хим.-фарм. журн.». 33 (10), 20–23;
- Швец В.И. и Краснопольский Ю.М. (2008). Липосомы в фармации. Продукты нанобиотехнологии. «Провизор». 3, 16–19;
- Оборотова Н.А., Смирнова Л.И., Круглова Г.В., Демина Е.А., Полозкова А.П., Орлова О.Л. (1996). Средство для лечения миеломной болезни. Патент № 2066183;
- Смирнова Л.И., Оборотова Н.А., Зимакова Н.И., Михайлова Л.М., Демина Е.А., Круглова Г.В. и др. (2001). Доклинические и клинические исследования нового противоопухолевого препарата — таблетки цифелина. «Российский онкологический журнал». 5, 46–48;
- Дудниченко А.С. (2000). Перспективы использования липосомальных форм противоопухолевых препаратов. «Провизор». 19;
- Allen T.M. Pharmacokinetics and biopharmaceutics of lipid-based drug formulations. In: Liposome technology / ed. by Gregoriadis G. NY: Informa Healthcare USA, 2007. P. 49–65;
- Charles O. Noble, Zexiong Guo, Mark E. Hayes, James D. Marks, John W. Park, et. al.. (2009). Characterization of highly stable liposomal and immunoliposomal formulations of vincristine and vinblastine. Cancer Chemother Pharmacol. 64, 741-751;
- Singh. (2010). Preparation, characterization, and in vitro release study of albendazole-encapsulated nanosize liposomes. IJN. 101;
- Crowe J.H., Tsvetkova N.M., Oliver A.E., Leidy Ch., Ricker J., Crowe L.M. Stabilization of liposomes by freeze-drying: lessons from Nature. In: Liposome technology / ed. by Gregoriadis G. NY: Informa Healthcare USA, 2007. P. 261–281;
- Гусаров Д.А. (2010). Лиофилизация биофармацевтических белков. «Биофармацевтический журнал». 2 (5), 3–7;
- Odintsova N., Kiselev K., Sanina N. (2001). Cryopreservation of primary cell cultures of marine invertebrates. Cryoletters. 22, 299–310;
- Brown I.M., Giaccia A.I. (1998). The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer Res. 58, 1408–1416;
- Rakesh K. Jain. (1990). Vascular and interstitial barriers to delivery of therapeutic agents in tumors. Cancer Metast Rev. 9, 253-266.