
Возможна ли жизнь без гемоглобина?
23 апреля 2013
Возможна ли жизнь без гемоглобина?
- 8241
- 1
- 5
Ледяная рыба или белокровка (Champsocephalus gunnari) обитает у берегов Антарктиды. Внешний вид представителей этого семейства напоминает известных еще древним грекам морских рыб ханна, — отсюда и длинное латинское название Channichthyidae (буквально: ханновые рыбы).
-
Автор
-
Редакторы
В декабре 1927 года норвежский зоолог Дитлев Рустад в 1750 километрах от побережья Антарктиды обнаружил очень странную рыбу с прозрачным телом и молочно-белыми жабрами. Когда Рустад вскрыл рыбу, он обнаружил, что ее кровь была бесцветной, как стекло. Так в его дневнике появилась запись «бесцветная кровь»...
«Биология — наука 21 века»
Эта работа публикуется в рамках конкурса научно-популярных статей, проведенного на конференции «Биология — наука 21 века» в 2013 году.
Зачем нужен гемоглобин?
Практически всем видам позвоночных животных для транспорта кислорода к тканям необходима специальная система доставки, поскольку молекулярный кислород плохо растворим в воде: в 1 л плазмы крови растворяется всего лишь 3,2 мл О2. Содержащийся в эритроцитах позвоночных белок гемоглобин (Hb, рис. 1) способен связать в 70 раз больше — 220 мл О2/л. Содержание Hb в крови человека варьирует в пределах 120–180 г/л, что вдвое выше, чем концентрация белков плазмы (50–80 г/л). Поэтому гемоглобин вносит наибольший вклад в поддержание рН-буферной емкости крови. По своей структуре гемоглобин взрослого человека (HbA) является тетрамером, состоящим из двух α- и двух β-субьединиц с молекулярными массами около 16 кДа. α- и β-цепи отличаются аминокислотной последовательностью, но имеют сходную конформацию.
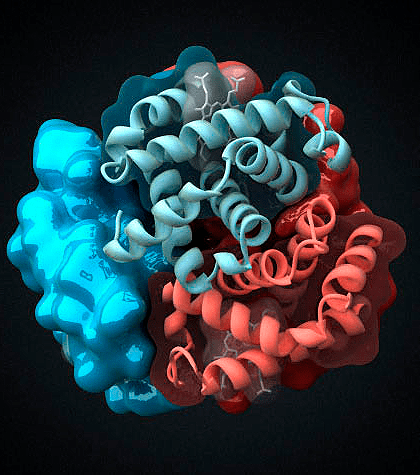
Рисунок 1. Молекула гемоглобина. Гемоглобин является одним из наиболее хорошо изученных белков. Он был открыт немецким физиологом Отто Функе в 1851 году, а структуру этого белка описал австрийский молекулярный биолог Макс Перутц в 1959 году, за что тремя годами позднее получил Нобелевскую премию по химии [1].
Visual Science
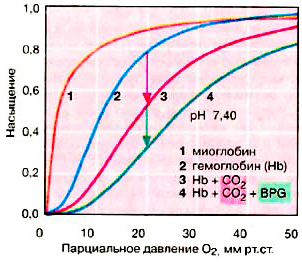
Рисунок 2. Насыщение гемоглобина и миоглобина кислородом
Каждая субъединица гемоглобина несет группу гема с ионом двухвалентного железа в центре. При связывании O2 с атомом железа в геме (оксигенация Hb) и отщеплении O2 (дезоксигенация) степень окисления атома железа не меняется. Окисление Fe2+ до Fe3+ в геме носит случайный характер. Окисленная форма гемоглобина — метгемоглобин — не способна переносить O2. Доля метгемоглобина поддерживается ферментами на низком уровне и составляет 1–2% [2]. Центры связывания O2 на каждой из четырёх субъединиц действуют кооперативно: когда молекула O2 связывается с одним из них, у других возрастает сродство к кислороду (данное явление называют положительной кооперативностью) [3]. Вследствие этого кривая насыщения гемоглобина кислородом имеет ярко выраженный сигмоидальный характер (рис. 2, кривая 2).
Другой мышечный белок — миоглобин, являющийся эволюционным предшественником гемоглобина, — является мономером и содержит единственный центр связывания O2, из-за чего его кривая насыщения кислородом несигмоидальна (рис. 2, кривая 1). Сродство к кислороду у миоглобина примерно в 13 раз выше, чем у гемоглобина (50%-насыщение миоглобина O2 достигается уже при парциальном давлении кислорода в 1–2 мм рт. ст., в то время как для гемоглобина эта цифра равна 26 мм рт. ст.) [4]. Из-за этого гемоглобин способен эффективно отдавать кислород в тканях и является более эффективным переносчиком, чем миоглобин. Но из этого не следует, что миоглобин малоэффективный и плохо устроенный белок, поскольку он выполняет принципиально иную биологическую функцию — запасание кислорода и обеспечение им митохондрий. Данные адаптивные различия между миоглобином и гемоглобином появились в результате миллионов лет эволюции...
Прозрачные рыбы
В 1927 году экспедицией норвежских китобоев близ острова Буве во время очередной промысловой охоты была поднята на сушу невиданная рыба, практически бесцветная и, самое интересное, с прозрачной («стеклянной») кровью. Это был первый обнаруженный вид позвоночных, не содержащих белка гемоглобина. За счет поразительного сходства головы рыбы с головой крокодила, рыбу назвали крокодиловая белокровка (Chaenocephalus aceratus). Белокровки (Channichthyidae; рис. 3) или ледяные рыбы обитают в холодных водах возле Антарктиды и южного побережья Южной Америки. Температура воды в этих краях опускается аж до −1,9 °C (температура замерзания морской воды ниже, чем пресной), причем является довольно постоянной.
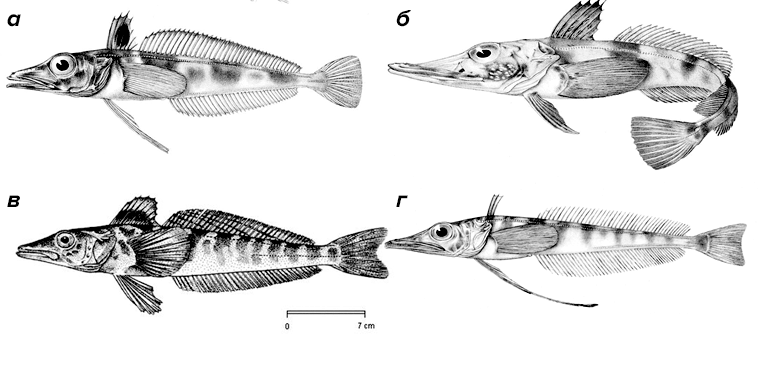
Рисунок 3. Некоторые представители белокровок. а — Chaenodraco wilsoni. б — Chaenocephalus aceratus. в — Champsocephalus gunnari. г — Cryodraco atkinsoni. Белокровки (Channichthyidae) — семейство из отряда Окунеобразные (Perciformes), в котором описано 16 видов. Данные рыбы питаются крилем, рачками и другими рыбами. Недавние исследования показали, что рацион этих рыб различается в зависимости от возраста. В целом, в рационе преобладает антарктический криль (Euphausia superba) и равноногие рачки (Themisto gaudichaudii). В рационе молодых особей преобладает Т. gaudichaudii и эвфаузииды (Thyanoessa sp.), а доля антарктического криля меньше. Ледяные рыбы достигают общей длины 25–75 см. Они являются пелагиальными представителями антарктических вод, обитают на глубине от 200 до 700 метров. Некоторые подвиды C. aceratus обнаруживаются в районе 1–2 тыс. метров. Белокровки — доминирующий вид в Антарктиде, полностью лишенный плавательного пузыря, в связи с чем многие виды этих рыб являются донными.
Очень немногие рыбы могут выжить в суровых условиях Антарктики. Ледяная рыба выживает за счет специального антифриза, присутствующего в крови и предотвращающего образование кристаллов льда в организме. Этот антифриз (AFGP, antifreeze glycoprotein) представляет собой гликопротеин, предположительно произошедший от панкреатической трипсиногеноподобной протеазы [9]. AFGP способен связываться с микроскопическими кристалликами льда и предотвращать их рост [10].
Ледяные рыбы имеют очень низкий уровень метаболизма и проводят большую часть времени практически неподвижно. Белокровки обитают в богатой кислородом воде и поглощают его непосредственно через кожу [11], потому что при пониженных температурах кровь, содержащая гемоглобин, становится очень вязкой, и выживание с такой кровью было бы весьма проблематично.
Отсутствие гемоглобина компенсируется модификацией сердечнососудистой системы. Все представители ледяных рыб имеют большее сердце, чем у других рыб такого же размера, а это увеличивает ударный объем, в несколько раз повышает общее количество циркулирующей крови и поднимает скорость кровотока. При низком артериальном давлении это достигается за счет снижения системного сопротивления потоку. Сочетание высокой пропускной способности сердечнососудистой системы, высокого содержания кислорода и относительно низких скоростей метаболизма ледяной рыбы позволяет обеспечить достаточное количество кислорода в тканях [12].
Гемоглобиновая потеря
Белокровки пережили потерю генов гемоглобина достаточно давно. Как показывает молекулярный анализ, почти у всех ледяных рыб одна мутация привела к потере гена, кодирующего β-цепь и часть α-цепи гемоглобина. Потеря способности к синтезу гемоглобина вызвала развитие компенсаторных изменений: увеличился объем сердца и общий объем крови (приблизительно в 3.5 раза по сравнению с костистыми рыбами аналогичного размера) [13–15]. Ученые, проанализировав ДНК представителей нототениевых рыб, пришли к выводу, что только у одного вида белокровок (Neopagetopsis iona) присутствуют гены гемоглобина, но они не являются функциональными [16].
Наряду с гемоглобином, у белокровок отсутствует и миоглобин, переносящий кислород в скелетных мышцах. При этом у десяти видов миоглобин сохранился только в сердечной мышце (в частности, в желудочке) [17], а у шести видов миоглобин был утрачен и там, причем механизм утраты гена у каждого вида индивидуален [18]. Общим механизмом подобной утраты является дупликация коротких (5–25-нуклеотидных) фрагментов, приводящая к сдвигу рамки считывания, преждевременной терминации транскрипции, появлению ложного сигнала полиаденилирования или нарушению связывания РНК-полимеразы с промоторной областью ДНК [19], [20].
Утрата гемоглобина первоначально должна была стать адаптацией к холоду: известно, что растворимость кислорода в холодной воде выше [21], а значит, потребность в гемоглобине, напротив, меньше. Отсутствие эритроцитов также снижает вязкость крови, что особенно критично в условиях экстремально низкой температуры. В процессе эволюции у белокровок произошли довольно радикальные изменения, компенсирующие утрату гемоглобина, включая вдвое большие энергозатраты по перекачке крови по сравнению с другими рыбами [22].
Ледяные рыбы произошли от малоподвижного донного предка. В холодных, хорошо перемешиваемых, богатых кислородом антарктических водах рыбы с низкой скоростью метаболизма могут выжить даже без гемоглобина. В середине третичного периода экологический кризис в Южном океане, вызванный похолоданием [23], привел к появлению обширных пустующих экологических ниш. Отсутствие конкуренции позволило мутантам, не имеющим гемоглобина, оставить после себя потомство, которое заселило пустые места обитания. У детенышей развились механизмы компенсации мутаций. В относительно изолированных фьордах образовались места обитания, которые колонизировали несколько особей, что привело к возникновению шести видов рыб, изолированных друг от друга и независимо потерявших гены глобинов [22].
Гистологически показано, что особенностью ледяных рыб является высокий объем митохондрий при сходном их количестве и высокое отношение липид/белок в митохондриальных мембранах в сравнении с близкородственными видами семейства нототениевых рыб (рис. 4). Интересно, что у белокровок, у которых отсутствует миоглобин в скелетной мускулатуре, но присутствует в сердечной, объем митохондрий в скелетных мышцах существенно выше, чем в миокарде. О молекулярных механизмах этого феномена известно довольно мало. Предположительно, это явление связанно с одним из ключевых белков-регуляторов биогенеза митохондрий PGC-1α [23].
PGC-1α является транскрипционным коактиватором и центральным звеном образования митохондрий в клетках. Недавно открыто, что PGC-1α регулирует состав и функции отдельных митохондрий и их окислительный метаболизм. Повышение окислительного метаболизма связано с повышенной работой PGC-1α, что сопровождается увеличением активных форм кислорода (АФК) в митохондриях. Но этот белок является и мощным регулятором удаления АФК, потому что высокий уровень PGC-1α запускает экспрессию многочисленных ферментов-антиоксидантов [25].
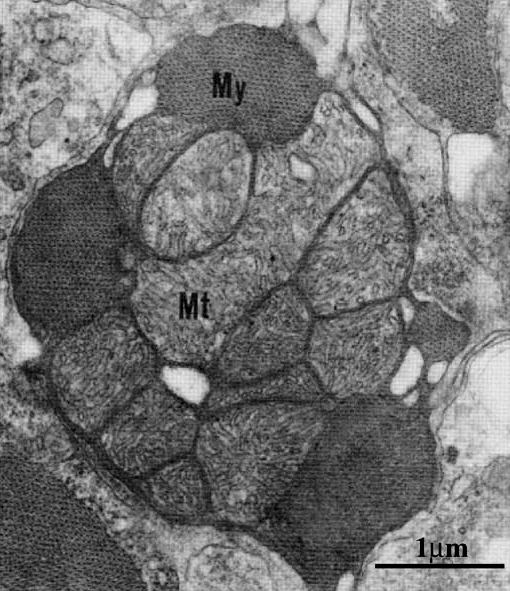
Рисунок 4. Поперечный разрез миоцитов желудочков сердца (C. aceratus). Большие митохондрии (Mt) по периферии окружены миофибриллами (My).
Регулятором биогенеза мембран митохондрий у белокровок является оксид азота-II (NO) (рис. 5). По сравнению с другими рыбами, у белокровок наблюдается повышенное содержание этого сигнального агента в крови. В ответ на потерю гемоглобина и миоглобина в мышцах ледяных рыб увеличивается биосинтез фосфолипидов, причем, независимо от синтеза митохондриальных белков и репликации митохондриальной ДНК, это приводит к увеличению размера митохондрий. Молекула NO стимулирует образование PGC-1α, который регулирует репликацию митохондриальной ДНК. Но ничего не известно о том, как биосинтез митохондриальных фосфолипидов интегрирован в этот процесс у ледяных рыб; возможно, это индуцируется высоким уровнем NO (темная стрелка на рисунке) [18].
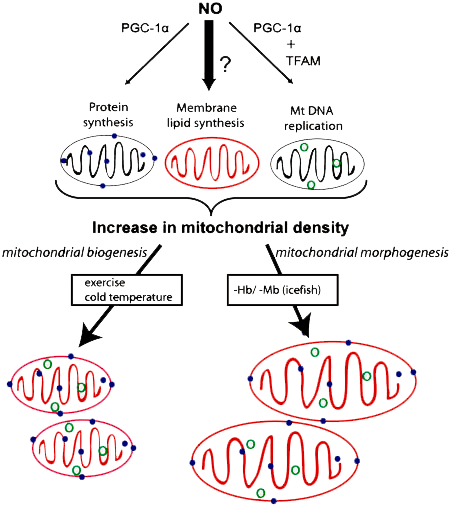
Рисунок 5. Процесс биогенеза митохондрий у ледяных рыб. Образование митохондрий включает в себя синтез митохондриальных белков (синие точки), фосфолипидов и репликацию митохондриального генома (зеленые кружки). В ответ на стимулы, такие как понижение температуры (или повышение физической нагрузки у млекопитающих) эти три компонента митохондриального биогенеза согласованно активируется, что приводит к увеличению плотности митохондрий.
Заключение
Безусловно, гемоглобин — жизненно важный белок, на котором основано дыхание большинства организмов. Эволюция гемоглобина происходила миллионы лет, но в специфических условиях Антарктики (холодная вода, обогащенная кислородом) адаптивные преимущества могут достигаться за счет эволюционной утраты гемоглобина (дезадаптация). Ледяные рыбы являются одной из ярких иллюстраций того, как гены, которые считаются абсолютно необходимыми для жизни позвоночных, в определенных условиях могут редуцироваться, обеспечивая выживание вида. Причудливы пути эволюции.
Литература
- Макс Перутц. «Наука и техника»;
- Кольман Я., Рём К.-Г., Вирт Ю. Наглядная биохимия. М.: «Мир», 2000. — 469 с.;
- Ленинджер А. Основы биохимии. М.: «Мир», 1985. — 369 с.;
- Проссер Л. Сравнительная физиология животных. М.: «Мир», 1977. — 574 с.;
- Tate R.C. Fishes. London: Printed by order of the trustees of the British Museum, 1914;
- Tate R.C. Antarctic fishes of the Scottish National Antarctic expedition. Edinburg: Robert Grant & Son, Williams & Norgate, 1913;
- Champsocephalus gunnari. Encyclopedia of life;
- Википедия: Белокровные рыбы;
- Chi-Hing C. Cheng, Liangbiao Chen. (1999). Evolution of an antifreeze glycoprotein. Nature. 401, 443-444;
- J. A. Raymond, A. L. DeVries. (1977). Adsorption inhibition as a mechanism of freezing resistance in polar fishes.. Proceedings of the National Academy of Sciences. 74, 2589-2593;
- C.-H Christina Cheng, H William Detrich. (2007). Molecular ecophysiology of Antarctic notothenioid fishes. Philosophical Transactions of the Royal Society B: Biological Sciences. 362, 2215-2232;
- Karl-Hermann Kock. (2005). Antarctic icefishes (Channichthyidae): a unique family of fishes. A review, Part I. Polar Biol. 28, 862-895;
- Yuqiong Zhao, Manoja Ratnayake-Lecamwasam, Sandra K. Parker, Ennio Cocca, Laura Camardella, et. al.. (1998). The Major Adult α-Globin Gene of Antarctic Teleosts and Its Remnants in the Hemoglobinless Icefishes. J. Biol. Chem.. 273, 14745-14752;
- Guido di Prisco, Ennio Cocca, Sandra K Parker, H.William Detrich. (2002). Tracking the evolutionary loss of hemoglobin expression by the white-blooded Antarctic icefishes. Gene. 295, 185-191;
- Guido di Prisco, Joseph T. Eastman, Daniela Giordano, Elio Parisi, Cinzia Verde. (2007). Biogeography and adaptation of Notothenioid fish: Hemoglobin function and globin–gene evolution. Gene. 398, 143-155;
- T. J. Near. (2006). A Genomic Fossil Reveals Key Steps in Hemoglobin Loss by the Antarctic Icefishes. Molecular Biology and Evolution. 23, 2008-2016;
- B. D. Sidell, M. E. Vayda, D. J. Small, T. J. Moylan, R. L. Londraville, et. al.. (1997). Variable expression of myoglobin among the hemoglobinless Antarctic icefishes. Proceedings of the National Academy of Sciences. 94, 3420-3424;
- K. M. O'Brien, I. A. Mueller. (2010). The Unique Mitochondrial Form and Function of Antarctic Channichthyid Icefishes. Integrative and Comparative Biology. 50, 993-1008;
- D. J. Small. (2003). The myoglobin gene of the Antarctic icefish, Chaenocephalus aceratus, contains a duplicated TATAAAA sequence that interferes with transcription. Journal of Experimental Biology. 206, 131-139;
- B. D. Sidell. (2006). When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes. Journal of Experimental Biology. 209, 1791-1802;
- L. Bargelloni, S. Marcato, T. Patarnello. (1998). Antarctic fish hemoglobins: Evidence for adaptive evolution at subzero temperature. Proceedings of the National Academy of Sciences. 95, 8670-8675;
- Daniela Giordano, Ignacio Boron, Stefania Abbruzzetti, Wendy Van Leuven, Francesco P. Nicoletti, et. al.. (2012). Biophysical Characterisation of Neuroglobin of the Icefish, a Natural Knockout for Hemoglobin and Myoglobin. Comparison with Human Neuroglobin. PLoS ONE. 7, e44508;
- M. R. Urschel, K. M. O'Brien. (2008). High mitochondrial densities in the hearts of Antarctic icefishes are maintained by an increase in mitochondrial size rather than mitochondrial biogenesis. Journal of Experimental Biology. 211, 2638-2646;
- F. Garofalo, D. Pellegrino, D. Amelio, B. Tota. (2009). The Antarctic hemoglobinless icefish, fifty five years later: A unique cardiocirculatory interplay of disaptation and phenotypic plasticity. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 154, 10-28;
- S. Austin, J. St-Pierre. (2012). PGC1 and mitochondrial metabolism - emerging concepts and relevance in ageing and neurodegenerative disorders. Journal of Cell Science. 125, 4963-4971.






