
Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека
08 сентября 2015
Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека
- 2306
- 0
- 6
Нитчатый бактериофаг М13 способен «выставлять» на своей оболочке в составе поверхностных белков случайные аминокислотные последовательности, заданные исследователем.
Рисунок в полном размере.
рисунок с сайта bio-faq.ru.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Одну из самых существенных опасностей для здоровья человека представляют бактерии. Но и у бактерий есть противники: вирусы-бактериофаги, которые используют микробную клетку в качестве гостиницы, где всё включено, а покидая пристанище, нередко убивают хозяина. Изобретение метода фагового дисплея позволило использовать свойства бактериофагов в поиске новых антител, которые чрезвычайно востребованы для совершенствования диагностики и терапии многих опасных заболеваний.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Антитела как лекарства
В фармакологии используются два основных понятия: лекарство и мишень. Мишень — это структура организма, связанная с определенной функцией, нарушение которой приводит к заболеванию. В случае болезни на мишень можно оказать определенное воздействие, которое должно привести к лечебному эффекту. Лекарством называется вещество, специфически взаимодействующее с мишенью и влияющее на состояние клетки, ткани, организма [1]. В качестве мишени может выступать рецептор на поверхности клеточной мембраны, фермент или канал, проводящий в клетку различные соединения. Однако путь к потребителю для любого лекарства долог: после подтверждения его функциональной активности следуют стадии доклинических и клинических испытаний, на которых малые молекулы подстерегает опасность так никогда и не стать лекарством. Под действием ферментных систем пациента они могут стать ядовитыми, или их изомеры окажутся токсичными. Низкомолекулярное вещество может выводиться слишком быстро или, напротив, накапливаться в организме, отравляя его. Поэтому в последние годы всё бóльшую долю на рынке лекарственных средств занимают макромолекулы, и среди них важнейшую роль играют антитела — защитные белки организма (рис. 1).
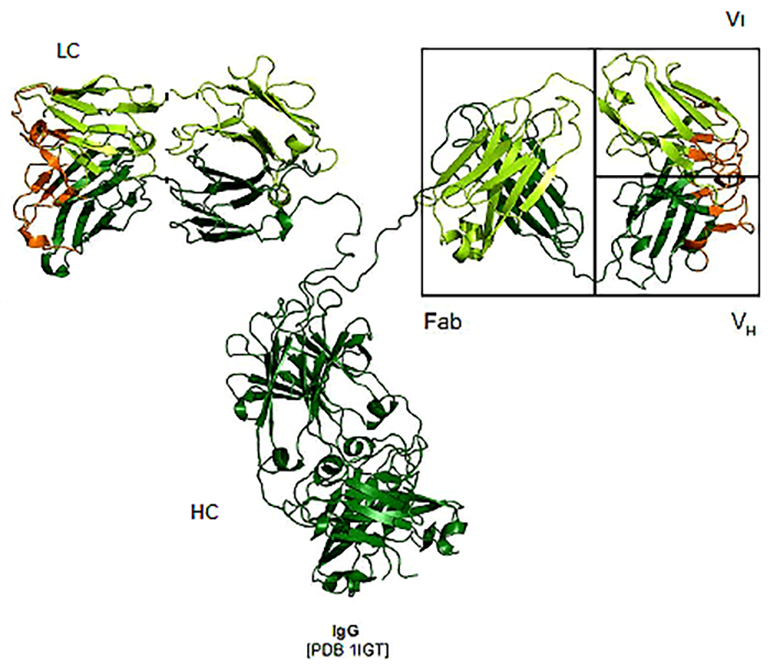
Рисунок 1. Структура антитела. Антитело состоит из двух тяжелых (HC) и двух легких (LC) аминокислотных цепей, соединенных между собой. Каждая из этих цепей имеет вариабельный домен (VH или VL), который ответственен за связывание антигена. Вариабельным он называется именно потому, что эти участки наиболее сильно отличаются у разных антител, то есть представлены множеством вариантов. Участок, который отщепляется ферментом папаином, называется Fab-фрагментом.
Когда в кровь попадает антиген — компонент бактерии или вируса, — он моментально оказывается под пристальным вниманием двух основных типов иммунных клеток: Т- и В-лимфоцитов. В-клетки после стимуляции со стороны Т-клеток или при непосредственном контакте с чужеродным агентом синтезируют антитела к нему. Некоторые из активированных В-лимфоцитов — плазматические клетки — специализируются на продукции антител, а остальные становятся клетками памяти, чтобы при встрече с тем же антигеном в будущем дать ему быстрый и эффективный отпор. Синтезированное плазматической клеткой антитело связывается с «чужаком», тем самым обезвреживая его. Происходит это несколькими путями: антитела специфически связываются с токсичными участками антигена, агглютинируют (слипаются) с крупными частицами, которые несут антигены на своей поверхности, или даже напрямую вызывают разрушение бактериальной клетки. Кроме того, «облепленный» антителами антиген становится уязвимым для других компонентов иммунитета — например, для макрофагов или системы комплемента [2].
От структуры антитéла зависят такие важные свойства, как связывание им антигена, прочность этого связывания и стабильность молекулы. Однако природа создания антител в организме очень сложна, и никто не может гарантировать, что в ответ даже на идентичные антигены образуются одинаковые по структуре антитела. Если же для создания лекарства или диагностического набора используются антитела к одному и тому же антигену, но обладающие разной структурой, то из-за разницы в стабильности и специфичности о стандартизации и воспроизводимости результатов работы можно будет забыть. Это означает, что такие антитела никак не могут стать диагностическими или лекарственными. Отсюда вывод: нужны антитела с идентичной структурой.
Антитела-«клоны» получают при помощи методов клеточной биологии из одной клетки-предшественницы. Такие антитела называются моноклональными. Их использование в качестве терапевтических агентов стало для медицины стратегическим этапом в смене концепции лечения — от неспецифической терапии к направленной. На сегодняшний день моноклональные антитела наиболее активно используются в онкогематологии, лечении опухолей, аутоиммунных заболеваний, а особенно широко — в диагностике [3].
Получение антител для нужд человека, как правило, начинается с иммунизации животных. Проводится несколько инъекций антигена, и в сыворотке крови накапливаются специфические антитела. Эти антитела, полученные напрямую из сыворотки иммунизированного животного, произведены разными плазматическими клетками, то есть они поликлональны. Для получения совершенно идентичных — моноклональных — антител в семидесятых годах прошлого века учеными Георгом Кёлером и Сéсаром Мильштейном был разработан метод гибридóм [3]. Он основан на слиянии плазматических лимфоцитов (продуцируют антитела, но не живут в культуре) и клеток миеломы (это опухолевые клетки, которые ничего не продуцируют, но зато замечательно культивируются), в результате чего такая гибридная клетка от В-лимфоцита наследует способность выделять нужные исследователям антитела, а от опухолевой — бессмертие (практически бесконечное деление).
Гибридома стала выдающимся достижением, открывшим огромные возможности для исследователей [4]. Однако антитела, которые можно получить с помощью гибридомного метода, всё же нарабатываются животными и не годятся для терапии человека. Поэтому перед исследователями встала задача получения полностью человеческих антител. Для ее решения была разработана группа методов, названная дисплейной. Общим для всех этих методов является то, что они предполагают работу со «сцепкой» нуклеотидной и аминокислотной последовательностей каждого конкретного варианта антитела. Название «дисплейные» происходит от английского display — выставлять напоказ, демонстрировать. Неотъемлемой стадией этих методов является «выставление» на поверхности фаговой частицы фрагментов антител для дальнейшего отбора нужных вариантов антигенами.
Библиотека в пробирке
Метод, который был назван фаговым дисплеем, основан на способности бактериофагов (вирусов, поражающих бактерии) выставлять на своей поверхности случайные пептидные последовательности в составе поверхностных белков [5]. Бактериофаг представляет собой ДНК, окруженную белковой оболочкой — капсидом, — и способен размножаться только внутри клетки-хозяина. Проникая туда, он беззастенчиво пользуется ферментными системами несчастной бактерии, предоставляя ей свою ДНК для синтеза необходимых для его размножения белков [6]. Инфицированная фагом бактериальная клетка послушно воспроизводит всё, что закодировано в геноме вируса, чтобы его потомство собрало свою оболочку из готовых строительных блоков. Если в геном фага-прародителя исследователем внедрена нуклеотидная последовательность, кодирующая нужный пептид, у его потомства на поверхности вирусной частицы появляется несколько копий гибридного капсидного белка, состоящего из собственной полипептидной цепи и фрагмента антитела. Множество бактериофагов, на поверхности которых представлены случайные фрагменты антител, называется фаговой библиотекой (рис. 2).
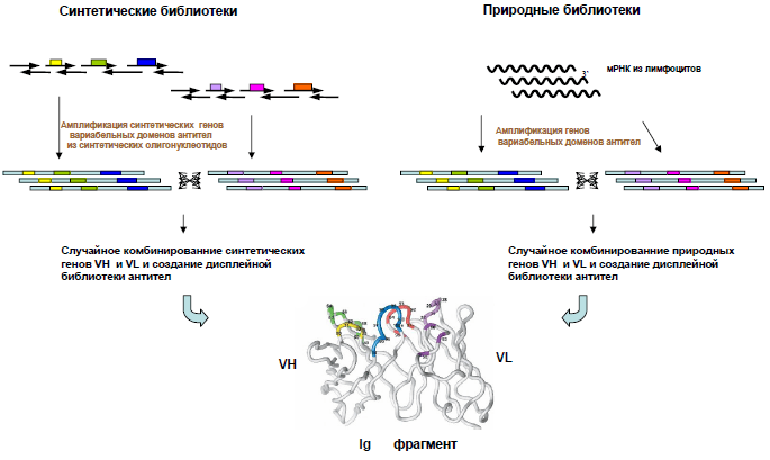
Рисунок 2. Создание синтетических и природных библиотек антител. За основу библиотеки берутся нуклеотидные последовательности вариабельных доменов антител (иммуноглобулинов, Ig), природные или синтетические. Далее их случайным образом комбинируют, и в результате образуется множество фрагментов антител, на основе которых можно создать фаговую библиотеку [8].
В современных библиотеках репертуар антител может достигать 10 миллиардов уникальных вариантов [7]. Как же выбрать из этого разнообразия всего несколько молекул, специфичных к одному-единственному антигену? В случае дисплейной библиотеки вирусные частицы работают «библиотекарями», а «читателями» становятся бактериальные клетки. Если бы поиск книг в обычной библиотеке осуществлялся так же, как антител в дисплейной, выглядело бы это весьма необычно. Допустим, перед нами стоит задача выбрать все книги об интересующем нас предмете из библиотеки, в которой находится 10 миллиардов книг: исторические, художественные, сказки, любовные романы в ярких обложках... Для поиска в дисплейной библиотеке не нужно путаться в карточках и заполнять заявку, а нужно всего лишь принести с собой сам этот предмет! И тогда к нему (антигену) тут же начнут подходить библиотекари (фаги) с книгами в руках. Специфичные книги (антитела), которые написаны только о том, что мы принесли с собой, «приклеятся» к антигену намертво, а те, в которых о предмете упоминается вскользь, можно будет без труда унести обратно на полку. После того как с помощью антигена (предмета) были найдены наиболее специфичные молекулы (книги), они передаются бактериям-«читателям». «Читатели» оказываются настолько добросовестными, что не только воспринимают информацию, но и многократно копируют ее. Отбор фагов с фрагментами антител, специфичных к антигену, называется селекцией (рис. 3).
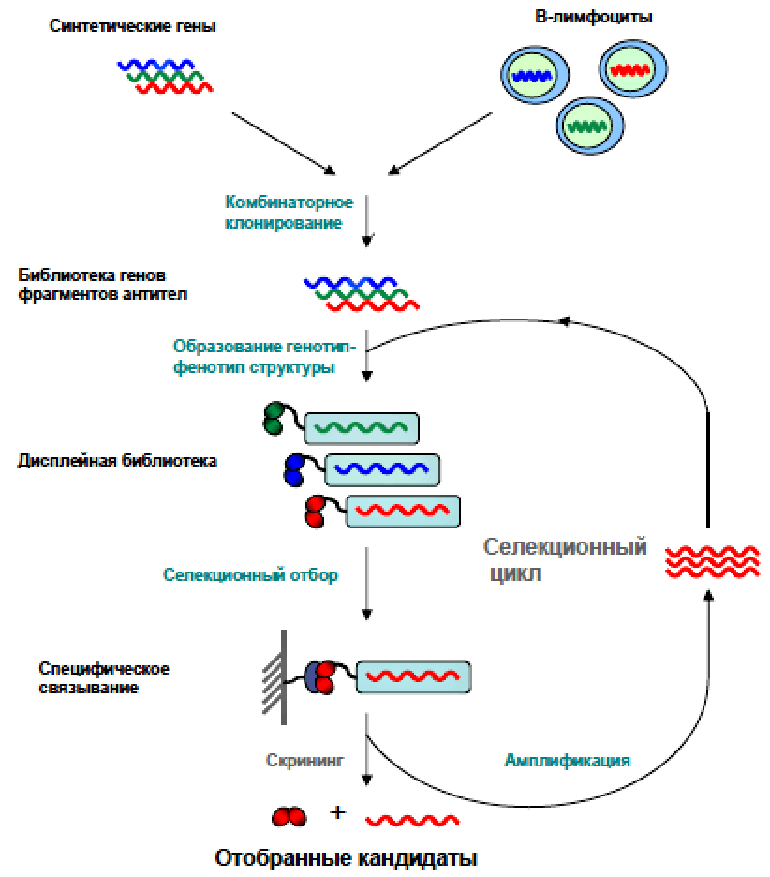
Рисунок 3. Схема селекции. Создание фаговой библиотеки из синтетического или природного источника предполагает образование структур, объединяющих в себе как нуклеотидные, так и аминокислотные последовательности фрагмента антитела (генотип-фенотип-структура). Затем обеспечивается контакт с антигеном (привязанным к пластику дисплейной библиотеки), который специфически связывается с определенными фрагментами антител, экспонированными на фаговой частице.
Обычно проводится 3–4 раунда селекции, в результате чего отбирается ДНК уже сравнительно небольшого количества фагов, и на ее основе в бактериальных клетках нарабатываются фрагменты антител для дальнейшего анализа. По источнику материала дисплейные библиотеки можно разделить на три группы.
- Библиотеки на основе ДНК иммунных клеток здоровых людей называются наивными. Раз люди-доноры здоровы, значит, их иммунным клеткам не доводилось сражаться с по-настоящему опасными антигенами. Как любого, кто не решал серьезных жизненных проблем, их называют наивными.
- Сфокусированные библиотеки создаются из клеток иммунизированного животного. В этом случае иммунной системе животного приходится потрудиться, ведь в течение нескольких недель ее регулярно атакуют, заставляя вырабатывать поликлональные антитела. Антиген, который вводят исследователи, оказывается в фокусе внимания иммунной системы животного, что увеличивает число вариантов антител к нужному антигену.
- Синтетические библиотеки состоят из генов, синтезированных искусственно [8].
Каждый из перечисленных видов библиотек имеет свои достоинства и недостатки. Например, синтетические библиотеки базируются на небольшом количестве структур вариабельных доменов антител, поэтому работать с ними гораздо проще, чем с природными, которые содержат разнообразные по термодинамическим и экспрессионным характеристикам последовательности. Зато при использовании вариантов из природных библиотек ниже вероятность развития иммунного ответа [9].
Полученные таким способом молекулы можно подвергнуть изменениям, совершенствуя их свойства. Кроме того, из одного и того же фрагмента антитела можно создать целый ряд терапевтических агентов. В зависимости от цели терапии его можно связать с токсином (например, для борьбы с опухолью), с цитокином (для адресной доставки к больному месту) или с другим фрагментом-помощником, даже с радионуклидом.
Успех современной фармакологии во многом зависит от развития таких областей науки, как молекулярная биология, биоинформатика и генная инженерия. Благодаря этим дисциплинам стало возможным синтезировать нужные последовательности ДНК, комбинировать и изменять их, а также получать животные белки в бактериальных системах. Несомненным достоинством современных технологий является то, что с их помощью можно не только получать аналоги уже существующих антител, но и создавать совершенно новые [7].
Рано праздновать победу!
Несмотря на все преимущества антител перед малыми молекулами, с их применением возникли проблемы. В 2004 году было обнаружено, что в нескольких случаях прием инфликсимаба (ремикейда, Remicade) — противовоспалительных моноклональных антител — сопровождался развитием у пациентов лимфом. В мае 2006 года в журнале Американской медицинской ассоциации (JAMA) опубликовали данные, что ремикейд усиливает риск развития рака в три раза [10]. В июне 2008 года FDA сообщило о возможной связи развития лимфом и других видов опухолей у детей и подростков с приемом ремикейда.
Установлено увеличение риска смертельного исхода у онкологических больных при приеме авастина (2,5%) — блокатора фактора роста эндотелия (VEGF) — по сравнению с использованием только химиотерапии (1,7%). Дело в том, что сам по себе Avastin (бевацизумаб) не взаимодействует с раковыми клетками. Он блокирует фактор роста эндотелия (клеток выстилки сосудов), который выделяет опухоль, чтобы создать вокруг себя больше кровеносных сосудов для интенсивного питания. Опухоль выделяет такой же VEGF, как и другие, здоровые части организма, поэтому блокирование роста определенной доли нужных организму сосудов (например, сосудов для питания сердца) оказывается неизбежным. Таким образом, в случае применения авастина повышение смертности пациентов связано не с основным заболеванием, а с сердечной недостаточностью [10].
Развитие подобных побочных эффектов предсказуемо. Живой организм — очень сложная система, и вмешательство, направленное на одну его часть, влечет за собой изменения в других. Поэтому даже с появлением такого тонкого инструмента, как терапевтические антитела, нельзя говорить об изобретении «идеального лекарства».
Современные протоколы уже основаны на комбинированном подходе к лечению, включая вакцины, химиотерапию и моноклональные антитела. Исследователям еще предстоит разработать такие препараты и схемы терапии, которые обеспечат эффективное и безопасное лечение пациентов.
Рисунки предоставлены российской биофармацевтической компанией «Антерикс».
Литература
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Как распознать рак при помощи биомаркеров?;
- Моноклональные антитела;
- Попов Н.Н. Клиническая иммунология и аллергология. М.: Реинфор, 2004. — 524 с.;
- Ильичев А.А., Миненкова О.О., Татьков С.И., Карпышев Н.Н., Ерошкин A.M., Петренко В.А., Сандахчиев Л.С. (1989). Получение жизнеспособного варианта фага М13 со встроенным чужеродным пептидом в основной белок оболочки. Докл. АН СССР. 307 (2), 481–483;
- Вирусы-платформы: яд во благо;
- Christine Rothe, Stefanie Urlinger, Corinna Löhning, Josef Prassler, Yvonne Stark, et. al.. (2008). The Human Combinatorial Antibody Library HuCAL GOLD Combines Diversification of All Six CDRs According to the Natural Immune System with a Novel Display Method for Efficient Selection of High-Affinity Antibodies. Journal of Molecular Biology. 376, 1182-1200;
- Chingwei V Lee, Wei-Ching Liang, Mark S Dennis, Charles Eigenbrot, Sachdev S Sidhu, Germaine Fuh. (2004). High-affinity Human Antibodies from Phage-displayed Synthetic Fab Libraries with a Single Framework Scaffold. Journal of Molecular Biology. 340, 1073-1093;
- Nils Lonberg. (2005). Human antibodies from transgenic animals. Nat Biotechnol. 23, 1117-1125;
- Иванов А.А. и Белецкий И.П. (2011). Терапия моноклональными антителами — панацея или паллиатив? Ремедиум. 3, 12–16.







