Земля и воля: как стриголактоны помогают гороху сохранять добрососедство
07 марта 2023
Земля и воля: как стриголактоны помогают гороху сохранять добрососедство
- 481
- 0
- 3
Выращивать зелень выгодно не только в поместьях английской аристократии, но и в лаборатории: на этот раз британские ученые с помощью гороха отыскали поистине джентльменские молекулы.
Кадр из фильма «Джентльмены»
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Британские ученые с помощью изящных вегетационных экспериментов на горохе установили, что стриголактоны важны для налаживания социальных связей в растительных сообществах. В исследовании, недавно опубликованном в Current Biology, группа биологов под руководством Тома Беннетта выяснила, что секреция определенных сигнальных молекул в почву дает возможность растениям популяции распознавать окружение и предусмотрительно организовывать свой рост с учетом потребностей живущих по соседству родственников. Свежее исследование пролило свет на богатый функционал стриголактонов в организмах растений.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
«Социальная» жизнь растений
В наши дни ученые находят всё больше доказательств довольно развитой социальной сферы в царстве Флоры. Например, индивиды в фитоценозе могут общаться посредством тактильных контактов и различных летучих соединений, с помощью отраженного света и даже звуков [1], [2].
Но особенно любопытный канал связи скрыт под землей: коммуникация друг с другом, а также с микроорганизмами там идет благодаря корневым экссудатам [1]. Вещества корневых выделений настолько важны в экологическом плане, что на них растение готово тратить до трети от всего углерода, ассимилированного листьями в ходе фотосинтеза [3].
От каждого по способностям — каждому по потребностям
Недавно лаборатории Тома Беннетта (рис. 1) из Лидсского университета удалось показать, что индивидуальные растения пшеницы в фитосообществе модулируют рост своих побегов в зависимости от доступного объема почвы, то есть от того, насколько плотно они окружены соседями. Это альтруистическое поведение позволяет популяции экономно (и справедливо) расходовать доступный запас почвенного питания долгое время. Такое самопожертвование обеспечивают вещества, называемые «сигналами считывания объема субстрата» (substrate volume-sensing signal, SVS) [4].

Рисунок 1. Том Беннетт (Dr Tom Bennett) — генетик растений и биолог развития из Университета Лидса в Англии.
Однако природа SVS, входящих в состав корневых выделений, до последнего времени оставалась неизвестной. Сегодня британские исследователи решили проверить предположение, что на роль почвенных мессенджеров годятся стриголактоны.
Стриголактон, кто ты такой?
Но почему специалисты заподозрили именно их? Вообще, стриголактоны — класс молекул бутенолидной природы, насчитывающий множество изоформ. Их относят к апокаротиноидам, то есть фрагментам каротиноидов (рис. 2).
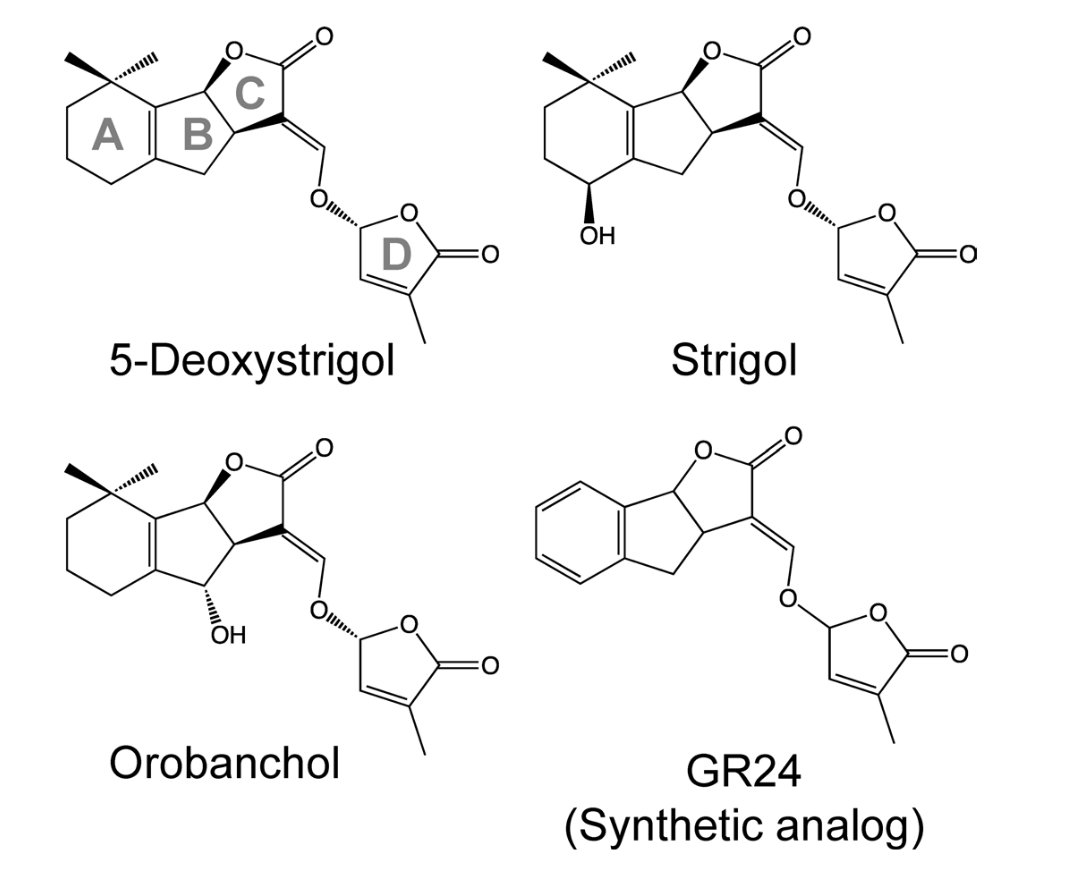
Рисунок 2. Структуры некоторых стриголактонов.
Всего их известно около 25 типов. Обычно одно растение сразу синтезирует целый ворох изоформ. На рисунке видна «визитная карточка» формулы: трициклический лактон (ABC-кольцо), соединенный енольным эфирным мостиком с бутенолидным D-кольцом.
Каротиноиды — всем известные пигменты, которые окрашивают ткани растений и задействованы в фотосинтезе. А стриголактоны синтезируются в корнях в результате их распада с помощью каротиноид-расщепляющих диоксигеназ (CCD), а также цитохромов (CYP) [5], [6].
Профессиональные киллеры
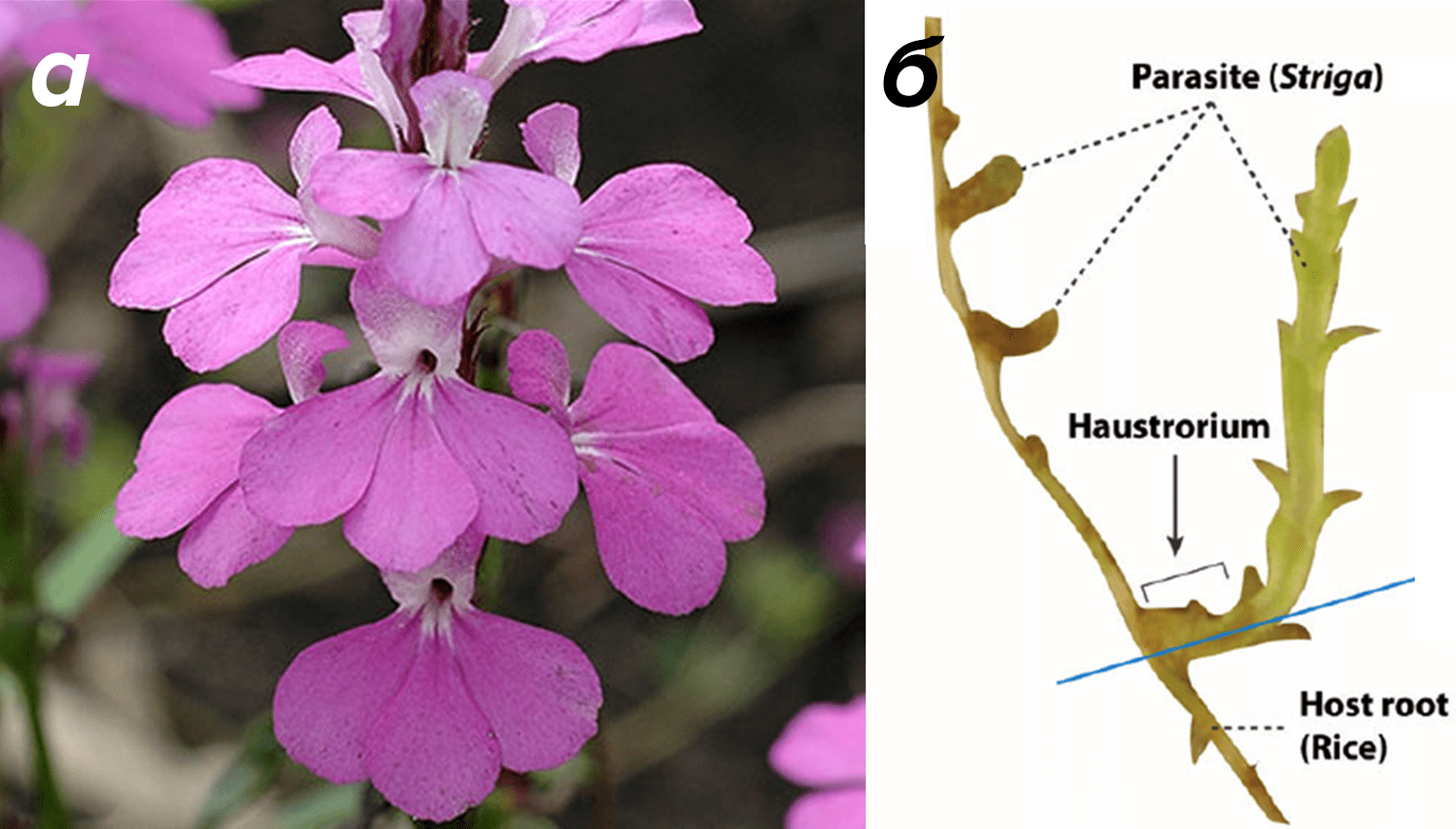
Впервые стриголактоны были описаны в далеком 1966 году в экссудатах корней хлопчатника как факторы прорастания семян растения-паразита Striga (рис. 3а) из семейства Заразиховых (Orobanchaceae). Отсюда, как не сложно догадаться, и их название [7], [8]. Striga — бич сельского хозяйства в странах Черной Африки. Этот сорняк, настоящий убийца злаковых культур, ежегодно наносит ущерб на миллиарды долларов. В Европе более известна Заразиха (Orobanche), которая чаще всего поражает двудольные растения. Многие Заразиховые вообще перестали заниматься фотосинтезом, зато развили корни-гаустории (рис. 3б).
Обычно ничего не подозревающие растения-хозяева выделяют стриголактоны в почву в очень низких концентрациях. Там стриголактоны легко гидролизуются, что создает вокруг растений убывающий концентрационный градиент. Тем не менее, даже таких исчезающе малых количеств оказывается вполне достаточно для активации покоящихся семян Заразиховых. Ведь у них есть специальные рецепторы к экзогенным стриголактонам. Активация этих рецепторов и дальнейший внутриклеточный сигналинг запускают прорастание.
Интересно, что коварные паразиты «начихали» на традиционный гиббереллиновый путь прорастания, характерный для большинства растений (рис. 4а). «Будильником» для покоящихся семян стали именно хозяйские стриголактоны (рис. 4б). Оно и не мудрено! Подобно саперам, паразиты не имеют права на ошибку. Поскольку запас питательных веществ в пылевидных семенах отсутствует, им суждено погибнуть от голода, если они быстро не отыщут хозяина по стриголактоновому следу [9], [10].
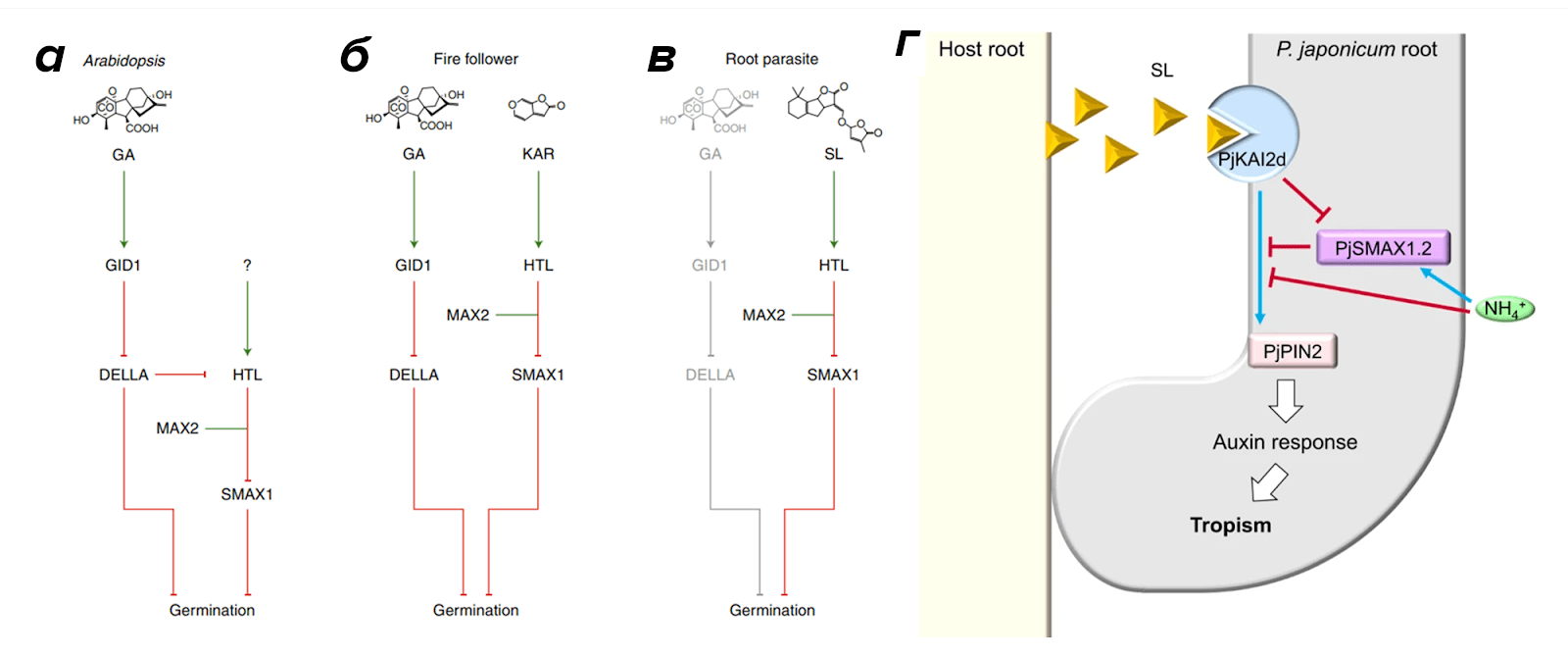
Рисунок 4. Разные стратегии прорастания:
а — гиббереллин (GA) активирует семена большинства растений, например, арабидопсиса;
б — семена растений-пирофитов реагируют и на гиббереллин, и на особые метаболиты дыма, каррикины (о них позже);
в — семена паразитов прорастают по пути независимому от гиббереллина. У Orobanchaceae есть специальный рецептор KAI2 / HYPOSENSITIVE TO LIGHT (HTL), который воспринимает стриголактоны хозяев. После распознавания стриголактонов, рецептор взаимодействует с F-box белком MORE AXILLARY GROWTH2 (MAX2), компонентом E3-убиквитин-лигазного комплекса. В результате протеолизу подвергается белок-репрессор SUPPRESSOR OF MAX2 1 (SMAX1). Снятие этого блока запускает прорастание.
Интересно, что рецептор стриголактонов принадлежит к тому же семейству, что и рецепторы каррикинов.
г — недавно описанная механика хемотропизма корешка Заразиховых в ответ на стриголактоны хозяина.
Помимо этого, совсем недавно ученым удалось показать, что стриголактоны нужны не только для пробуждения семян, но и на следующей стадии развития паразитизма. Они являются хемоаттрактантами для корней Заразиховых. Эта функция обеспечивается дополнительными рецепторами, которые вызывают реакцию перераспределения транспортеров ауксина PINов и поворот корешка (рис. 4г) [11].
Таким образом, стриголактоны — полифункциональные и жизненно необходимые молекулы для растений-паразитов. Когда ученые занялись этой проблемой, сразу же возник вопрос, зачем вообще растения-хозяева выделяют в почву соединения, пробуждающие их собственных убийц? Логично предположить, что стриголактонам изначально должна быть отведена другая роль.
Доминируй. Властвуй. Унижай
Она, и правда, есть! В тканях цветковых стриголактоны служат классическими фитогормонами: подавляют ветвление побегов и в меньшей степени корней. То есть они наряду с ауксинами и цитокининами регулируют морфогенез, в особенности апикальное доминирование.
Ученые давно знакомы с ауксинами [12]: еще Чарльз Дарвин проводил опыты по фототропизму с декапитацией проростков. Позже физиологи открыли феномен апикального доминирования и надолго зациклились на вечном противостоянии индолилуксусной кислоты и цитокининов. Парадигма была следующая: ауксины подавляют ветвление побегов, а цитокинины — наоборот. Правда, окончательный механизм действия оставался неясен.
Однажды исследователи выделили ряд мутантов (рис. 5а), демонстрирующих специфическое увеличение роста боковых почек, которое не коррелировало с каким-либо известным тогда гормональным сигналом. Неожиданно у хорошо ветвящихся растений были высокие уровни ауксина и низкие уровни цитокинина в побегах, что прямо противоречило традиционным представлениям!
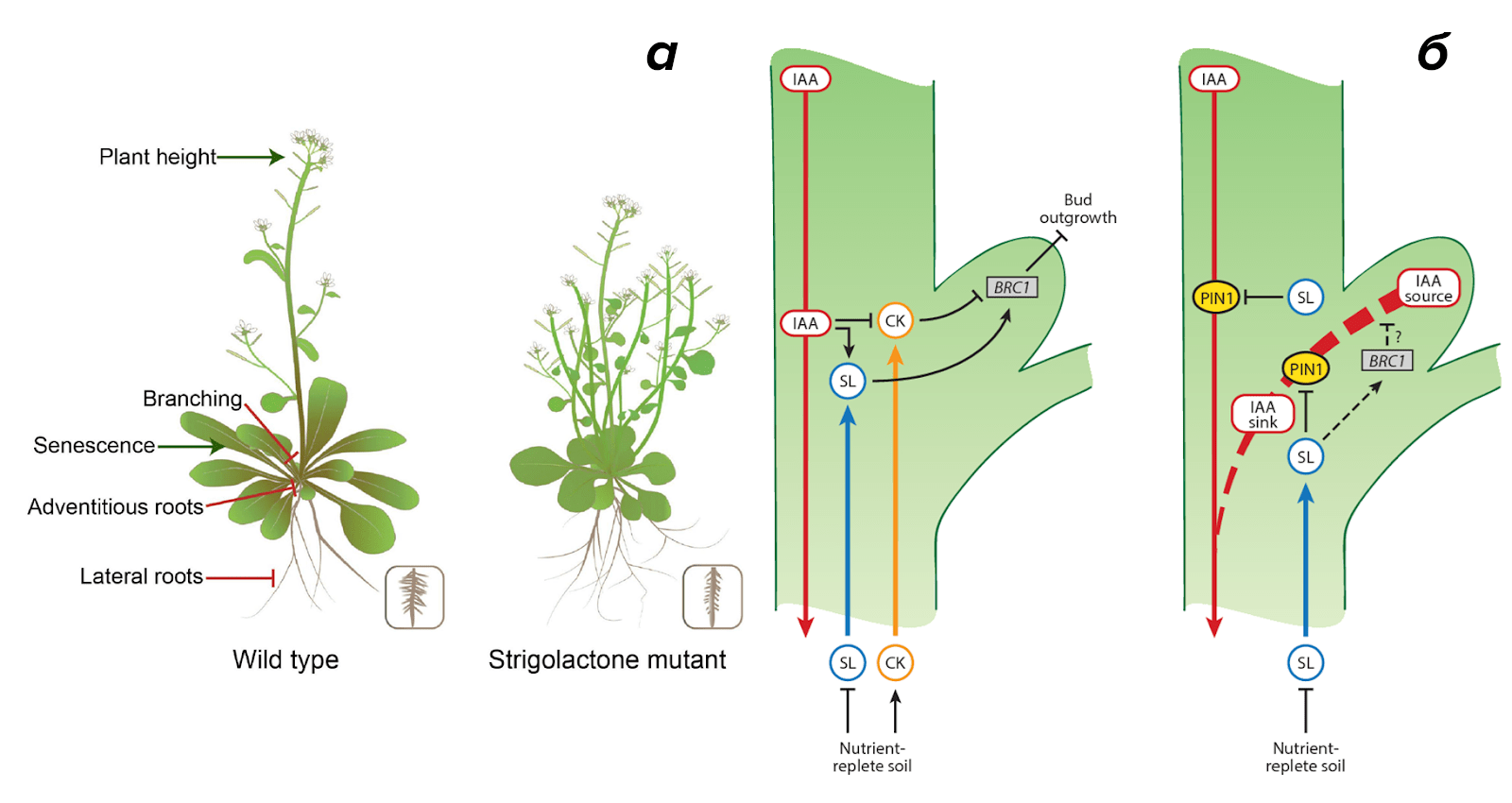
Рисунок 5. Стриголактоны разрушили устоявшийся фитогормональный дуэт.
а — «найди 10 отличий»: дикий тип (слева) и стриголактоновый мутант (справа) арабидопсиса. Так, мутант в отличие от нормального растения похож на куст: он карликовый, активно ветвится побегами, а также у него больше боковых корней.
б — феномен апикального доминирования обсуждается в каждом учебнике. Однако механизм подавления роста пазушных почек апексом побега до сих пор дискуссионен. Тем не менее теперь на красивых и сложных схемах появился «третий лишний». Это стриголактоны. Предполагается, что один из механизмов их действия заключается в блокировании оттока ауксина через PIN1 из боковых почек.
Мутанты были такие: ramosus (rms) у гороха, decreased apical dominance (dad) у петунии, more axillary growth (max) у арабидопсиса и карлик dwarf (d) у риса. Позже выяснилось, что эти фенотипы обусловлены поломками в генах биосинтеза и рецепции стриголактонов. Например, rms1, max4, dad1 и d10 объяснялись мутациями в последовательности каротиноид-расщепляющей диоксигеназы 8 (CCD8) [14], [15].
В конце концов ученым ничего не оставалось сделать, как закрепить за стриголактонами прочное место (рис. 5б) в списке регуляторов апикального доминирования у цветковых и заодно досконально разобраться с их биосинтезом (рис. 6).
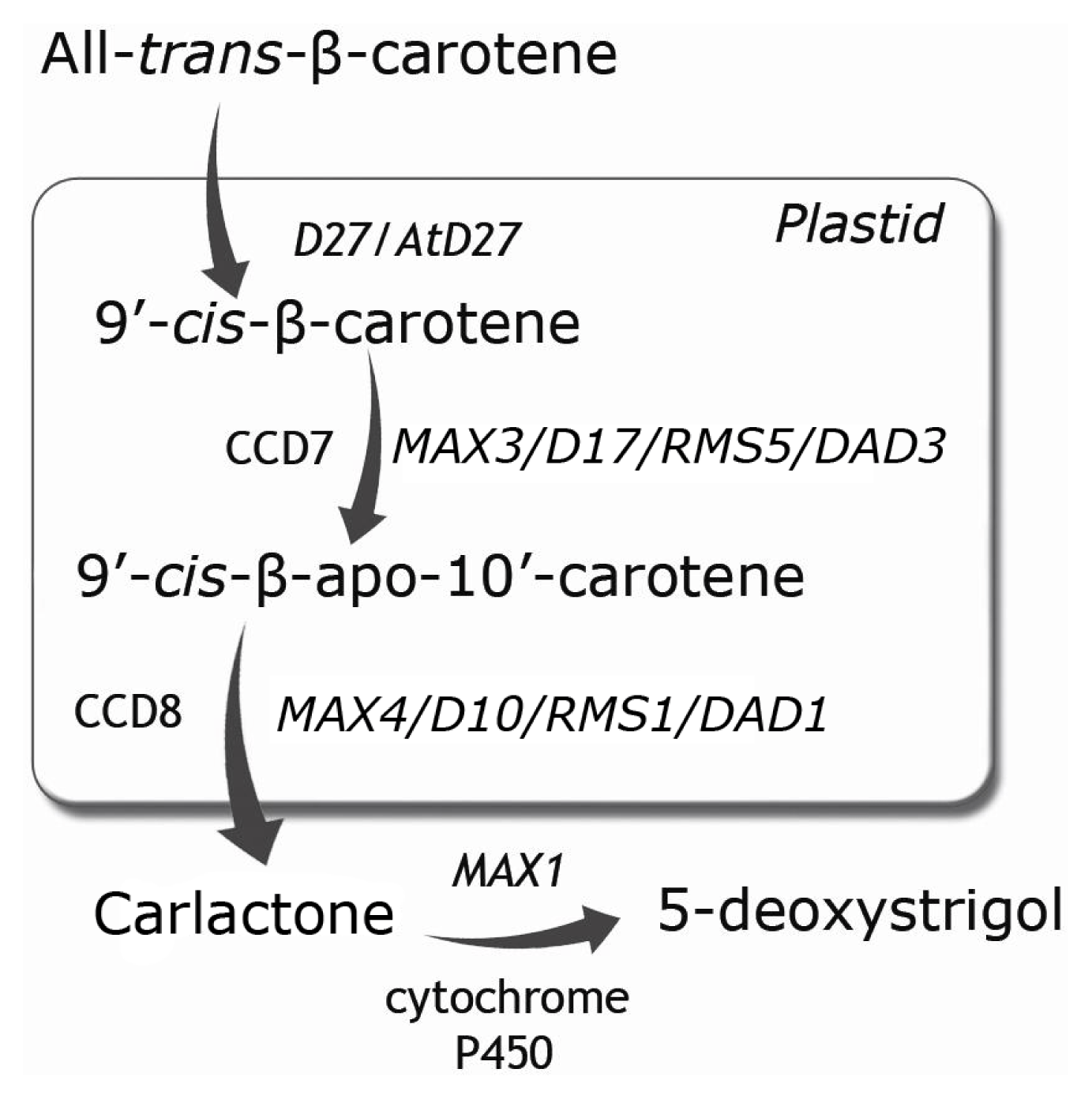
Рисунок 6. Путь биосинтеза стриголактонов и названия характерных мутантов.
Сначала в пластидах из каротиноидов каротинизомеразой (D27) и двумя каротиноид-расщепляющими диоксигеназами (CCD7 и CCD8) синтезируется карлактон. Далее карлактон в ходе окислительных реакций под действием цитохрома P450 (MAX1) в цитозоле превращается в карлактоновую кислоту. А карлактоновая кислота является предшественником стриголактонов.
Когда деревья были небольшими
Быть фитогормоном — это хорошо. Но все же главное и эволюционно древнее предназначение стриголактонов — дипломатия. Именно они устанавливают симбиотические отношения с грибами арбускулярной микоризы (AMF) [17].
В этом типе микоризы нуждается 80% современных наземных растений, начиная с мохообразных и заканчивая цветковыми. Арбускулярная микориза настолько важна для питания, что на ее содержание со стороны растения может уходить до 20% фотосинтантов [18]. Вот такая неожиданная иллюстрация закона Парето в природе!
Стриголактоны, биосинтез которых запускается голоданием по фосфату, выступают в ризосфере факторами ветвления грибных гиф. Они запускают активность митохондрий и метаболизм спор Glomeromycota [6], [19].
Арбускулярные грибы — мастера по извлечению минеральных веществ из почвы, особенно фосфора. Мицелий даже метафорично называют расширенной корневой системой, стриголактоны же — криком о помощи растений. А вышеупомянутые паразитические растения как раз научились «подслушивать» химические диалоги голодающих растений с грибами и вмешиваться в них (рис. 7).
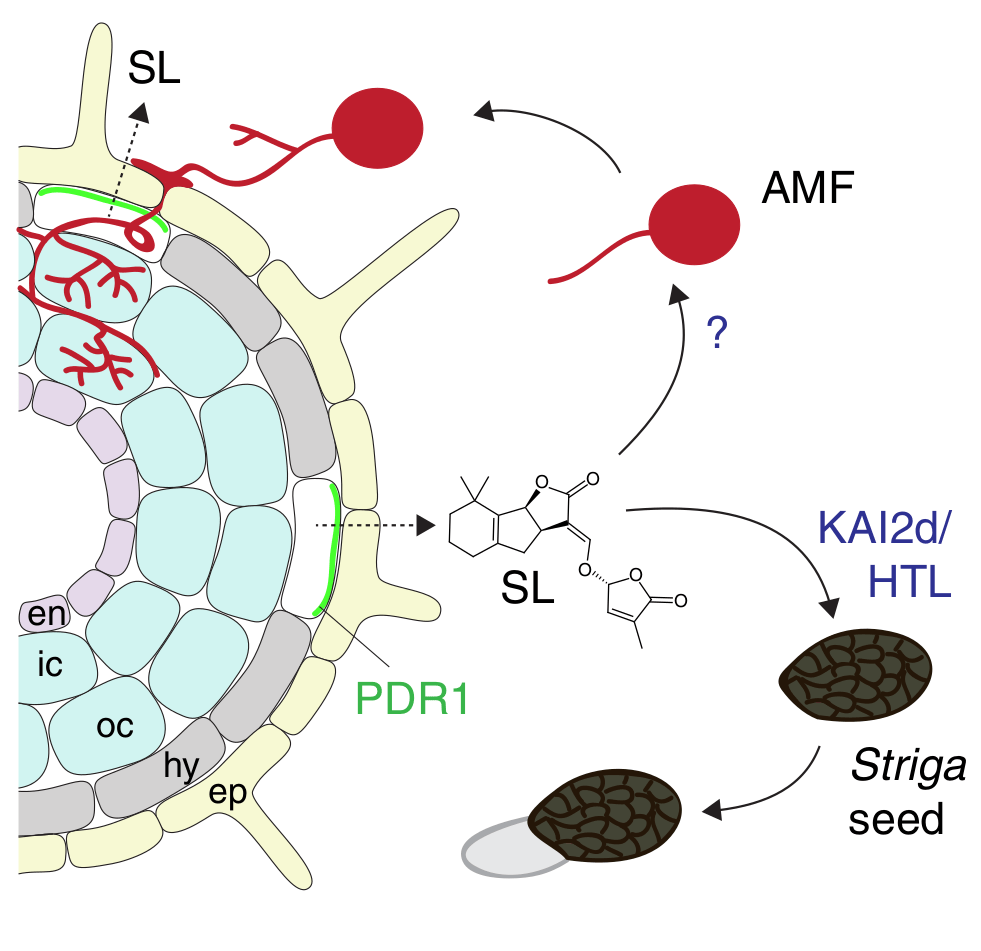
Рисунок 7. Сапплиментарная грибная поддержка или неожиданное «нападение» паразитов?
На рисунке изображен поперечный срез корня, секретирующего стриголактоны в ризосферу с помощью транспортера PDR1. В почве стриголактоны могут быть детектированы микоризными грибами (AMF) благодаря еще не описанному рецептору или же семенами Striga за счет KAI2d/HTL-рецептора.
Дальнейшее развитие событий в этих двух сценариях кардинально различается: грибы помогают растению добывать минеральное питание из почвы, а Striga, наоборот, объедает бедное растение-жертву.
По-видимому, в ответ на дефицит минеральных веществ в почве стриголактоны действуют по всем возможным направлениям для спасения растения: как эндогенные фитогормоны они подавляют совершенно неуместное при голодовке ветвление побегов, а ex planta начинают диалог с микоризными грибами.
Следует отметить, что участвовать в ризосферном сигналинге, связанном с арбускулярными грибами, стриголактоны начали гораздо раньше, чем выполнять фитогормональную функцию, а тем более паразитическую. Это было связано с более поздним и независимым от их биосинтеза появлением рецепторов к стриголактонам. Логично же, что когда сами растения выделяют стриголактоны в почву, им совершенно не обязательно уметь их рецептировать, так как вещества являются БАДами для грибов.
Более того, ученые предполагают, что стриголактоны сыграли крайне важную роль при колонизации суши предками растений (рис. 8). Гены биосинтеза стриголактонов обнаружены у многих водорослей, а также печеночников и мхов. У них молекулы стимулируют верхушечный рост ризоидов, что позволяет закрепляться лучше в субстрате. Появление пути биосинтеза стриголактонов скорее всего стало крупной преадаптацией к наземному образу жизни [13], [17], [21].
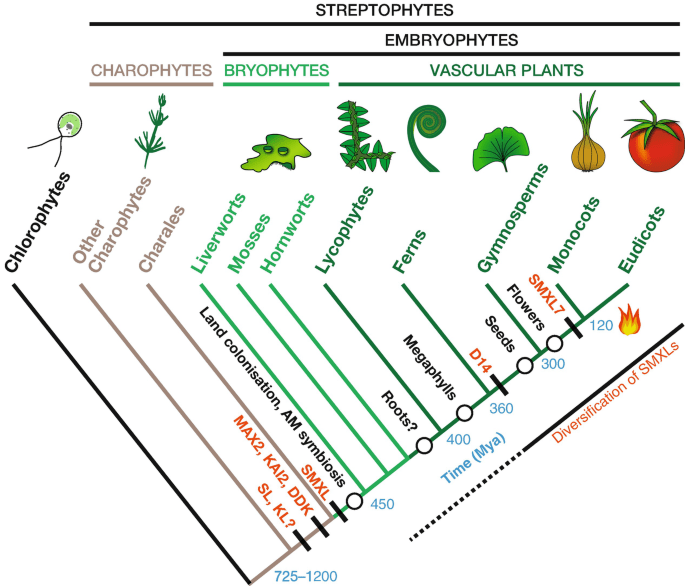
Рисунок 8. Предполагаемая схема появления некоторых компонентов биосинтеза и рецепции стриголактонов на филогенетическом древе высших растений. Биосинтез стриголактонов появился раньше системы их рецепции, хотя сами гены рецепторов, способных воспринимать их, уже были.
Если у вас нет… микоризы, то вам ее не потерять
На этот раз группа Беннетта в качестве объекта исследования использовала любимую модель Грегора Менделя — горох. Читатель может задаться вопросом: а почему не классический арабидопсис [22]?
Здесь нужно вспомнить, что Крестоцветные, к коим арабидопсис и принадлежит, потеряли способность к образованию арбускулярной микоризы. По-видимому, они утратили какие-то симбиотические гены [23]. Капустные не экскретируют стриголактоны, да и еще выделяют в почву глюкозинолаты, которые метаболизируются в изотиоцианаты — вещества не очень-то привлекательные для ризосферных обитателей. Тем не менее, даже без симбионтов Крестоцветные живут и здравствуют.
Как это часто бывает, при отсутствии одной способности компенсаторно усиливается другая. Так, у многих безмикоризных, а особенно Proteaceae, при дефиците фосфора развиваются протеоидные или кластерные корни [24]. Это настоящий ершик (рис. 9) из плотного скопления боковых корней, который заменяет тончайшие гифы грибов. Впрочем, бобовые тоже могут образовывать кластерные корни, хотя уж их точно не назовешь несимбиотическими организмами.

Рисунок 9. Протеоидные корни. Всё по по закону необратимости эволюции Долло: если уж утратил микоризу, старое не вернешь. Придется компенсировать по-другому.
Предвариловка
Но вернемся, однако, к британским ученым. Наши экспериментаторы выращивали семена гороха в гидропонной установке. Причем в двух режимах: свободно (1 растение в горшке) и скученно (4 растения в горшке). В течение 5 недель после прорастания семян они скрупулезно замеряли ветвление и биомассу (рис. 10).
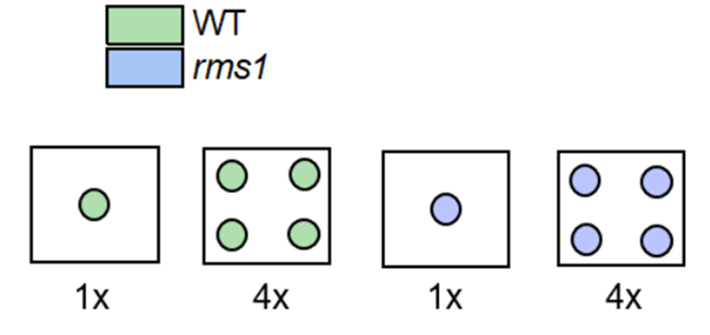
Рисунок 10. Дизайн эксперимента с диким типом и мутантами.
При скученной посадке проростки сразу же демонстрировали замедление роста по сравнению с одиночками, хотя никаких предпосылок для этого не было — благодаря проточному режиму культивирования биологи исключили возможность наступления почвенного дефицита, важнейшего фактора запуска биосинтеза стриголактонов. Значит, дело было в чем-то другом. Ученые повторили тот же опыт с мутантными растениями, не синтезирующими стриголактоны из-за выключенного гена фермента CCD8 (rms1). В густой посадке мутанты по сравнению с диким типом значительно дольше не реагировали на соседей, не замедляли рост, а их побеги продолжали ветвиться. Хотя в конечном итоге они тоже «затормаживались» (рис. 11а). Биологи вынесли свой предварительный вердикт: стриголактоны действительно как-то координируют отношения между соседями, главным образом, на ранней фазе развития.
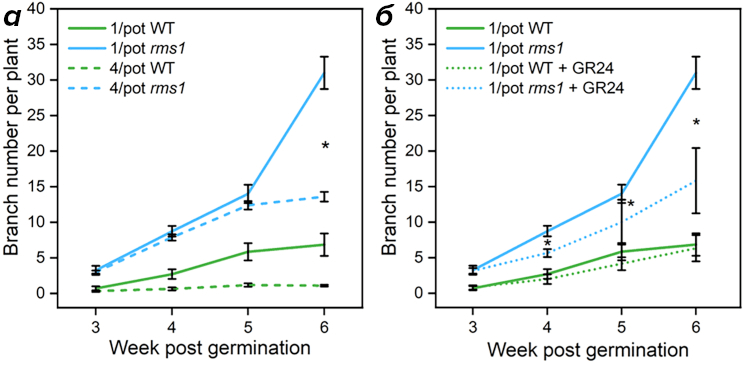
Рисунок 11. Мониторинг параметра ветвления в течение нескольких недель после прорастания.
Рисунок а наглядно демонстрирует, что мутанты по гену биосинтеза стриголактонов в скученной посадке (4/pot rms1) ветвятся в первые 5 недель после прорастания ровно также, как и одиночки (1/pot rms1).
Рисунок б показывает, что при обработке экзогенными стриголактонами одиночные мутантные растения (1/pot rms1 + GR24) начинают вести себя по-общественному, когда этого и не требуется.
Посредники или настоящие сигналы?
При этом истинная сущность стриголактонов всё равно оставалась неочевидной. Они могли быть собственно молекулами общения, которые выделяются корнями одних растений и детектируются их соседями. В то же время вещества годились и на роль вторичных посредников в передаче сигнала иной неизвестной молекулы, распространяемой в субстрате и воспринимаемой рецепторами растений.
Чтобы выбрать одну из возможных альтернатив, исследователи вырастили в одном горшке четырех мутантов по биосинтезу (rms1), добавив синтетический стриголактон GR24 . Экзогенно введенная молекула восстановила дикий фенотип, что позволило ученым принять первую гипотезу (рис. 11б).
Тогда биологи вырастили в одном горшке горох, мутантный по гену биосинтеза стриголактонов (rms1), вместе с растениями дикого типа (WT). И с помощью хроматографии детектировали небольшие количества стриголактонов в тканях мутантов. Надо сказать, что сделать это было непросто — стриголактоны выделяются корнями в пикомолярных концентрациях!
Было очевидно, что с нокаутированными генами ферментов CCD, такие растения нахватали сигнальных молекул из окружающей среды, так как синтезировать их самостоятельно они просто не могли. А это буквально значит, что передача по субстрату и восприятие «соседских» стриголактонов реально происходят!
Страшный слепец-социопат
Чтобы окончательно убедиться в том, что стриголактоны — настоящие межорганизменные сигналы, неутомимые исследователи посадили в один горшок 3 мутантов по гену фермента CCD8 (rms1), а вместе с ними 1 экземпляр другого растения, уже не экспрессирующего функциональный рецептор к стриголактонам (rms3). В процессе наблюдения выяснилось, что у трех мутантов по продукции стриголактонов слегка снизилось ветвление побегов и сухая биомасса (рис. 13а).
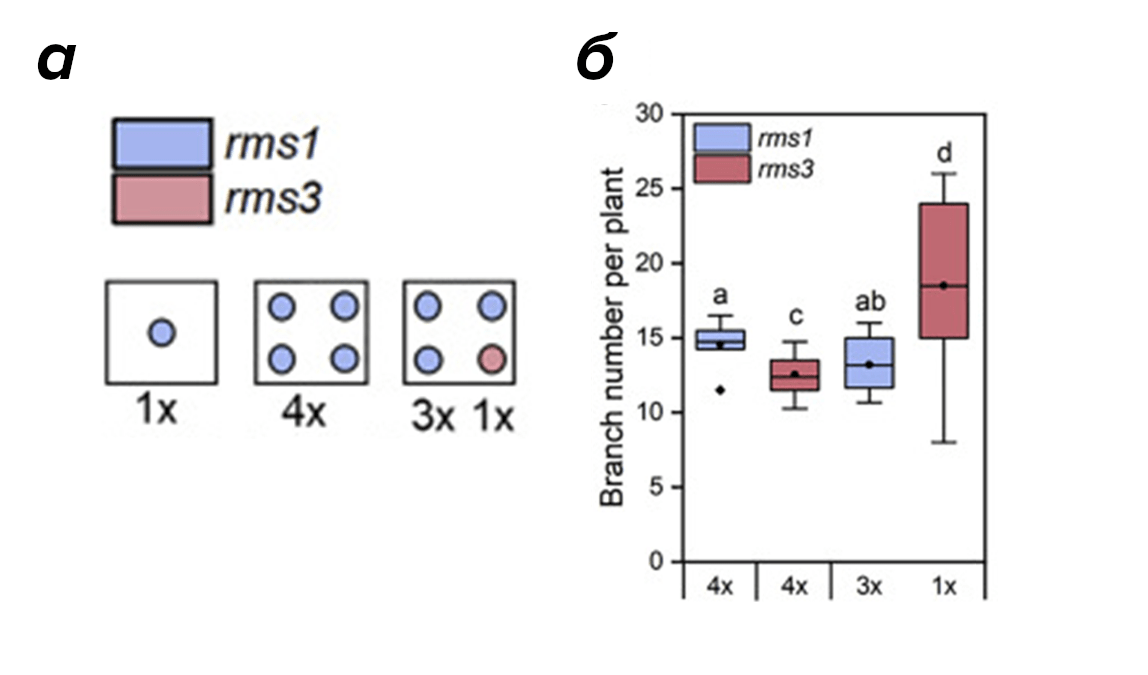
Рисунок 13:
а — дизайн опыта с «горохом-социопатом»;
б — результаты: при посадке бесчувственного к стриголактонам rms3 в окружении трех растений, не синтезирующих стриголактоны, наблюдалось значительное увеличение как ветвления побегов, так и сухой биомассы у одиночки rms3. А вот у трех мутантов rms1 все ровно наоборот.
А вот их «безрецепторный» родственник, напротив, активно разрастался. Иными словами, мутант-одиночка rms3 был совершенно слеп к присутствию рядом с ним других растений и поэтому вел себя не по-соседски (рис. 13б).
Это однозначно доказывало: экзогенные стриголактоны не просто оказываются в тканях растений, а именно воспринимаются белками-рецепторами , что в конечном итоге ведет к физиологическому ответу.
Фидбэк
Когда биологи показали, что соседские стриголактоны рецептируются окружающими растениями гороха, возник вопрос: «А что происходит в ответ на экзогенные стриголактоны на молекулярном уровне?». Ученые провели количественную ПЦР в реальном времени. Британцы не стали смотреть весь транскриптом, а прицельно сравнили экспрессию генов биосинтеза стриголактонов у растений дикого типа, выращенных свободно (1 растение в горшке) и скученно (3 в горшке).
В густой посадке у проростков гороха наблюдалось 2–3-кратное снижение экспрессии генов ферментов биосинтеза стриголактонов: каротиноид-расщепляющих диоксигеназ (RMS1, RMS5) и цитохромов (CYP711A12). Получалось, что рецепция соседских сигнальных веществ приводила к снижению продукции собственных стриголактонов по механизму отрицательной обратной связи (рис. 16).
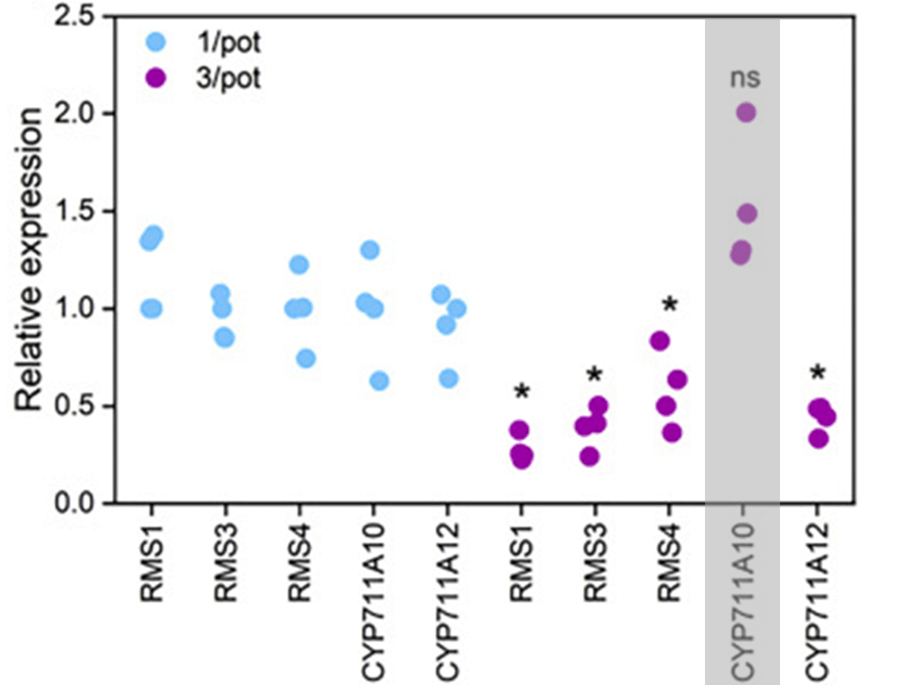
Рисунок 16. Снижение экспрессии генов биосинтеза стриголактонов в ответ на соседские стриголактоны при посадке 3 растения на горшок.
Джентльменский набор молекул
Анализ результатов подводил к парадоксальным выводам: растения гороха рецептируют «приплывшие» от соседей стриголактоны, выключая биосинтез своих молекул. И одновременно перестают ветвиться — но за эту реакцию обычно и ответственны стриголактоны?! Как же так?
Тут генетикам развития ничего не оставалось, как высказать предположение, что многообразие стриголактонов привело к диверсификации их функций. Неканонические молекулы в тканях покрытосеменных являются эндогенными фитогормонами, отвечающими за апикальное доминирование. Это их более современная сфера деятельности.
Канонические же стриголактоны, то есть самые древние, выделяются в ризосферу. А здесь — очередная функциональная бифуркация: одни изоформы — это SOS-сигналы для грибов при голодании по фосфату, в то время как другие — переговорный канал по поводу «общественного землепользования» среди родственных индивидов.
Причем выключение синтеза одних изоформ не обязательно подразумевает выключение других. Подтверждением этому служит анализ транскрипции цитохрома CYP711A10 (рис. 16). В загущенной посадке экспрессия этого гена не снижается, в отличие от всех других генов биосинтеза стриголактонов. Видимо, растения в ответ на приплывшие от соседей молекулы просто переключаются с канонических на неканонические изоформы. Тем самым горох «убивает двух зайцев»: с одной стороны, прекращает ветвиться — так как в стриголактонном пуле начинают доминировать неканонические изоформы; а с другой — уменьшает экссудацию стриголактонов в почву — за счет сокращения биосинтеза форм канонических.
Заключение
Специалисты из Лидсского университета предполагают, что экссудация «социальных» изоформ стриголактонов в почву в краткосрочной перспективе дает конкурентные преимущества отдельным индивидам, поскольку подавляет рост их соседей.
Но одновременно вся популяция получает долгосрочную выгоду. Каждый член фитосообщества, реагируя на ранних стадиях развития на определенную концентрацию стриголактонов в окружающей среде, «прикидочно» оценивает свой кусок общего пирога почвенного объема и подстраивает под него ростовые параметры — ветвление и биомассу, дабы избежать конкуренции среди сородичей. В противном случае, считают ученые из группы Беннетта, сложно было бы вообще объяснить поддержание отбором такого явления как экссудация стриголактонов. Ведь из-за них растения становятся легкой добычей смертельно опасных паразитических сорняков.
Итак, на этот раз ученым удалось отыскать у гороха довольно простую и несколько механистическую систему социальной регуляции у растений, а также добавить еще одну позицию к длинному списку функций стриголактонов в Царстве Флоры. Любопытно, что общественную значимость стриголактонов уже описывали ранее у модельного мха Physcomitrella patens [32]. Хотя мхи и не образуют арбускулярную микоризу, P. patens независимо от семенных растений приспособил стриголактоны в качестве межорганизменных коммуникационных сигналов, которые координируют разрастание популяции. Ученые даже сравнили такое поведение с чувством кворума у бактерий!
Литература
- Cara D. Wheeldon, Maxime Hamon-Josse, Hannah Lund, Kaori Yoneyama, Tom Bennett. (2022). Environmental strigolactone drives early growth responses to neighboring plants and soil volume in pea. Current Biology. 32, 3593-3600.e3;
- Plant deafness. (2022). Nat. Plants. 8, 859-859;
- Умаров М.М. Ассоциативная азотфиксация. М.: Издательство МГУ, 1986. — 134 с.;
- Cara D. Wheeldon, Catriona H. Walker, Maxime Hamon‐Josse, Tom Bennett. (2021). Wheat plants sense substrate volume and root density to proactively modulate shoot growth. Plant Cell Environ. 44, 1202-1214;
- Fenghui Wu, Yinping Gao, Wenjing Yang, Na Sui, Jianping Zhu. (2022). Biological Functions of Strigolactones and Their Crosstalk With Other Phytohormones. Front. Plant Sci.. 13;
- Mikihisa Umehara. (2011). Strigolactone, a key regulator of nutrient allocation in plants. Plant Biotechnology. 28, 429-437;
- C. E. Cook, Leona P. Whichard, Beverly Turner, Monroe E. Wall, Grant H. Egley. (1966). Germination of Witchweed ( Striga lutea Lour.): Isolation and Properties of a Potent Stimulant. Science. 154, 1189-1190;
- Prandi C. (2017). Strigolactones: new plant hormones in action. Journal of Experimental Botany;
- Yasunori Ichihashi, J. Musembi Mutuku, Satoko Yoshida, Ken Shirasu. (2015). Transcriptomics exposes the uniqueness of parasitic plants. Briefings in Functional Genomics. 14, 275-282;
- Darren C. Machin, Tom Bennett. (2020). Two routes to germinate a seed. Nat. Plants. 6, 602-603;
- Satoshi Ogawa, Songkui Cui, Alexandra R. F. White, David C. Nelson, Satoko Yoshida, Ken Shirasu. (2022). Strigolactones are chemoattractants for host tropism in Orobanchaceae parasitic plants. Nat Commun. 13;
- Ауксин — великий мотиватор;
- Mark T. Waters, Caroline Gutjahr, Tom Bennett, David C. Nelson. (2017). Strigolactone Signaling and Evolution. Annu. Rev. Plant Biol.. 68, 291-322;
- Philip B. Brewer, Elizabeth A. Dun, Brett J. Ferguson, Catherine Rameau, Christine A. Beveridge. (2009). Strigolactone Acts Downstream of Auxin to Regulate Bud Outgrowth in Pea and Arabidopsis. Plant Physiology. 150, 482-493;
- Manu Kumar, Inyoung Kim, Yeon-Ki Kim, Jae Bok Heo, Mi Chung Suh, Hyun Uk Kim. (2019). Strigolactone Signaling Genes Showing Differential Expression Patterns in Arabidopsis max Mutants. Plants. 8, 352;
- Marek Marzec, Aleksandra Muszynska, Damian Gruszka. (2013). The Role of Strigolactones in Nutrient-Stress Responses in Plants. IJMS. 14, 9286-9304;
- Kyoichi Kodama, Mélanie K. Rich, Akiyoshi Yoda, Shota Shimazaki, Xiaonan Xie, et. al.. (2022). An ancestral function of strigolactones as symbiotic rhizosphere signals. Nat Commun. 13;
- Martin Parniske. (2008). Arbuscular mycorrhiza: the mother of plant root endosymbioses. Nat Rev Microbiol. 6, 763-775;
- О.Ю. Штарк, М.Ф. Шишова, М. Н. Повыдыш, Г. С. Авдеева, В.А. Жуков, И.А. Тихонович. (2018). СТРИГОЛАКТОНЫ - РЕГУЛЯТОРЫ СИМБИОТРОФИИ РАСТЕНИЙ И МИКРООРГАНИЗМОВ, "Физиология растений". Физиология растений. 83-100;
- Aashima Khosla, David C Nelson. (2016). Strigolactones, super hormones in the fight against Striga. Current Opinion in Plant Biology. 33, 57-63;
- Carolien De Cuyper, Sofie Goormachtig. (2017). Strigolactones in the Rhizosphere: Friend or Foe?. MPMI. 30, 683-690;
- Модельные организмы: арабидопсис;
- Marco Cosme, Ivan Fernández, Marcel G.A. Van der Heijden, Corné M.J. Pieterse. (2018). Non-Mycorrhizal Plants: The Exceptions that Prove the Rule. Trends in Plant Science. 23, 577-587;
- Воронина Е. (2015). Различные аспекты биологии микоризы растений с автотрофным, миксотрофным и гетеротрофным способом питания. Кафедра микологии и алгологии МГУ;
- Dawei Wang, Zhili Pang, Haiyang Yu, Benjamin Thiombiano, Aimee Walmsley, et. al.. (2022). Probing strigolactone perception mechanisms with rationally designed small-molecule agonists stimulating germination of root parasitic weeds. Nat Commun. 13;
- Sphynolactone-7. (2018). ITbM, Nagoya University;
- Nicholas Morffy, Lionel Faure, David C. Nelson. (2016). Smoke and Hormone Mirrors: Action and Evolution of Karrikin and Strigolactone Signaling. Trends in Genetics. 32, 176-188;
- Qia Wang, Steven M. Smith, Jinling Huang. (2022). Origins of strigolactone and karrikin signaling in plants. Trends in Plant Science. 27, 450-459;
- Eugene V. Nadezhdin, Margaret S. Brody, Chester W. Price. (2011). An α/β Hydrolase and Associated Per-ARNT-Sim Domain Comprise a Bipartite Sensing Module Coupled with Diverse Output Domains. PLoS ONE. 6, e25418;
- Rohan Bythell-Douglas, Carl J. Rothfels, Dennis W. D. Stevenson, Sean W. Graham, Gane Ka-Shu Wong, et. al.. (2017). Evolution of strigolactone receptors by gradual neo-functionalization of KAI2 paralogues. BMC Biol. 15;
- Williams M. (2015). Evolution and function of strigolactone / karrikin receptors. APSB Plant Science Today;
- Hélène Proust, Beate Hoffmann, Xiaonan Xie, Kaori Yoneyama, Didier G. Schaefer, et. al.. (2011). Strigolactones regulate protonema branching and act as a quorum sensing-like signal in the moss Physcomitrella patens. Development. 138, 1531-1539.