Ауксин — великий мотиватор
27 ноября 2018
Ауксин — великий мотиватор
- 5581
- 5
- 8
Это все стоит прочитать хотя бы ради подобных потрясных фоток
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Если вы мало знаете об ауксине, то очень зря, ведь без этого растительного гормона в зеленом организме неосуществимо почти все: от закладки жилочек листа и роста плодов до приспособляемости к новым условиям среды. Еще с первых своих дней растительный эмбрион уже не обходится без ауксина. Без него о грамотном росте и развитии зеленому организму можно было бы только мечтать. Именно поэтому для меня ауксин — Великий мотиватор. Тут возникает много вопросов, которые можно свести к одному большому «КАК?!». Вот сейчас мы и попробуем ответить на него: разберемся в том, как система транспорта ауксина позволяет ему быть столь влиятельным и почему эта и без того увлекательная тема действительно важна.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Растения — очень сложные многотканевые организмы. Хоть и очень отличным от нас, им тоже просто необходимо как-то управлять всей своей махиной. В этих целях растения, как и мы, пользуются гормонами, но только своими особенными, растительными — фитогормонами.
Для меня мир фитогормонов — особая волшебная вселенная . Вселенная, которая ничуть не уступает миру наших с вами гормонов не только занимательностью, но и размером. Ведь в последние десятилетия обнаружили множество новых фитогормонов, о которых раньше мы и помыслить не могли — даже стероидные! Но из всего этого многообразия ауксин — один из наиболее изученных. Не огорчайтесь, это не значит, что изучено в нем всё, — напротив, чем больше мы узнаём, тем непреклоннее растет количество новых вопросов к этому волшебнику. Тем не менее о нем уже можно вполне подробно рассказать столько интересностей, что мне было очень и очень трудно не сделать этот рассказ еще более длинным.
И для некоторых других участников конкурса тоже. Георгий Куракин написал целых две работы, посвященных фитогормонам: «Абсцизовая кислота: гормон покоя и стресса, лекарство от сахарного диабета» [1] и «Жасмонаты: «слезы феникса» из растений» [2]. — Ред.
И, честно говоря, за время копаний в статьях, не будь я собою, наверное, уже устал бы от замираний дыхания из-за восторга от обширности его работы. Надеюсь, и вы это почувствуете — растения без такого Великого мотиватора не смогут ничего из всех тех вещей, за которые мы их так любим.
Если просто, ауксин активирует рост клетки. Чем гормона больше, тем рост интенсивнее. Такое простое действие на клетку определяет всё многообразие его влияния.
Некоторые эффекты ауксина на зеленый организм я перечислил в аннотации, а сейчас предлагаю сначала разобраться в том, почему он так работает, а уже потом перейти к последствиям всех рассмотренных ниже сложностей. Однако если вам лень копаться в биохимии, то милости прошу сразу во вторую часть, но предупреждаю, что в таком случае объяснения будут, увы, непонятны.
Такой запутанный транспорт
Пусть ауксин и просто небольшая молекула (рис. 1), многообразие его воздействий на рост зеленого организма определяется множеством транспортеров и регуляторов — в общем, самых разных белков.
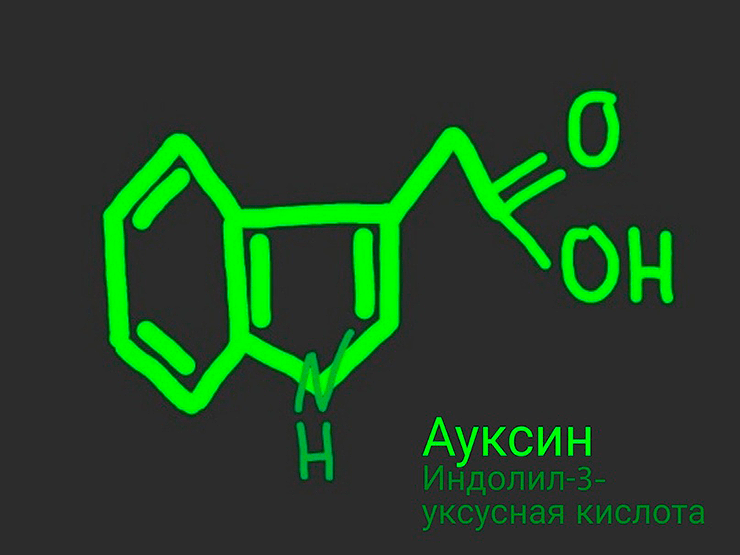
Рисунок 1. Структурная формула молекулы ауксина
И это вполне логично: Великому мотиватору без армии помощников никак не обойтись. Ведь без них он бы ненаправленно и беспорядочно диффундировал куда-нибудь и не смог бы регулировать процессы роста. И необходимым элементом этой системы является направленность — транспорт ауксина с определенной полярностью от места его синтеза к точке действия. Именно такая векторность переноса фитогормона позволяет ему задавать нужное направление роста органов растения или же более активное развитие некоторых конкретных клеток среди общего пласта. Именно поэтому полярный транспорт — особенное свойство ауксина, без которого он просто никуда.
PIN-белки — транспортеры, перекачивающие молекулы ауксина через биологические мембраны. Разумеется, это далеко не единственный для ауксина способ попасть в клетку или выйти из нее, но PIN-белков больше, чем любых других переносчиков, и многое решают именно они, поэтому сегодня займемся именно ими.
Мы знаем множество типов PIN-белков (под разными номерами), и у каждого свои особенности работы и локализации. Но все они — трансмембранные белки (рис. 2), формирующие каналы и перекачивающие ауксин через мембрану. Короче говоря, работают схоже [3].
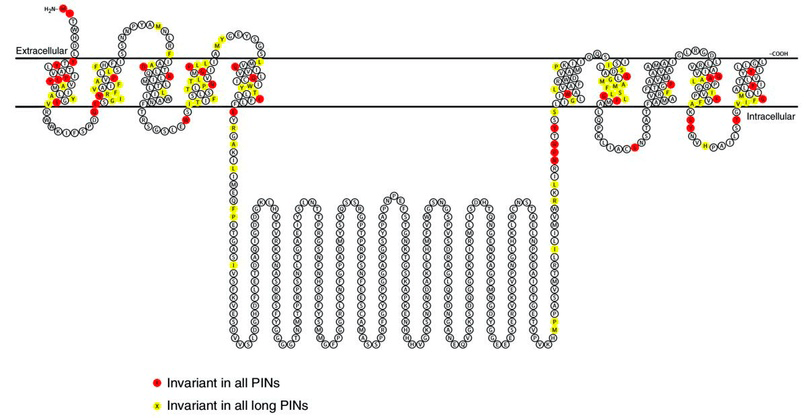
Рисунок 2. Общая модель строения PIN-переносчика и его расположения относительно клеточной мембраны, составленная учеными по последовательности остатков аминокислот в его составе. Домены, локализованные в мембране, наиболее важны, поскольку их последовательность наиболее консервативна (такие остатки помечены цветом).
Приступив к изучению PIN-белков, мы обнаружим, что здесь нас снова подстерегла система систем. Переносчики, регулирующие полярность транспорта ауксина, сами регулируются кучей способов. Вообще, они — исполнители, простые работяги, которые сами ничего не решают. Они просто перекачивают ауксин, а вот уже полярность этих процессов зависит от полярности распределения PIN-белков по разным частям мембраны. И вот на контроле и изменении этой полярности локализации переносчиков и завязаны разнообразные способы регулировки.
Куда же нам без фосфорилирования!
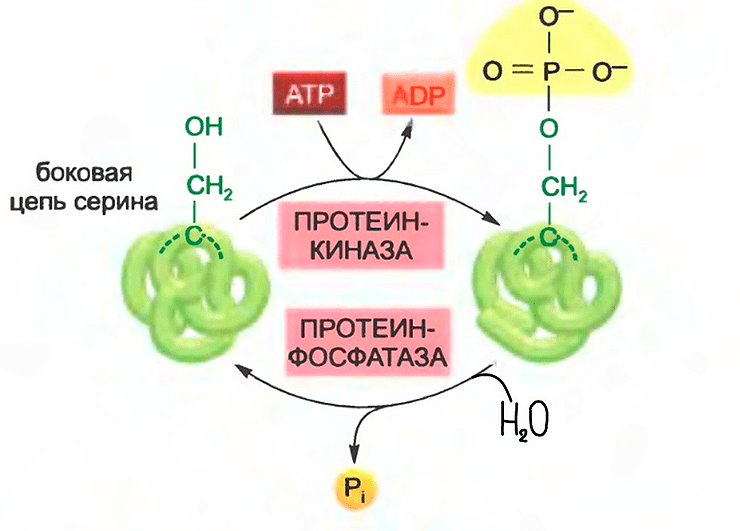
Если вы хоть немного смыслите в биохимии, то можете смело пропускать этот абзац. А я пока расскажу об этом очень распространенном среди биологических систем способе регуляции работы белков. Фермент, подверженный такому контролю, имеет, по крайней мере, один достаточно консервативный участок (обычно у PIN-белков это три гидрофильных петли), который может фосфорилироваться и дефосфорилироваться. Дефосфорилирование — акт отсоединения фосфата. А фосфорилирование — это присоединение фосфорильной (а не фосфатной!) группы (–PO32–) — советую не путать и поправлять других (рис. 3).
Наличие/отсутствие фосфорильной группы может менять свойства, активность белка (или даже вообще выключать/включать его работу). Эта регулировка проводится двумя разными типами ферментов: протеинкиназы присоединяют фосфорильную группу, фосфатазы же гидролизуют эту связь, отсоединяя фосфат (рис. 4).
А теперь вернемся во вселенную ауксина. Чаще всего киназа, работающая с PIN-белками, — фермент под названием PID. А наиболее обычная для них фосфатаза — PP2A. Установлена закономерность, из которой логично вытекает такая модель: фосфорилированные PIN-белки переносятся на апикальную (верхнюю) мембрану клетки и наоборот [3]. А уже эти и другие киназы и фосфатазы переносчиков ауксина в свою очередь контролируются разными ферментами и сигнальными путями. Вот такая регуляция.
Правда, здесь остается не совсем ясно, с помощью какого именно механизма случается это перераспределение, ведь PIN весьма замысловато путешествует по клетке...
Найти ту самую мембрану
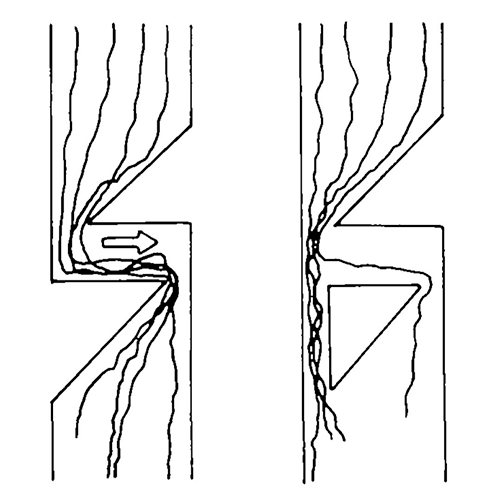
Все время переносчик PIN «бултыхается» в мембранах, и все его перемещения связаны с ними: везикулы и другие органеллы системы эндомембран (ЭПР и КГ) — его излюбленные способы миграции и пересадочные пункты. Так что обычно самостоятельно он нигде вне мембраны не плавает. Фактом является и полярность расположения PIN. Ну правда: почему в верхнем и нижнем участках клеточной мембраны переносчика может быть завались, а в ее боковых участках он встречается редко?
Одна из причин — эндоцитоз, опосредованный клатрином. И да, это абзац, который биохимикам тоже можно пропустить. Клатрин — специальный белок, который «по команде» конкретных регуляторных молекул помогает формировать везикулы (рис. 5).
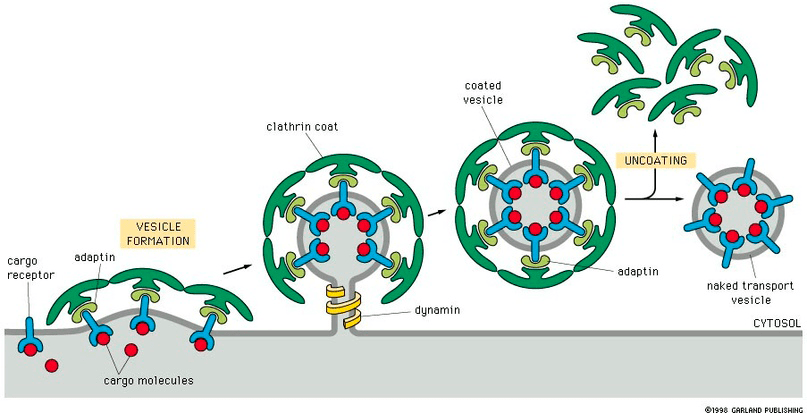
Рисунок 5. Формирование зелененьким клатрином окаймленного пузырька. Слева — первый этап, начало сборки каемки из клатрина за счет его связывания с трансмембранными белками, захватившими транспортируемые молекулы. Затем отшнуровывание каемчатой везикулы с помощью белка динамина, ну и потом транспорт куда положено и открепление молекул клатрина за их ненадобностью для дальнейшего перемещения.
Но только активность такого эндоцитоза зависит от различных белочков-регуляторов. Вообще, изменение числа переносчиков (эндоцитоз и последующий возврат в мембрану) сильно влияет на активность транспорта в конкретной части мембраны. Тут просто так ничего не случится: если переносчик поглощается клеткой или переносится на ее другую сторону, это не ни с того ни с сего, а имеет свои причины. Вот их и рассмотрим: зачем вообще нужен эндоцитоз?
Для начала, некоторые из переносчиков могут быть просто лишними, ненужными или уже отработавшими своё — такие без сожаления переварятся. А везикулы и комплекс Гольджи (КГ) чаще занимаются перераспределением PIN-переносчиков — впоследствии изменением полярности транспорта ауксина.
Некоторые «мутные» типы PIN-белков не просто путешествуют по клетке, а имеют в ней некоторое, скажем так, ПМЖ. Например, в мембране ЭПР (эндоплазматического ретикулума). Зачем? Пожалуй, единственное, на что способны PIN-белки, — перекачка ауксина. Вот и в мембранах ЭПР даже три типа переносчиков работают наперекор друг другу: один закачивает ауксин в люмен (внутримембранное пространство) ЭПР, а другие — наоборот. Зачем же?
Еще несколько лет назад предположение о том, что фитогормон изнутри ЭПР может перекачиваться в ядро и влиять там на экспрессию генов, казалось неправдоподобным. Но в последнее время оно стало уверенной теорией, и сейчас можно говорить, что путь через ЭПР — основной способ ауксина подбираться к ДНК [5]. Однако при этом люмен ЭПР становится важным элементом регуляции влияния ауксина на экспрессию генов белков, обусловливающих рост клетки (ведь тут проходит поток ауксина в ядро, его можно и перекрыть).
Химические скрепы
Так, вернемся к началу — сохранению полярности. И вспомним, что вообще-то мембрана — тоже жидкость (а точнее, жидкий кристалл) [6]: в этом плоском море липидов скорость латеральной диффузии очень высока. Конечно, эндоцитоз и фосфорилирование — это важно, но все это было бы сизифовым трудом, если бы сразу после буксировки в нужные части мембраны переносчики безотлагательно расплывались во все стороны. Ну ладно, вы уже догадались, что это «предусмотрено»: для «заморозки» транспортеров на месте у PIN-белков образовались свои скрепы.
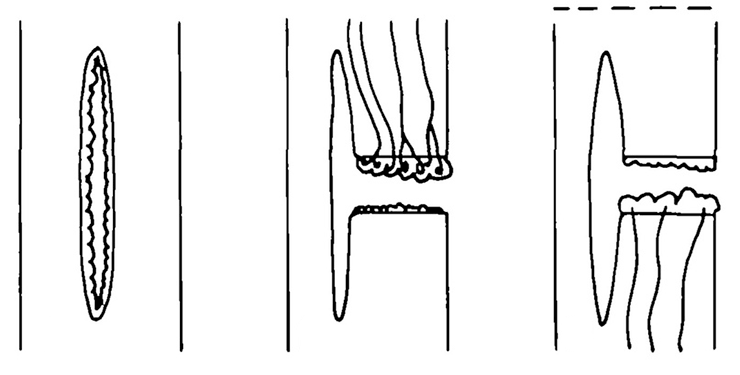
И скрепы — это даже не преувеличение. Во-первых, и вправду, часто в местах, где переносчиков для этого достаточно, они объединяются в кластеры, которые держатся примерно в одном и том же месте мембраны (рис. 6).
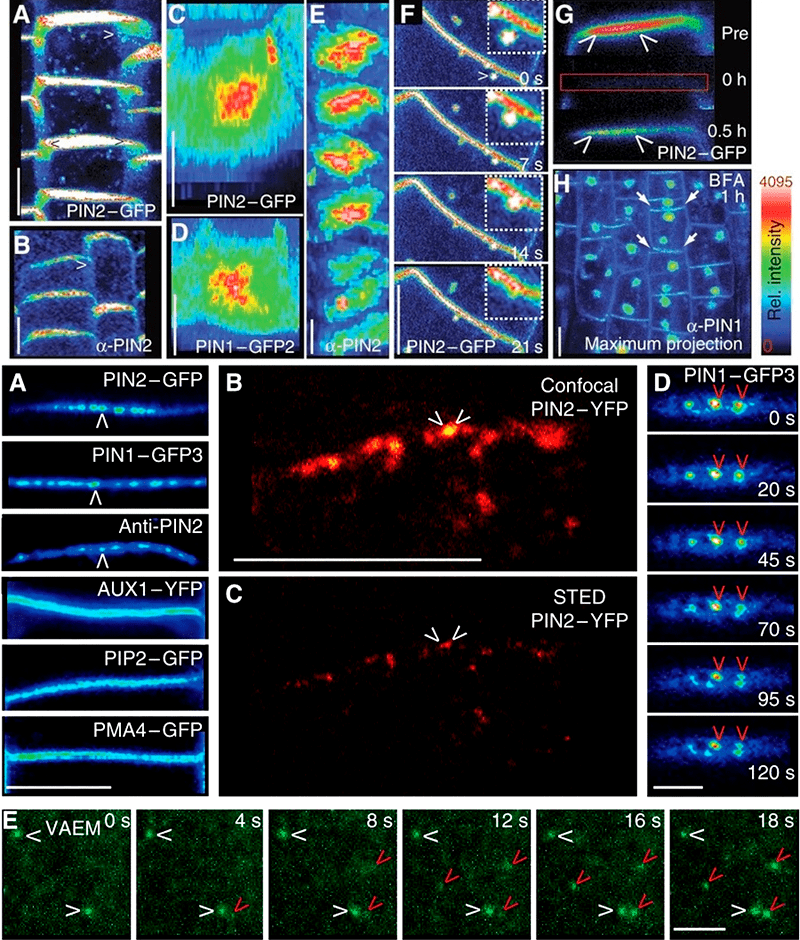
Рисунок 6. А вот и момент, ради которого стоило читать всю эту писанину: наконец можно насладиться фотографиями конфокальной и вообще флуоресцентной микроскопии. Хочется верить, вы тоже видите эти пятна — области высокой локальной концентрации переносчиков в мембране. Зная, какова скорость латеральной диффузии в липидном бислое, можно понять, что целые кластеры переносчиков остаются вместе не просто так.
Но эти кластеры PIN не просто так кружатся в липидном бислое. Обычно они вдобавок ко всему прикреплены к клеточной стенке (рис. 7 и 8). Все эти и другие опыты подтверждают идею с кластерами, «цепляющимися» за клеточную стенку.
Чем больше ауксина, тем... больше ауксина
Зачастую важнейший фактор регуляции полярного транспорта ауксина — сам гормон. Точнее, больше не регуляции, а развития конкретной направленности. Тут работает положительная обратная связь. Если полярность транспорта и может быть задана изменившимся условием среды, то обычно развитие этого направления переноса происходит благодаря самому гормону (рис. 9). Ведь транспортный ряд клеток будет тем эффективнее, чем «собраннее» будет поток переносимого вещества. Куда удобнее побольше переносчиков на меньшей площади межклеточного контакта.
Рисунок 9. Мотивируй себя сам! Стрелочки показывают направление транспорта ауксина. Здесь можно наблюдать систематизацию полярного транспорта ауксина в пласте клеток, которая развивается по тому самому принципу положительной обратной связи. В итоге из чего-то вроде болота развивается подобие реки со своим бассейном и вполне конкретным удобным руслом.
Вот настолько наш мотиватор великий — мотивирует сам себя! Но он делает это не в одиночку. Один из важных белков, контролирующих полярность транспорта в соответствии с описанным принципом — ABP1 (ауксинсвязывающий белок). И он «плавает» вне клетки — казалось бы, как там можно регулировать полярность переноса гормона? Из названия вы наверняка догадались, что этот фермент может связываться с ауксином. А в несвязанной форме вызывает тот самый эндоцитоз, опосредованный клатрином (рис. 10). Вывод: там, где ауксина мало, его транспорт происходить не будет (и наоборот).
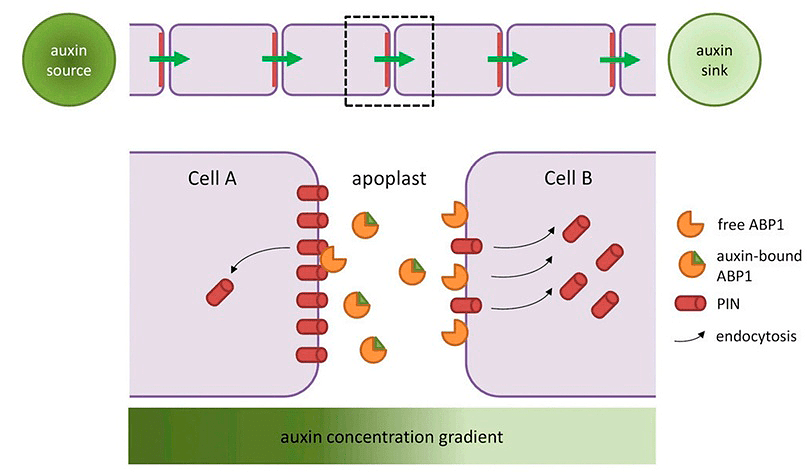
Рисунок 10. Межклеточный транспорт ауксина. Здесь ABP1 изображен этаким рыжим пэкманом, ухватывающимся за треугольный на этой схеме ауксин, а PIN-белок — просто красным конусом. По схеме понятно, что в месте контакта «пустого» ABP с рецепторами в клеточной мембране (которые для простоты не изображены отдельно) инициируется эндоцитоз переносчиков ауксина.
Разумеется, все не так примитивно. Скажем, есть специальные сигнальные пути, которые в условиях переизбытка ауксина наоборот начинают вызывать уничтожение части PIN-переносчиков. И еще множество различных и взаимосвязанных способов тонкой регуляции. Просто у нашего великого мотиватора так много функций в разных тканях и органах растения, что для их правильного выполнения требуется куча различных способов контроля его работы.
В одиночку однозначно не воин
Какие же мы молодцы: наконец разобрались в том, как работают механизмы, задающие и изменяющие направление полярного транспорта. Ну и вообще ощутили размеры и мощь этой махины (рис. 11) [10].
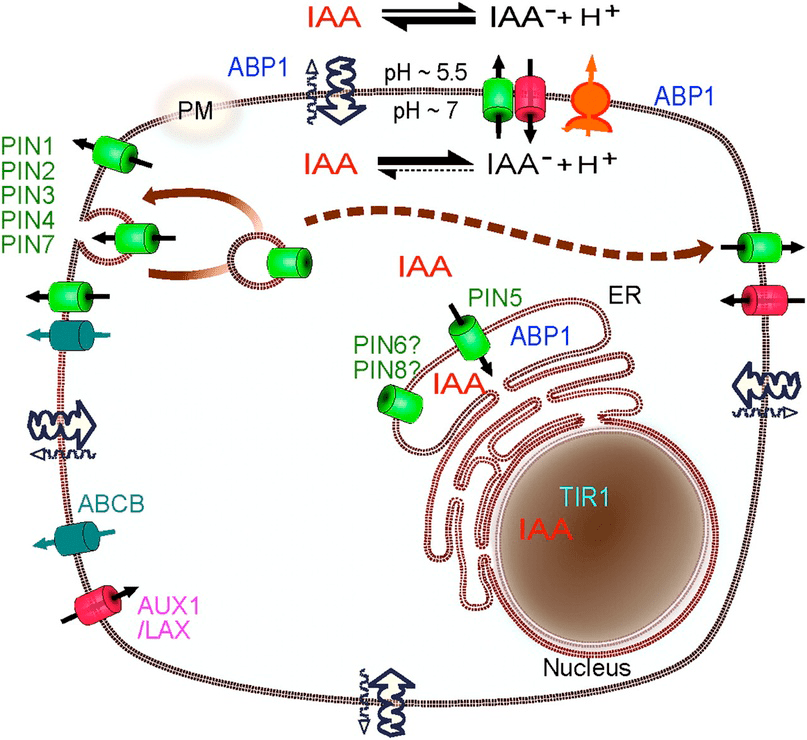
Рисунок 11. Сложность транспортной системы ауксина
И поэтому, изучая воздействие ауксина на растение, будем сразу понимать, как это работает. Так давайте же разберемся, как и какие клетки может менять система полярного транспорта ауксина (СПТА для краткости).
Импервиус ауксинус!
Многоликая и слабоизученная регуляция СПТА — это, конечно, хорошо, но пришло время переводить биохимию в волшебство нашего Великого мотиватора.
Для начала
А для начала не стоит забывать, что большинство воздействий ауксина на клетку можно свести к двум последствиям:
- Быстрый эффект — закисление среды клеточной стенки (за счет активации белка клеточной мембраны, перекачивающего протоны). В результате запускается работа ферментов, которые «размягчают» ее — вот тогда-то оболочка и растягивается под действием тургора (давления изнутри клетки). Уже через несколько минут. И это рост растяжением, он не слишком затратный: просто увеличение объема, для достижения которого не нужно синтезировать много ферментов и проходить затратные этапы качественного развития.
- Долгий эффект (проявляется спустя час после действия ауксина) — выработка различных белочков, стимулирующих уже качественный рост клетки. И как раз он зависит от транспорта ауксина через ЭПР.
Как выявляются конкретные функции белков, связанных с действием ауксина или его транспортом? Обычно за счет мутаций в генах, кодирующих их, или просто намеренного вырезания этой ДНК человеком. Ну правда, «ломается» почти любой из них — и у такого растения сразу появляются какие-то нарушения роста и развития.
С этого и начнем, ведь роль ауксина становится определяющей уже на стадиях первых клеточек (рис. 13). Направление его перераспределения задает ось полярности зеленого организма и запускает дифференцировку в будущие проводящие пучки клеток, переносящих ауксин [11].
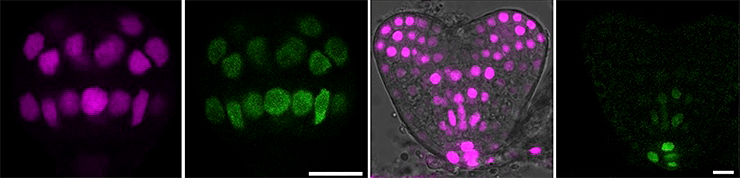
Рисунок 12. Растительные эмбрионы спустя несколько дней развития: «светятся» клетки с PIN-переносчиками в мембране (чем больше, тем ярче). По правой части видно, как СПТА задает апикально-базальную ось. Тут самое время вспомнить, как же это развивается — тот самый черно-белый рисунок. Ведь на тех же фотографиях справа видно, что светятся не только клетки в переносящих пучках, но и очень слабо — остальные. Значит, дело не в том, что переносчики синтезируются только в одной группе клеток, а в регуляции (например, уже знакомым ABP1).

Рисунок 13. Точки роста. По свечению видно, насколько высока концентрация переносчиков в мембранах именно тех клеток, которым нужно особенно активно расти (будущие пазушные почки).
А в растении постарше ауксин синтезируется уже очень локально: главным образом к этому прикладываются всякие меристемы (недифференциованные клетки обычно в апексах и примордиях) (рис. 13).
Локальные максимумы концентрации ауксина в развивающихся листочках задают направление формирования жилкования. И вообще, великий мотиватор не забывает ни про кого: и камбий активизирует, и запускает развитие боковых корней (рис. 14).
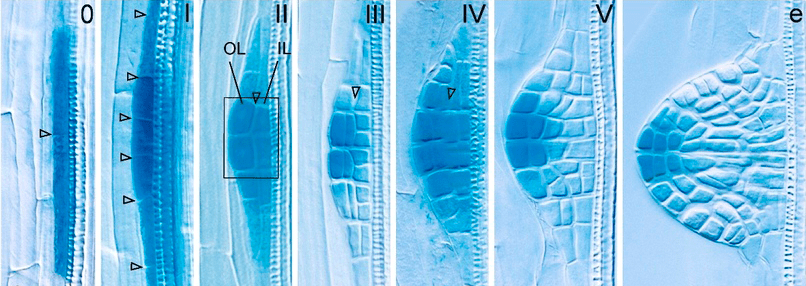
Рисунок 14. Начало развития латерального корешка. По рисунку видно, что повышенная концентрация ауксина в клетках (темно-синий цвет на I) запускает дифференцировку бокового корня и обеспечивает его рост в длину впоследствии (темные клетки на конце корешка на V и е).
Регенерация проводящей системы
Честно говоря, раньше я об этом удивительном действии ауксина и не слышал, хотя оно очень логично вытекает из способности образовывать сосуды на основе проводивших ауксин путей. Конкретный пример: вырежем кусочки из стебля растения так, чтобы срезы пересекали проводящие пути двумя разными способами (рис. 15 и 16) [9]. В итоге пучки сосудов развивались за счет изменения полярности транспорта ауксина в обход этих повреждений и делали это, судя по картинке, максимально рационально. Как видите, регенерация тоже связана с ауксином. А механизм ее очень прост: можно даже представить транспорт ауксина как «поток», который ищет, куда бы ему утечь.
Так что я бы сказал, что регенерация — нечто вроде полезного побочного эффекта ауксина, просто следствие другой его функции, поскольку это свойство не обеспечивается какими-то отдельными регуляторами.
Тропизмы — блуждая в потемках
И этот подзаголовок — не переход к фототропизму, а намек на малоизученность процесса: здесь ученые просто как недоумевающие ежики, бродящие в тумане.
Вот, к примеру, гравитропизм [13]. Точно подтверждено, что при изменении направления силы тяжести корень тоже начинает расти в другую сторону. И так же уверенно изучено, что происходит эта перемена за счет перенаправления полярного транспорта ауксина. Теперь, зная СПТА, мы даже можем запросто представить механизм таких изменений. И вот недавно изучена регуляция переносчиков фосфорилированием в ответ на изменения направления силы тяжести [14]. Непонятно только, каким образом система переноса ауксина «чувствует» важные для нее факторы среды.
С фототропизмом же дела идут лишь чуть лучше, и белых пятен, опять же, предостаточно. Очевидно только, что без таких умений растительному организму будет несладко.
Галотропизм — способность корней растений (по крайней мере, видов из этого эксперимента) избегать высоких концентраций солей в почве (видео и рис. 17). Ведь нам всем очевидно, что такие условия вообще никак не помогают всасыванию воды (в основе которого осмос, работающий как раз потому, что в клетках корня концентрация веществ выше, чем в окружающей земле). А в среде с повышенной соленостью того и гляди до плазмолиза дойдет. Короче говоря, расти подальше от таких мест корешку очень даже имеет смысл.
Видео. Галотропизм. О господи, что это такое? А это, господа, галотропизм (изменение направления роста корня из-за превышения концентрации соли в почве подальше от такого страшного места). И да, в том, что вы о таком не знаете, ничего зазорного нет — он был открыт совсем недавно, в 2013 году.

Рисунок 17. Галотропизм воочию: можно разобраться, как направление роста корня зависит от солености. Видно, что после определенного предела уровня солености корешки решительно сворачивают в сторону более нормальных условий.
Каким бы новоявленным галотропизм ни был, механизма такой реакции растения уже сформулирован. Согласно ему, повышение солености активизирует фосфолипазу, которая «пинает» клатринчик, — вот и увеличение скорости эндоцитоза переносчиков-PIN (на стороне корня, на которую действует градиент соли). Точнее, это установлено только для PIN2, а даже родственный ему PIN1 плюет с высокой колокольни на такие перемены.
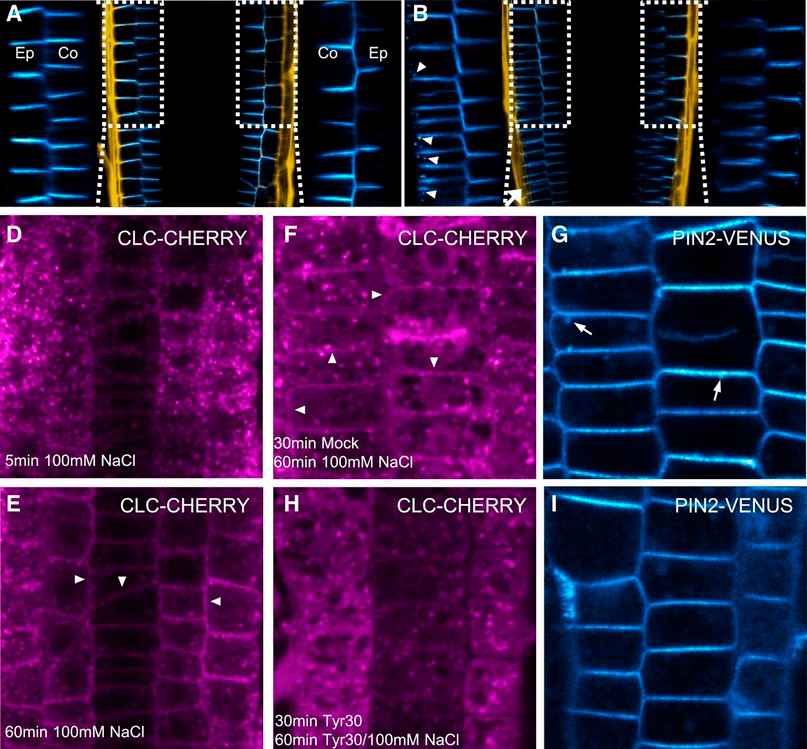
Рисунок 18. Механизм галотропизма. На фотках А и B синеньким флуоресцирует PIN2. Фото В — через 6 часов после действия градиентом соли со стороны, обозначенной стрелкой внизу. И тут очень важны эти синие точки, указанные треугольными стрелками в левой части фото В. Эти пятнышки — везикулы с эндоцитированным PIN2 — обнаружены только в клетках эпидермиса со стороны корня, ближайшей к повышенной концентрации соли, но не с другой. По фоткам D и E видно быстрое (в течение часа) перераспределение клатрина в клетках: так и жмется к мембранкам.
Галотропизм сейчас активно изучают, и вскрывается много интересного: например, он не происходит в отсутствии синих лучей (то есть когда растение растет в темноте или в красном свете), без которых не вырабатываются флавоноиды, играющие ключевую роль в этом процессе [16]. Ну и копание в галотропизме не просто фундаментальное: цивилизация потребляет всё больше пресной воды, поэтому уровень солености водички для полива понемножечку, но повышается.
ОПГ ауксина и глобального потепления
Адекватное повышение температуры ускоряет развитие проростков не просто так, а тоже за счет активизации системы выработки и транспорта ауксина. Разве это не прекрасно (рис. 19)?
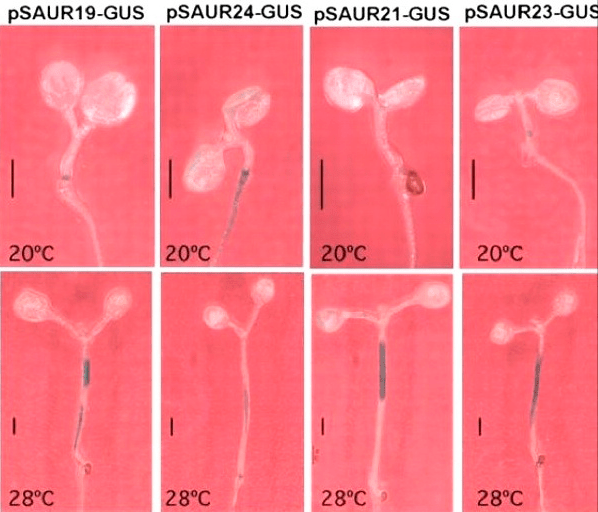
Рисунок 19. В теплоте, да не в обиде. Сравнение размеров проростков: видно, как разнится длина в зависимости от температуры.
На самом деле, не совсем. Ведь это значит, что глобальное потепление ускоряет рост растений. И это далеко не так классно, как может показаться: если рост опережает уровень качественного развития, это ослабление продуктивности растений (банальный пример: хилые вытянувшиеся проростки на затемненном подоконнике). Конечно, тут можно возразить: мол, ты же сам говорил про всякую регуляцию действия ауксина на клетку.
Но совсем недавно было проведено исследование, в котором изучили регуляцию синтеза белка, находящегося в ЭПР и ограничивающего поступление ауксина в ядро (путем связывания с ним — секвестирования), — а значит, и запуск им экспрессии (реализации информации) генов белков, важных для активного роста клеточки. И оказалось, что выработка этого фермента очень чувствительна к повышению температуры (количество белка снижается с ее ростом) (рис. 20). Значит, глобальное потепление потенциально способно вывести действие ауксина на экспрессию конкретных генов из-под контроля [18].
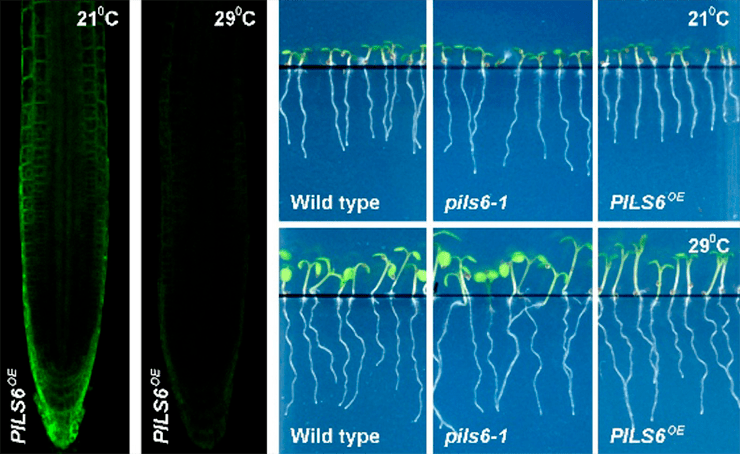
Рисунок 20. Влияние температуры. По двум левым фоткам видно, насколько разительно отличаются уровни экспрессии белка-ингибитора действия ауксина при разных температурах. А по проросткам справа — последствия для реального роста.
Выходит, что быть Великим мотиватором — конечно, круто, но даже в такой роли стоит вовремя останавливаться.
Но на этом я не могу поставить точку в теме связи глобального потепления с фитогормонами, ведь все завязано не только на ауксине. Продолжим ее в следующих частях.
Независимые баклажанчики
Не хватило важных эффектов ауксина? Вот вам еще! На этот раз СПТА стимулирует рост завязей — плодов (в которые преобразуются завязи) у цветковых растений. Только, очевидно, обычно используется этот необходимый допинг уже после секса: иначе зачем тратить ресурсы на плод, который никак не поможет потомкам, поскольку не содержит семян?
А ученые в свое время, конечно же, стали такие предположения проверять — придумали эксперимент с баклажаном. Ну а почему бы и нет? Исследователи встроили в последовательность растения бактериальные гены ферментов для синтеза индолилуксусной кислоты (ИУК, или гетероауксина). Собственно, они с избытком выполнили свою задачу. Вдобавок дисбаланс синтеза ИУК предотвратил образование семян. А сами баклажаны вышли здоровенными — были размером вчетверо больше обычных.
Так и доказали, что именно ауксин важен для развития плода [19].
Зов предков
Кажется, после этого объема инфы мог остаться лишь один нераскрытый вопрос. Вот влияет этот ауксин на всё, а как же долго он, такой важный, контролирует что ни попадя?
Что же, и так очевидно, гормон очень уж «старенький»: десяток переносчиков и десятки других белков — так или иначе эта система не могла не развиваться очень долго. Гуру молекулярки еще наверняка отдельно отметит аж несколько типов переносчиков в мембране ЭПР: это особенно яркий признак древности. Но пора прекращать теоретизировать и уже рассказать все по фактам и с бомбическими снимками.
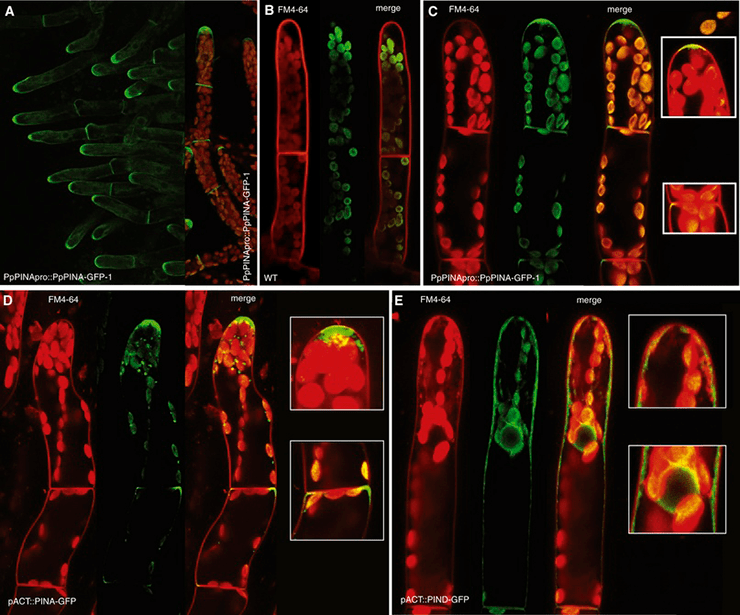
Недавно и довольно неплохо была изучена работа СПТА у модельного вида мха Physcomitrella patens [20], [21]. Вот он, кстати (рис. 21). И у него были обнаружены сразу несколько типов PIN и других белков, занимающихся регуляцией действия нашего мотиватора на клетки. Даже в мембране ЭПР переносчик ауксина нашли! Первая стадия развития мха из споры — протонема (рис. 22).
Кажется, вы уже догадались: ученые установили, что развитие из одной клеточки именно «нити» клеток происходит благодаря полярности транспорта ауксина (рис. 23).
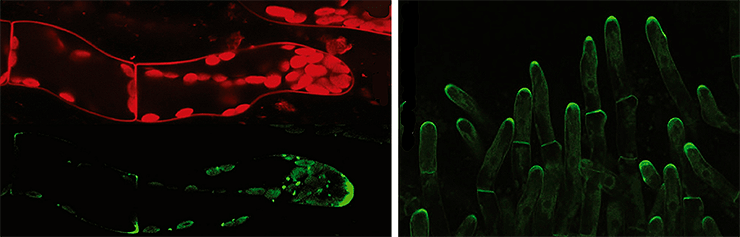
Рисунок 23. Полярный транспорт ауксина во мху. Пятна внутри клеток — переносчики в мембране ЭПР. Собственно, обе фотографии явно демонстрируют полярность расположения переносчиков (где ярче, там их больше) — соответственно, и полярность проводимого ими транспорта, которая обеспечивает апикальный рост нитей мха.
А чуть позже протонема функционально и морфологически разделяется на две части: зеленую и фотосинтезирующую хлоронему и каулонему, играющую роль якоря, закрепляющего организм в почве (рис. 24). И эта дифференцировка тоже напрямую зависит от градиента концентрации молекул нашего Великого мотиватора.
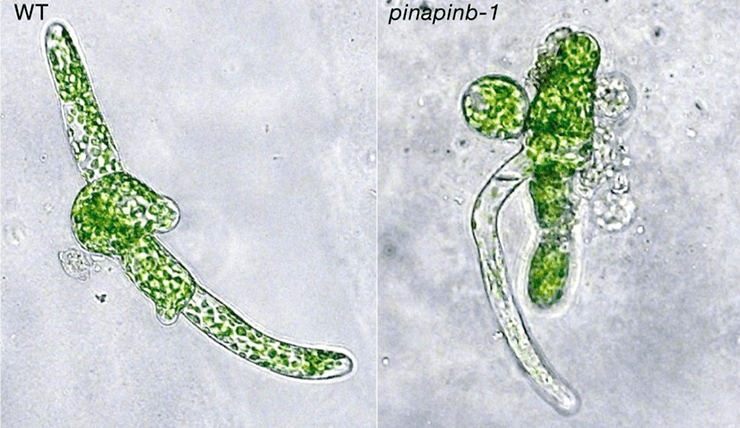
Рисунок 24. Дальнейшее развитие мха. Справа уже произошло разделение на хлоронему и каулонему.
Затем нужно продолжать развиваться: например, необходимость «листьев» тоже никто не отменял (в кавычках, потому что выпячивания стебля мха по причине простоты своего устройства не соответствуют характеристикам, которым должен соответствовать настоящий лист). Развитие «листочков» Physcomitrella patens запускает и контролирует тоже ауксин (рис. 25).
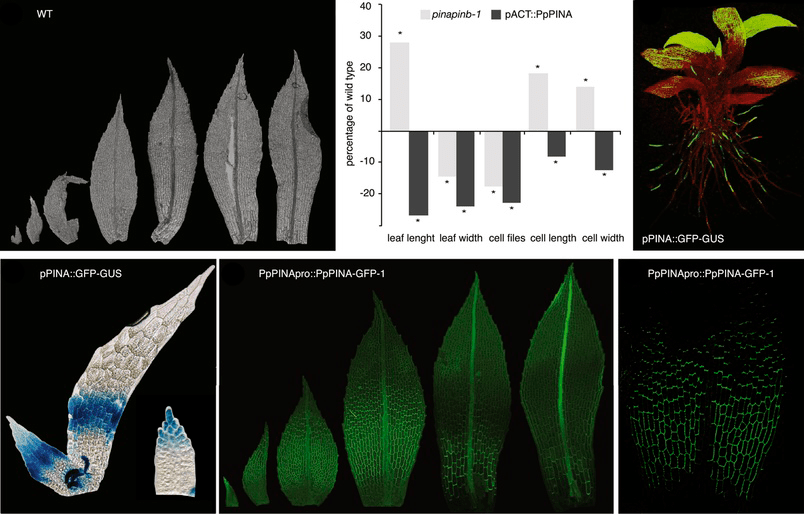
Рисунок 25. Развитие «листьев» мха. На снимке видно, сколь много переносчиков в активно растущих клетках (на концах корешков и молодых «листьев»).
Короче говоря, ауксин точно «захватил власть», начиная еще с самых примитивных растений. Логично предположить, что если нормальное развитие спорофита мхов завязано на ауксине, то и у других групп мохообразных он же контролирует этот процесс. Раз фототропизм сегодняшних наземных растений определяется нашим Великим мотиватором, то, скорее всего, и у древнейших высших растений тяга к солнышку сразу развивалась с эволюцией его полярного транспорта.
Не в одиночку
Несмотря на всю сложность системы управления жизнью растения (рис. 26), связанной с ауксином, она работает во взаимодействии с другими (тоже весьма непростыми!) фитогормонами, причем ауксин и иной гормон вполне могут быть антагонистами. Например, ауксин может задерживать образование отделительного слоя в листьях и плодах — в этом случае противостоит этилену (обычно он стимулирует различные формы старения).
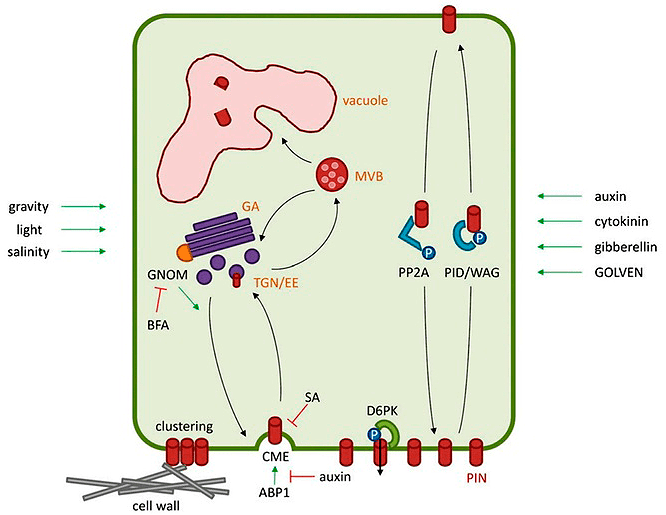
Рисунок 26. Одна из схем, дающих общее представление о взаимосвязи работы разных компонентов СПТА. Справа стрелочками обозначены факторы, которые могут дополнительно действовать на всю эту красоту.
Поскольку мы еще не изучили так подробно работу других фитогормонов, то и об их сложном комплексе взаимных влияний друг на друга говорить пока рано. Ведь хочется верить, что интересностей из этой статьи вполне хватило. Так что я заброшу удочку-интригу на следующий раз...
Лично я искренне обожаю темную сторону работы растительного организма в особенности за то, насколько сильно она ломает подсознательную предустановку о примитивности этих палок и листочков. А, глядя на очень даже хорошие учебники по физиологии растений, выпущенные считанные годы назад, еще сильнее ощущаю стремительность развития научного знания. Особенно если речь идет о темах вроде нашего, теперь ясно, действительно Великого мотиватора.
Ну и, конечно же, очень надеюсь, что дочесть всю эту писанину досюда для вас было приятно и интересно.
Первая версия этой статьи опубликована в блоге автора в «ВК».
Литература
- Абсцизовая кислота: гормон покоя и стресса, лекарство от сахарного диабета;
- Жасмонаты: «слёзы феникса» из растений;
- Maciek Adamowski, Jiří Friml. (2015). PIN-Dependent Auxin Transport: Action, Regulation, and Evolution. Plant Cell. 27, 20-32;
- Pavel Křeček, Petr Skůpa, Jiří Libus, Satoshi Naramoto, Ricardo Tejos, et. al.. (2009). The PIN-FORMED (PIN) protein family of auxin transporters. Genome Biol. 10, 249;
- Alistair M. Middleton, Cristina Dal Bosco, Phillip Chlap, Robert Bensch, Hartmann Harz, et. al.. (2018). Data-Driven Modeling of Intracellular Auxin Fluxes Indicates a Dominant Role of the ER in Controlling Nuclear Auxin Uptake. Cell Reports. 22, 3044-3057;
- Липидный фундамент жизни;
- J. Kleine-Vehn, K. Wabnik, A. Martiniere, ukasz angowski, K. Willig, et. al.. (2014). Recycling, clustering, and endocytosis jointly maintain PIN auxin carrier polarity at the plasma membrane. Molecular Systems Biology. 7, 540-540;
- Elena Feraru, Mugurel Ioan Feraru, Jürgen Kleine-Vehn, Alexandre Martinière, Grégory Mouille, et. al.. (2011). PIN Polarity Maintenance by the Cell Wall in Arabidopsis. Current Biology. 21, 338-343;
- Sachs T. (1991). Cell polarity and tissue patterning in plants. Development. 113, 83-93;
- J. Friml, A. R. Jones. (2010). Endoplasmic Reticulum: The Rising Compartment in Auxin Biology. PLANT PHYSIOLOGY. 154, 458-462;
- Che-Yang Liao, Wouter Smet, Geraldine Brunoud, Saiko Yoshida, Teva Vernoux, Dolf Weijers. (2015). Reporters for sensitive and quantitative measurement of auxin response. Nat Methods. 12, 207-210;
- Eva Benková, Marta Michniewicz, Michael Sauer, Thomas Teichmann, Daniela Seifertová, et. al.. (2003). Local, Efflux-Dependent Auxin Gradients as a Common Module for Plant Organ Formation. Cell. 115, 591-602;
- Растения в космосе: инструкция по применению;
- Peter Grones, Melinda Abas, Jakub Hajný, Angharad Jones, Sascha Waidmann, et. al.. (2018). PID/WAG-mediated phosphorylation of the Arabidopsis PIN3 auxin transporter mediates polarity switches during gravitropism. Sci Rep. 8;
- Carlos S. Galvan-Ampudia, Magdalena M. Julkowska, Essam Darwish, Jacinto Gandullo, Ruud A. Korver, et. al.. (2013). Halotropism Is a Response of Plant Roots to Avoid a Saline Environment. Current Biology. 23, 2044-2050;
- Dominic P. Petrella, Eunhyang Han, Edward J. Nangle, Joseph C. Scheerens, David S. Gardner, Joshua J. Blakeslee. (2018). Modulation of halotropic growth in rough bluegrass ( Poa trivialis L.) by flavonoids and light. Environmental and Experimental Botany. 153, 163-175;
- K. A. Franklin, S. H. Lee, D. Patel, S. V. Kumar, A. K. Spartz, et. al.. (2011). PHYTOCHROME-INTERACTING FACTOR 4 (PIF4) regulates auxin biosynthesis at high temperature. Proceedings of the National Academy of Sciences. 108, 20231-20235;
- Elena Feraru, Mugurel I. I Feraru, Elke Barbez, Lin Sun, Angelika Gaidora, Juergen Kleine-Vehn PILS6 is a temperature-sensitive regulator of nuclear auxin input and organ growth in Arabidopsis thaliana — Cold Spring Harbor Laboratory;
- Хелдт Г.-В. Биохимия растений. М.: «Бином», 2014. — 471 с.;
- Tom Viaene, Katarina Landberg, Mattias Thelander, Eva Medvecka, Eric Pederson, et. al.. (2014). Directional Auxin Transport Mechanisms in Early Diverging Land Plants. Current Biology. 24, 2786-2791;
- Tom A. Bennett, Maureen M. Liu, Tsuyoshi Aoyama, Nicole M. Bierfreund, Marion Braun, et. al.. (2014). Plasma Membrane-Targeted PIN Proteins Drive Shoot Development in a Moss. Current Biology. 24, 2776-2785.