
Охотники за кристаллами
29 июля 2016
Охотники за кристаллами
- 982
- 0
- 3
Кристаллы рибосомного белка L1
-
Авторы
-
Редакторы
Статья на конкурс «био/мол/текст»: В повседневной жизни мы сталкиваемся с кристаллами ежедневно, создавая любимый вкус привычной пищи с помощью соли и сахара. Причем нас, как правило, не волнует, как возникают такие кристаллы и что с ними еще можно сделать. В Институте белка РАН кристаллизуют биомолекулы для изучения их пространственной структуры и понимания взаимодействий атомов, составляющих эти вещества. Умение закристаллизовать биомолекулу балансирует на грани науки и искусства, точного расчета и интуитивных ощущений. На этот процесс может влиять множество факторов: природа биомолекулы, ее гомогенность, выбранный метод кристаллизации, температура помещения, где проходит кристаллизация, вибрация и даже электромагнитное излучение. Иногда лишь определение структуры молекулы позволяет предположить ее функциональное значение и положить начало поиску ингибиторов или активаторов.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2016.

Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
В школе на уроке химии часто проводят эксперимент по кристаллизации неорганических молекул: в насыщенный голубой раствор медного купороса погружают нить, ждут несколько дней, и на нити вырастают красивые голубые кристаллы (см. видео ниже).
Если такой кристалл затем поместить под рентгеновский луч, то можно получить снимки, которые после обработки специальными компьютерными программами расскажут о пространственной структуре молекулы и объяснят, как связаны между собой атомы CuSO4 в кристалле. В Институте белка РАН, что находится в подмосковном городе Пущино, такой подход используют и при исследовании пространственной структуры сложных органических молекул, таких как нуклеиновые кислоты (РНК и ДНК), разнообразные белки и комплексы этих молекул. Познание пространственной структуры молекул — это ключ к их тайнам. Знание структуры позволяет понять, что движет атомами в реакциях и как происходят те или иные процессы в живой клетке. Однако прежде чем прийти к структуре, ученым предстоит преодолеть непростой путь поиска благоприятных для кристаллизации условий и получить пригодные для рентгеноструктурного анализа кристаллы.
Хороший кристалл — вершина упорядоченности, совершенства и разумного подхода к окружающему миру (см. заглавный рисунок). Однако довольно часто получение чистого препарата исследуемой биомолекулы требует удачи, выдержки и терпения экспериментатора. Как правило — так поступаем и мы, — сначала клонируют ген белка или фрагмента нуклеиновой кислоты в плазмидный вектор [1], потом наращивают клетки штамма-хозяина (чаще всего — кишечной палочки), которые вынуждены синтезировать нужный продукт, затем — разрушают эти клетки и выделяют из них нужную биомолекулу в препаративных количествах.
Очистку препарата проводят, используя разницу в поверхностном заряде, молекулярном весе, гидрофобности и других интересных свойствах молекул. Чистоту препарата оценивают с помощью электрофореза: наличие одной полоски в геле на конечном этапе очистки очень радует экспериментатора. Такой препарат вселяет надежду на удачу в его кристаллизации.

Рисунок 1. Кристаллы комплекса рибосомного белка L4 cо специфическим фрагментом рибосомной РНК
Кристаллизация — это экзамен на качество проделанной работы. Кристаллы образует только такой раствор молекулы, в котором нет ничего постороннего, отвлекающего молекулу на ненужные связи. Биомолекула упаковывается в элементарную ячейку, а они формируют кристалл, обладающий определенной пространственной симметрией. Чтобы увидеть кристалл в капле глазом, вооруженным оптическим микроскопом, нужны сотни тысяч копий одной и той же молекулы, собранные в какой-то точке раствора.
Кристаллизацию можно вести несколькими методами: диализом, диффузией паров в «висящей» или «сидящей» капле, свободной диффузией. Суть их в следующем: препарат молекулы смешивается (уравновешивается) с раствором осадителя, так называемым противораствором. Осадителями выступают различные соли, органические соединения — полиэтиленгликоли, спирты и прочие вещества. Далее концентрация препарата и осадителя увеличивается путем диализа или диффузии паров. Скорость этих процессов зависит от температуры помещения, концентрации и природы противораствора. Для того чтобы найти подходящие условия для получения кристаллов, надо опробовать сотни, а иногда и тысячи сочетаний различных осадителей, значений рН, добавок в виде солей, детергентов, коротких пептидов и др.
В наиболее продвинутых лабораториях мира для кристаллизации используют специальных роботов [2], за короткое время раскапывающих в плашки множество «условий». В этом случае используется метод диффузии паров в его модификации «сидящая» капля. Задача исследователя — найти или создать такие условия, при которых раствор с биомолекулой будет находиться в стадии перенасыщения, и тогда даже легкое касание кристаллизационной капли волоском может вызвать образование кристаллов. Очень важен баланс между выпадением биомолекулы в осадок и образованием зародышей-кристаллов. Иногда для выращивания больших кристаллов мы пересаживаем один кристалл в каплю, которая практически «готова» к началу кристаллизации, и тем самым способствуем росту этой «затравки». Основные «заповеди» кристаллизации изложены в книге А. Макферсона [3].

Рисунок 2. Кристаллы эндо-1,4-β-ксиланазы
Кристаллизация — это не только критерий чистоты препарата, но также и проверка на гомогенность и структурную устойчивость биомолекулы. Никакие «хвосты» молекулы особо не болтаются, «петли» слишком не торчат, «концы» нуклеиновых кислот однородны... Наблюдение за ростом кристаллов доставляет экспериментатору эстетическое и интеллектуальное наслаждение. Вид кристаллов, пусть даже не вполне совершенных, их разноцветность, четкие грани и причудливые формы не на шутку завораживают. Кристаллы порой похожи на карамельки, иголочки, призмы, алмазы, у каждой молекулы свой характер, своя любимая форма упорядочивания. К сожалению, способность кристалла отражать рентгеновские лучи с высоким разрешением не зависит от его формы и эстетической составляющей. Каждый раз, вынимая кристалл из капли для рентгеноструктурного анализа, чувствуешь волнение и надежду: может быть, это тот самый кристалл, о котором мечталось долгие месяцы, а порой и годы (рис. 1). Ведь кристаллизация — процесс долгий, отнимающий много сил, требующий изобретательности и терпения.
Из капли кристаллы переносят петлей в криораствор, в котором присутствуют вещества, не позволяющие образовываться льду вокруг кристалла (например, полиэтиленгликоль, синтетические масла или соли в высокой концентрации). Основное требование к криораствору — он не должен замерзать при температуре −195 °C (температура струи жидкого азота). Иначе на дифракционном снимке появляется область с отражениями от микрокристаллов льда, что мешает определению пространственной структуры молекул. Кристалл обмакивают в криораствор, а иногда даже держат в нем несколько минут. И только после этого ставят под струю жидкого азота и подвергают облучению в генераторе.
Очень много красивых и достойных кристаллов прошло перед глазами сотрудников лаборатории структурных исследований аппарата трансляции Института белка за годы ее существования. Некоторые чудесные на вид кристаллы совершенно не отражали рентгеновский луч, оказывались «интеллектуально бесплодными», не давая никакой информации о строении молекулы. Другие отражали рентгеновские лучи с недостаточно высоким разрешением — ниже 3 Å (рис. 1). Однако бывало, что совсем невзрачные с виду кристаллы (рис. 2) — смотреть не на что, угловатые и худосочные, — вдруг выдавали рефлексы высочайшего разрешения, доставляющие нам огромную нечаянную радость.
Каждый раз, когда кристалл, утонувший в криорастворе, погружается в струю жидкого азота и отправляется на гониометрическую головку генератора (рис. 3), попадая под пучок Рентгена, ожидание первого дифракционного снимка (рис. 4) приводит экспериментатора в смятение — из-за непредсказуемости результата. На старых рентгеновских установках этот процесс занимал до двадцати минут. Сейчас на синхротронах весь набор рентгеновских данных собирается за несколько минут, и сразу же появляются надежда и непреодолимое желание узнать тайны этой молекулы. В нашем городе единственный рентгеновский генератор — комплекс X8 PROTEUM (см. врезку) — установлен в Институте белка РАН.
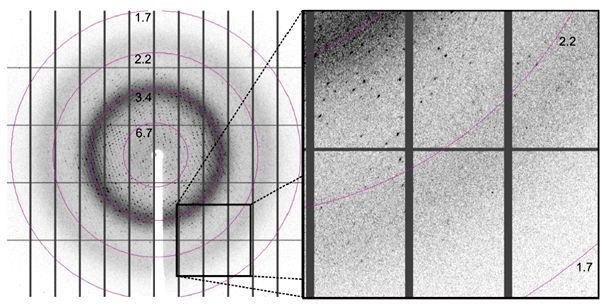
Рисунок 4. Дифракционный снимок. Цифры означают разрешение в ангстремах.
Первые кристаллы бактериальных рибосом и рибосомных субчастиц получены в лаборатории структурных исследований аппарата трансляции [4]. С помощью рентгеновского генератора мы исследовали структуры многих рибосомных белков и их комплексов с фрагментами РНК [5], [6]. Долгое время не удавалось определить структуру рибосомы с высоким разрешением, поэтому первоочередной задачей было определение структур рибосомных белков, а в особенности — их комплексов с фрагментами рибосомной РНК. Полную современную структуру рибосомы уточняли, как «пазл», из различных кусочков [7]. Структуры определенных ранее в нашей лаборатории комплексов рибосомных белков S8, S15 и особенно L1 со специфическими фрагментами рРНК внесли большой вклад в уточнение структур малой и большой субчастиц рибосомы [5–7]. В 2009 году за определение структуры рибосомы три исследователя из Америки, Англии и Израиля получили Нобелевскую премию по химии [8].

Рисунок 5. Кристаллы фермента лакказы
Сейчас в лаборатории структурных исследований аппарата трансляции продолжают изучать биосинтез белка, происходящий на рибосомах, со структурной точки зрения. Недавно были получены пространственные структуры факторов инициации трансляции [9], [10].
В нашей лаборатории занимаются и другими объектами: изучают структуры различных ферментов. Недавно мы получили кристаллы и определили структуры двухдоменных лакказ бактерий рода Streptomyces (рис. 4 и 5) [11].
Лакказы — это медьсодержащие оксидоредуктазы, участвующие в разложении лигнина. Эти ферменты — перспективный объект для промышленности: они отбеливают ткани и бумагу, способствуют биоремедиации загрязненных почв и вод.
Также мы участвовали в кристаллизации и определении структур таких функционально важных ферментативных комплексов, как комплекс Galphao-субчастицы гетеротримерного G-белка с фрагментом RGS-белка [12] и комплекс OAS-белка со специфическим фрагментом РНК [13].
За десятилетия существования нашей лаборатории методы рентгеноструктурного анализа и кристаллизации значительно усовершенствовались, и мы шагнули в новое тысячелетие во всеоружии. Теперь собрать набор данных для несложной молекулы и определить ее структуру может даже продвинутый аспирант. Однако кристаллизация до сих пор остается самым тонким и уязвимым моментом в этом процессе познания окружающего мира.
Литература
- Важнейшие методы молекулярной биологии и генной инженерии;
- Ловля бабочек, или Чем структурная геномика поможет биологии;
- McPherson A. Preparation and analysis of protein crystals. Chichester: John Wiley, 1982. — 371 p.;
- Trakhanov S., Yusupov M., Agalarov S., Garber M., Ryazantsev S., Tishchenko S., Shirokov V. (1987). Crystallization of 70S ribosomes and 30S ribosomal subunits from Thermus thermophilus. FEBS Lett. 220, 319–322;
- Nikonov S., Nevskaya N., Eliseikina I., Fomenkova N., Nikulin A., Ossina N. et al. (1996). Crystal structure of the RNA-binding ribosomal protein L1 from Thermus thermophilus. EMBO J. 15, 1350–1359;
- Nikulin A., Serganov A., Ennifar E., Tishchenko S., Nevskaya N., Shepard W. et al. (2000). Crystal structure of the S15-rRNA complex. Nat. Struct. Biol. 7, 273–277;
- Gabdulkhakov A., Nikonov S., Garber M. (2013). Revisiting the Haloarcula marismortui 50S ribosomal subunit model. Acta Crystallogr. D Biol. Crystallogr. 69, 997–1004;
- Белоксинтезирующая Нобелевская премия по химии (2009);
- Nikonov O., Kravchenko O., Arkhipova V., Stolboushkina E., Nikonov S., Garber M. (2016). Water clusters in the nucleotide-binding pocket of the protein aIF2γ from the archaeon Sulfolobus solfataricus: proton transmission. Biochimie. 121, 197–203;
- Arkhipova V., Stolboushkina E., Kravchenko O., Kljashtorny V., Gabdulkhakov A., Garber M. et al. (2015). Binding of the 5’-triphosphate end of mRNA to the γ-subunit of translation initiation factor 2 of the crenarchaeon Sulfolobus solfataricus. J. Mol. Biol. 427, 3086–3095;
- Tishchenko S., Gabdulkhakov A., Trubitsina L., Lisov A., Zakharova M., Leontievsky A. (2015). Crystallization and X-ray diffraction studies of a two-domain laccase from Streptomyces griseoflavus. Acta Crystallogr. F Struct. Biol. Commun. 71, 1200–1204;
- Lin C., Koval A., Tishchenko S., Gabdulkhakov A., Tin U., Solis G.P., Katanaev V.L. (2014). Double suppression of the Gα protein activity by RGS proteins. Mol. Cell. 53, 663–671;
- Lohofener J., Steinke N., Kay-Fedorov P., Baruch P., Nikulin A., Tishchenko S. et al. (2015). The activation mechanism of 20-50-oligoadenylate synthetase gives new insights into OAS/cGAS triggers of innate immunity. Structure. 23, 1–12.






