Атомно-силовая микроскопия: увидеть, прикоснувшись
28 октября 2011
Атомно-силовая микроскопия: увидеть, прикоснувшись
- 14328
- 2
- 1
Атомно-силовой микроскоп, подобно слепцу с тростью, «ощупывает» перед собой дорогу, определяя рельеф
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Современное понимание микроскопии уже давно вышло за рамки классического представления об оптических приборах, позволяющих более детально рассмотреть объект. В течение XX века были разработаны новые подходы визуализации, позволившие ученым заглянуть в наномир и даже увидеть отдельные атомы и молекулы. Одним из таких методов является сканирующая зондовая микроскопия, которая с каждым годом находит все большее примение не только в материаловедении, но и при исследовании самых разных биологических объектов.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Немного историии
Невиданный прогресс фундаментальной науки во второй половине XX века обусловлен совершенствованием методик и экспериментального оборудования, вызванным бурным развитием технологий в послевоенные годы. Микроскопия ещё со времен Левенгука является неотъемлемой частью научных исследований в области биологии, физики и материаловедения, — ведь недаром говорят, что «лучше один раз увидеть, чем сто раз услышать». Однако возможности методов оптической микроскопии не безграничны, и в какой-то момент все уперлось в физические ограничения — разрешающая способность не может превзойти 0,2 мкм, что связано с так называемым дифракционным пределом.
Естественным выходом из ситуации было бы уменьшить длину волны, однако более коротковолновое излучение (например, рентгеновские лучи) губительно для биологических объектов. Впрочем, если не ставить целью наблюдение исключительно за живым объектом, то оказывается, что изучение «фиксированного» препарата способно дать чрезвычайно подробную информацию о внутреннем устройстве клетки.
Проблема увеличения разрешающей способности микроскопов без разрушения или изменения исследуемого образца была разрешена посредством визуализации физико-химических свойств поверхности, — например, способности отражать или поглощать электроны. Разработка таких методов как сканирующая электронная микроскопия (СЭМ) и трансмиссионная электронная микроскопия (ТЭМ) позволила преодолеть физические ограничения оптической микроскопии и перейти к изучению объектов не только на клеточном, но и на молекулярном уровне. Все это не могло не привлечь молекулярных биологов и биофизиков.
Кроме того, в 80-х годах были заложены основы популярной в настоящее время дисциплины — нанотехнологий [1], для которой возможность изучать свойства и взаимодействия отдельных молекул или атомов — не прихоть, а самая насущная потребность. Мало того, ученые хотели не только «почувствовать» молекулы или атомы, получив спектры или измерив характеристики частиц, но и в прямом смысле слова увидеть их. Сама идея нанотехнологий — конструирование наноразмерных структур — позволяет придать уже известным веществам новые свойства или усилить их действие. Перед инженерами и учеными встала задача разработать новый метод визуализации c нанометровой и даже субнанометровой разрешающей способностью.

Рисунок 1. Герд Бинниг и Генрих Рорер вместе с первой моделью сканирующего туннельного микроскопа, за которую они и были удостоены Нобелевской премии в 1986 году
Концепция и предпосылки для разработки методов сканирующей зондовой микроскопии появились еще в 1960-х годах. В 1981 году швейцарец Герд Бинниг (G. Binning) и немец Генрих Рорер (G. Rohrer) разработали технологию сканирующей туннельной микроскопии. Этих двух талантливых ученых-физиков свела вместе работа в лаборатории IBM в Цюрихе, где представленная ими в 1982 году модель первого типа сканирующих зондовых микроскопов — сканирующего туннельного микроскопа (СТМ) — стала ключом, открывшим ученым дверь в мир атомов. За эту работу они были удостоены в 1986 году Нобелевской премии по физике (рис. 1).
В 1986 году Рорер разработал и первый атомно-силовой микроскоп (АСМ) — продолжатель рода сканирующих зондовых микроскопов. Принципиальное отличие АСМ от СТМ заключается в регистрации не туннельного эффекта, а сил межмолекулярных взаимодействий, что позволило использовать АСМ для работы с непроводящими образцами. Вклад Биннинга и Рорера в разработку методов сканирующей зондовой микроскопии был столь высок, что сегодняшние сканирующие туннельные микроскопы (помимо перехода к использованию цифровых технологий) мало чем принципиально отличаются от модели, представленной научной публике в 1982 году.
Как же он работает?
Если вы сравните оптический микроскоп с человеком, обладающим супер-зрением, то сканирующий зондовый микроскоп можно описать как слепого человека с супер-чувствительными пальцами. Как следует из названия метода, принцип сканирующей зондовой микроскопии заключается в сканировании поверхности образца сверхтонким зондом. Зонд с толщиной кончика порядка нескольких нанометров позиционируется непосредственно над образцом, позволяя регистрировать взаимодействие с ним. В процессе сканирования (перемещения зонда относительно образца) значение взаимодействия поддерживается постоянным за счет изменения расстояния между образцом и зондом, регистрация которого и формирует изображение (рис. 2).
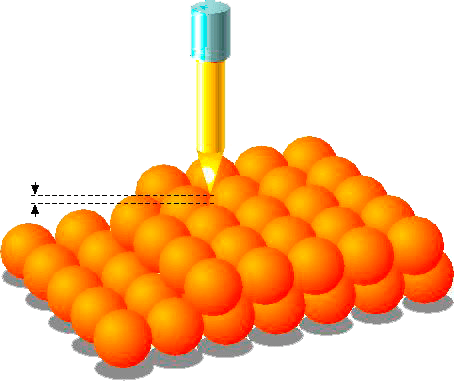
Рисунок 2. Принципиальная схема устройства сканирующего зондового микроскопа. Зонд подводится к образцу на расстояние порядка нескольких нанометров. В зависимости от регистрируемого сигнала различают сканирующую туннельную микроскопию (сигнал — туннельный ток между зондом и проводящей поверхностью) и атомно-силовую микроскопию (сигнал — силы молекулярных взаимодействий).
Сканирующая туннельная микроскопия
В зависимости от типа регистрируемого взаимодействия между зондом и поверхностью различают сканирующую туннельную (СТМ) и атомно-силовую микроскопию (АСМ). В случае первой (СТМ) подложка с образцом и зонд, сделанный из какого-либо проводящего металла (например, вольфрама или платины), замкнуты в общую электрическую цепь с источником тока (рис. 3), и регистрируемой величиной является туннельный ток. Этот ток возникает при сближении зонда и образца до расстояний, на которых наблюдается туннельный эффект (~1 нм). В процессе сканирования туннельный ток поддерживается постоянным за счет изменения расстояния зонд-поверхность, и таким образом регистрируется изображение (рис. 3).
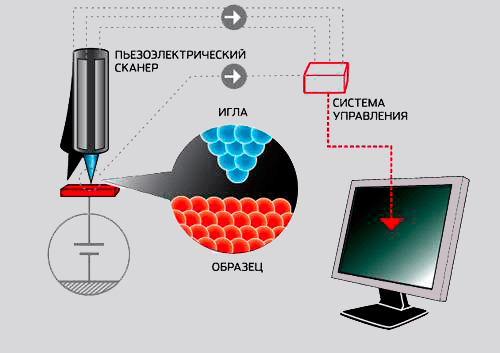
Рисунок 3. Схема устройства сканирующего туннельного микроскопа. Когда зонд подходит к образцу на расстояние, достаточно малое для возникновения туннельного тока, начинается регистрация «полезного» сигнала. Этот сигнал представляет собой расстояние, пройденное опускающимся зондом из исходной точки до позиции, где возникает туннельный ток. Сигналы, полученные в каждой точке образца, складываются в цельное изображение поверхности.
Разработка СТМ стимулировала прогресс в исследованиях разнообразных полупроводниковых и металлических материалов, поскольку данный метод позволяет не только изучать структуру на атоматном уровне, но и может использоваться для измерения электрического или магнитного полей в масштабе молекул или атомов. Так, например, использование СТМ позволило изучить квантовые точки, существование которых теоретически было предположено еще в 1975 году. Еще одним важным приложения СТМ стало исследование углеродных нанотрубок (рис. 4).
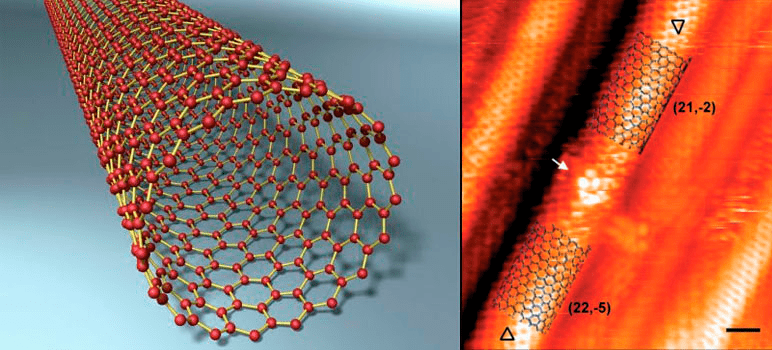
Рисунок 4. Углеродные нанотрубки — крошечные цилиндры диаметром 0,5–10 нм и длиной примерно 1 мкм — являются особой кристаллической формой углерода, открытой в 1991 году. Углеродные нанотрубки стали новым материалом, чрезвычайно перспективным технически — стоит упомянуть хотя бы полупроводниковую технику и аккумуляцию водорода. Слева — модель структуры углеродной нанотрубки. Справа — изображение сканирующей туннельной микроскопии углеродной нанотрубки. Разрешающая способность метода позволяет фиксировать положение атомов углерода в наноструктуре. Шкала: 1 нм.
Главным недостатком сканирующей туннельной микроскопии является возможность исследования только проводящих образцов и невозможность работы в жидкостях, что зачастую исключает работу с биологическими объектами. Однако благодаря разработке метода атомно-силовой микроскопии ученые смогли перенести исследования биологических объектов на субнанометровый уровень.
Атомно-силовая микроскопия
В случае атомно-силовой микроскопии измеряют силу Ван-дер-Ваальсовых взаимодействий или электростатическое притяжение / отталкивание, а зонд, называемый кантилевером, представляет собой тонкую иглу, закрепленную вертикально на тонкой упругой балке (рис. 5). Проще говоря, метод основывается на регистрации притяжения или отталкивания атомов образца и зонда.

Рисунок 5. СЭМ-фотография кантилевера, использующегося для контакта с образцом в атомно-силовой микроскопии. На тонкой балке помещен зонд, кончик которого (диаметром лишь несколько нанометров) приходит во взаимодействие с поверхностью образца. Кантилеверы изготовляют из кремния, нитрида кремния или полимеров путем химического травления.
На кончик балки, несущей кантилевер, направлен луч лазера, отражающийся от поверхности и поступающий в центр регистрирующего устройства, разбитого на четыре сектора. В зависимости от изменения силы взаимодействия кантилевер—поверхность, происходит изгиб балки, несущей зонд, и луч лазера отклоняется от центральной позиции в один из секторов детектора. Система обратной связи изменяет положение кантилевера, возвращая его (и лазер тоже) в «нулевое» центральное положение. Таким образом, регистрируя сдвиг кантилевера, необходимый для возврата лазера в «нулевую» точку, система измеряет топологию поверхности (рис. 6).
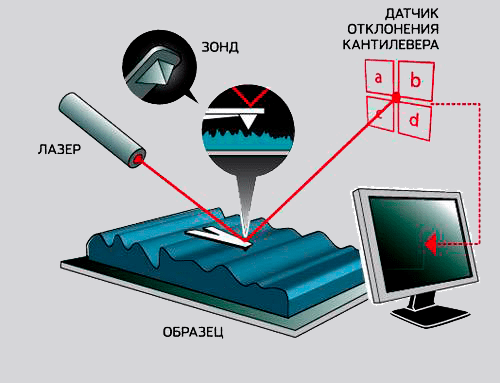
Рисунок 6. Принцип регистрации сигнала в методе атомно-силовой микроскопии. Лазерный луч отражается от кончика кантилевера и попадает в центр детектора, разделенного на 4 сектора. При приближении зонда, находящегося на кончике балки, к поверхности образца возникают силы притяжения или отталкивания, отклоняющие зонд. В качестве регистрируемого сигнала используется расстояние, на которое надо сдвинуть кантилевер, чтобы вернуть отклонившийся луч лазера в центральную точку.
Не только микроскоп

Рисунок 7. Изображение Мерилин Монро, полученное точечным окислением титана методом анодно-окислительной литографии. Изображение 7×11 мкм.
изображение компании НТ-МДТ (Россия)
Помимо базовых возможностей исследования размеров и морфологии обьектов на нано- и субнаноуровнях (в случае СТМ), сканирующая зондовая микроскопия получила ряд модификаций. Наиболее ярким примером таких модификаций являются методы анодно-окислительной и силовой литографии, которые позволяют создавать или изменять не только форму или размеры наноструктур, но и влиять на электрохимические свойства образца (рис. 7).
На сегодняшний день методы атомно-силовой микроскопии нашли широкое применение в физике, электронике и метериаловедении. Возможность исследования размеров, структуры, магнитных и электрических свойств объектов сделала данные методы важной частью современной микро- и наноэлектроники. Например, использование такого метода позволяет контролировать или модифицировать расположение элементов на миниатюрных чипах (рис. 8).

Рисунок 8. АСМ-изображение участка поверхности чипа. АСМ и СТМ позволяют проверять чипы на наличие дефектов, а в ряде случаев использоваться и для создания микро- или наноструктур из проводящих элементов. Это очередной шаг на пути к миниатюризации электроники и повышению производительности вычислительных систем.
Одно из основных направлений развития современной электроники — миниатюризация. Уменьшение размеров микросхем и проводящих элементов напрямую связано со снижением энергозатрат и увеличением производительности современной техники. Уже в ближайшем будущем в отдельных наноразмерных контактах и проводящих элементах для переноса зарядов будут использоваться не более десятка электронов (в современных микросхемах эта цифра на несколько порядков выше). Именно для работы со столь малыми структурами идеально подходят методы сканирующей зондовой микроскопии.
Сканирующая микроскопия применяется и в фундаментальных исследованиях: ученые смогли «пощупать» структуру отдельных молекул, получая изображения, на которых видно расположение отдельных атомов (рис. 9)! Если провести параллель с историей, то можно сказать, что СЗМ открыла ученым, до этого пользовавшимся «рисунками» молекул, мир фотографии на атомарном уровне, как это случилось в начале XIX века в макромире.

Рисунок 9. Пентацен. а — Модель молекулы пентацена. б — СТМ-изображение единичной молекулы пентацена. в и г — АСМ-изображения этой молекулы. Разрешающая способность метода позволяет различать отдельные атомы в молекуле.
На службе биологии
Еще одним важным шагом вперед была разработка модификаций сканирующих модулей, позволяющих проводить сканирование в жидкости, что сделало доступным применение методов СЗМ для исследования биологических объектов. Метод АСМ нашел применение в биохимии и молекулярной биологии во всем диапазоне размеров исследуемых объектов — от целых бактерий и клеток различных живых организмов до отдельных белковых молекул. Цели, решаемые методом АСМ в этом диапазоне размеров, чрезвычайно разнообразны: идентификация микроорганизмов по их морфологии, исследование влияния различных веществ на жизнедеятельность клеток, визуализация и контроль образования фермент-субстратных комплексов, контроль размеров, структуры и стабильности различных наноструктур, использующихся для доставки лекарственных средств, визуализация единичных биомолекул и многое другое. Гибкость методик АСМ позволяет ученым находить все новые и новые приложения в биохимии, молекулярной биологии и биотехнологии.
Для иллюстрации перечисленных выше биологических возможностей АСМ спустимся вниз по лестнице размеров, рассматривая конкретные примеры. С помощью данного метода проводятся исследования антибактериального действия различных препаратов: на рисунке 10 представлены изображения бактерий E. coli до и после обработки низкомолекулярным и высокомолекулярным хитозаном — биополимером, который обладает антибактериальной активностью. На рисунке можно видеть, как с течением времени происходит изменение морфологии бактерий вплоть до полного разрушения.

Рисунок 10. Исследование методом АСМ антибактериального действия биополимера хитозана на клетки E. coli. В левой колонке представлены изображения бактерий после обработки низкомолекулярным хитозаном, а в правой — после обработки высокомолекулярным хитозаном. Данный полисахарид взаимодействует с клеточной стенкой бактерий, нарушая работу ионообменных каналов и электролитный баланс, что быстро приводит к гибели. Хорошо видно, что в левом столбце происходит более быстрая гибель клеток (а значит, антибактериальная активность низкомолекулярного хитозана выше).
АСМ используется для изучения действия различных лекарств или изменения внешних условий на клетки; на рисунке 11 приводится изображение симпатической нервной клетки человека. В ходе данного исследования ученые наблюдали изменение морфологии и механических свойств нервных клеток при воздействии различных нейротоксинов. АСМ сейчас применяется для исследований широкого спектра клеток человека, в том числе и клеток раковых опухолей, нейронных сетей, стенок сосудов и многих других объектов человеческого организма.
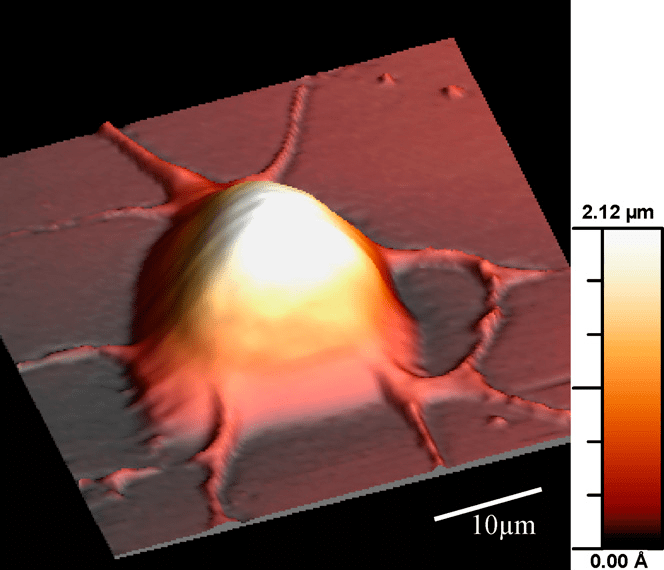
Рисунок 11. Изображение симпатической нервной клетки человека, полученное методом АСМ
АСМ позволяет определять размеры, стабильность и морфологию различных наноструктур, использующихся для доставки лекарственных препаратов, а также контролировать «степень загрузки» лекарственным препаратом, склонность к аггрегации и некоторые другие параметры, способные помочь ученым при дальнейшей работе с исследуемым носителем. На рисунке 12 представлены наночастицы на основе хитозана и галактоманнана до загрузки лекарственным препаратом лактоферрином (а), после загрузки (б), а также случай агрегации таких наночастиц (в) и модель агрегата, созданная на основе данных АСМ (г) [6].
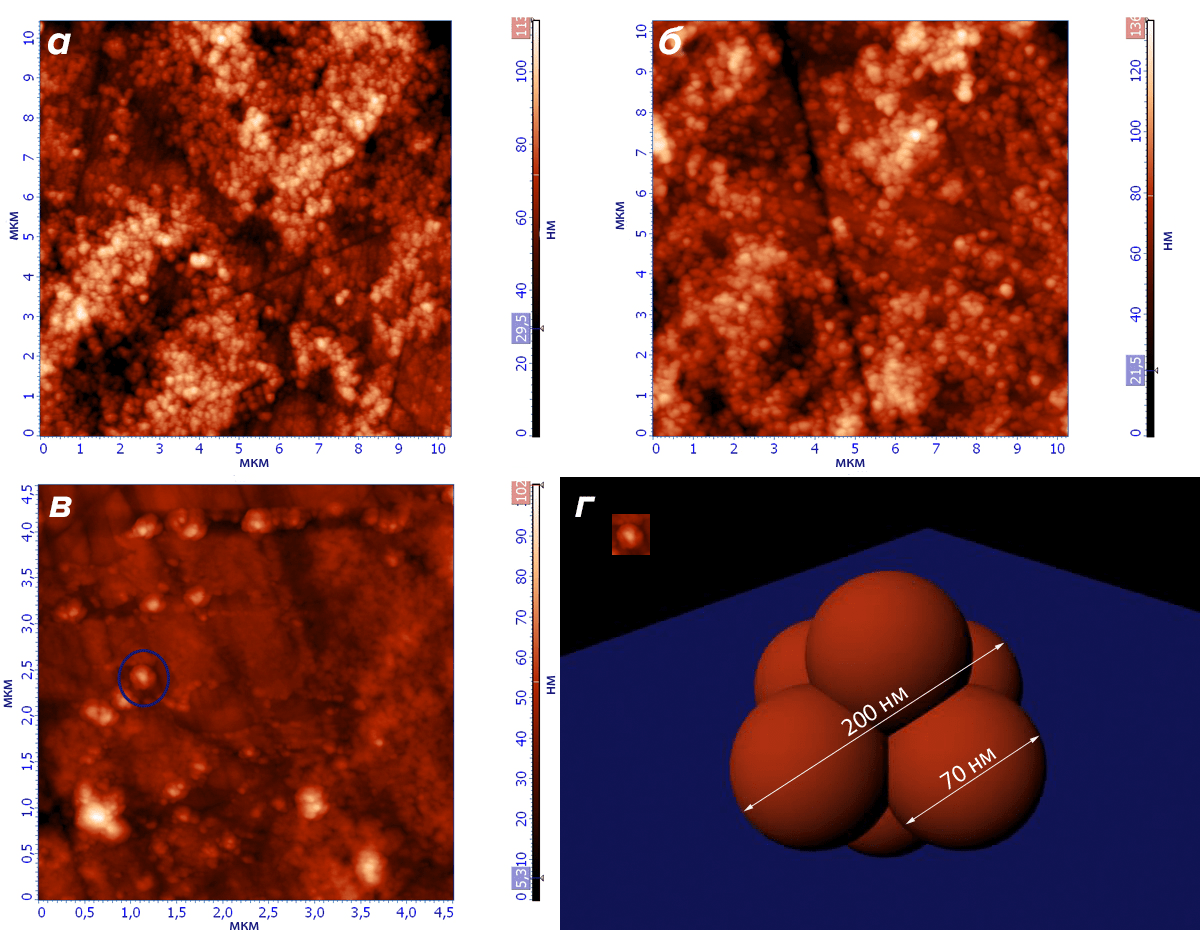
Рисунок 12. Использование АСМ для определения основных характеристик наночастиц на основе хитозана и галактоманнана
Переходя к структурным компонентам клетки, АСМ позволяет визуализовать конформационные и структурные изменения молекул ДНК, позволив изучить влияние внешних факторов (например, УФ-излучения или радиации, рис. 13) на молекулу и определить места связывания различных ферментов и кофакторов, участвующих в транскрипции и репликации ДНК. Еще один интересный вариант использования метода при работе с ДНК — секвенирование с помощью СЗМ, основанное на регистрации зондом единичных азотистых оснований в нити ДНК. Специальная модификация кончика зонда позволяет поочередно фиксировать положения нуклеотидов каждого типа в цепочке ДНК, а потом объединить информацию о местоположении нуклеотидов в непрерывную последовательность генетического кода. Однако такой вариант секвенирования сейчас находится лишь в стадии разработки: ученым предстоит преодолеть еще целый ряд серьезных препятствий — в первую очередь, это стремление к соотношению цена/скорость/точность, сравнимому с классическими методами секвенирования, — прежде чем такой метод сможет найти коммерческое применение.

Рисунок 13. АСМ-изображения молекул ДНК до (а) и после (б) УФ-облучения. Хорошо видны конформационные изменения в структуре молекул после облучения (цепочки ДНК значительно сильнее скручены).
изображения компании НТ-МДТ (Россия)
Зачастую в околонаучной прессе можно увидеть статьи о различных миниатюрных устройствах, микрофабриках или нанороботах, однако описывается это больше с точки зрения научной фантастики. На самом же деле ученые уже вплотную приблизились к разработке технологий, позволяющих воплотить в жизнь такие задумки. Прекрасной иллюстрацией служит работа американских ученых, которые с помощью сканирующей туннельной микроскопии показали, что молекулы антрахинона, размещенные на очень ровной поверхности, двигаются по прямой линии и способны переносить с собой одну или две молекулы СО2 (рис. 14). При этом размер такого «молекулярного переносчика» составляет не многим более 10 Å и является ярким примером детали биологических наномеханизмов, которые будут разрабатываться в ближайшем будущем.

Рисунок 14. На серии СТМ-снимков показана молекула антрахинона, несущая две (а) и одну (б) молекулы СО2, и пошаговое движения молекулы (в—е). Размер каждого изображения 20×40 Å.
И это далеко не все
На сегодняшний день развитие методов СЗМ идет в направлении совершенствования технических нюансов приборов, что позволит значительно увеличить разрешение и эффективность СЗМ. Например, разработка методов создания кантилеверов с толщиной зонда менее 1 нм позволит увеличить разрешающую способность микроскопов вплоть до ее максимума в случае, когда кончик зонда будет иметь толщину в один атом.
Увеличение скорости сканирования (на сегодняшний день время получения одного изображения составляет от нескольких минут до нескольких десятков минут) позволит следить за движениями молекул в растворах вплоть до визуального изучения, например, ферментативных реакций.
Модификация кончиков зондов различными биомолекулами позволит исследовать физико-химические характеристики взаимодействий фермент—субстрат или антиген—антитело. Так, например, к иммобилизованному на поверхности субстрату на достаточное для взаимодействия расстояние подводится кантилевер, модифицированный субстратсвязывающим доменом фермента. Величина силы, которую необходимо приложить для разрыва образовавшегося комплекса, может много сказать о взаимодействиях в таком комплексе. Выше перечислены лишь немногие из возможных улучшений метода, позволяющих расширить его возможности.
При сегодняшних темпах развития науки и технологий уже в ближайшее десятилетие произойдет значительное усовершенствование сканирующих зондовых микроскопов и упрощение технологий их производства, что приведет к снижению цен на данную продукцию. Уже вскоре СЗМ станет таким же рутинным методом, каким сегодня является оптическая микроскопия, однако фронт работ будет переброшен уже на новый уровень — исследований отдельных молекул и атомов...
Литература
- Невидимая граница: где сталкиваются «нано» и «био»;
- M. Ouyang. (2001). Atomically Resolved Single-Walled Carbon Nanotube Intramolecular Junctions. Science. 291, 97-100;
- L. Gross, F. Mohn, N. Moll, P. Liljeroth, G. Meyer. (2009). The Chemical Structure of a Molecule Resolved by Atomic Force Microscopy. Science. 325, 1110-1114;
- Peter Eaton, João C. Fernandes, Eulália Pereira, Manuela E. Pintado, F. Xavier Malcata. (2008). Atomic force microscopy study of the antibacterial effects of chitosans on Escherichia coli and Staphylococcus aureus. Ultramicroscopy. 108, 1128-1134;
- Mirela Mustata, Ken Ritchie, Helen A. McNally. (2010). Neuronal elasticity as measured by atomic force microscopy. Journal of Neuroscience Methods. 186, 35-41;
- Ильина А.В., Местечкина Н.М., Курек Д.В., Левов А.Н., Семенюк П.И., Орлов В.Н. и др. (2011). Получение, исследование и перспектива использования наночастиц на основе хитозана и галактоманнана. «Российские нанотехнологии». 6, 18–23;
- K. L. Wong, G. Pawin, K.-Y. Kwon, X. Lin, T. Jiao, et. al.. (2007). A Molecule Carrier. Science. 315, 1391-1393.