
Ахиллесова пята биологической сложности
30 мая 2011
Ахиллесова пята биологической сложности
- 2120
- 7
- 3
Белок–белковые взаимодействия лежат в основе большинства биологических процессов, и роль их наиболее многообразна у многоклеточных организмов. Сложность этих взаимодействий часто графически представляют в виде карт, где каждая точка соответствует одному белку, а каждая линия — межбелковому взаимодействию.
-
Автор
-
Редакторы
Сложность устройства биомолекулярных систем многократно возрастает в ряду прокариоты → одноклеточные эукариоты → многоклеточные эукариоты, — и одновременно на многие порядки снижается размер популяций. Чем более высоко развит организм, тем сложнее устроена сеть взаимодействий белковых молекул между собой, — и, по-видимому, само возникновение многоклеточности обязано замысловатым белок–белковым взаимодействиям. Оригинальное компьютерное исследование структурной стабильности родственных белков из различных групп организмов показывает, что эта сложность может быть следствием не эволюционных адаптаций, а «залатыванием» белковых дефектов, постепенно накапливающихся в популяциях ограниченного размера под действием генетического дрейфа.
Вопрос о том, почему мы так сложно утроены, не дает покоя многим поколениям биологов, и эта сложность стала еще более очевидна, когда накопилась критическая масса знаний об устройстве биологических молекул и связях между ними. Исследователям открылась невероятно сложная картина взаимодействий между белковыми молекулами, обеспечивающих передачу информации всех типов как внутри клетки, так и в межклеточном пространстве. (Таким образом, и сама многоклеточность обязана своим возникновением, по-видимому, сложной сети белок–белковых взаимодействий.)
Однако недавно опубликованное компьютерное исследование говорит, что эта сложность может быть не «фичей» (то есть, не эволюционной адаптацией, позволившей развиться высокоорганизованным организмам), а «багом» (побочным эффектом отчаянной попытки «залатать» структурные дефекты, постепенно накапливающиеся в белковых молекулах) [1]. Основной мыслью этой оригинальной работы, основанной на компьютерном анализе структурной стабильности белков, является то, что огромная сложность сети белок–белковых взаимодействий многоклеточных организмов развилась из-за сравнительно небольшого размера популяций эукариот (по сравнению с микробными сообществами), в которых, согласно представлениям классической генетики, возрастает роль явления, называемого дрейфом генов.
Дрейф генов был открыт в 1930-х годах Сьюэлом Райтом, эксперимент которого заключался в изучении популяционного разнообразия мушек-дрозофил, первоначально представленного всего двумя парами гетерозиготных самцов и самок (всего четыре мухи). Райт экспериментально показал, что в маленьких популяциях частота мутантного аллеля меняется быстро и случайным образом, не подчиняясь статистическим закономерностям, а вместо этого фиксируя случайно возникшие различия. Таким образом, закон эволюционных адаптаций (когда выживают наиболее приспособленные особи) может перестать быть главной движущей силой эволюции, уступив место случайным процессам, таким как накопление нейтральных мутаций. Но это, повторим, было показано для небольших популяций, а вот что дрейф генов мог оказать существенное влияние на молекулярный облик практически всего живого на планете, — никто и предположить не мог.
«Времяночка» на скотчике
Авторы статьи — Ариэль Фернандес (Ariel Fernández) и Майкл Линч (Michael Lynch) — сделали предположение, что дрейф генов, выражающийся в этом случае в накоплении нейтральных мутаций в белках, снижающих, тем не менее, их структурную стабильность, приводит к необходимости контакта белковых молекул между собой, чтобы компенсировать невыгодные взаимодействия с растворителем (водой). Сложные белок–белковые взаимодействия, наблюдаемые у эукариот (особенно многоклеточных), сформированы вторичным отбором, направленным на стабилизацию структуры белков, целостность которой «подточена» случайно накопленными мутациями, закрепившимися в результате генетического дрейфа. Ключевую роль здесь играет снижение численности популяций — на многие порядки в сравнении с бактериями. По мнению авторов, именно этот феномен увеличивает роль дрейфа генов в эволюции эукариотических популяций.
Для проверки гипотезы исследователи применили оригинальную компьютерную методику, основанную на структурном анализе родственных белковых молекул (всего 106 семейств), встречающихся в различных организмах — от бактерий до человека (36 видов). При этом пространственная структура должна была быть известна минимум для двух видов, чтобы строение остальных белков в группе можно было предсказать с помощью сопоставительного моделирования (о том, как это делается, см. в статье «Торжество компьютерных методов: предсказание строения белков» [2]).
Структурную стабильность и склонность белков к ассоциации оценивали с помощью методов молекулярной динамики [3] и термодинамических параметров участков поверхности белка. В частности, одной из характеристик была выбрана экспонированность на поверхность молекулы амидной и карбонильной групп белкового остова, снижающая стабильность белка из-за создания избыточного поверхностного натяжения и образования водородных связей с молекулами растворителя (рис. 1). Величина этого избыточного натяжения оказалась чрезвычайно близко связана с площадью олигомеризации белков для тех случаев, где структура олигомеров была известна. Эта связь позволила сделать предположение насчет того, что олигомеризация (а, следовательно, и белок–белковые взаимодействия) могла стать средством увеличения стабильности белков в ситуации, когда накопленные структурные дефекты снижают их устойчивость (рис. 1, внизу).
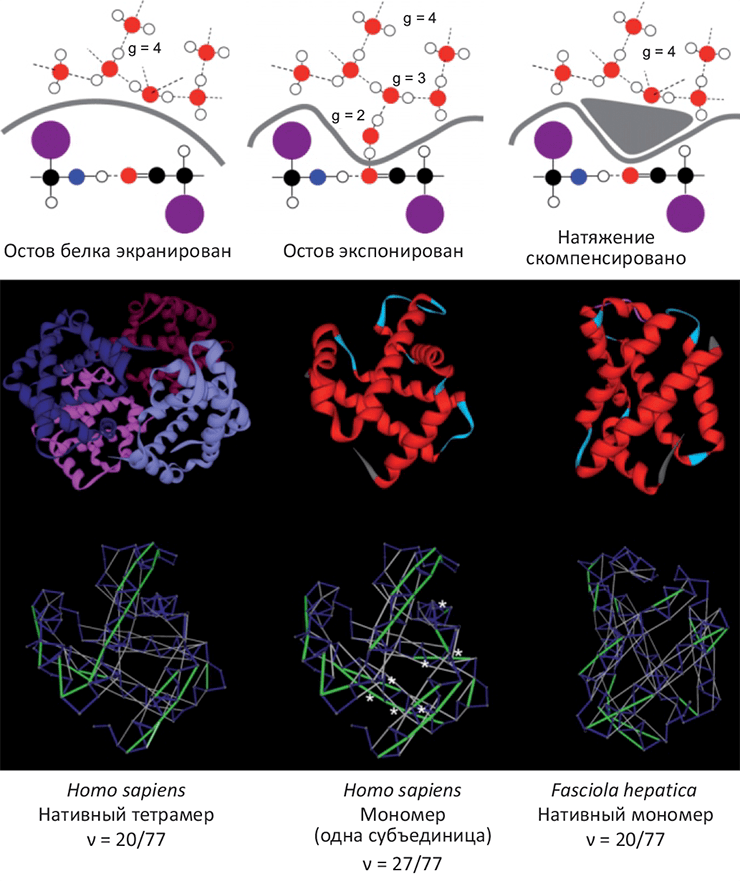
Рисунок 1. Структурные дефекты глобулярных белков способны вызывать ассоциацию. Сверху: схематичное объяснение, как экспонированность полярных атомов белкового остова может снижать стабильность белка. Карбонильная и амидная группы, находясь на поверхности глобулы, уменьшают координационное число молекул растворителя (g; для «чистой» воды g=4). Белок–белковая ассоциация может скомпенсировать избыточное поверхностное натяжение, образованное структурными дефектами белковых молекул. Снизу: Сравнение структурной стабильности гемоглобина человека (существует в виде тетрамера, слева) и печеночного сосальщика (мономер, справа). Анализ экспонированных на поверхность молекулы полярных групп остова выявляет семь избыточных структурных дефектов человеческого гемоглобина, рассмотренного в виде мономера (в центре; показано белыми точками). В то же время, в составе тетрамера этот параметр структурной стабильности совпадает с гемоглобином сосальщика. Таким образом, не исключено, что появление олигомерных форм гемоглобина у позвоночных животных вызвано необходимостью компенсации избыточного поверхностного натяжения, появившегося в результате накопления структурных дефектов.
Дополнительное исследование показало, что основной вклад в уменьшение стабильности дают именно нескомпенсированные водородные связи белкового остова, и только во вторую очередь роль играют участки гидрофобной поверхности белковой молекулы, также индуцирующие межмолекулярную ассоциацию.
Для более систематического сравнения снижения структурной стабильности в зависимости от характерного размера популяций (и, следовательно, силы генетического дрейфа) ученые ввели относительную характеристику свободной энергии поверхности белка в растворе, описывающую одновременно потенциальную сложность сети белок–белковых взаимодействий. За «точку отсчета» приняли кишечную палочку E. coli: положительные значения характеристики соответствуют более сложной сети взаимодействий, отрицательные — более простой (рис. 2). 36 изученных видов удивительным образом выстроились в порядке уменьшения характерного размера популяции (и, соответственно, увеличения сложности белок–белковых взаимодействий).
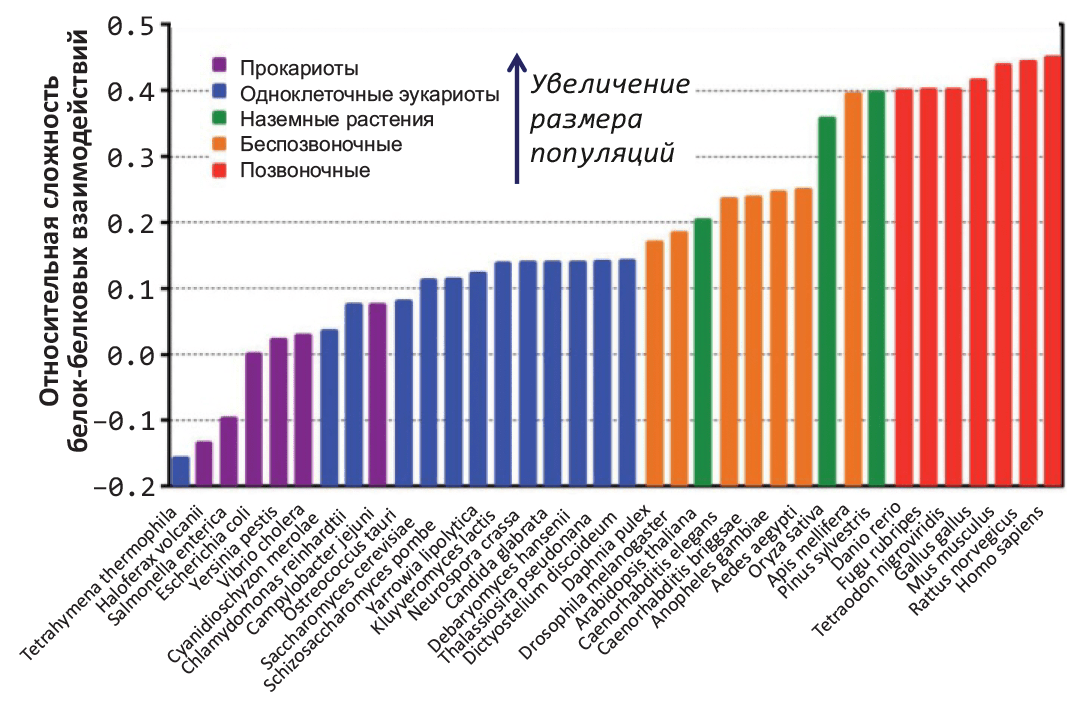
Рисунок 2. Уменьшение структурной стабильности увеличивает сложность белок–белковых взаимодействий у видов с (относительно) небольшим размером популяций. Предположительная относительная сложность сети межбелковых взаимодействий рассчитана методами молекулярного моделирования, основываясь на расчетах свободной энергии сольватации поверхности молекулы белка. За «точку отсчета» принята бактерия Escherichia coli (значение 0,0); виды сгруппированы по окраске согласно систематике и характерному размеру популяции. В организмах с (относительно) низкой численностью популяций интенсивность дрейфа генов достаточно высока, что предположительно вызывает накопление структурных дефектов и, как следствие, повышает сложность сети белок–белковых взаимодействий.
Все это приводит к тревожному выводу, что дарвиновская эволюция может быть не такой уж беспроигрышной стратегией в длинных «забегах», — особенно в популяциях ограниченного размера. «Залатывая» структурные дефекты «скотчиком», природа, возможно, взводит механизм часовой бомбы, которая сработает, как только «времяночка» перестанет действовать и какие-нибудь важные белки одномоментно утратят стабильность. В качестве первых «звоночков» можно назвать белки болезней Альцгеймера и Паркинсона, а также прионы, которые в определенных условиях сворачиваются по совершенно неправильному пути, вовлекая за собой все большее число молекул и приводя в итоге к гибели организма. «Виды с низкой численностью, в конце концов, окажутся обречены из-за природной стратегии наращивания сложности», — делает невеселое заключение Фернандес [4].
Сложность против устойчивости
Давно замечено, что белки прокариот (а в особенности архей) обладают большей термодинамической стабильностью, нежели их эукариотические аналоги. Последние более многофункциональны — за счет многогранных межбелковых взаимодействий, увеличивающих «информационную обеспеченность» клетки, — но, как мы видим, это далось далеко не бесплатно. Проблема генетического дрейфа нависла над судьбой нашего вида и наших ближайших родственников, — хотя неизвестно, какое время может потребоваться эволюции, чтобы довести сложность до той финальной черты, когда организм буквально рассыплется от потери контроля над несчетным числом взаимодействующих частей.
В то же время, жизнь может в очередной раз оказаться «сложнее самой себя», и этот гипотетический сценарий никогда не реализуется: какой-нибудь третичный отбор создаст очередной защитный механизм, и эволюция никогда не прервется.
Напоследок хотелось бы подчеркнуть ещё одно (пусть и чрезвычайно спекулятивное) соображение: эта «самосовершенствующаяся» сложность добавляет еще одну монетку в копилку эволюционного происхождения жизни (а не творения ее согласно «разумному замыслу»): вряд ли творец (разве что обладай он чрезвычайно специфическим чувством юмора) создал бы настолько несовершенную, в конечном счете, жизнь [5].
Литература
- Ariel Fernández, Michael Lynch. (2011). Non-adaptive origins of interactome complexity. Nature. 474, 502-505;
- Торжество компьютерных методов: предсказание строения белков;
- Молекулярная динамика биомолекул. Часть I. История полувековой давности;
- Philip Ball. (2011). The Achilles' heel of biological complexity. Nature;
- Когда б вы знали, из какого сора….





