
Антиген — невидимка
06 декабря 2015
Антиген — невидимка
- 2039
- 0
- 2
Если антиген «невидим», никакой иммунитет не справится с болезнью.
Рисунок в полном размере.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Клетки многоклеточного организма живут в полном смысле этого слова «напоказ», выставляя на своей поверхности фрагменты всех производимых ими белков. Каким же образом раковым клеткам удается «спрятать» опухолевые антигены от вездесущего Т-клеточного надзора и стать «клетками-невидимками»?
«Био/мол/текст»-2015
Эта работа опубликована в номинации «Лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Преамбула
Иммунология — удивительная наука, в которой практика (вакцинация, подбор групп крови при переливании и т.д.) на несколько столетий опередила теорию — полноценное научное обоснование механизмов распознавания «свой—чужой» в организме. Наше знакомство с ее достижениями начинается с первых дней жизни и первых прививок в роддоме, и даже самый далекий от биологии человек знает (главным образом из рекламы) о необходимости укрепления иммунитета. Но и у людей, знакомых с биологией более основательно, представления о молекулярных механизмах формирования иммунного ответа во многом остаются на каком-то «полуинтуитивном» и очень приблизительном уровне. Причем многие даже не подозревают о пробелах в своей научной картине мира. А начнешь задавать себе или другим «детские вопросы»: как иммунные клетки распознают раковые или вирусные антигены, если враг — внутри, а иммунитет — снаружи? Или почему одни виды рака иммунная система уничтожает лучше, чем другие? И понимаешь, что наивное полузнание на эти вопросы не отвечает. А значит, самое время поговорить о королях и капусте, об антигенах и комплексах гистосовместимости, и составить наконец более отчетливое представление о том, как именно организм распознает зараженные клетки. И почему некоторым клеткам удается этого избежать.
Мы будем говорить о механизмах презентации антигенов на примере злокачественных опухолей. Но те же самые универсальные принципы лежат в основе любого иммунного ответа, будь то бактериальная инфекция или вирусное заражение. Разумеется, в каждом случае есть свои тонкости и детали, но в них мы сегодня вдаваться практически не будем. Попробуем составить для начала общую картину процесса.
Что такое антиген и как с ним бороться
Что такое антиген? Поскольку, как уже было сказано выше, иммунология развивалась от практики к теории, то и определение этого важнейшего термина долгое время оставалось сугубо эмпирическим: «Антиген — это молекула (частица), способная вызывать иммунный ответ». Это определение продолжает оставаться актуальным и по сей день, хотя оно, естественно, обросло множеством дополнений и уточнений. Самым важным из них мне представляется следующее: «Антигены — это биологические тела и молекулы, несущие признаки чужеродной биологической информации» [1], поскольку оно отражает ключевую цель иммунитета — борьбу за генетическую однородность организма, важной частью которой является контроль над собственными клетками, которые в результате ракового перерождения могут перестать быть полностью «своими» и приобрести признаки этой самой «чужеродности».
Если говорить о химической природе данных соединений, то это в основном белки, хотя полисахариды и липиды также способны в отдельных случаях вызывать иммунный ответ, но в данной статье будет говориться почти исключительно о «классических» — белковых — антигенах.
Опухолевые антигены — соответственно, это белки, по которым раковая клетка опознается иммунной системой организма как «чужак», подлежащий уничтожению, что позволяет ликвидировать большинство злокачественных перерождений еще в зародыше — или, по крайней мере, сдерживать их рост. (У людей, страдающих иммунодефицитом, и мышей с поврежденной иммунной системой опухоли развиваются стремительно и с гораздо большей частотой.)
Множество опухолевых антигенов довольно сильно пересекается со множеством белков, которые называют маркерами злокачественных опухолей [2], что зачастую вызывает определенную путаницу. Например, в соответствующей статье русской Википедии, где два эти понятия употребляются практически как синонимы. Но это не так. Далеко не все маркеры — белки, которые ассоциированы с опухолями сильнее, чем со здоровыми клетками, — являются антигенами (способны вызывать естественный иммунный ответ). Часто это обычные «здоровые» белки, чей синтез по каким-то причинам усилен в опухоли.
Настоящими опухолевыми антигенами являются белки, мутированные в опухолях (в том числе и благодаря встраиванию в их гены онковирусов), то есть те, у которых аминокислотная последовательность отличается от нормальной — исходно закодированной в клетках данного организма, а также так называемые онкофетальные антигены — эмбриональные белки, экспрессируемые в раковых клетках (в норме они синтезируются в организме только на ранних стадиях зародышевого развития, когда иммунитет еще неактивен, в результате иммунной системе взрослого организма они незнакомы и воспринимаются как чужеродные. (К «знакомым» — собственным белкам организма — иммунная система в норме неагрессивна, «толерантна». Рассмотрение механизмов, которыми достигается подобная избирательность, лежат за рамками данной статьи, просто примем ее как эмпирический факт .)
Однако в других конкурсных статьях этого года немного рассказывается, как осуществляется эта «отрицательная селекция»: например, в статье «Т-лимфоциты: путешественники и домоседы» [3]. — Ред.
Клетки, в которых содержится такой чужеродный белок-антиген, будь то клетка, пораженная вирусом или бактерией, или же опухолевая клетка, содержащая мутации (неоантигены), иммунная система стремится уничтожить, и таким образом поддерживается генетическое единообразие многоклеточного организма. Но как именно иммунная система узнает о белках-«чужаках», если они синтезируются и работают внутри клетки, а иммунная система надзирает за порядком снаружи?
Себя показать и на других посмотреть
Для того, чтобы разобраться с ответом на этот вопрос, необходимо вспомнить, что живая клетка, существуя, непрерывно обновляет себя. Срок жизни одних белков в ней измеряется минутами, других — часами, но в конце концов все они отправляются в расход. Управление деградацией белков, так же, как и управление их синтезом, — важный механизм внутриклеточной регуляции. Белки утилизируются клеткой несколькими путями. Одним из основных является протеасомный способ деградации. Протеасома — это гигантский белковый комплекс в цитоплазме клетки. Она распознает белки, связанные с маленьким белком убиквитином [4], [5]. Именно так, путем убиквитинирования, клетка метит отслужившие свое белки, и протеасома расщепляет их на короткие фрагменты — пептиды. Большая часть этих пептидов разбирается потом до аминокислот, которые экономная клетка пускает в оборот для синтеза новых белков, но некоторая их часть экспортируется из цитоплазмы в эндоплазматический ретикулум (ЭПР) и там образует комплексы со специальными белками, носящими общее название: «Белки главного комплекса гистосовместимости первого типа» (MHC I) (рис. 1). Эти белки имеют общий структурный мотив, образующий своего рода «щель», способную связывать короткие пептиды (8-10 аминокислотных остатков) (рис. 2). Связав пептид, комплекс МНС I вместе с ним транспортируется на поверхность клетки, находится там какое-то время, а потом деградирует и в свою очередь распадается на аминокислоты. Таким образом каждая клетка непрерывно «в режиме реального времени» экспонирует (представляет) на своей поверхности случайные фрагменты всех стабильно экспрессируемых в ней белков. Такой своего рода «пептидный портрет» или «пептидный каталог» жизнедеятельности [6], [7].
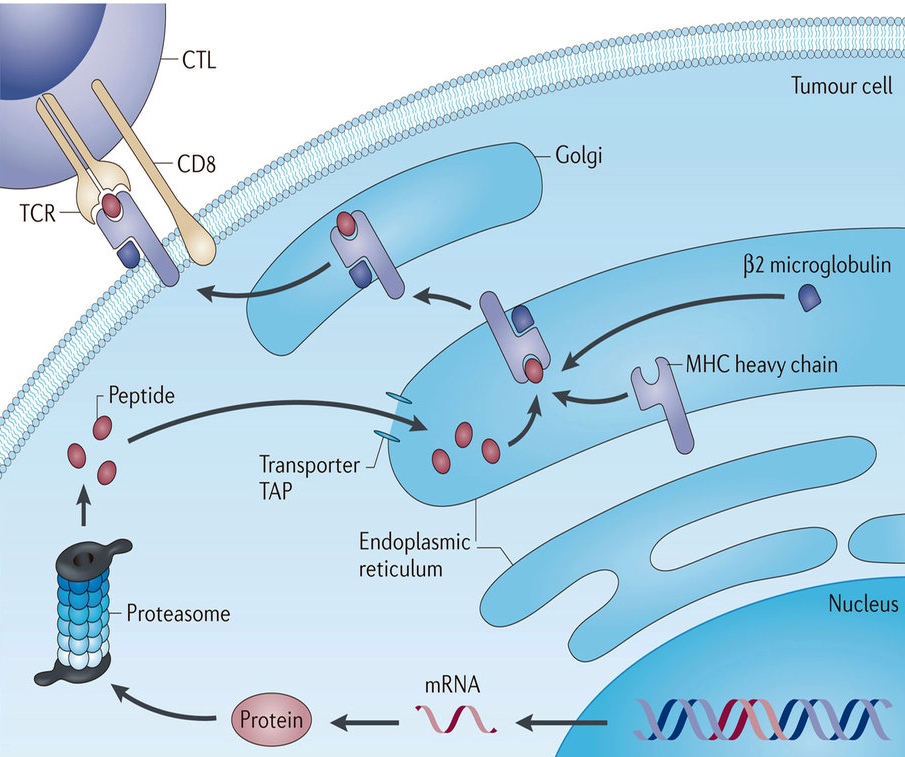
Рисунок 1. Презентация опухолевого антигена на поверхности клетки и распознавание его TCR рецепторами Т-клетки.
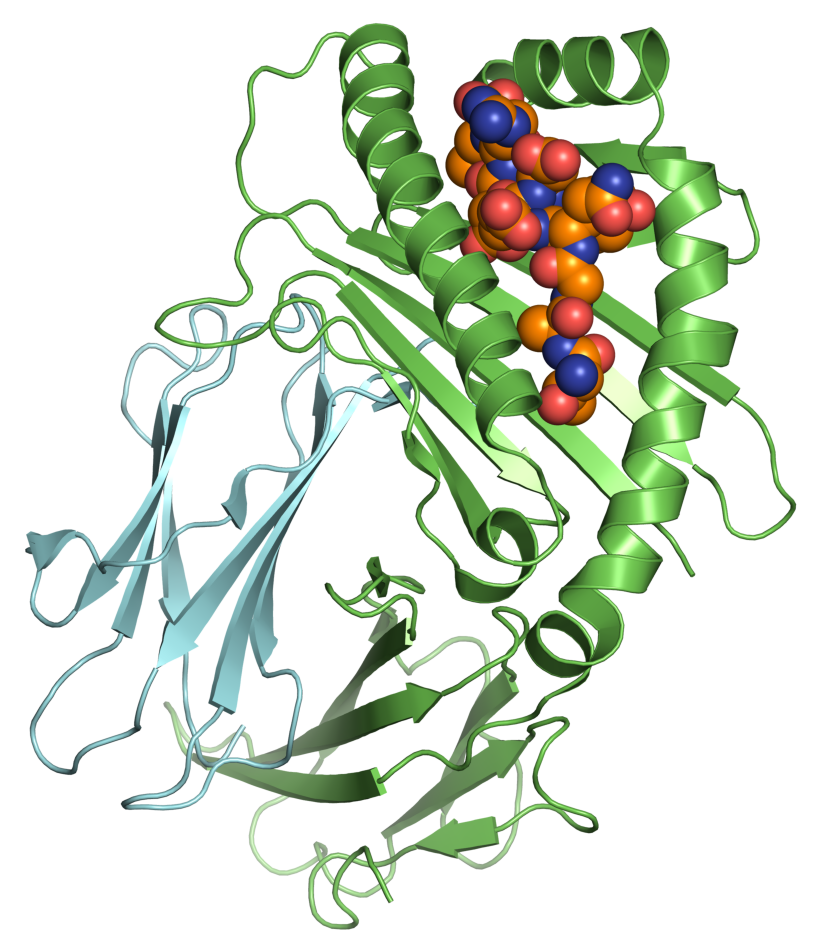
Рисунок 2. Пептид в «щели» белка MНС I.
Всех белков — это важно понимать. Клетка не стремится специально выставить на поверхность фрагменты именно чужеродной макромолекулы — она, собственно говоря, и понятия не имеет, какой из белков внутри нее «не такой, как все». Даже при инфекционном поражении на долю чужеродных пептидов приходится не более 0,1% от общего числа выделенных из мембранных молекул MHC пептидов. Таким образом, из примерно 100 000 молекул MHC, присутствующих на поверхности клетки, чужеродный эпитоп (пептид чужеродного белка, связанный с МHC I) будет входить в состав всего лишь 100 молекул [1]. В случае с онкоантигенами эта доля, вероятно, еще ниже.
Нет антигена — нет проблемы!
Чем больше опухолевого антигена (антигенов) экспрессирует клетка, тем больше эпитопов представлено на ее поверхности, тем эффективнее будет иммунный ответ, так как именно чужеродные эпитопы в составе комплекса MHC I служат сигналами для уничтожения опухолевых клеток цитотоксическими Т-киллерами. Если иммуногенность опухоли достаточно велика, она с большой вероятностью будет уничтожена организмом на самой ранней стадии. Однако в случаях, когда иммунной системе не удается «с наскоку» уничтожить сразу все раковые клетки зарождающейся опухоли, побочным результатом иммунных атак становится естественный отбор опухолевых клонов, способных уклоняться от иммунного контроля. Способы этого уклонения многообразны. Некоторые из них из них, относящиеся к регуляции врожденного иммунного ответа, уже обсуждались на страницах «биомолекулы» [8]. Другие самым непосредственным образом касаются темы данной статьи, а именно регуляции презентации опухолевых антигенов на поверхности раковых клеток.
С точки зрения интересов опухоли, нет представления опухолевого антигена на поверхности клетки — нет проблемы! Этого эффекта раковая клетка может добиться несколькими путями (и как правила использует сразу несколько из них). Можно воздействовать на синтез компонентов протеасомы и нарушить процесс деградации клеточных белков. Можно повредить белки-транспортеры (ТАР-белки) отвечающих за доставку пептидов из цитозоля, где работает протеасома, в эндоплазматический ретикулум, где собираются MHC комплексы (рис. 1). Можно нарушить экспрессию самих белков MHC I или их коактиватора — белка β2-микроглобулина [6], [7]. Пути различные — результат один: процесс нормальной презентации пептидов всех белков (и опухолевого антигена в том числе) на поверхности таких клеток оказывается нарушен. А поскольку Т-клетки не способны распознавать антигены иначе как в составе MCH I комплекса, то такие опухолевые клетки и их антигены становятся «невидимыми» для Т-клеточного ответа.
Почему понимание всего этого механизма так важно не только для теоретической, но и для самой что ни на есть прикладной науки? Большие успехи онкофармакологии последних лет связывают с появлением новых иммунопрепаратов, усиливающих Т-клеточный ответ [9]. Однако в отзывах о действительно впечатляющих успехах данной области неизменно присутствует «ложка дегтя». Усиление Т-клеточного ответа работает лишь там, где есть что усиливать. Все иммунотерапевтические методы демонстрируют эффективность лишь для опухолей, обладающих достаточно высокой иммунногенностью — способностью инициировать иммунный ответ, — в том числе и путем презентации опухолевых антигенов на поверхности своих клеток. Опухоли, утратившие эту способность, теряют и чувствительность к иммунотерапии. Перед современной иммунологией стоит вопрос: а можно ли заставить эти антигены-«невидимки» снова сделаться «видимыми» для иммунной системы? Положительный ответ на него сможет спасти множество человеческих жизней и приблизит время окончательной победы над раком.
Литература
- Ярилин А.А. Иммунология. М.: ГЭОТАР-Медиа, 2010. — 752 с.;
- Как распознать рак при помощи биомаркеров?;
- Т-лимфоциты: путешественники и домоседы;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Seliger B., Maeurer M.J., Ferrone S. (2000). Antigen-processing machinery breakdown and tumor growth. Immunol. Today. 21, 455–464;
- Leone P., Shin E.C., Perosa F., Vacca A., Dammacco F., Racanelli V. (2013). MHC class I antigen processing and presenting machinery: organization, function, and defects in tumor cells. J. Natl. Cancer Inst. 105, 1172–1187;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль.







