«Вездесущий убиквитин» возвращается
13 мая 2009
«Вездесущий убиквитин» возвращается
- 3534
- 3
- 4
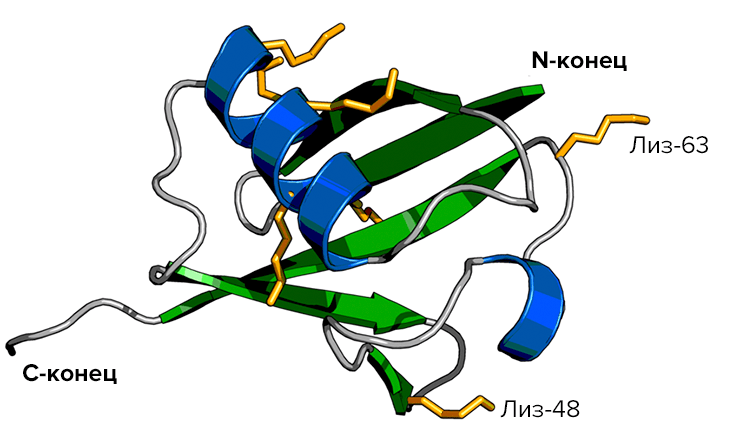
«Ленточное» представление молекулы убиквитина. Семь боковых цепей лизина, присутствующих в молекуле, показаны жёлтым цветом; по последним данным, большинство из них (а не только Лиз-48 и Лиз-63, как считалось ранее) участвуют в образовании полимеров.
-
Автор
-
Редакторы
Темы
Одним из самых интересных феноменов в молекулярной биологии является убиквитиновая сигнализация в клетке. Элементарная единица этого пути — небольшой белок убиквитин (76 аминокислотных остатков, 8,5 кДа), открытый в 1975 году. Год за годом исследования убиквитин-опосредованных событий в живой клетке приносят всё новые и новые неожиданности. В заметке «Вездесущий убиквитин» мы давали прогноз, что вскоре снова услышим об этом белкé. Приятно заметить, что это предсказание сбылось. Правда, простоты в общую картину эти открытия не добавили — приходится говорить, скорее, о путанице в ранее стройной теории «казнить–помиловать».
Начнём с того, что коротко опишем предысторию. Белок убиквитин получил название от англ. ubiquitous — «присутствующий везде» [1], [2]. Давно замечено, что разные органы и ткани имеют свой характерный набор белков. Также известно, что те белки, которые экспрессируются во всех тканях, являются важнейшими звеньями метаболических и сигнальных процессов, — поэтому действительно повсеместное распространение убиквитина вызвало большой интерес. Долгое время не удавалось даже понять его функцию, пока, наконец, в 1980 г. не было объявлено: убиквитин является молекулярной «меткой смерти»! Согласно открытию, он является молекулярной меткой белков клетки, которые должны быть уничтожены в процессе протеасомной деградации. Авторы этого открытия — израильтяне Аарон Чихановер (Aaron Ciechanover), Аврам Хершко (Avram Hershko) и американец Ирвин Роуз (Irwin Rose) — в 2004 году получили Нобелевскую премию по химии «за открытие убиквитин-опосредованной деградации белков в клетке». И не зря. Прошло время, и теперь убиквитилирование можно встретить буквально во всех метаболических и регуляторных путях. Сигнал от любого гормона, ответ на стрессорные факторы, внутриклеточные сигналы, — всё это приводит к каскадам убиквитилирования-деубиквитилирования сигнальных молекул [3].
Сначала была обнаружена уникальная система убиквитилирования белков (рис. 1). Процесс «выписывания» «черной метки» довольно сложен — в нем принимает участие комплекс из трёх ферментов, которые называются довольно тривиально — Е1, Е2 и Е3. Е3 распознает белок, который нужно пометить; Е1 активирует мономер убиквитина; наконец, фермент Е2 соединяет активированный убиквитин с белком. В таком виде меченый белок может быть узнан протеасомой — белковым «шредером».
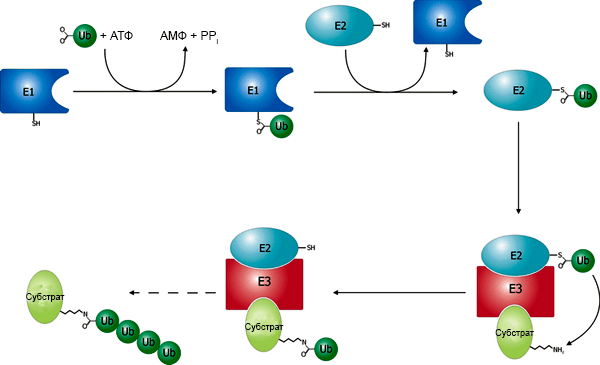
Рисунок 1. Общий вид процесса убиквитилирования. Через сульфидную группу белок Е1 связывает убиквитин. Это энергозависимый процесс, и для активации убиквитина используется молекула АТФ. Е1 «передаёт» активированный убиквитин ферменту Е2. Последний узнаёт и связывает фермент Е3 — убиквитин-лигазу, которая специфически распознаёт белки-субстраты. В результате совместного действия Е2 и Е3 происходит модификация субстрата молекулой убиквитина. Дальше цикл повторяется, и полимер убиквитина «вырастает» до необходимого размера. Интересно, что число разновидностей ферментов групп Е1 и Е2 в клетке — не больше десятка, тогда как Е3 — самая гетерогенная группа ферментов, и включает в себя несколько сотен разных белков. Это говорит о том, что Е1 и Е2 — консервативные и неспецифичные ферменты, тогда как группа Е3 отвечает за специфичность действия комплекса, распознавая множество конкретных субстратов.
Дальнейшие исследования показали, что убиквитин образует довольно экзотические полимеры — путём сшивки через боковые радикалы внутренних (не концевых) аминокислот. По всем канонам аминокислоты соединяются посредством пептидной связи (NH2-группа к COOH-группе). Однако в случае убиквитина его С-концевая аминокислота (глицин) связывается с боковой (ε) аминогруппой лизина другой молекулы «метки смерти»; эта молекула таким же образом связывается с третьей, и так далее, пока не образуется целый полимер.
Потом обнаружилось, что есть два типа полимеров убиквитина, различающиеся по типу сшивки. Она может происходить через боковые цепи или 48-го, или 63-го остатка лизина. И оказалось, что «смертельный» для белков полиубиквитин — это только один тип полимера, сшиваемый через 48-й лизиновый остаток (Ub-48).
Интересным оказалось, что другой полимер — убиквитин-63 (Ub-63, в котором мономеры сшиты между собой через 63-й остаток лизина) — играет уже вполне «мирные» роли. Он выполняет множество регуляторных функций — активацию или ингибирование активности белков, участвует в их транспорте и процессинге, но никак не в деградации! (Хотя позже нашлись исключения и из этого правила.) Как системы клетки различают эти два полимера? Скорее всего, различия в функциях определяются пространственным строением этих полимеров, разным для различных вариантов межмолекулярной сшивки.
Совсем недавно учёные всерьез задались вопросом — если полиубиквитин полимеризуется через боковые цепи лизинов 48 и 63, а в его составе есть ещё лизины, — то что мешает и им участвовать в полимеризации, образуя полимеры со своей специфической конформацией и ролью в клетке? И действительно: опыты показали, что полиубиквитин может формироваться, даже если оба «критичных» лизина (Лиз-48 и Лиз-63) удалены. За этим последовали неуверенные сообщения об обнаружении полиубиквитиновых молекул, связанных между собой по Лиз-6, Лиз-29, Лиз-33, и в завершение — «смешанной» молекулы, в которой мономеры убиквитина связаны с помощью разных комбинаций этих вариантов [3]. В результате получаются сложные разветвлённые структуры, роль которых в метаболизме клетки еще предстоит определить.
В ряде свежих статей [4–6] опубликованы данные о новой форме полимера — это традиционный линейный «полиполипептид», в котором молекулы убиквитина связаны обычной пептидной связью «хвост к голове» (СООН-группа глицина-76 связана с NH2-группой метионина-1 другой молекулы белкá). Сам факт существования такой формы полимера известен уже несколько лет, но только в этом году обнаружилось, что такой «традиционно» сшитый убиквитин играет важную роль в регулировании активности ряда транскрипционных факторов, таких как МАПК и NF-κB — важнейших «мессенджеров» иммунной системы организма. Модификация осуществляется особым белковым ферментным комплексом — LUBAC (от linear ubiquitin chain assembly complex) [4], [5]. Функцию такой формы убиквитина понять ещё не удалось: в ряде случаев он вызывал разрушение меченых белков, а некоторых последних публикациях [6] — служил аналогом «дружественного» Ub-63 (т. е. выступал не как «смертельная метка», а в роли «мирной» регуляторной модификации). Как объяснить все эти факты вместе — пока неизвестно. (Тем более что это ещё не всё.) Пока что принята рабочая гипотеза, согласно которой конформация такого линейного полипептида по структуре больше похожа на Ub-63, и в большинстве случаев распознаётся клеточными системами как «мирная» модификация. Хотя стоит отметить, что такое объяснение, в общем-то, «притянуто за уши» (то есть, является сугубо спекулятивным).
Появляются также свидетельства, что Ub-63 может быть не столь уж и безобиден, — ряд молекул после модификации этим полимером сразу же деградирует. А ещё оказалось, что и сам «поцелуй смерти» — полиубиквитин-48 — не всегда является таковым [3]. Открыт ряд белков (и дальше наверняка откроют ещё), для которых «смертельная метка» является лишь стимулятором активности!..
Интересны также результаты по изучению метилированного убиквитина — то есть такого, который не может образовывать полимеры, поскольку метилирование «скрывает» все акцепторные участки. По данным одного из основателей теории убиквитинизации Аарона Чихановера, достаточно одиночной молекулы убиквитина (т. е. моноубиквитилирования) или нескольких моноубиквитинов для деградации меченого белка. Более того, в некоторых случаях им показано, что полиубиквитиновая метка несёт функцию «удлинителя», помогая коротким пептидам «дотянуться» до активного центра протеасомы. Эти результаты были доложены в прошлом месяце в Мадриде на конференции TNF2009 и скоро будут опубликованы в научной прессе.
В этом потоке информации радует только суть: современная наука находится в постоянном поиске, не стесняясь попадать в логические тупики. Наверняка, убиквитин, в соответствии с названием, будет встречаться во всех областях молекулярной биологии и радовать нас новыми ребусами и в будущем. Наш сайт будет продолжать держать вас в курсе событий.
Литература
- David H. Schlesinger, Gideon Goldstein, Hugh D. Niall. (1975). Complete amino acid sequence of ubiquitin, an adenylate cyclase stimulating polypeptide probably universal in living cells. Biochemistry. 14, 2214-2218;
- Вездесущий убиквитин;
- W. Li, Y. Ye. (2008). Polyubiquitin chains: functions, structures, and mechanisms. Cell. Mol. Life Sci.. 65, 2397-2406;
- Takayoshi Kirisako, Kiyoko Kamei, Shigeo Murata, Michiko Kato, Hiromi Fukumoto, et. al.. (2006). A ubiquitin ligase complex assembles linear polyubiquitin chains. EMBO J. 25, 4877-4887;
- Fuminori Tokunaga, Shin-ichi Sakata, Yasushi Saeki, Yoshinori Satomi, Takayoshi Kirisako, et. al.. (2009). Involvement of linear polyubiquitylation of NEMO in NF-κB activation. Nat Cell Biol. 11, 123-132;
- Arthur L. Haas. (2009). Linear polyubiquitylation: the missing link in NF–κB signalling. Nat Cell Biol. 11, 116-118.