
Человек генно-модифицированный / Homo genere mutatio
04 декабря 2017
Человек генно-модифицированный / Homo genere mutatio
- 5206
- 3
- 6
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Когда Олдос Хаксли писал «Дивный новый мир», думал ли он, что на самом деле может наступить эра детей, созданных по заказу? «Дети здесь не рождаются. Их выращивают в специальных инкубаторах и делят на альфы, беты, гаммы, дельты и эпсилоны в зависимости от умственных способностей». На сегодняшний день вряд ли найдется более рьяно обсуждаемая в СМИ тема биомедицины, чем CRISPR/Cas. СМИ готовят общество к появлению в будущем фабрик по производству детей на заказ, ученые — к возможности создания генетической панацеи. Исследования на человеческих эмбрионах с применением генетических модификаций лишь подливают масла в огонь. Общественность строит догадки, какие перспективы дает этот инструмент генного редактирования в руках ученых. Ждет ли мир появление «отредактированных» людей? Станет ли Homo genere mutatio в эволюционный ряд после Homo sapiens sapiens? К чему бы ни привела технология CRISPR/Cas, несомненно, что это шаг в бездну новых возможностей.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое CRISPR/Cas9 и с чем его едят
Хотя система CRISPR известна с 1980-х, активно о ней заговорили лишь несколько лет назад [1]. Повышенное внимание к технологии генной модификации связано с перспективами, которые она открывает. В частности, лечение генетических заболеваний. Это может изменить медицину. Освоение CRISPR/Cas9 в рамках человеческого тела подобно первым шагам в космосе.
Технология CRISPR (от англ. Clustered Regularly Interspaced Short Palindromic Repeats — короткие палиндромные повторы, регулярно расположенные группами) основана на направленном редактировании генома с помощью эндонуклеазы Cas9. Словно умные ножницы, фермент Cas9 совершает двунитевые разрезы в нужных участках гена, удаляя дефекты генетической информации (рис. 1). После того как разрыв внесен, включаются системы восстановления ДНК, и нужная неповрежденная последовательность встает на место удаленной дефектной [2].

Рисунок 1. Схема работы CRISPR/Cas9.
Это позволяет не просто добавлять новую ДНК-последовательность в ген, а встраивать ее направленно, заменяя конкретный непригодный участок новым. CRISPR/Cas9 может стать мостиком над пропастью наследственных заболеваний. Сейчас известны тысячи генетических патологий, не подвластных лечению . Больным можно оказать только симптоматическую или паллиативную помощь. Вылечить генетический дефект врачам не под силу. А CRISPR как инструмент модификации дает шанс людям с генетическими патологиями. Становится возможным «ремонтировать» мутации, вызвавшие болезни.
Это уже не совсем так. В начале ноября 2017 года появилось сообщение о том, что мальчику, больному буллезным эпидермолизом, заменили 80% площади кожи на трансплантаты из его собственных клеток, в которых дефектный ген, вызывающий болезнь, заменили нормальным. — Ред.
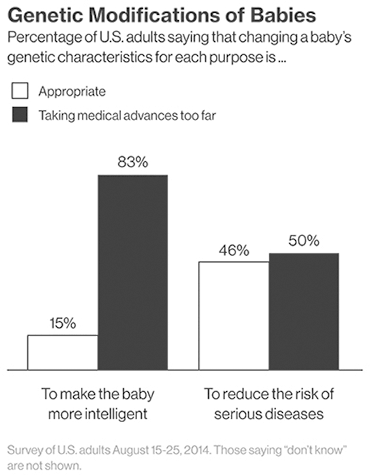
Рисунок 2. Общественное мнение относительно технологии CRISPR/Cas9.
Другой стороной медали может стать использование технологии не по задуманному назначению. Общество страшится появления «дизайнерских» детей, сделанных на заказ родителями. Проведенный опрос среди американцев говорит о том, что люди еще не готовы принять возможности генной терапии. Так, 83% респондентов не хотят использовать технологию для совершенствования детей (рис 2).
Еще один шаг к совершенству
Однако технология генного «ремонтирования» не без изъянов. Она не доведена до совершенства. CRISPR/Cas9 — это не волшебная палочка, призванная исправлять любой генетический дефект. Генетический скальпель не отличается высоким уровнем точности. Эндонуклеаза может совершить разрезы и в нецелевых участках. При этом система CRISPR/Cas9 может не исправлять мутации, как задумывалось, а создавать новые.
Отсутствие стопроцентной точности в работе эндонуклеазы Cas9 делает технологию небезопасной и ненадежной. Пока система не станет более точной, она не получит широкое распространение в практической медицине. Однако маленькие шаги в сторону реальности метода совершаются. Работа ученых из Массачусетского технологического института выводит технологию CRISPR на новый уровень посредством создания улучшенной версии фермента — eSpCas9.
eSpCas9 имеет повышенную специфичность, что снижает вероятность побочных эффектов при редактировании генома. Разрезы этого фермента более точные. Это позволило снизить риск вероятных ошибок примерно в 10 раз. Несомненно, такое открытие — настоящий прорыв для генного редактирования. Оно стало более специфичным и точным, а значит, стало ближе к практической медицине, чем когда-либо [3].
Первый блин комом
В апреле 2015 года мир должен был ахнуть от удивления: впервые ученым удалось не просто прочитать, а еще и отредактировать геном человека (рис. 3). Удивительно, но это событие не привлекло к себе много внимания. Такие авторитетные издания, как Nature и Science, не пожелали публиковать данные об исследовании ввиду его неэтичности. Связано это с тем, что впервые методику генного редактирования CRISPR/Cas9 проверили на человеческих эмбрионах [4].
Рисунок 3. Человеческие эмбрионы с отредактированным геномом.
Китайские ученые из университета Гуанчжоу использовали нежизнеспособные эмбрионы. Их получили посредством ЭКО. На этапе их образования произошел сбой, который привел к формированию трипронуклеарных эмбрионов, которые содержат не два пронуклеуса — материнский и отцовский, — а три. Такие зародыши обычно погибают еще до имплантации и нежизнеспособны: они содержат аномальный тройной набор хромосом (69 шт.), тогда как в норме кариотип составляют 46 [5]. Лишние 23 хромосомы не дают плоду развиваться нормально, что приводит к его гибели [6].
Перед учеными не стояла задача продлить время жизни трипронуклеарных эмбрионов. Их целью было осуществить генный нокаут бета-талассемии, которой страдали эмбрионы. Задумку не вполне удалось реализовать. Из 86-и лишь полсотни эмбрионов удалось протестировать. Генная модификация произошла в 28 зародышах, но почти во всех случаях — не такая, как надо, или в неправильном месте. Дефектный ген бета-талассемии был успешно удален из клеток лишь четырех эмбрионов.
Эксперимент не только не принес ожидаемого эффекта, но и создал новые непредвиденные мутации в геноме множества клеток. По словам лидера научной группы, использованная технология пока слишком «сырая». Она не может быть использована на нормальных эмбрионах. Чтобы приступить к ее клиническому использованию, процент успеха должен приближаться к 100.
Модификация людей одобрена законом
Официальное разрешение от вневедомственного органа Министерства здравоохранения Соединенного Королевства — HFEA (Human fertilisation and embryology authority) — на редактирование человеческих эмбрионов с помощью технологии CRISPR/Cas9 в 2016 году получила исследовательская группа из Института Фрэнсиса Крика в Великобритании под руководством биолога Кэти Ниакан. В качестве объекта исследования будут использоваться лишние эмбрионы, которые получают при ЭКО, — те, что оказались не нужны семьям ввиду свершившегося успешного подсаживания других зародышей. Раньше такой материал просто утилизировали за ненадобностью.
Это первое разрешение на подобную деятельность в Великобритании, и ученых не ждет полная свобода действий. Эмбрионы могут быть использованы лишь для определенных целей, которые будут оценены экспертной комиссией (рис. 4). Применять можно семидневные эмбрионы. Срок жизни объектов исследования после начала эксперимента — 14 дней. После этого они должны быть утилизированы. Подсаживание их к суррогатной матери исключено. Пролонгировать беременность генномодифицированными эмбрионами запрещено [7].
Рисунок 4. Человеческому эмбриону вводят отредактированную ДНК в лондонской лаборатории Института Фрэнсиса Крика.
Успех CRISPR/Cas9
Первые полосы научных журналов в августе 2017 года вновь украшала аббревиатура CRISPR/Cas9. На этот раз новостями об успешном эксперименте спешили поделиться ученые из Орегонского университета здоровья и науки (OHSU). Группа ученых во главе с уроженцем Казахстана Шухратом Миталиповым применили технологии редактирования генов CRISPR/Cas9, чтобы изменить ДНК больных человеческих эмбрионов [8].
Среди безумного моря наследственных патологий выбор объекта исследования пал на гипертрофическую кардиомиопатию. Это серьезное генетическое заболевание сердца с аутосомно-доминантным типом наследования. Это значит, что патология проявится при наличии хотя бы одной дефектной копии гена. При этом данный ген не сцеплен с половой хромосомой, поэтому встречается как у мужчин, так и у женщин.
Каждый год гипертрофическая кардиомиопатия уносит жизни 50% больных ей. Мутации в гене MYBPC3, отвечающем за сокращение кардиомиоцитов (клеток сердца), приводят к хаотичному расположению мышечных волокон и их утолщению. Возникает нарушение ритма, сердечная недостаточность и как следствие — смерть.
Особенно часто заболевание поражает молодых спортсменов [9]. Технология CRISPR/Cas9 позволила группе ученых отредактировать дефектный ген. В исследовании использовали 12 здоровых яйцеклеток и сперму, несущую мутантный ген MYBPC3. С помощью CRISPR/Cas9 из ДНК сперматозоидов удалось вырезать дефект, словно ножницами (рис. 5) [10].
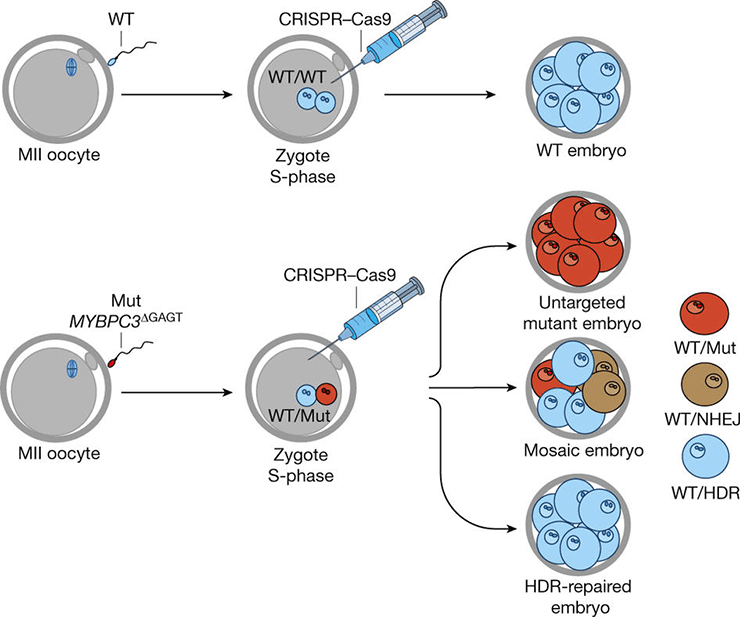
Рисунок 5. Схема воздействия CRISPR/Cas9 на ген MYBPC3.
В результате получили 42 здоровых эмбриона из 58-и. Это составило 72,4% потомства без патологии. Такие результаты оказались довольно успешными по сравнению с полученными ранее при других исследованиях с CRISPR/Cas9 на эмбрионах с генетическими заболеваниями. Улучшение показателей, их приближение к ста процентам, дает надежду на лечение наследственных болезней в ближайшем будущем.
«Мы продемонстрировали возможность исправлять мутации в человеческом эмбрионе безопасным способом и с заметной степенью эффективности», — говорит один из руководителей проекта, Хуан Карлос Бельмонте.
Что может предложить миру CRISPR/Cas9
Каждое крупное открытие в истории человечества встречало сопротивление. С этим столкнулись и Галилео Галилей, и Джордано Бруно, и Парацельс, и Игнац Земмельвейс, осмеянный за свое предложение мыть врачам руки перед осмотром больных. Мир с трудом принимает новые открытия. Сотни известных имен стали признанными лишь после смерти и были гонимы за свои убеждения при жизни.
Инквизиция и научное невежество остались далеко позади. Сегодня медицина развивается очень быстро — в сравнении с минувшими столетиями она движется семимильными шагами. Несомненно, CRISPR/Cas9 станет одним из важнейших биотехнологических открытий XXI века. Что же может предложить миру эта технология?
- Лечение наследственных заболеваний. Реальным на данный момент представляется избавить мир от моногенных патологий — болезней, вызванных мутацией в одном гене. В техническом плане это осуществить проще, чем редактировать дефект нескольких генов (рис. 6) [11], [12].
- Борьба с ретровирусными инфекциями, в том числе с ВИЧ [13].
- Лечение рака может стать возможным при определении роли генов, отвечающих за перерождение нормальных клеток в атипичные. Если ученые откроют мутацию, которая запускает процесс злокачественной пролиферации, то появится возможность исправить дефект с помощью генетического редактирования [14].
- Исследования, которые помогут пополнить библиотеку знаний о развитии человека. В частности, технология CRISPR будет полезна для выяснения процессов формирования здорового эмбриона (рис. 7). В перспективе это поможет предотвращать выкидыши и сделать процедуру ЭКО более эффективной. В настоящее время из 100 оплодотворенных яйцеклеток лишь половина способна достигнуть стадии бластоцисты, из них только 25 имеют шанс на имплантацию в материнской утробе и лишь 13 могут развиваться в течение минимум трех месяцев. Комментирует Кэти Ниакан, руководитель проекта в Великобритании: «Именно поэтому эти исследования так важны. Выкидыши и бесплодие имеют чрезвычайное распространение, а мы до сих пор не владеем полной картиной того, как устроены все механизмы» [15].
- Ксенотрансплантация — пересадка органов от животных к людям — станет возможной благодаря системе CRISPR/Cas9. Многообразие травм и заболеваний нередко требует трансплантации. Не всегда пациент может получить требуемый орган. Использование органов животных могло бы спасти многие жизни (рис. 8). Свиньи имеют приближенные по характеристикам к человеческим органы, однако их геном содержит особые эндогенные ретровирусы — PERV, которые могут привести к опасным для пациента последствиям при пересадке. Инактивация этих вирусов открывает дверь к безопасному источнику органов и тканей для трансплантации больным людям органов от животных [16].
- ГМ-животные и пища, которые с помощью генной модификации могут получить полезные свойства и потерять неблагоприятные (рис. 9) [17].
- Создание «дизайнерских детей» у многих ассоциируется с технологией CRISPR/Cas9. Хотя такие исследования не проводили и ни один из ученых не ставил перед собой такую цель, именно возможность создания ГМ-детей по своему вкусу вызывает наибольшие опасения у общественности (рис. 10). Однако биологи считают, что на данном этапе освоения технологии это неподвластно человеку. Цитата профессора Хуана Карлоса Бельмонте: «Никто из нас пока не думает об этом [имеется в виду редактирование геномов людей — прим. ред.], потому что на данный момент это невозможно реализовать на практике. Пока исследования CRISPR/Cas9 относятся к области фундаментальной науки. Я уже не говорю о том, что мы рассуждаем о системах, которые природа создавала миллионы лет».
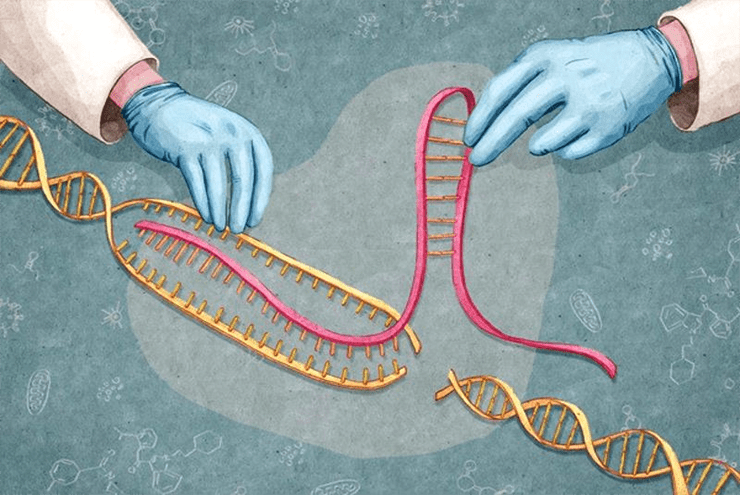
Рисунок 6. Руками врача буквально лечится геном.
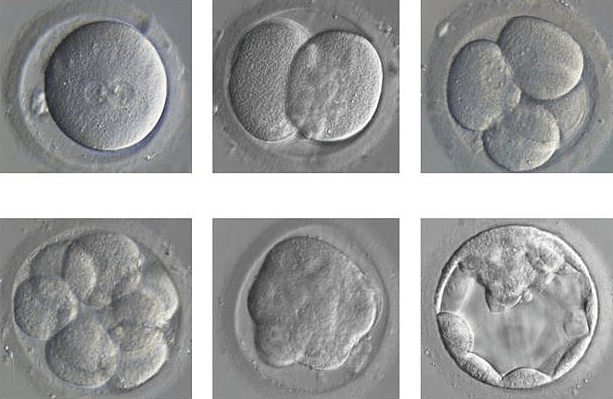
Рисунок 7. Развитие эмбриона из одного оплодотворенного яйца до бластоцисты.
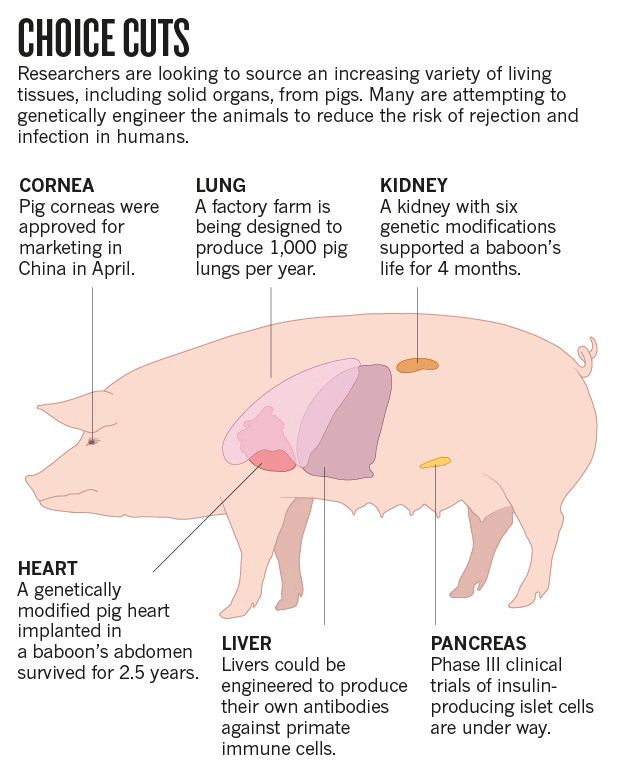
Рисунок 8. Схема возможного использования органов свиней.

Рисунок 9. ГМ-пища.
Рисунок 10. Схематичное изображение «дизайнерского» ребенка.
Тем не менее случайные мутации, которые ненароком могут появиться при редактировании генома, потенциально могут быть еще опаснее, чем имеющиеся (рис. 11).

Рисунок 11. Схематичное изображение гена с опасной мутацией.
Этично ли редактировать людей?
CRISPR/Cas9 предстоит преодолеть не только технические трудности, которые требуют приближенного к ста процентам результата для внедрения в практическую медицину, но и этические (рис. 12). Насколько нравственно редактировать геном человека, данный ему при рождении? Можем ли мы вмешиваться в работу природы и модифицировать ее по своему усмотрению?

Рисунок 12. Обложка книги профессора Калифорнийского университета Пола Кнопфлера — GMO sapiens.
сайт ipscell.com
Международный мораторий на опыты над людьми говорит сам за себя. А проведенные на данный момент исследования имели четкие рамки, закрепленные законодательно. Вынашивание и рождение «редактированного ребенка» в таких условиях невозможно.
В противовес широким возможностям CRISPR/Cas9 выступают и ее непредсказуемые долговременные последствия. Ввиду этого директор национальной разведки США Джеймс Клэппер объявил, что технологию CRISPR теперь можно рассматривать как угрозу национальной безопасности: «Редактирование генома — это оружие массового уничтожения. Его легко использовать и трудно контролировать» [18].
По мнению биоэтика из Университета Висконсина в Мэдисоне Альты Чаро, «дизайнерские дети» — сомнительная перспектива для CRISPR/Cas9. Исследовав положение дел с технологией генной модификации, она сделала заявление: «Озабоченность по поводу проведенных экспериментов раздута. Это увлекательный, важный и достаточно внушительный шаг к изучению правильного редактирования эмбрионов. Независимо от беспокойных предположений, это не начало эпохи „дизайнерских детей“. Наследование таких признаков, как интеллект или атлетизм, определено множеством генов. Разгадать каждый из них и спроектировать ребенка не представляется возможным» [19].
Что же принесет миру технология генного редактирования CRISPR/Cas9 — пользу или вред? Однозначного ответа на этот вопрос не даст никто. Хотя практической пользы от технологии пока получено не было, то будущее, которое рисует CRISPR/Cas9 в рамках биомедицины, рано или поздно наступит. И нам откроется возможность узреть и понять этот новый и смелый отредактированный мир (рис. 13).

Рисунок 13. Безграничные возможности CRISPR/Cas9.
Литература
- CRISPR-системы: иммунизация прокариот;
- Просто о сложном: CRISPR/Cas;
- I. M. Slaymaker, L. Gao, B. Zetsche, D. A. Scott, W. X. Yan, F. Zhang. (2016). Rationally engineered Cas9 nucleases with improved specificity. Science. 351, 84-88;
- Puping Liang, Yanwen Xu, Xiya Zhang, Chenhui Ding, Rui Huang, et. al.. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6, 363-372;
- Миньженкова М.Е. Метафазная сравнительная геномная гибридизация в диагностике хромосомного дисбаланса: дис.....канд. мед. наук. — Москва, 2014. — 131 с.;
- Байкошкарова С.Б., Сабырбек Ж.Б., Садыбекова Л.С., Махамбетова А.М., Уморбекова Г.А., Курманалиев С.К. (2016). Морфологические характеристики раннего эмбриогенеза триплоидных эмбрионов человека. Сайт Казахского национального университета;
- Gallagher J. (2016). Kathy Niakan: Scientist makes case to edit embryos. BBC News;
- Connor S. (2017). First human embryos edited in U.S. MIT Technology Review;
- Джанашия П.Х., Круглов В.А., Назаренко В.А., Николенко С.А. Кардиомиопатии и миокардиты. М.: Российский государственный медицинский университет, 2000. — 128 с;
- Hong Ma, Nuria Marti-Gutierrez, Sang-Wook Park, Jun Wu, Yeonmi Lee, et. al.. (2017). Correction of a pathogenic gene mutation in human embryos. Nature. 548, 413-419;
- Lu Xiao-Jie, Xue Hui-Ying, Ke Zun-Ping, Chen Jin-Lian, Ji Li-Juan. (2015). CRISPR-Cas9: a new and promising player in gene therapy. J Med Genet. 52, 289-296;
- Смирнихина С.А. и Лавров А.В. (2016). Генная терапия наследственных заболеваний с использованием технологии CRISPR/Cas9 in vivo. Медицинская генетика. 9, 3–11;
- CRISPR/Cas9 как помощник в борьбе с ВИЧ;
- Cyranoski D. (2016). CRISPR gene-editing tested in a person for the first time. Nature News;
- Devlin H. (2017). DNA editing in human embryos reveals role of fertility 'master gene'. The Guardian: Genetics;
- Dong Niu, Hong-Jiang Wei, Lin Lin, Haydy George, Tao Wang, et. al.. (2017). Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science. 357, 1303-1307;
- Еще раз про ГМО;
- . (2016). Gene intelligence. Nature. 531, 140-140;
- Cha A.E. (2017). First human embryo editing experiment in U.S. ‘corrects’ gene for heart condition. The Washington Post.






