
CRISPR/Cas9 как помощник в борьбе с ВИЧ
19 октября 2016
CRISPR/Cas9 как помощник в борьбе с ВИЧ
- 8920
- 4
- 16
Система CRSIPR/Cas9 удалит вирусную информацию в геноме человека, зараженного ВИЧ
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: СПИД и ВИЧ-инфекция до сих пор остаются неизлечимыми заболеваниями, с которыми в мире живут 35 миллионов человек. Современная терапия, направленная в основном на ингибирование ферментов ВИЧ, никак не влияет на провирус — то есть на ДНК вируса, встроенную в наш геном. Избавиться от вируса у нас в геноме возможно благодаря революционной системе CRISPR/Cas9, которая позволит вырезать гены ВИЧ.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
CRISPR/Cas9
Еще лет 5 назад никто не мог бы поверить, что появится столь революционный подход к лечению заболеваний. Фурор в мире науки произвела система «натурального» направленного редактирования генома CRISPR/Cas9 [1], [2]. Открыта эта система была почти тридцать лет назад у бактерий, а затем и у архей [3], [4]. Началось все с того, что в геноме микроорганизмов были обнаружены повторяющиеся участки ДНК длиной 20–50 нуклеотидов, неизвестно зачем нужные и разделенные уникальными последовательностями (спейсерами) такой же длины [5]. В непосредственной близости к этим повторам находились гены различных белков, разрезающих и расплетающих ДНК (cаs-гены). Генетический анализ показал, что эти уникальные участки ДНК гомологичны различным участкам ДНК (протоспейсерам) бактериофагов и плазмид — врагов бактерий. Причем, имея соответствующий спейсер, бактерия становится устойчивой к проникновению чужеродной ДНК [3]. Таким образом, было показано, что CRISPR/Cas система является своеобразной системой бактериального «иммунитета» (рис. 1).
На страже иммунитета стоят Cas-белки, которые соединяются с РНК-продуктом транскрипции спейсеров, комплементарным участку гена чужака. Эта РНК — «фоторобот» преступника, с которым полицейский ищет самого преступника. Обнаружив его, полицейский, то есть Cas-белок, разрезает нарушителя [6].
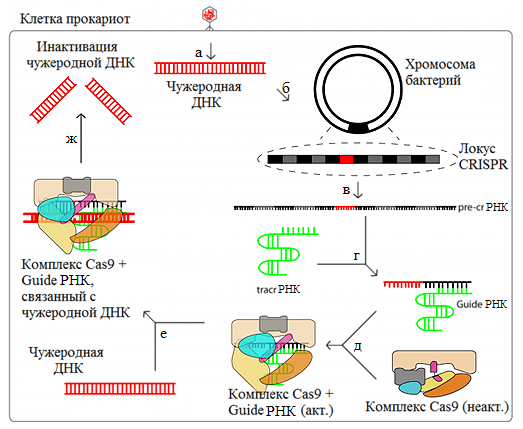
Рисунок 1. Система CRISPR/Cas9 как один из вариантов бактериального иммунитета. а — Внедрение чужеродной ДНК в клетку бактерии. б — Приобретение спейсера. в — Транскрипция CRISPR-локуса. г — Образование guideРНК. д — Образование активного комплекса Cas9 + guideРНК. е — Связывание чужеродной ДНК. ж — Внесение двухцепочечного разрыва в ДНК. Сокращения см. в тексте.
Но затем в 2012 году бактериальную защитную систему взяли на вооружение ученые, ведь если соединить Cas9 с определенной РНК, то можно разрезать необходимый ген. Разрезанный ген запускает в клетке систему репарации, которая в буквальном смысле пытается соединить концы с концами. При этом происходят различные мутации репарируемого гена — в основном удаления, но бывают и разные вставки. Однако если мы предоставим матрицу для репарации, ген может вернуться к правильной форме. Так можно вносить любые изменения в геном. Это означает, что мы в теории можем лечить генетические заболевания, рак и не только. Сегодня мы поговорим о том, как CRISPR/Cas9 поможет решить проблему избавления от вируса иммунодефицита человека (ВИЧ).
ВИЧ
ВИЧ — возбудитель синдрома приобретенного иммунодефицита (СПИДа) — относится к роду лентивирусов семейства ретровирусов, чей геном представлен двумя копиями одноцепочечной РНК, на двух концах которой находятся длинные концевые повторы (или по-английски long terminal repeat, LTR) [7]. В самой вирусной частице содержатся еще три фермента: протеаза, обратная транскриптаза и интеграза (рис. 2). Протеаза расщепляет продукты считывания вирусных генов с образованием зрелых белков.
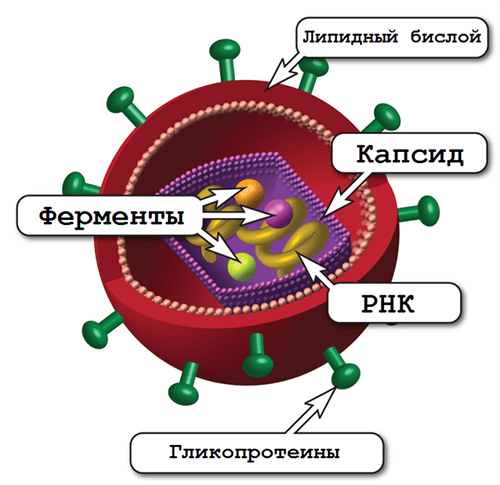
Рисунок 2. Строение вириона ВИЧ. Частица покрыта липидным бислоем, происходящим из клеточной мембраны организма-хозяина, и усеяна молекулами вирусных гликопротеинов.
сайт agscientific.com
Жизненный цикл ВИЧ довольно прост (рис. 3). Вначале вирус инфицирует клетку, причем в качестве рецептора служит молекула CD4, а корецепторами становятся рецепторы хемокинов, поэтому поражаются клетки иммунной системы: T-лимфоциты (T-хелперы), моноциты, макрофаги, а также клетки мозга (макрофаги, микроглия, астроциты), клетки лимфоидной ткани желудочно-кишечного тракта и другие. Затем одноцепочечный РНК-геном с помощью обратной транскриптазы превращается в двухцепочечную ДНК, так называемую провирусную ДНК. Наконец интеграза встраивает двухцепочечную провирусную ДНК в геном хозяина. Эта встроенная информация считывается, причем промоторами (то есть местами, привлекающими РНК-полимеразу для транскрипции) служат длинные концевые повторы — LTR. Собираются новые вирусные частицы, поражающие новые клетки. В целом весь этот процесс приводит к частым мутациям вируса, особенно вариабельны поверхностные гликопротеины, в том числе поэтому частицы ВИЧ так неуловимы для нашего иммунитета [8], [9].
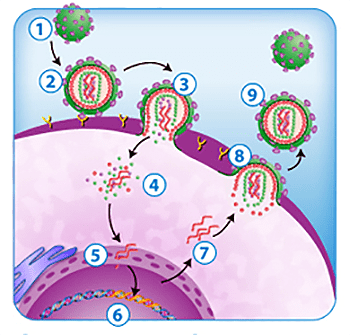
Рисунок 3. Жизненный цикл ВИЧ. 1 — зрелая вирусная частица; 2 — связывание с клеткой благодаря рецепторам; 3 — слияние мембран вируса и клетки; 4 — высвобождение вирусной РНК; 5 — превращение РНК в ДНК (обратная транскрипция); 6 — интеграция в геном клетки; 7 — считывание вирусной информации; 8 — сборка и выход вирусной частицы; 9 — новая вирусная частица.
сайт dentalcare.com
Терапия ВИЧ

Рисунок 4. Удаление провируса из генома человека приведет к невозможности размножения и распространения вируса.
Современная высокоактивная антиретровирусная терапия основывается на ингибировании обратной транскриптазы, протеазы, интегразы, слияния вируса с клеткой, что значительно осложняет жизнь вируса. Но все же ВИЧ-инфекция в настоящий момент остается неизлечимым заболеванием, так как такая терапия никак не влияет на ДНК вируса у нас в геноме: у пациентов, принимающих антиретровирусную терапию, около 106 клеток содержат провирус. Сверх того, у пациентов могут быть серьезные побочные эффекты или устойчивость к антиретровирусной терапии [10].
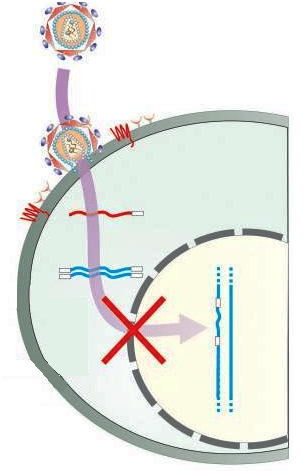
Рисунок 5. Система CRISPR/Cas9, интегрированная в клетки, может препятствовать их заражению вирусом и интеграции вируса в геном.
Даже во время приема терапии, вирусные гены могут считываться на некотором уровне, что вызывает различные осложнения у пациентов с ВИЧ-инфекцией, а при прекращении терапии вирус может «активизироваться». Избавиться от этих болезнетворных записей в нашей ДНК предлагается с помощью системы CRISPR/Cas9, если она будет узнавать участки вирусного генома и их удалять. Такой подход может привести к полному избавлению от ВИЧ-инфекции (рис. 4).
Предложенная система протестирована японскими учеными в 2013 году на культуре клеток человеческих T-лимфоцитов [8]. В качестве мишени они предложили использовать LTR, а в них — разные участки, необходимые для связывания факторов инициации и элонгации транскрипции. Трехкратное внесение в клетки конструкции CRISPR/Cas9 снижало считывание вирусного генома почти в 3 раза (с 97,8% до 35,5%). Дальнейший анализ показал, что почти все клетки содержали в области провируса различные мутации.
Так как LTR — это концевые повторы, то разрезание с двух концов теоретически может привести к полному вырезанию встроенного в геном вирусного куска. И действительно — почти у трети клеток (31,8%) после трехкратного внесения системы CRISPR/Cas9 этот участок полностью удалялся.
А что насчет мутаций вируса? Ведь если целевой участок изменит свою структуру, система CRISPR/Cas9 не сможет его найти и обезвредить. Понимая это, ученые выбрали именно тот участок LTR, что содержит высококонсервативные последовательности ДНК, практически одинаковые у всех подвидов ВИЧ.
В 2014 году эти исследования провели американские ученые на клетках микроглии, макрофагах и моноцитах, подтвердив успешность такой терапии [9]. Кроме того, ученым удалось иммунизировать клетки от ВИЧ: они добились того, чтобы клетки постоянно содержали систему CRISPR/Cas9 с соответствующей РНК, направленной против ВИЧ (то есть интегрировали ее в геном). Клеткам это не повредило, и после заражения ВИЧ встраивание в геном и размножение вируса в них не происходило [9], [11], [12]. Кто знает, может, в будущем мы все будем таким образом «вакцинированы» от ВИЧ (рис. 5)?
Не все так просто

Рисунок 6. Повышение специфичности разрезания гена с использованием никаз, вносящих одноцепочечные разрывы.
Предложенная система изменения генов не так чудесна, как может показаться на первый взгляд, как бы я ни старалась вас в этом убедить. Есть много подводных камней, которые требуют дальнейшего исследования.
Одной из главных проблем этого метода остается его эффективность. Зачастую работы по прицельному изменению одного участка требуют много времени и средств, но не приводят к 100% результату: не все мишени удается найти и исправить.
Еще одна проблема — исправление других участков ДНК, похожих на искомую последовательность, или так называемые off-target-эффекты, которые могут затронуть ген, даже если мы не хотели его менять. Эта проблема устранима, если заранее выбирать последовательность, встречающуюся только в гене, который должен стать мишенью Cas9. Так, в уже упомянутом исследовании ученые, подобрав верную последовательность спейсера, комплиментарную вирусному геному, не обнаружили лишних мутаций в человеческом геноме после применения CRISPR/Cas9 [9]. Повысить специфичность можно и другим способом: направлять Cas9 не к одному участку, а к двум близко расположенным участкам гена, разрезая в них не две цепи ДНК сразу, а одну в первой мишени, вторую — во второй (рис. 6). Такие системы называются никазы. Ответ клетки будет такой же, как при двухцепочечном разрыве ДНК, но специфичность выше, ведь у полицейского теперь два фоторобота преступника [12]. Предлагается также настроить эту систему так, чтобы ее можно было «включать» и «выключать» после использования, чтобы она не работала постоянно в клетке.
И наконец, проблема доставки системы CRISPR/Cas9. Мы уже научились поставлять ее в отдельные клетки, но как действовать эффективно на уровне организма человека, где около 106 зараженных клеток? Есть разные подходы к такой генной терапии: доставка с помощью вирусных векторов (вирусов, «заражающих» нас хорошими генами), использование наночастиц [13], забор собственных стволовых клеток костного мозга, введение в них CRISPR/Cas9 и последующая обратная трансплантация [9]. При разработке такой терапии стоит также учитывать, что резервуаром вируса служат и клетки головного мозга, куда не так просто проникнуть большим конструкциям [11].
Таким образом, стремительно развивающаяся генная терапия с использованием CRISPR/Cas9 — ключ к избавлению от ВИЧ-инфекции и ассоциированных с ней заболеваний и осложнений. Однако не стоит ожидать, что такое лекарство сегодня-завтра появится на прилавках в аптеке, ведь еще о многом стоит подумать, чтобы разработать действительно эффективное и безопасное лечение.
Литература
- А не замахнуться ли нам на... изменение генома?;
- CRISPR-системы: иммунизация прокариот;
- Немудрый А.А., Валетдинова К.Р., Медведев С.П., Закиян С.М. (2014). Системы редактирования геномов TALEN и CRISPR/Cas — инструменты открытий. Acta Naturae. 6, 20–42;
- Jusiak B., Cleto S., Perez-Piñera P., Lu T.K. (2016). Engineering synthetic gene circuits in living cells with CRISPR technology. Trends Biotechnol. 34, 535–547;
- Wright A.V., Nuñez J.K., Doudna J.A. (2016). Biology and applications of CRISPR systems: harnessing nature’s toolbox for genome engineering. Cell. 164, 29–44;
- Cavanagh P. and Garrity A. (2014). CRISPR/Cas9;
- СПИД: как ВИЧ разрушает нашу иммунную систему;
- Ebina H., Misawa N., Kanemura Y., Koyanagi Y. (2013). Harnessing the CRISPR/Cas9 system to disrupt latent HIV-1 provirus. Sci. Rep. 3, 2510;
- Hu W., Kaminski R., Yang F., Zhang Y., Cosentino L., Li F. et al. (2014). RNA-directed gene editing specifically eradicates latent and prevents new HIV-1 infection. Proc. Natl. Acad. Sci. USA. 111, 11461–11466;
- Saayman S., Ali S.A., Morris K.V., Weinberg M.S. (2015). The therapeutic application of CRISPR/Cas9 technologies for HIV. Expert. Opin. Biol. Ther. 15, 819–830;
- Liao H.K., Gu Y., Diaz A., Marlett J., Takahashi Y., Li M. et al. (2015). Use of the CRISPR/Cas9 system as an intracellular defense against HIV-1 infection in human cells. Nat. Commun. 6, 6413;
- Khalili K., Kaminski R., Gordon J., Cosentino L., Hu W. (2015). Genome editing strategies: potential tools for eradicating HIV-1/AIDS. J. Neurovirol. 21, 310–321;
- Наномеханика для адресной доставки лекарств – насколько это реально?.







