
Что общего у боеголовок и антител? ADCs
17 декабря 2021
Что общего у боеголовок и антител? ADCs
- 1524
- 0
- 6
Антитело обманом протаскивает в клетку токсическую молекулу, которая убивает клетку. Рисунок в полном размере.
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Несколько загадочный заголовок отсылает к термину warhead (англ. «наконечник стрелы, боеголовка»), которым в фармакологии образно называют токсин, связанный с антителом. Антитело играет роль системы наведения этой «ракеты» под названием ADC — antibody-drug conjugate, или «конъюгат антитела с лекарством». В продолжение спецпроекта о современных лекарствах рассмотрим этот класс лекарств, его тернистую историю и последние успехи.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.

Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
ADCs состоят из рекомбинантного моноклонального антитела (им был посвящен целый спецпроект на «Биомолекуле») и ковалентно связанного с ним лиганда — обычно это цитотоксическое вещество, способное убить клетку. Пока ADCs используются только в онкологии: антитело служит для селективного связывания с рецептором опухолевой клетки, после чего комплекс рецептора и ADC, как троянский конь, попадает внутрь клетки, и токсин убивает ее. Идея выглядит просто и заманчиво, но на практике масса нюансов долго не позволяла добиться широкого использования ADCs. Сейчас наблюдается очередная волна интереса к этой технологии — за последние четыре года одобрено целых восемь таких препаратов.
Строение и механизм
Современные ADCs состоят из трех компонентов (рис. 1): моноклонального антитела, нацеленного на рецептор (мишень [1]) на поверхности клетки; линкера, связывающего антитело и токсин; и действующего вещества — токсина (цитотоксического агента), который высвобождается после проникновения ADC внутрь клетки и убивает ее.
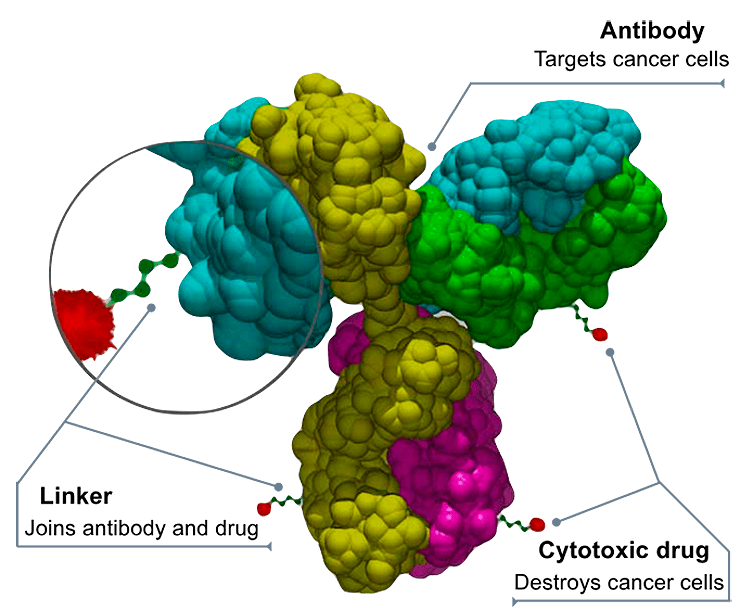
Рисунок 1. Общая схема ADC. Голубым, малиновым, желтым и светло-зеленым показаны различные цепи антитела, темно-зеленым — линкер, красным — токсин.
Свободные цитотоксические вещества (химиотерапия) уничтожают все делящиеся клетки, поражая не только опухоли, но и нормальные ткани. Особенно страдают быстро делящиеся клетки, такие как кроветворные, клетки кишечника, волосяные фолликулы. С этим и связаны наиболее частые эффекты химиотерапии: усталость, тошнота, рвота, диарея, цитопении (падение числа клеток крови), облысение. Идея ADCs — донести токсин только до раковых клеток, по возможности не задев нормальные. Поэтому важно найти такие мишени, которые будут экспонироваться преимущественно на раковых клетках. Кроме того, линкер должен быть достаточно стабильным, чтобы токсин не отцепился по дороге и не начал уничтожать все клетки подряд.
Если удается создать достаточно селективное антитело с очень хорошим линкером, то и токсин можно выбрать «посильнее» — такой, который в свободном виде вводить вообще нельзя. На рисунке 2 рассмотрены этапы механизма действия ADC и проблемы, которые возникают на каждом из них.

Рисунок 2. Механизм действия ADC.
- Циркуляция — ADC попадает в кровоток. Требуется стабильный линкер, чтобы токсин не высвободился раньше времени.
- Связывание — антительный компонент ADC связывается с опухолевым антигеном. Антитело должно быть высокоаффинным.
- Интернализация — комплекс рецептор—ADC затягивается внутрь клетки по механизму рецептор-опосредованного эндоцитоза [2]. Если антигена на поверхности клетки мало, внутри клетки будет недостаточная концентрация токсина.
- Рециклизация — часть ADCs связывается с рецептором FcRn (неонатальный рецептор, связывающий Fc-фрагмент антитела и отвечающий за перенос антител от матери к ребенку, а также за возврат антител из лизосом в кровоток) в ранних эндосомах и попадает обратно в кровоток. Слишком сильное связывание с FcRn приведет к снижению концентрации токсина в клетке.
- Высвобождение — лизосомы сливаются с поздними эндосомами, и токсин отсоединяется от антитела. Активный токсин должен эффективно отделяться от ADC.
- Действие токсина — токсин взаимодействует с клеточными компонентами (например, ДНК, микротрубочками), приводя к апоптозу. Активность токсина должна быть достаточно велика, чтобы убивать клетку даже в низких концентрациях.
- Токсин убивает соседнюю клетку — небольшие размеры молекулы токсина позволяют ему преодолеть клеточную мембрану клетки, в которую попал ADC, и диффундировать к соседним клеткам, оказывая на них цитотоксическое воздействие.
иллюстрация Ирины Ефремовой по [12]
Линкеры могут быть двух типов: расщепляемые и нерасщепляемые. Первые полагаются на то, что в лизосомах среда не такая, как в крови и межклеточном пространстве. Как правило, используются три принципа:
- Линкер может быть стабилен в щелочной среде, но расщепляться в кислой (именно такая среда в лизосомах).
- Дисульфидный линкер, расщепляющийся в восстановительной среде лизосомы под воздействием тиолов (глутатиона).
- Пептидные линкеры, расщепляемые ферментами лизосом (например, катепсином В).
Все эти варианты в разной степени ненадежны, потому что возможно неспецифическое расщепление линкера до того, как он попадет в лизосому. Нерасщепляемые линкеры в этом смысле надежнее, потому что свободный активный токсин высвобождается только тогда, когда деградирует и антитело, и линкер, а это с высокой вероятностью происходит только в клетке. Впрочем, у нерасщепляемого линкера есть свои недостатки. Так, токсин должен быть активен, даже если к нему что-то прицеплено (например, недоотщеплённая аминокислота). Кроме того, ADC с отщепляемым линкером способен уничтожать не только клетки, несущие мишень, но и соседние — за счет диффузии туда свободного токсина (так называемый bystander effect [3]), — а неотщепляемый так сделать обычно не позволяет. В итоге сейчас чаще используют отщепляемые линкеры, но ищут пути, как сделать их более селективными.
Следующий важный вопрос — где и как токсин прицепляется к антителу. Конъюгация может быть неселективной (через остатки лизина или цистеина на поверхности антитела) или селективной (например, через специально введенные ненатуральные аминокислоты). В зависимости от способа конъюгации получится разное соотношение между лекарством и антителом — DAR, drug-antibody ratio. Если токсина будет мало, препарат окажется недостаточно эффективным, если много — снизится его период полувыведения. У зарегистрированных ADC DAR находится в пределах от 2 до 8.
Выбор формата самого антитела тоже немаловажен. От этого зависит его период полувыведения и то, будут ли механизмы иммунной системы участвовать в уничтожении раковых клеток. Имеются в виду эффекторные функции, рассмотренные в статье «Биотехнология антител» [4].
Наконец, выбор токсина — очень важная часть будущего успеха. Они в 100–1000 раз сильнее используемых в свободном виде химиотерапевтических препаратов (рис. 3) и обладают устойчивостью к клеточным механизмам, отвечающим за резистентность раковых клеток (таким как помпы, выбрасывающие лекарства наружу). В основном используют две категории токсинов: ингибиторы образования микротрубочек, препятствующие митозу, и ДНК-связывающие агенты, которые садятся на ДНК в районе малой бороздки и приводят к ее лизису. В последние два года к ним присоединились еще и ингибиторы топоизомеразы I, которые препятствуют репликации ДНК (рис. 4).
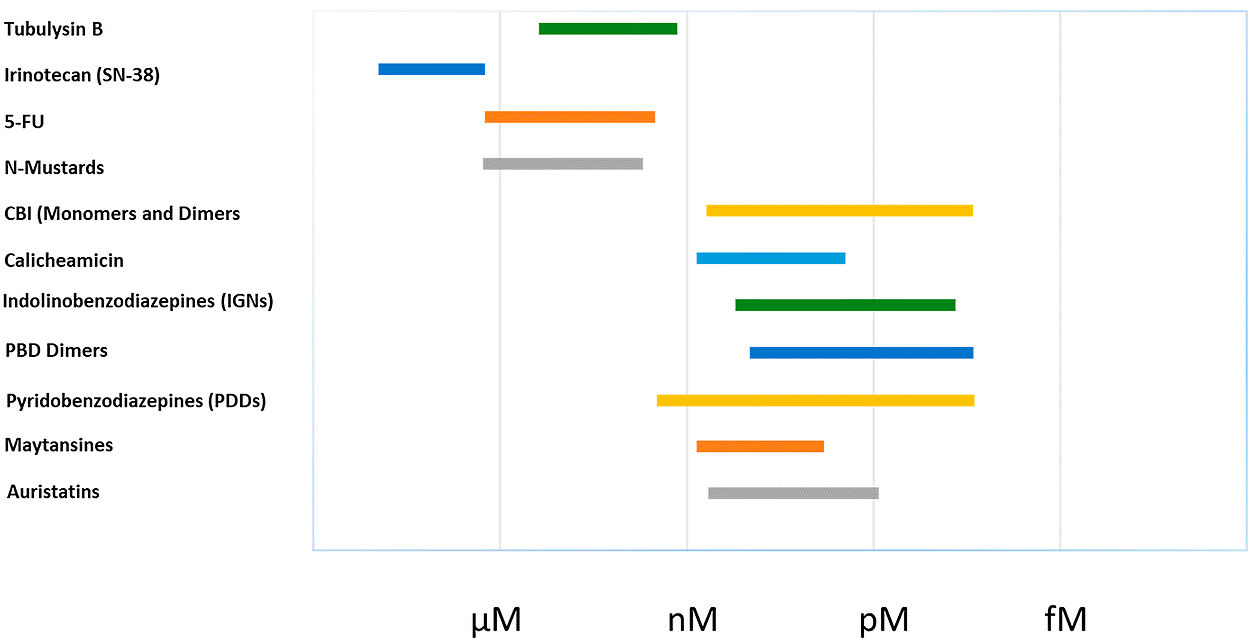
Рисунок 3. Активность in vitro различных токсинов, используемых в ADC. По оси абсцисс отложен порядок концентрации лекарства. По оси ординат — IC50: концентрация препарата, при которой наблюдается 50% ингибирования в тестовой системе (в данном случае речь об ингибировании роста раковых клеток). Иринотекан и 5-FU (5-фторурацил) — химиопрепараты, используемые в повседневной клинической практике. Видно, что их IC50 находится в микромолярном диапазоне. Наиболее мощные токсины имеют IC50 менее пикомоля.
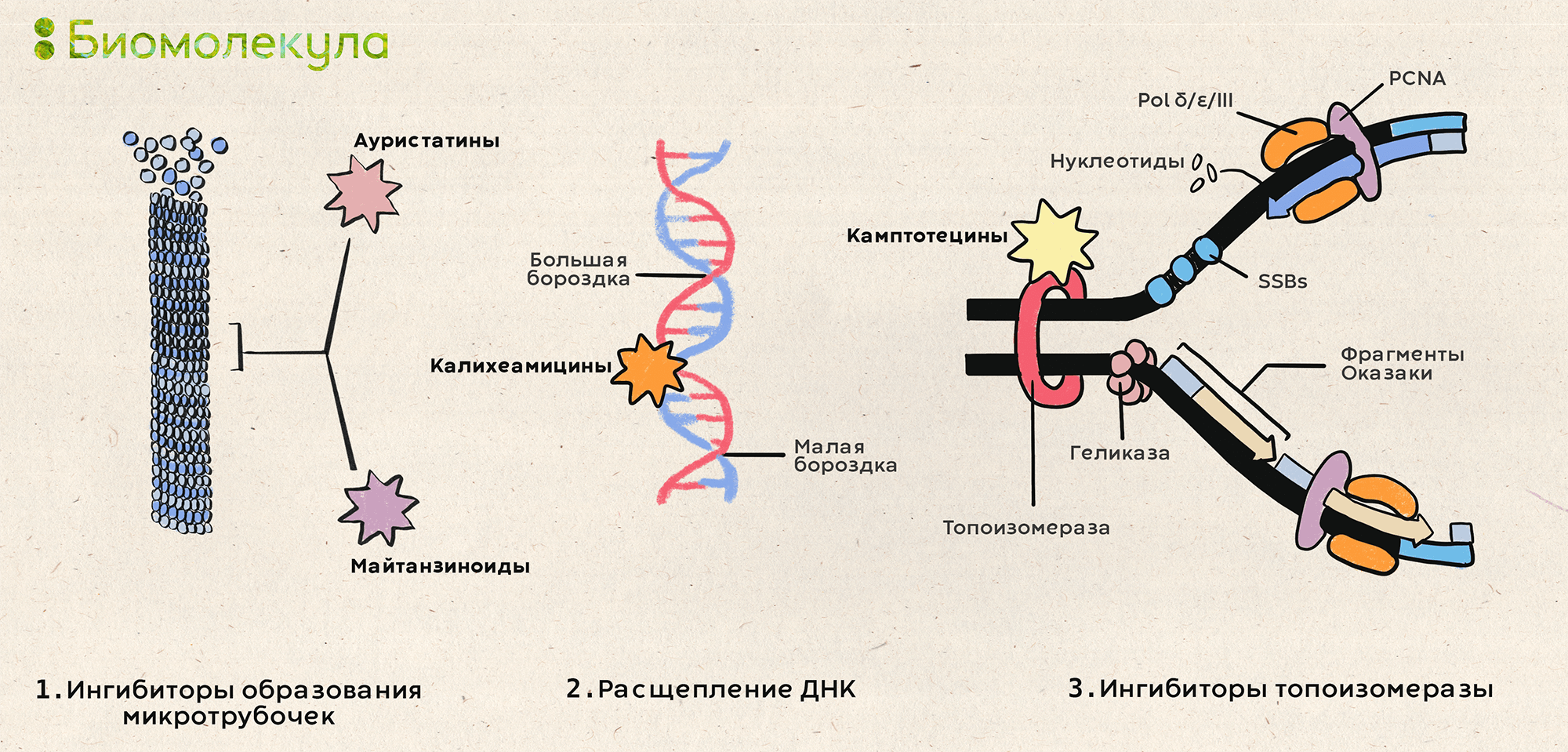
Рисунок 4. Три типа токсинов, используемых в ADC. Сокращения: SSBs — белки, связывающие одноцепочечную ДНК; Pol δ/ε/III — полимеразы δ/ε/III; PCNA — ядерный антиген пролиферирующих клеток.
иллюстрация Ирины Ефремовой по [8]
История
Еще в начале XX века Пауль Эрлих описал концепцию «волшебной пули» — направленной доставки в опухоль цитотоксического лекарства с помощью селективно нацеливающего агента (рис. 5) [5]. Первые эксперименты с ADCs на животных относятся аж к 1960-м годам; тогда это были еще поликлональные антитела. Открытие гибридомной технологии [6], [7] и возможность создания моноклональных антител в 1970-х годах дали толчок исследованиям ADCs. В 1980-х годах начались клинические эксперименты с использованием конъюгатов с мышиными моноклональными иммуноглобулинами.
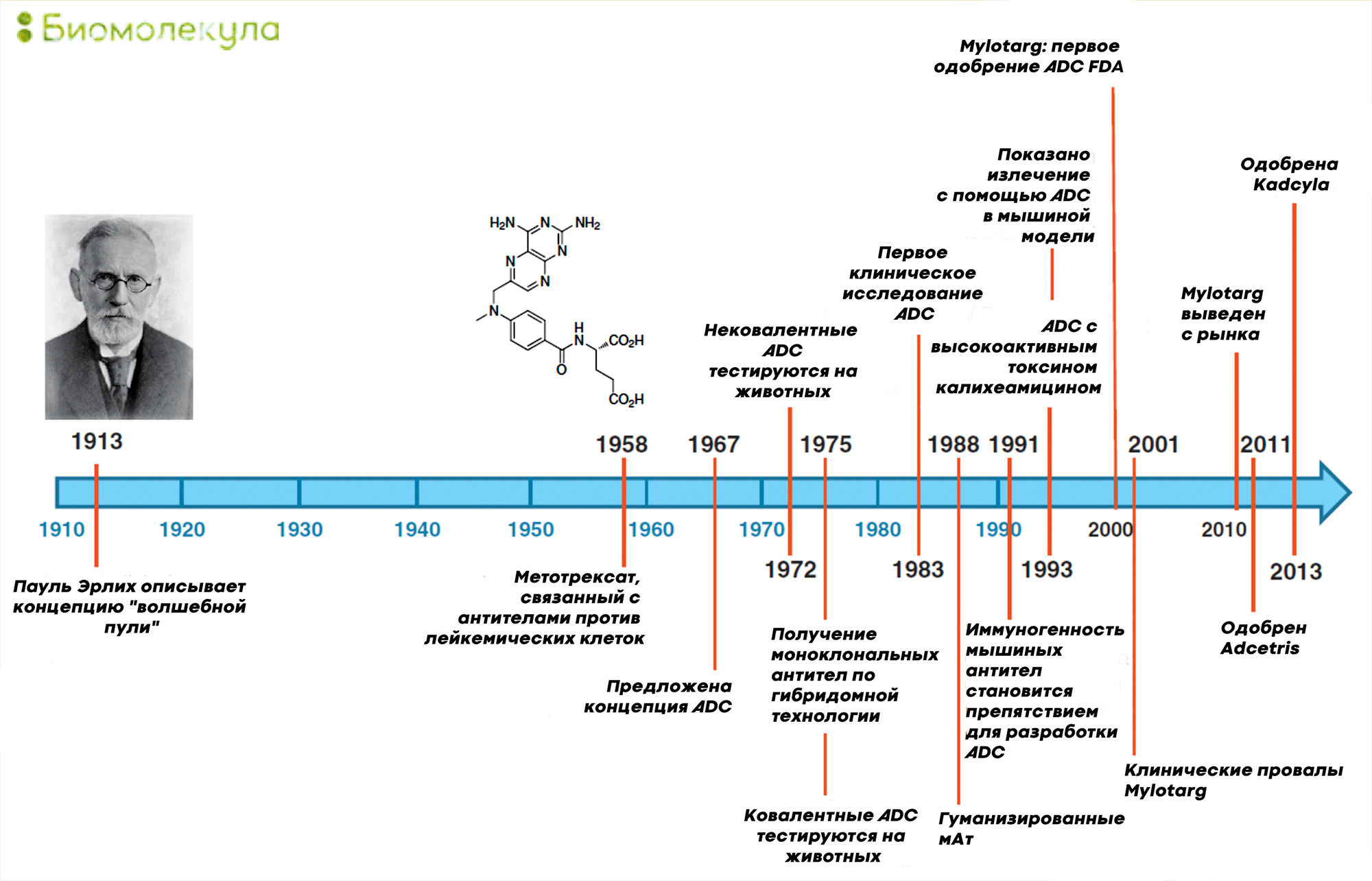
Рисунок 5. История разработки ADC c 1910 по 2014 годы
[13], рисунок адаптирован
Однако первые полтора десятка лет все ADC, выходящие в клинические исследования, проваливались из-за токсичности и неэффективности, и вот почему:
- Несовершенство и нестабильность линкеров, что приводит к отщеплению токсина до попадания в клетку, появлению свободного токсина в кровотоке или межклеточном пространстве и гибели нормальных клеток.
- Недостаточная активность токсинов. Так, в ранних ADCs использовался доксорубицин, концентрации которого в клетках не хватало для оказания токсического эффекта.
- Первые ADCs, как и антитела, были мышиными, что приводило к их иммуногенности и снижению эффективности.
- Сначала не удавалось подобрать достаточно селективные мишени, что вызывало токсичность, связанную с гибелью нормальных клеток, экспонирующих мишень (так называемая on-target-токсичность).
Первым одобренным препаратом класса ADC стал гемтузумаб озогамицин (Mylotarg) компании Wyeth (позже приобретенной «Пфайзером») в 2000 году. Этот препарат нацелен на белок CD33, который экспонируется на клетках миелоидного ростка и на злокачественных клетках (бластах) при острой миелоидной лейкемии. В качестве линкера используется отщепляемый в кислой среде остаток гидразона. У препарата оказалась непростая судьба: из-за проблем с токсичностью его вывели с рынка в 2010 году. Во-первых, CD33 — неидеальная мишень, так как этот белок экспонируется и на здоровых клетках. Во-вторых, понижение кислотности приводит к отщеплению токсина вне липосом, что становится причиной нежелательных явлений. Впрочем, неудовлетворенная потребность в области острого миелолейкоза так велика, что препарат вернули на рынок в 2017 году, снизив дозу и изменив целевую популяцию пациентов.
Второй ADC был зарегистрирован через 11 лет после первого — им стал брентуксимаб ведотин (Adcetris), разработанный компанией Seattle Genetics (нынче Seagen). Этот препарат, направленный против белка CD30 на лимфоидных клетках, и по сей день — стандарт терапии лимфомы Ходжкина. Впрочем, и Adcetris не идеален — он несет black box warning (предупреждение в черной рамке) о тяжелых нежелательных явлениях: прогрессирующей мультифокальной энцефалопатии и нейтропении.
Современное состояние
Начиная с 2013 года поле разработок ADCs заметно оживилось. На сентябрь 2021 года одобрено 12 ADC (рис. 6), из них 8 — за последние четыре года, и этот список явно будет расти, потому что в клинических исследованиях еще находится больше ста лекарственных кандидатов.
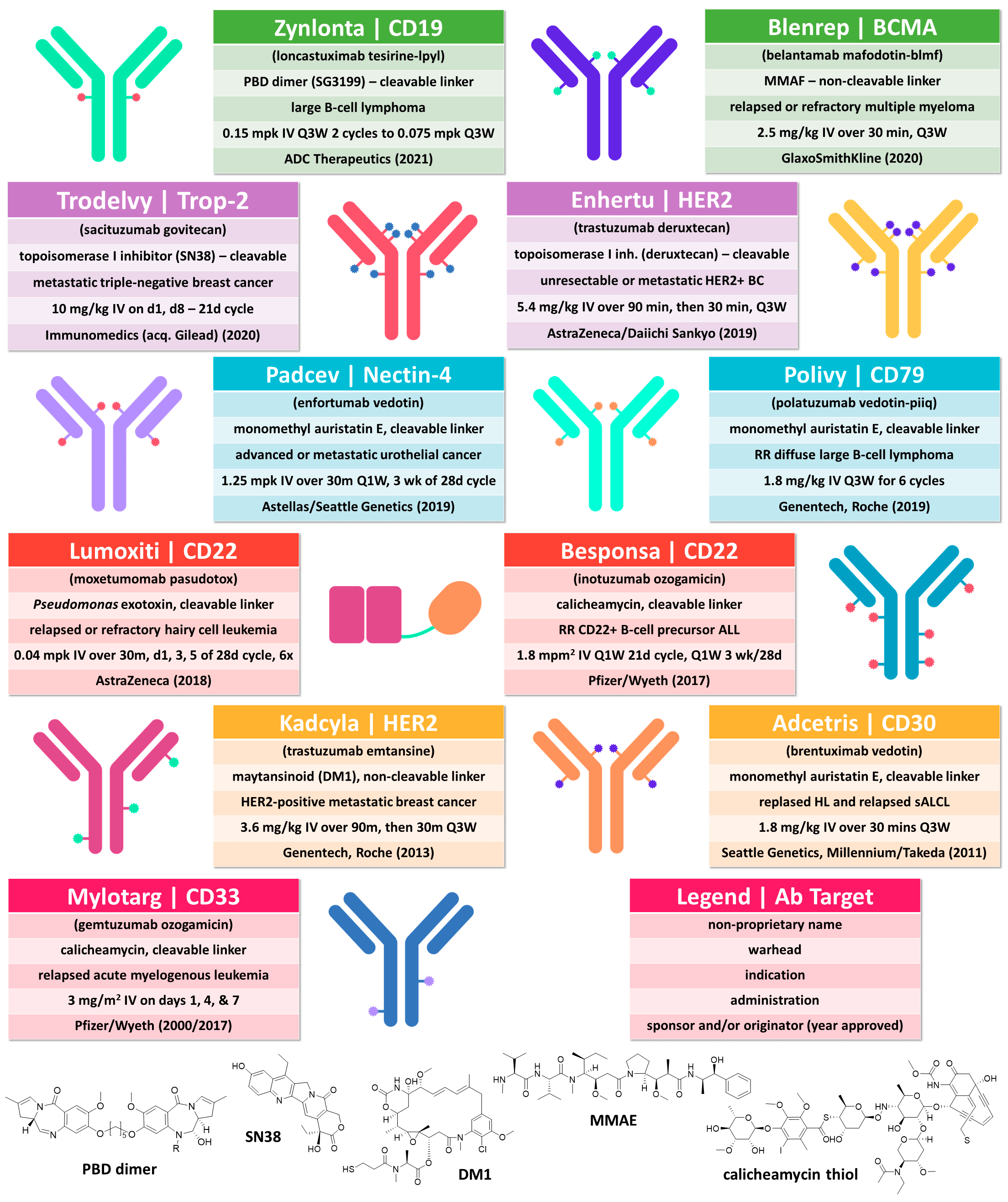
Рисунок 6. ADCs, одобренные на сентябрь 2021 года. Видно, что все, кроме одного, представляют собой антитела, конъюгированные с токсинами. Мишень указана справа в заголовке плашки. Единственная «белая ворона» — Lumoxiti — конъюгат антительного фрагмента Fv с бактериальным токсином, зарегистрирован для лечения редкого вида лейкемии — волосатоклеточной.
Все одобренные ADC направлены на лечение онкологических заболеваний, при этом четыре из них — против сóлидных опухолей. Это замечательный результат, потому что для солидных опухолей труднее подобрать селективную мишень. Если мишень хоть немного экспонируется на здоровых клетках, то такое мощное оружие как ADC, будет вызывать сильную токсичность. В случае онкогематологических заболеваний это будут разного рода цитопении, которые часто обратимы, потому что популяция клеток крови восстановится из предшественников в костном мозге. А вот в случае солидных опухолей может наблюдаться необратимое поражение жизненно важных органов — сердца, легких, печени и других. Однако соотношение пользы и рисков для одобренных препаратов оказалось достаточно высоким: так, Trodelvy (cацитузумаб говитекан) увеличил медианную выживаемость пациенток с трижды негативным раком молочной железы в два раза: с 6,7 до 12,1 мес. (рис. 7) [8].
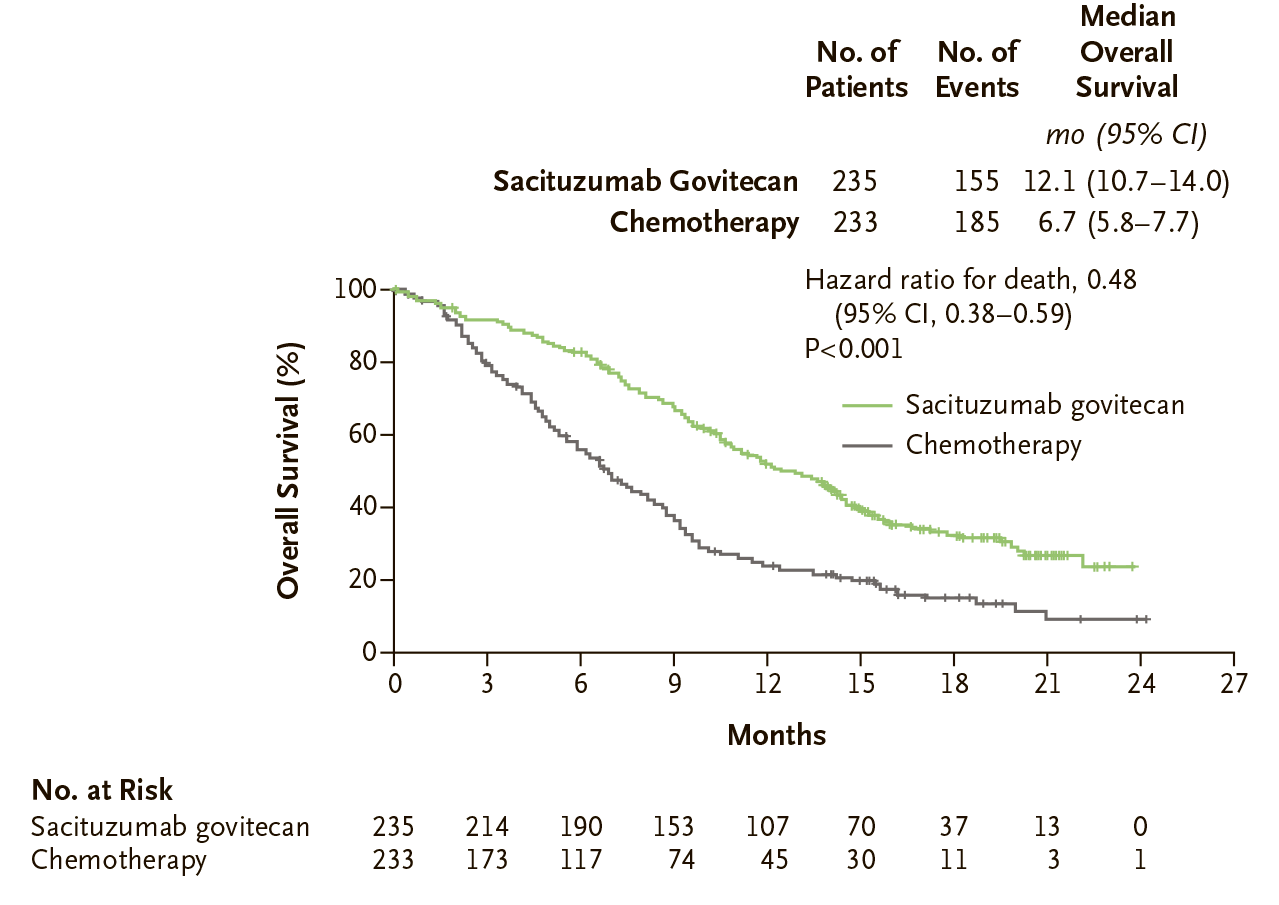
Рисунок 7. Общая медианная выживаемость у пациенток с трижды негативным раком молочной железы без метастазов в мозг при лечении ADC Trodelvy (cацитузумаб говитеканом) по сравнению со стандартной химиотерапией
Другой препарат — Padcev (энфортумаб ведотин) — увеличил выживаемость без прогрессирования и общую выживаемость при метастатическом раке мочевого пузыря у пациентов, которым не помогли химио- и иммунотерапия [8].
Помимо того, что оба приведенных в пример препарата (зарегистрированные в 2020–2021 годах) показали эффективность у довольно безнадежных пациентов без стандартных опций терапии, они нацелены на новые мишени, против которых раньше не было препаратов на рынке. Это белки Trop2 и Nectin4, которые слабо экспонируются на здоровых клетках, но повышенно — на раковых. Первые успехи открыли дорогу для так называемых basket trials («корзинных» исследований), когда в одну когорту включают пациентов с гистологически разными опухолями, но повышенным производством одного и того же антигена. На рисунке 8 показаны уровни ответов , которых удалось добиться в таких исследованиях для опухолей разной гистологии.
Ответ опухоли — это снижение ее размеров в трех измерениях. Если очагов несколько, измеряют их все и складывают. Полный ответ (complete response) — это снижение на 100%, частичный (partial response) — минимум на 30%. Если размеры опухоли остались на уровне от −30 до +20% — это называется стабилизацией (stable disease), если выросли более чем на 20% — прогрессией (progressive disease).
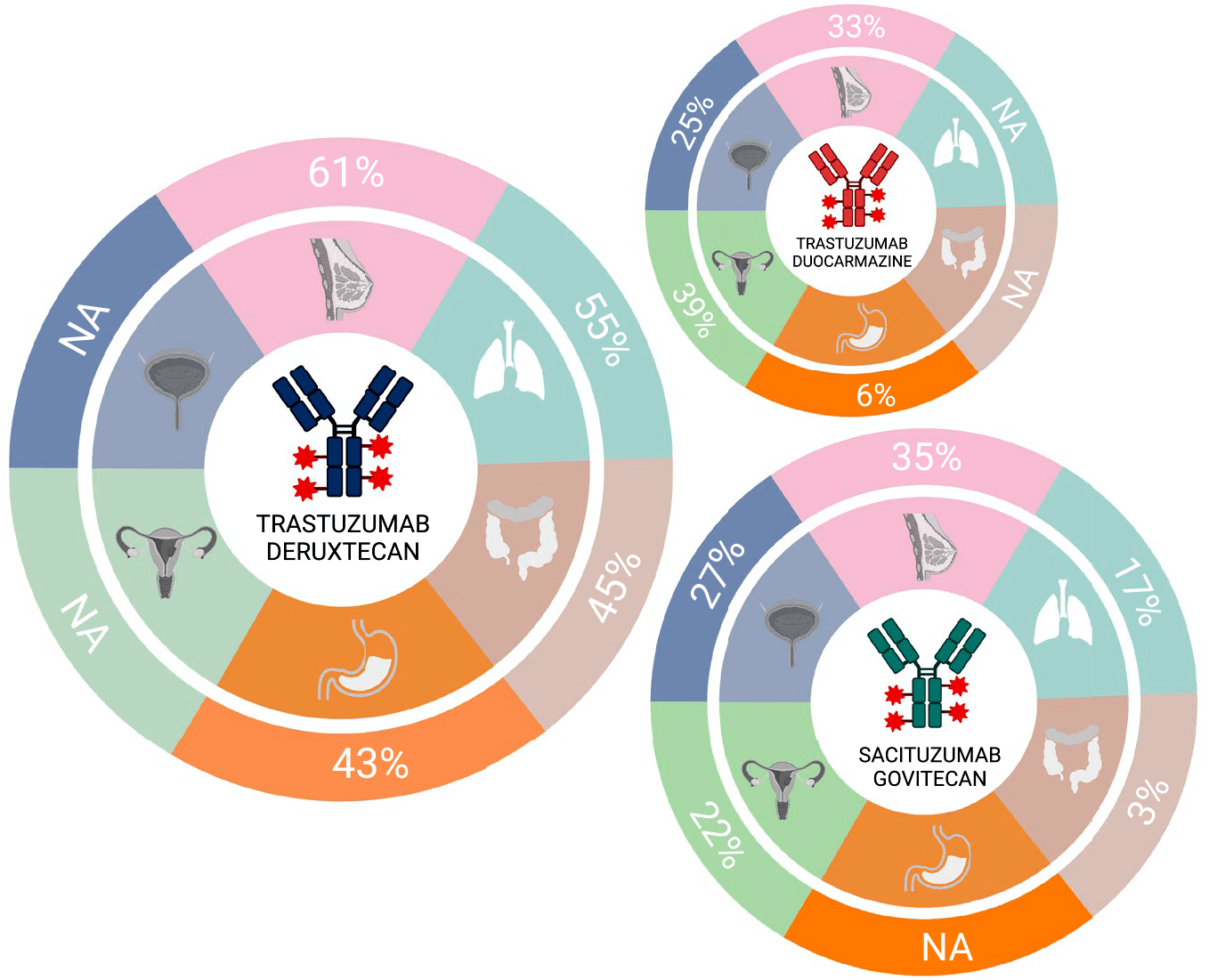
Рисунок 8. Уровень ORR (objective response rate), равный сумме полных и частичных ответов для опухолей разной гистологии для трех ADCs
Правда, уровень ответов опухоли не всегда коррелирует с выживаемостью, но у пациентов без опций лечения спонтанная редукция опухоли происходит достаточно редко, поэтому если она произошла после применения новой терапии, можно с большой долей уверенности говорить о том, что именно терапия послужила причиной редукции опухоли.
Вместе с тем, только сравнительные исследования могут подтвердить или опровергнуть эти первые сигналы активности. Красноречивый пример — ADC Rova-T компании Stemcentrx (приобретена AbbVie), который всего за три года прошел путь от «многообещающего передового лекарства», способного спасать жизни, к опасному препарату, ускоряющему смерть. В исследовании фазы I по мелкоклеточному раку легкого он показал неплохой уровень ответов — 31% и медианную выживаемость 5,8 месяцев. Во второй фазе ответов было уже 14,3%, а третья фаза показала, что медианная выживаемость при приеме препарата сокращается с 8,6 до 6,3 месяцев [9]. Печальный, но поучительный результат.
Перспективы
При всех успехах ADC в последнее время они пока далеки от идеала — высокая эффективность неизменно сопровождается токсичностью, и врачам приходится лавировать между Сциллой и Харибдой.
Способов улучшить ситуацию масса. Много усилий направлено на поиск новых, более селективных мишеней [10]. Каждая компания ищет способы, как сделать так, чтобы токсин отщеплялся преимущественно в опухоли, не слишком быстро, но достаточно, что убить опухолевые клетки и обеспечить bystander-эффект (см. выше).
Из новых стратегий можно назвать конъюгацию токсинов с биспецифическими антителами [11], одноцепочечными антительными фрагментами (scFv), нанотелами. Есть попытки конъюгировать токсины с таргетными пептидами. Пытаются конъюгировать с антителами не один токсин, а сразу два, или заменить токсин чем-нибудь другим — иммуностимулятором или радионуклидом [8].
Для повышения безопасности ADC имеет смысл манипулировать гликозилированием антительной части, чтобы снизить ее сродство к FcRn-рецепторам, отвечающим за рециркуляцию (см. рис. 2), и к рецепторам на поверхности клеток других органов (например, связывание ADC c маннозными рецепторами печени может приводить к гепатотоксичности).
Для правильного определения пациентов, которым ADC помогут больше всего, необходима разработка специфических биомаркеров, способных предсказать ответ на лечение. Чаще всего это сами мишени, в таких случаях нужно, чтобы тесты надежно их определяли, и был установлен уровень экспрессии, при котором имеет смысл применять ADC.
В клинических исследованиях ведется активная работа над поиском наиболее эффективных комбинаций ADCs с другими агентами, в первую очередь, иммуноонкологическими.
Наконец, ADC можно применять и за пределами онкологии. Так, при аутоиммунных заболеваниях возможна селективная доставка в патогенные Т- или В-клетки убивающего их токсина. Есть попытка таким образом уничтожать бактерии для лечения тяжелых инфекций [3].
В заключение, ADC — не новый, но современный и перспективный тип лекарств, недавно переживший второе рождение и уже ставший стандартом терапии при ряде онкологических показаний. В будущем ADC обещают помочь еще большему числу онкологических больных, а может, и не только им.
Литература
- Поиск лекарственных мишеней;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Alain Beck, Liliane Goetsch, Charles Dumontet, Nathalie Corvaïa. (2017). Strategies and challenges for the next generation of antibody–drug conjugates. Nat Rev Drug Discov. 16, 315-337;
- Биотехнология антител;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Краткая история открытия и применения антител;
- Открытие моноклональных антител;
- Paolo Tarantino, Roberto Carmagnani Pestana, Chiara Corti, Shanu Modi, Aditya Bardia, et. al.. (2021). Antibody–drug conjugates: Smart chemotherapy delivery across tumor histologies. CA A Cancer J Clin;
- Fiona Blackhall, Kevin Jao, Laurent Greillier, Byoung Chul Cho, Konstantin Penkov, et. al.. (2021). Efficacy and Safety of Rovalpituzumab Tesirine Compared With Topotecan as Second-Line Therapy in DLL3-High SCLC: Results From the Phase 3 TAHOE Study. Journal of Thoracic Oncology. 16, 1547-1558;
- Umbreen Hafeez, Sagun Parakh, Hui K. Gan, Andrew M. Scott. (2020). Antibody–Drug Conjugates for Cancer Therapy. Molecules. 25, 4764;
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- Ilona Pysz, Paul J. M. Jackson, David E. Thurston. (2019). CHAPTER 1. Introduction to Antibody–Drug Conjugates (ADCs). Cytotoxic Payloads for Antibody–Drug Conjugates. 1-30;
- Heidi L. Perez, Pina M. Cardarelli, Shrikant Deshpande, Sanjeev Gangwar, Gretchen M. Schroeder, et. al.. (2014). Antibody–drug conjugates: current status and future directions. Drug Discovery Today. 19, 869-881;
- Aditya Bardia, Sara A. Hurvitz, Sara M. Tolaney, Delphine Loirat, Kevin Punie, et. al.. (2021). Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 384, 1529-1541.






