Биотехнология антител
27 июля 2018
Биотехнология антител
- 34875
- 4
- 49
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Первые статьи спецпроекта о терапевтических антителах были посвящены истории открытия и применения антител, их структуре и разнообразию. В этом тексте мы затронем то, как ученые научились производить антитела для лекарственного применения, а также модифицировать их. Поскольку антитело — очень сложная молекула, обладающая пространственной структурой, определяющей ее функцию, — антитело нельзя синтезировать химически, а нужно обязательно использовать для этого биологические системы, например, клеточные культуры животных, в которые заложены все необходимые средства для производства таких сложных белков. В этой статье мы рассмотрим современные подходы в биоинженерии антител.
Терапевтические антитела

Спецпроект об антителах, истории их изучения, методах работы с ними, а также о применении антител в современной медицине и биотехнологии.
Партнер спецпроекта — Департамент вычислительной биологии одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
В первой статье спецпроекта — «Краткая история открытия и применения антител» [1] — рассказывается о том, как: были открыты антитела; возникла идея их использования в диагностике и терапии; были разработаны методы получения высокоочищенных моноклональных антител; антитела применяются в лабораторной и медицинской диагностике; а также о наиболее успешных терапевтических антителах. Вторая статья — «Антитело: лучший способ распознать чужого» [2] — посвящена устройству антител и механизму их образования в организме. В третьей статье цикла мы расскажем о том, как биотехнологи создают антитела к нужным мишеням: о генной инженерии антител, создании их «с нуля», оптимизации структуры и производстве в клеточных культурах животных (рис. 1).
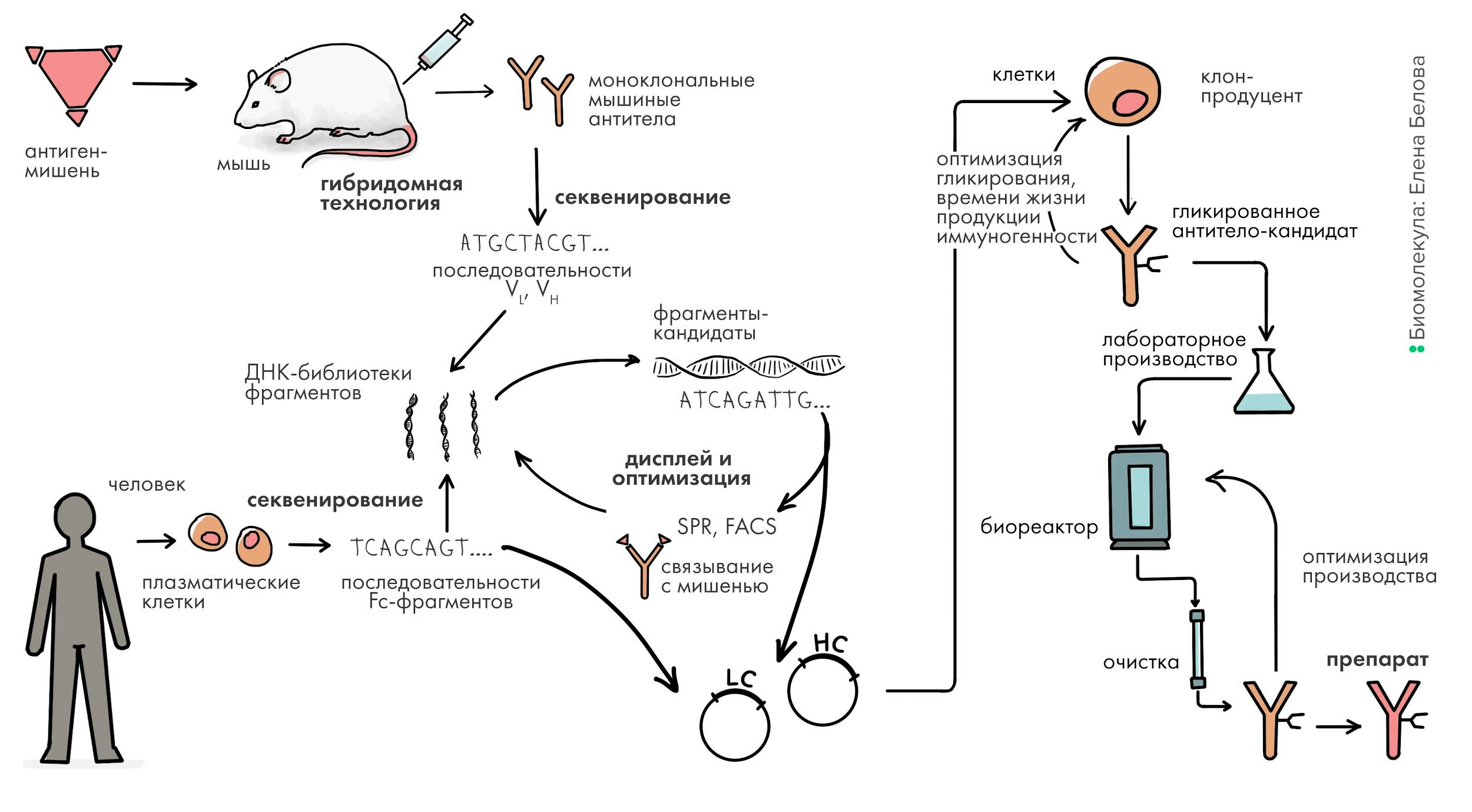
Рисунок 1. Общая схема разработки антитела
рисунок Елены Беловой
Для того чтобы клетка производила антитело, необходимо ввести в нее гены, кодирующие его тяжелые и легкие цепи. Также нужно, чтобы генетическая конструкция, которая вводится в клетку (ее называют вектором), содержала ряд вспомогательных элементов, обеспечивающих наиболее эффективную транскрипцию и трансляцию гена в клетке (рис. 2). Уже на данном этапе необходимо продумать весь путь разработки антитела вплоть до выхода на рынок. Для этого еще на стадии конструирования антитела создают Target product profile — документ, который со временем превратится в инструкцию к препарату. Именно он определяет, каким пациентам будет показано антитело, с какой частотой оно будет вводиться, а значит, каков должен быть его формат и другие параметры, о которых мы расскажем ниже.
Путем изменения генетических конструкций, кодирующих антитело, можно влиять на такие его характеристики, как способ действия (будет оно убивать клетку-мишень или только препятствовать проведению сигнала), селективность к мишени, время выведения из организма и др. Если необходимо модифицировать специфичность или селективность антитела (выделенные жирным термины см. в «Словарике»), то изменению подлежат вариабельные фрагменты антител, отвечающие за связывание с антигеном (Fab-фрагменты). Если же нужно изменить другие параметры — время полужизни антитела, его механизм действия, — модифицируют константные участки (Fc-фрагмент).
Генная инженерия антител
Обычно создание генно-инженерной конструкции для экспрессии антитела начинается с выбора системы экспрессии, вектора и оптимизации нуклеотидной последовательности, кодирующей антитело. Необходимо откорректировать состав кодонов таким образом, чтобы экспрессия антитела была максимальной. Аминокислотный состав белка оптимизируют для снижения вероятности выпадения в осадок, агрегации, а также иммуногенности, о чем мы подробнее расскажем далее. Кроме того, важно обеспечить правильное сворачивание (фолдирование, упаковку) цепей и их соединение между собой. Сейчас существуют программы, позволяющие оптимизировать нуклеотидную последовательность генно-инженерных конструкций для продукции антител in silico, хотя, конечно, последнее слово остается за экспериментальными данными.
В качестве вектора используют плазмиды — кольцевые ДНК, кодирующие как сам ген белка, так и вспомогательные элементы. Так, для экспрессии в эукариотических клетках используют промотор цитомегаловируса (CMV), обеспечивающий высокую эффективность транскрипции.
Поскольку антитело состоит из двух полипептидных цепей — легкой и тяжелой, — используют либо двухплазмидную систему экспрессии, либо один вектор, содержащий оба гена. Последний вариант предпочтительнее, так как позволяет точнее контролировать соотношение продукции легких и тяжелых цепей. Было показано, что в природных условиях в B-клетках легкие цепи синтезируются в бóльшем количестве, чем тяжелые, и такое соотношение скоростей синтеза наиболее благоприятно для продукции антител [3].
Вектор должен также содержать ген устойчивости к антибиотику, в присутствии которого выращивают клетки. Это нужно, чтобы клетки не избавлялись от вектора — при добавлении антибиотика клетки, не несущие вектор, погибнут. Хотя антитело синтезируется в клетках млекопитающих, предварительные манипуляции с вектором (например, вставка туда гена и клонирование, то есть получение одинаковых копий вектора) проводят в бактериях . На рис. 2 показан вектор с двумя генами устойчивости к антибиотикам — один для бактерий, второй для эукариотических клеток.
О том, как и зачем ученые работают с клеточными культурами, мы рассказывали в статье «12 методов в картинках: клеточные технологии» [4]. — Ред.
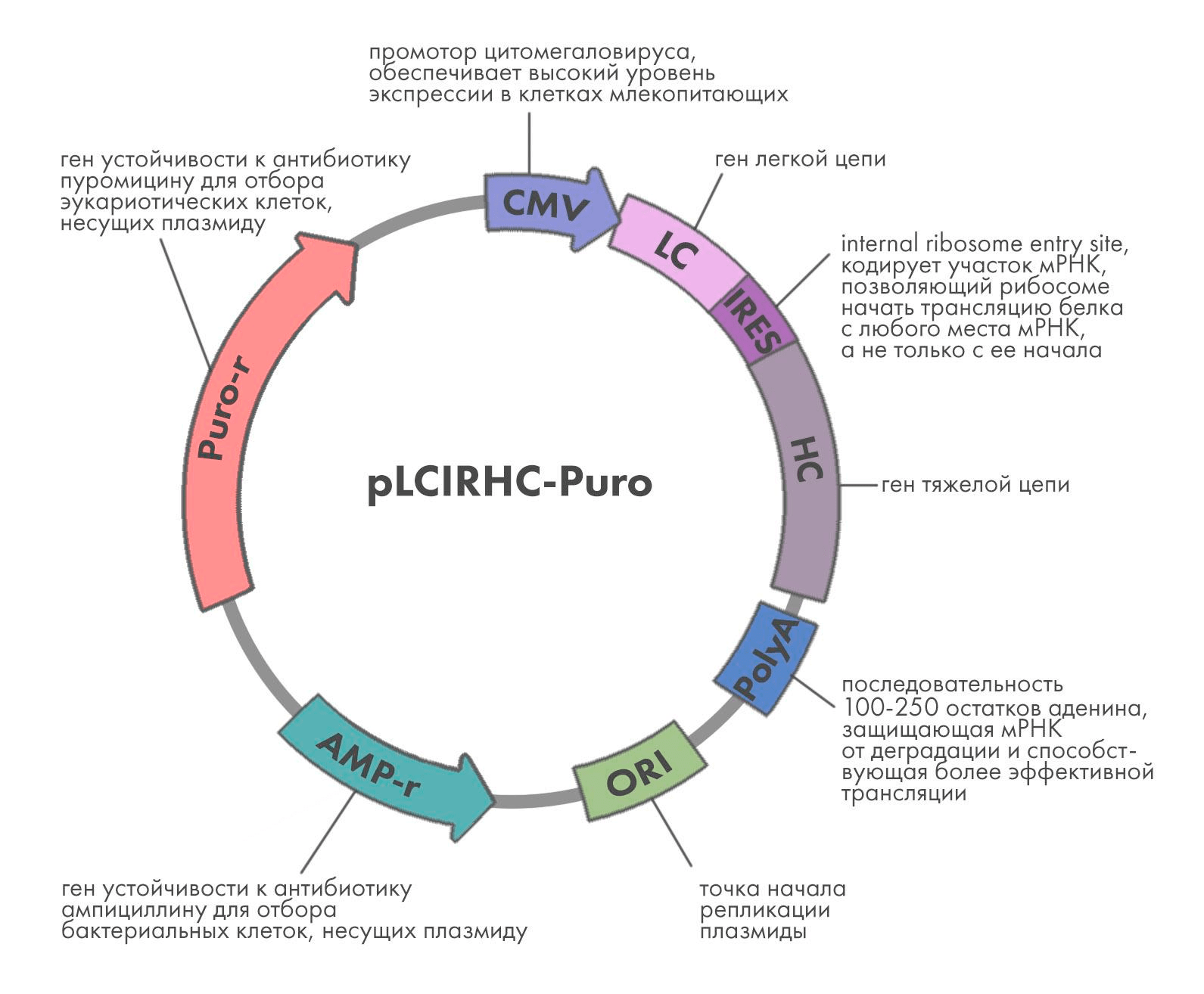
Рисунок 2. Схема плазмиды для экспрессии антител в клетках млекопитающих
рисунок Елены Беловой по [55]
Получение вариабельных фрагментов антител
Перейдем к тому, как получаются последовательности вариабельных фрагментов антител, которые и определяют их специфичность и селективность.
Исследователи пока не могут предсказать, какая именно последовательность вариабельного фрагмента антитела будет оптимальной для связывания антигена. Антиген, как правило, представляет собой белковую молекулу, и площадь поверхности контакта антитела с антигеном слишком велика для моделирования in silico (рис. 3), которое также осложняется наличием молекул воды. Поэтому приходится использовать биологические объекты, у которых есть способность очень тонко настраивать последовательность аминокислот антитела для обеспечения высочайшей аффинности к антигену.
Биологические процессы настолько сложны, что порой их намного удобнее смоделировать на компьютере, нежели пытаться повторить в пробирке. О том, как устроена работа биоинформатика, мы уже писали в статьях «12 методов в картинках: сухая биология» [5], «Вычислительное будущее биологии» [6] и в других [7–9]. — Ред.
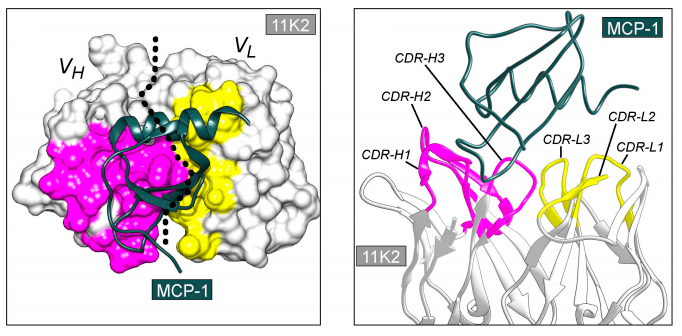
Рисунок 3. Кристаллическая структура комплекса антитела 11К2 (серый, розовый и желтый цвета) и антигена MCP-1 (зеленый цвет) в двух проекциях. Структура иллюстрирует сложность поверхности контакта антитело—антиген.
Методы получения антител подразделяются на гибридомные и дисплейные. Гибридомный метод, более подробно описанный в статьях «Краткая история открытия и применения антител» [1] и «Моноклональные антитела» [10], использует для получения антител организм млекопитающего, который после иммунизации (введения антигена) вырабатывает антитела с высокой аффинностью и селективностью. В дальнейшем эти антитела или их гены можно выделить, отсеквенировать [11] и модифицировать с целью придания им нужных фармакологических свойств.
Дисплейные методы
Дисплейные методы используют в качестве исходного материала широкий репертуар генов, кодирующих антитела. Самым распространенным методом является фаговый дисплей [12], [13]. Метод представления (отсюда название — «дисплейный») пептида на поверхности бактериофага М13 был изобретен в 1985 году. В 1989 г. научились клонировать гены иммуноглобулинов, что позволило обойтись без гибридомной технологии для получения антител. Первоначально в бактериях синтезировали Fab или scFv фрагменты антител, создавая библиотеки клонов, и проводили вручную отбор наиболее аффинных клонов с помощью радиоактивно-меченного антигена. Однако это была очень трудоемкая и неэффективная процедура. В 1990 году впервые использовали дисплейную технологию представления фрагментов антител на поверхности фагов, а в 1991 создали первую библиотеку вариабельных фрагментов. Первым антителом, созданным с помощью технологии фагового дисплея, стала «Хумира» (адалимумаб компании Abbott) против мишени TNF для лечения ревматоидного артрита [14] и болезни Крона. «Хумира» зарегистрирована в 2002 году, и уже долгое время возглавляет список лекарств — лидеров продаж.
Получение антитела дисплейным методом in vitro схематически подражает эволюционному процессу формирования антител в организме [15]:
- Сперва необходимо породить разнообразие генов, кодирующих вариабельные фрагменты — так получаются библиотеки антител.
- Затем нужно экспрессировать эти гены, то есть преобразовать генотип в фенотип.
- Потом нужно осуществить селективное давление, которое бы заставило генотип эволюционировать.
- И наконец необходимо амплифицировать полученный результат.
Таким образом, в процессе присутствуют все составляющие эволюции — наследственность, изменчивость и отбор. Рассмотрим эти шаги подробнее.
Качество получаемой библиотеки фрагментов зависит от способности получить широкий репертуар разнообразных и при этом качественных антител [16]. Существует два принципиально разных подхода к получению библиотек: естественный (наивный) и синтетический.
Естественные библиотеки вариабельных доменов антител получают методом полимеразной цепной реакции природных генов с обратной транскрипцией (RT-PCR) [17] из лимфоидных тканей или периферической крови людей, а также других животных. Преимущество этого метода в том, что полученные антитела будут в правильной конформации, так как их гены кодируют функциональные антитела. Однако недостаток в том, что разнообразие последовательностей ограничено охватом естественной иммунной системы, в которой существует определенная неравномерность использования тех или иных последовательностей. Также фрагменты из природных библиотек сильно отличаются по качеству и непредсказуемы по составу; многие из них могут оказаться недостаточно стабильными или неподходящими по другим причинам. Репертуар естественных библиотек составляет 107–1011 фрагментов [18].
Синтетические библиотеки создают путем встраивания искусственно синтезированной ДНК в последовательности, кодирующие вариабельные домены. ДНК синтезируется таким образом, чтобы вносить совершенно случайные (рандомизированные) мутации в получающиеся фрагменты антител и тем самым расширять разнообразие определяющего комплементарность сайта (complementarity-determining region, CDR). Синтетические библиотеки позволяют использовать определенную коровую (germline) структуру вариабельного домена, про которую известно, что она наиболее представлена в каждом индивидууме, неиммуногенна и стабильна. Однако введение полностью синтетических участков CDR может привести к неправильному сворачиванию и агрегации белка. Потребовалось время для отработки подходов к определению того, какие CDR лучше использовать. Репертуар синтетических библиотек, как правило, доходит до 109–1011 фрагментов.
Далее начинается самое интересное: как дисплейная технология позволяет связать генотип с фенотипом и отобрать клоны с нужными свойствами. Гены всех фрагментов антител вставляют в геном бактериофага в одно и то же положение — внутрь гена, кодирующего белок оболочки фага. Потом гены переносят в кишечную палочку Escherichia coli (это называется трансдукцией) и заражают вспомогательным фагом, который вызывает сборку бактериофага, содержащего на поверхности фрагмент антитела. В результате получается библиотека бактериофагов, у каждого из которых на поверхности экспрессируется фрагмент антитела, соответствующий гену, который попал в данного бактериофага. Препарат библиотеки добавляют к иммобилизованному на поверхности пластиковой пробирки антигену, против которого надо создать антитела, и проводят отмывку. На поверхности остаются только бактериофаги, содержащие вставку гена фрагмента антитела с высоким сродством к антигену. Чтобы отобрать самые высокоаффинные клоны, связавшиеся с антигеном, фаги снимают с поверхности и снова заражают ими E. coli (рис. 4). После нескольких этапов отбора ДНК полученных фагов секвенируют и узнают последовательность, кодирующую самые аффинные фрагменты [19].

Рисунок 4. Процесс селекции нужных генотипов в соответствии с аффинностью к антигену. а — Бактериофаг, обеспечивающий связь генотип—фенотип. Ген фрагмента антитела (розовый) вставляется в фаговую ДНК, что приводит к экспрессии на поверхности фага белка — фрагмента антитела. б — Схема фагового дисплея. 1. Фаговую библиотеку, состоящую из 106–1011 клонов, инкубируют с иммобилизованным антигеном. 2. Не связавшиеся фаги удаляют промывкой. 3. Связавшиеся фаги снимают с поверхности. 4. E. coli заражают фагом для амплификации полученных кандидатов. 5. Клетки высевают на среду с антибиотиком и амплифицируют. Процесс повторяют 2–3 раза для обогащения популяции антительными фрагментами, специфичными к антигену.
Важное преимущество использования дисплейных методов по сравнению с гибридомными — возможность отбирать только те антитела, которые НЕ связываются с ненужными белками, например, с близкими к мишени, но которые не надо блокировать, чтобы не вызывать токсичность. Для этого достаточно иммобилизовать теперь уже нежелательный белок и отбирать те фаги, которые не связались с ним.
Также бывает полезно создать антитело, которое бы хорошо связывалось и с мышиным, и с обезьяньим, и с человеческим вариантами мишени — это обеспечивает быстрое успешное прохождение доклинических исследований и контроль безопасности до выведения потенциального лекарственного кандидата в клинические испытания.
Существуют и другие типы дисплеев, помимо фагового, например, рибосомный или дрожжевой [20]. Здесь я не буду подробно на них останавливаться, так как принцип у них тот же: они обеспечивают связь гена, кодирующего фрагмент антитела, с его аффинностью к мишени, то есть с фенотипом, и позволяют производить отбор по заданным свойствам из огромного количества вариантов в библиотеке.
Созревание аффинности антител
После получения фрагментов-кандидатов разработчики приступают к более сфокусированной настройке аффинности, которая носит название созревание аффинности. В иммунной системе созревание аффинности происходит путем последовательного внесения мутаций в участки, кодирующие CDR, и селективного давления отбора в сторону бóльшей аффинности. In vitro процесс примерно такой же. Разработчики берут ген лидерного кандидата, вносят мутации в положениях соответствующих CDR и проводят скрининг на аффинность. Индивидуальные мутации, усиливающие аффинность, затем объединяют в одном клоне. Рибосомный дисплей позволяет довольно быстро проскринировать миллионы клонов, а использование нескольких раундов отбора имитирует естественный процесс созревания аффинности. В результате получаются антитела с аффинностью даже выше, чем у природных.
Полученная генетическая последовательность фрагмента антитела, содержащая вариабельные домены, объединяется с последовательностью, кодирующей константные участки тяжелой и легкой цепей (Fc-фрагмент). Если оптимизация вариабельного фрагмента касается аффинности и селективности антитела, то Fc-фрагмент отвечает за фармакокинетику и эффекторные функции антитела, о чем я более подробно расскажу далее.
Так выглядит простейшая схема получения антитела, однако на практике разработчики прибегают к модификации и совмещению различных подходов. Расскажу для примера, как была получена молекула уже упомянутой «Хумиры»: за основу взяли тяжелую цепь мышиного антитела против TNF, ее ген скомбинировали с библиотекой человеческих легких цепей и провели селекцию на связывание с человеческим TNF (hTNF). Полученное антитело-кандидат имело аффинность около 15 нМ. Далее провели созревание аффинности, которое позволило добиться аффинности на уровне 300 пМ [21].
Эпитопная специфичность
Если оптимизация аффинности — относительно простая задача, то инженерия эпитопной специфичности может оказаться достаточно трудным делом. От того, с каким участком мишени свяжется антитело, часто зависит итоговый эффект. Особенно это существенно в случае активирующих антител. Однако и для блокирующих антител это тоже важно: например, антитело с тщательно подобранной эпитопной специфичностью может предотвратить связывание мишени с одним из лигандов, не влияя на связывание с другими.
Один из самых ярких примеров важности определенной эпитопной специфичности — антитела против рецептора HER2, который часто повышенно экспрессируется в клетках рака молочной железы и выставляется на их поверхности. Антитело «Герцептин» (трастузумаб компании Roche/Genentech), одобренное в качестве первой линии терапии метастатического рака молочной железы с повышенной экспрессией HER2, связывается с С-концевым доменом HER2 [22], который отвечает за связывание с другим рецептором, HER3, и препятствует активации последнего. Трастузумаб работает только у пациенток с высокой экспрессией HER2, и у большинства впоследствии развивается резистентность к препарату, то есть опухоль снова начинает расти. Компания Roche разработала антитело «Перджета» (пертузумаб), которое связывается с другим эпитопом HER2, отвечающим за его связывание с рядом рецепторов [23]. Пертузумаб предотвращает активацию самого HER2, тем самым позволяя преодолеть резистентность к трастузумабу.
Один из методов создания антител к выбранному эпитопу состоит из двух этапов [24]. На первом этапе проводится скрининг исходной библиотеки антительных фрагментов на связывание с выбранной мишенью, как описано выше. После того, как получены высокоаффинные фрагменты, проводится их скрининг с мутантной мишенью, у которой аминокислотные остатки в области эпитопа заменены на другие, препятствующие связыванию с ним. В ходе скрининга отбираются те антитела, которые НЕ связываются с мутантной мишенью. Это и будут антитела, специфичные к нужному эпитопу.
Выбор системы экспрессии
Выше было сказано, что систему экспрессии, то есть тип клеток, в котором будет происходить производство антитела, выбирают на раннем этапе, и ее выбор влияет на то, как должна выглядеть генетическая конструкция и как будут происходить дальнейшее масштабирование и оптимизация экспрессии. Наиболее распространенный во всем мире промышленный вариант системы экспрессии — клетки яичника китайского хомячка CHO (chinese hamster ovary). Клетки СНО дают хорошие выходы белка (как правило, 1–2 г с литра культуры, иногда до 10 г/л), обеспечивают правильное сворачивание и гликозилирование антител, способны к суспензионному росту (то есть в объеме, а не на поверхности) и хорошо адаптируются к изменению условий культивирования, что позволяет масштабировать процесс в различных объемах и использовать их в биореакторах. Другие клеточные линии включают NS0, Sp2/0 (обе — мышиной миеломы), HEK293 (клетки почки человеческого эмбриона) и PER.C6 (получены из человеческих фетальных ретинобластов). Также предпринимаются попытки производства антител в трансгенных растениях и животных, но они пока не дошли до коммерческого использования [25].
Оптимизация вариабельной части антитела — гуманизация
В случае классической гибридомной технологии антиген вводится, как правило, мыши, и в ходе естественного иммунного ответа вырабатываются антитела нужной специфичности. Помимо того, что естественная иммунизация не позволяет контролировать аффинность и селективность антитела, потому что мы не можем проконтролировать представление антигена в иммунной системе и последующий процесс продукции антител, есть еще более важная проблема: при гибридомной технологии мышиное антитело получается чужеродным по отношению к человеку из-за наличия других аминокислотных остатков по сравнению с антителами человека в определенных позициях константной части. Поэтому первое же коммерческое антитело против CD3 — OKT3 — вызывало у многих пациентов антительный ответ.
Такие антитела получили название HAMA — human anti-mouse antibodies, то есть «человеческие противомышиные антитела». Антительный ответ на введенное лекарство сильно снижает его эффективность, потому что приводит к выведению лекарства из организма и делает бессмысленным повторное введение препарата, так как во второй раз антительный ответ гораздо сильнее, и никакой пользы от лекарства точно не будет. Кроме того, антительный ответ может привести к серьезным аллергическим реакциям. Еще одна проблема не полностью человеческих антител — слабое взаимодействие мышиных антител с рецепторами человеческих клеток, которые обеспечивают некоторые из механизмов действия антител и длительность их пребывания в организме. Поэтому перед исследователями встала задача поиска технологий гуманизации антител, то есть приближения их к естественным человеческим аналогам [26].
Химерные антитела
Первым типом антител, приближенных к человеческим, стали химерные (рис. 5). В 1997 году был одобрен ритуксимаб — антитело против белка CD20 на поверхности В-лимфоцитов, предназначенное для лечения В-клеточных лимфом. Для его генерации полученные гибридомным методом вариабельные фрагменты объединили с человеческими константными доменами и таким образом достигли содержания человеческих участков более 70%. Включение ритуксимаба в схемы лечения лимфом произвело революцию, позволив не только увеличить время до прогрессирования заболевания, но и повысить общую выживаемость.
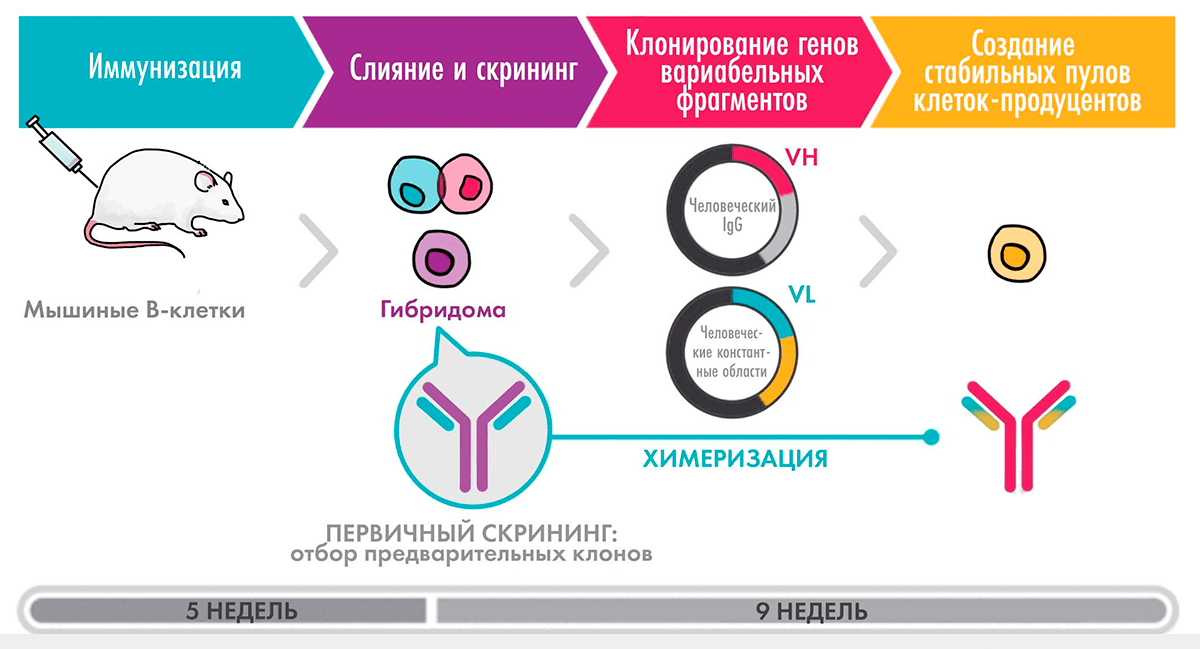
Рисунок 5. Схема получения химерного антитела
Рассмотрим более подробно процесс получения химерного антитела на примере инфликсимаба — препарата против TNF, который, как и рассмотренный выше адалимумаб, применяется для лечения ревматоидного артрита и болезни Крона. Вначале мышь иммунизировали человеческим TNF (hTNF) в сочетании с адъювантом — веществом, усиливающим иммунный ответ, — выделяли спленоциты и сливали их с клетками миеломы. Для отбора клонов клеток, экспрессирующих нужные антитела, использовали радиоиммунный метод с иммобилизованным hTNF. Затем после построения геномных библиотек с использованием фаговых векторов и скрининга путем саузерн-блоттинга [27] выделяли гены, кодирующие легкие и тяжелые цепи антитела. После этого получали плазмиду, содержащую гены мышиных вариабельных участков, объединяли с генами человеческих константных областей (полученных ранее секвенированием генов В-клеток человека) и вводили ее в клетки мышиной миеломы для продукции химерного антитела [28].
Гуманизированные антитела
Хотя химерные антитела оказались более эффективными и менее иммуногенными, чем полностью мышиные, они все же вызывают HACA-ответ — образование human anti-chimeric antibody, то есть человеческих антител против химер. Поэтому с 1980-х годов начали разработку гуманизированных антител, у которых чужеродны человеку только CDR и отдельные позиции FR-регионов вариабельных доменов, а остальные части, включая каркас, почти полностью человеческие (рис. 6). Первым таким антителом в разработке стал алемтузумаб против антигена лимфоцитов CD52. Это лекарство применяется для лечения некоторых гемобластозов и рассеянного склероза [29]. Оно было получено на основе крысиного антитела, чьи CDR перенесли в человеческие домены VH и VL уже существующего человеческого антитела [26].
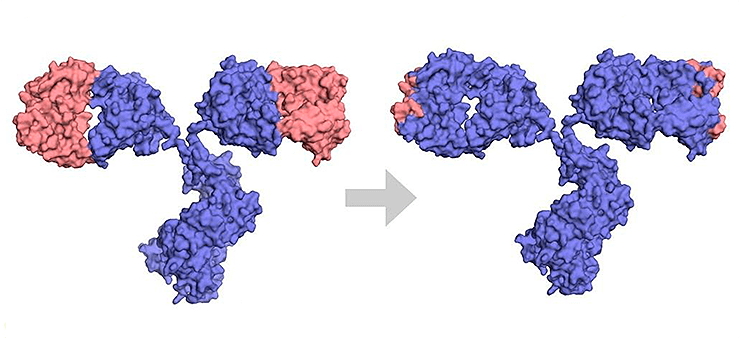
Рисунок 6. Разница между химерным и гуманизированным антителами. Синим показаны человеческие последовательности, оранжевым — мышиные.
Другой подход применили при разработке антитела даклизумаб против рецептора CD25 на Т-лимфоцитах, которое стало первым гуманизированным антителом на рынке (оно использовалось для лечения рассеянного склероза, но уступило конкурентам и было выведено с рынка). Даклизумаб также был получен включением мышиных CDR в человеческий каркас, но на этот раз человеческие участки антитела подобрали компьютерными методами так, чтобы максимизировать сходство с мышиным антителом, откуда взяты CDR. Кроме того, построили компьютерную модель мышиного антитела, и те аминокислотные остатки каркаса, которые контактировали с CDR, перенесли в каркас человеческого антитела, что позволило улучшить аффинность [26].
Хотя гуманизированные антитела включают повышенное количество человеческих последовательностей по сравнению с химерными, вероятность выработки антител против них остается — они называются HAHA (human anti-human antibody, человеческие анти-человеческие антитела).
HAMA-ответ может быть направлен на все антитело, HACA — против вариабельных областей, а HAHA-ответ еще более фокусный — только против CDR. Некоторые компании предприняли попытки заменить CDR-последовательности, чужеродные для человека, на человеческие. Таким образом удается повысить количество полностью человеческих последовательностей на 17–29% и получать с помощью гибридомной технологии почти полностью человеческие антитела [26].
Полностью человеческие антитела
Существует две группы технологий получения полностью человеческих антител. Одна из них подробно описана выше — это технологии дисплея, в первую очередь, фагового. Вторая — технология использования трансгенных животных, экспрессирующих человеческий репертуар антител. У метода трансгенных животных есть два важных преимущества перед дисплейными: антитела получаются быстрее и, поскольку отбор идет in vivo, а не in vitro, исключено образование антител с плохой растворимостью и другими проблемами в дальнейшей разработке.
Этим методом было получено одно из самых известных сейчас антител ниволумаб против мишени PD-1 на активированных T-лимфоцитах [30], которое вместе с другими антителами класса ингибиторов иммунологических чекпойнтов произвело революцию в лечении метастатических злокачественных заболеваний: меланомы, рака легкого, рака мочевого пузыря, дав впервые в истории надежду на полное выздоровление части пациентов. Ниволумаб был разработан по технологии компании Medarex, которая в 1993 году получила линию мышей, экспрессирующих человеческие IgM, IgG и Igκ и не экспрессирующих мышиные IgM и Igκ. Мыши оказались способными к производству полноценных В-клеток, в которых происходит V(D)J-рекомбинация человеческих трансгенных участков, а после введения антигенов — переключение класса тяжелой цепи и соматический мутагенез. Далее из этих мышей по обычной гибридомной технологии получают человеческие антитела [31].
Так, для получения ниволумаба трансгенных мышей иммунизировали рекомбинантным человеческим белком PD-1-Fc, состоящим из внеклеточного домена PD-1 и Fc-фрагмента IgG. Одновременно мышам ввели клетки яичников китайского хомячка CHO, экспрессирующие на поверхности PD-1. Спленоциты мышей слили с клетками миеломы SP2/0 и отобрали гибридомы, производящие антитела, реактивные против PD-1-Fc, с помощью ELISA. Связывание ниволумаба с CD4+ лимфоцитами определяли методом проточной цитофлуориметрии [32], а кинетику связывания с мишенью — методом плазмонного резонанса [33] (см. раздел «Методы изучения свойств антител»).
Несмотря на то, что у мышей технология Medarex порождает довольно ограниченный репертуар генов, кодирующих человеческие VH и VL, даже его хватает для генерации антител с высокой аффинностью, правда, не во всех случаях. Если антиген, к которому надо получить антитела, высокогомологичен с мышиным аналогом, сделать это не удастся. Здесь на помощь могут прийти трансгенные крысы, куры или дисплейные технологии. Также дисплейные технологии являются единственным выходом, если мишень токсична в концентрациях, необходимых для иммунизации животного [26], например, при разработке нейтрализующих антител против природных токсинов.
Изобретение множества методов разработки и гуманизации антител привело к тому, что граница между химерными, гуманизированными и человеческими антителами во многих случаях размыта. В связи с этим в 2017 году ВОЗ решила упразднить существовавшую ранее номенклатуру [34], по которой мышиные антитела имели суффикс -momab, химерные — -ximab, гуманзированные — -zumab, a полностью человеческие — -mumab.
Оптимизация константной части антитела
До сих пор речь шла в основном о том, как получить правильные последовательности CDR, которые определяют взаимодействие антитела с мишенью, его аффинность и отчасти иммуногенность. Теперь пришла пора поговорить о другой части антитела — Fc-фрагменте, структура которого определяет изотип антитела и такие важные его характеристики, как механизм действия (так называемые эффекторные функции), фармакокинетику и взаимодействие с остальными молекулами организма, помимо мишени.
Выбор подкласса IgG
У человеческого IgG четыре подкласса: IgG1, IgG2, IgG3 и IgG4 . Подклассы отличаются последовательностями Fc, и их особенности определяют профиль связывания с рецепторами на клетках иммунной системы — натуральных киллерах, нейтрофилах, макрофагах, а также связывание с белком системы комплемента C1q.
Более подробно строение антител и особенности различных изотипов описаны во второй статье цикла — «Антитело: лучший способ распознать чужого» [2].
Мутации в Fc-фрагменте IgG могут как увеличивать эффекторные функции — ADCC, ADCP и CDC, — так и снижать их. Так, оказалось, что ADCC антитела трастузумаб зависит от того, какой у пациента вариант рецептора FcγRIIIa. У пациентов с определенной мутацией в этом рецепторе антитело оказывается недостаточно эффективным. Введение мутаций в Fc-фрагмент трастузумаба повысило ADCC, что, возможно, позволит создать препарат, подходящий всем пациентам независимо от варианта FcγRIIIa [26].
В некоторых случаях необходимо только заблокировать мишень, например растворимые лиганды, при этом нет необходимости в гибели клеток. Тогда либо используют антитело другого подкласса — IgG2 или IgG4, которые почти не проявляют ADCC-активности, — либо вводят в Fc-фрагмент мутации, снижающие эффекторные функции. Так, для ниволумаба был выбран подкласс IgG4, потому что его мишень PD-1 экспрессируется в нормальных клетках иммунной системы, и было бы нежелательно их уничтожать. Вместо этого ниволумаб, не проявляя ADCC и CDC, блокирует взаимодействие PD-1 на Т-лимфоците с лигандом PD-L1 на поверхности раковой клетки и тем самым не дает раковой клетке снизить активность лимфоцита [26].
Гликозилирование
У молекул IgG в домене CH2 находится сайт N-гликозилирования, то есть присоединения остатков сахаров по атому азота (рис. 8). Модификация остатков сахаров, связанных с антителом, позволяет модулировать некоторые эффекторные функции.
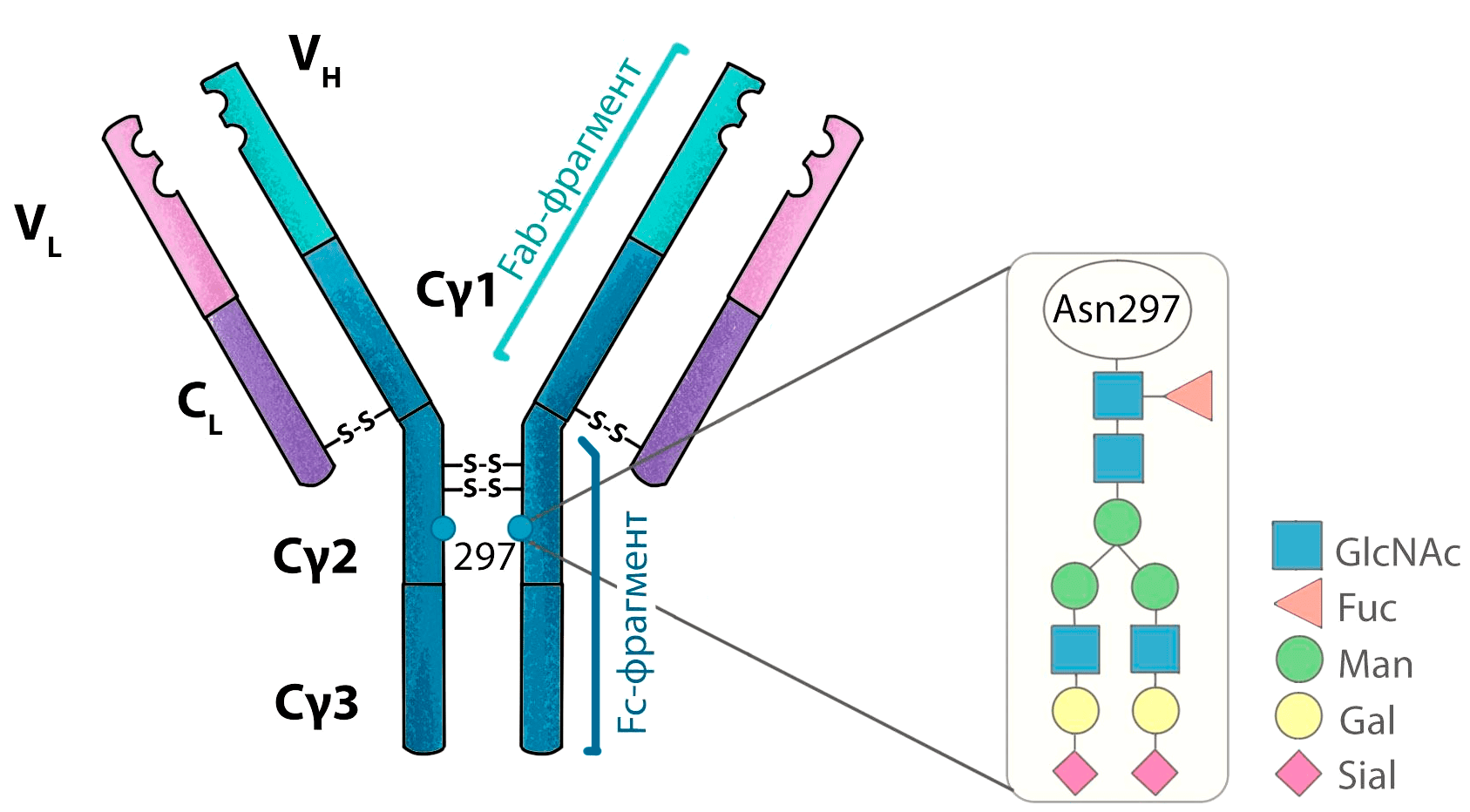
Рисунок 8. Структура гликана IgG. Гликозилирование антител происходит всегда в одном месте — по остатку аспарагина-297.
рисунок Елены Беловой по [58]
Гликозилирование абсолютно необходимо для взаимодействия антитела с Fcγ-рецепторами, поэтому удаление остатков сахаров приводит к тому, что CH2-домен изменяет свою конформацию, и антитело теряет все эффекторные свойства.
Модуляция состава сахаров, присоединенных к аспарагину-297, также позволяет увеличивать ADCC. К примеру, удаление остатка фукозы (дефукозилирование) приводит к росту ADCC. Чтобы добиться дефукозилирования, для производства антитела используют клеточную линию, в которой выключен фермент, отвечающий за добавление фукозы — фукозилтрансфераза.
Фармакокинетика
Специфические последовательности, расположенные в районе соединения доменов CH2 и CH3 молекулы IgG, отвечают за ее связывание с рецептором FcRn, которое в значительной мере определяет период полувыведения антитела. Этот удивительный рецептор экспрессируется на многих эндотелиальных и эпителиальных клетках и отвечает за транспорт антител через клеточные барьеры, а также за их возврат в кровоток [36]. Связывание Fc-фрагмента антитела с FcRn в кровотоке при рН 7,4 незначительно, тогда как в кислой среде в эндосомах (pH < 6,5) связывание происходит. Клетки эндотелия постоянно захватывают белки плазмы в эндосомы, FcRn перехватывает антитела и возвращает их в циркуляцию. Если антитело не свяжется с FcRn, оно будет направлено на деградацию в лизосому (рис. 9).
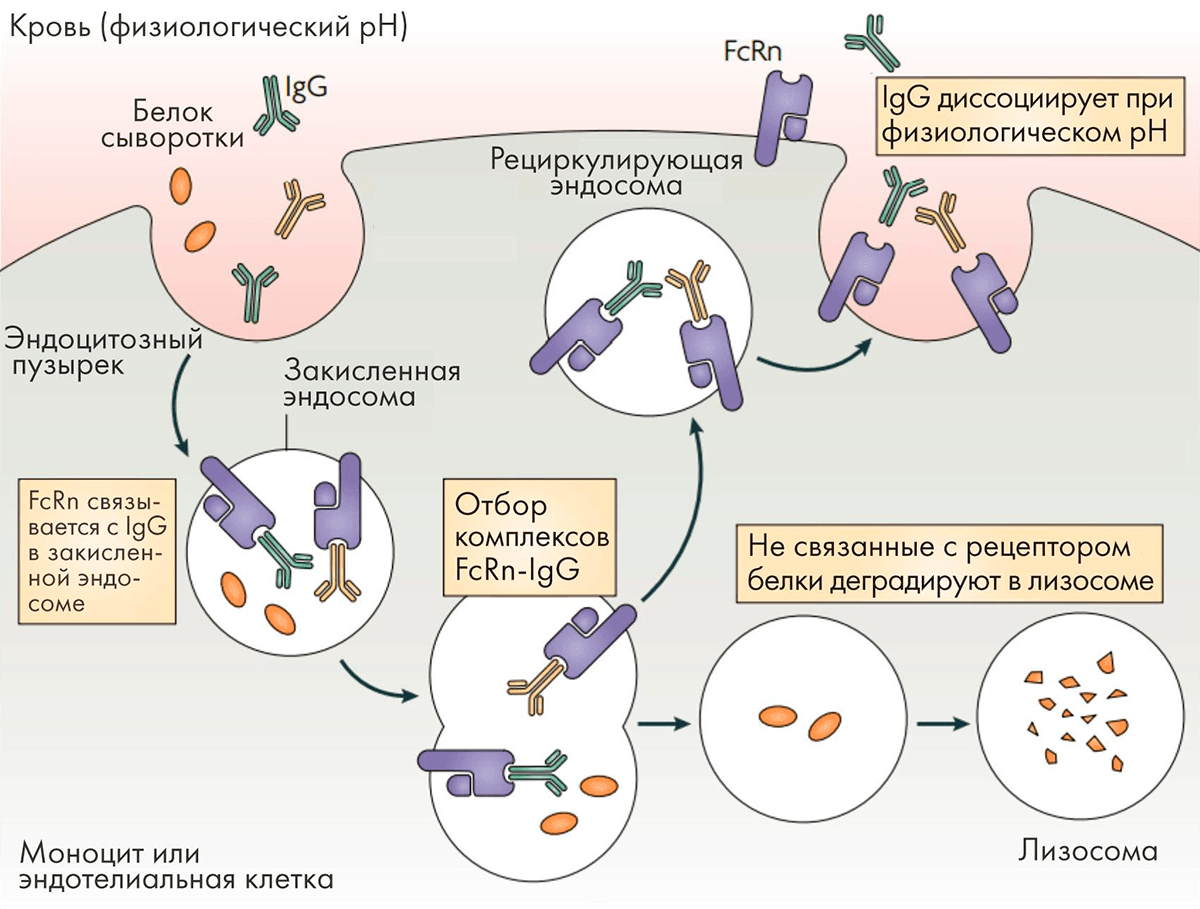
Рисунок 9. Взаимодействие антител с рецептором FcRn
Именно поэтому антитела подклассов IgG1, IgG2 и IgG4, обладающие высоким сродством к FcRn, имеют период полувыведения из организма 21 день, а антитела подкласса IgG3 с более низким сродством к нему — всего 5–7,5 дней. Были найдены мутации, усиливающие связывание IgG1 с FcRn, что позволило еще больше продлить период полувыведения.
Иногда, наоборот, нужно ускорить выведение антитела из организма, например, если оно потенциально токсично. В таких случаях вводят мутации, снижающие сродство к FcRn [26].
Методы изучения свойств антител
Плазмонный резонанс
Основной метод изучения кинетики и аффинности связывания антигена с антителом — поверхностный плазмонный резонанс (surface plasmon resonance, SPR). Метод основан на том, что на поверхности металлов при возбуждении источником света под определенным углом возникает плазмон — электромагнитная волна, распространяющаяся вдоль поверхности. Угол, при котором он возникает, зависит от свойств среды в непосредственной близи от поверхности, поэтому адсорбция веществ на поверхности металла приводит к изменению этого угла, и таким образом ее можно измерять (рис. 10) [37].
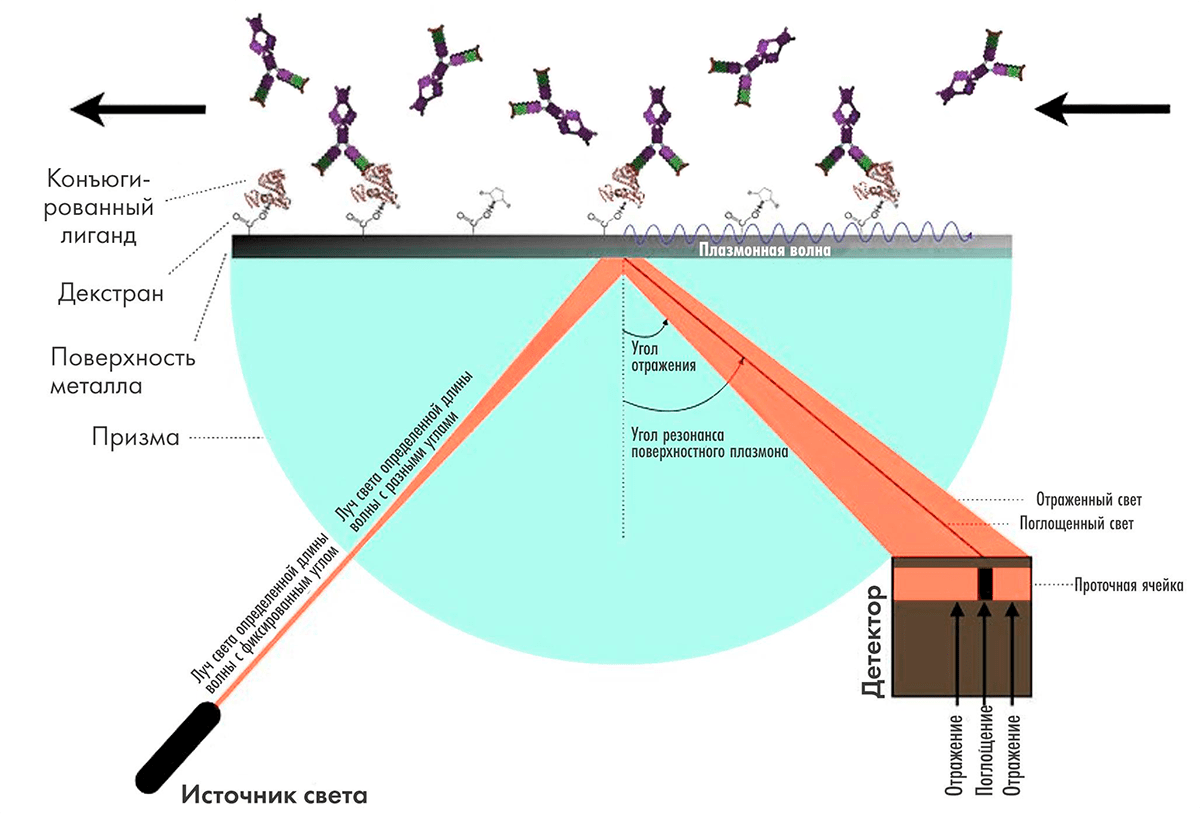
Рисунок 10. Схема работы прибора на принципе поверхностного плазмонного резонанса. Излучение от источника с длиной волны 760 нм отражается от металлической подложки, на противоположной поверхности которой закреплена одна из двух взаимодействующих молекул. Один из углов отражения является резонансным, и явление поверхностного плазмонного резонанса приводит к снижению интенсивности отраженного под этим углом света. При связывании антитела с конъюгированным лигандом меняется показатель преломления среды вблизи поверхности, резонансный угол отражения изменяется, что регистрируется фотоэлементом.
Наилучшие параметры метода, которые используются в наиболее популярных приборах для плазмонного резонанса Biacore, достигаются при применении в качестве поверхности золотых пластинок толщиной 50 нм [37]. К слою золота ковалентно присоединяется декстрановая матрица, и молекула мишени иммобилизуется в декстране (разветвленном полимере глюкозы).
Антитело в буферном растворе пропускается над иммобилизованным лигандом, и связавшиеся антитела приводят к изменению резонансного сигнала. Метод SPR крайне чувствительный — предел обнаружения связывания антител составляет менее 10 пг/мм2.
Использование метода решает следующие основные задачи:
- обнаружение взаимодействия между молекулами;
- анализ кинетики взаимодействия;
- анализ аффинности;
- измерение концентраций;
- скрининг с целью поиска партнеров связывания.
Изучение плазмонного резонанса идеально подходит для скрининга, поскольку он не требует химических модификаций метками для измеряемых биологических молекул в растворе и хорошо автоматизируется.
Одним из ограничений метода является то, что вследствие иммобилизации области взаимодействия антигена с антителом могут экранироваться от антитела или возникнут пространственные затруднения для связывания. Это приведет к ложноотрицательным результатам. В таких случаях антиген модифицируют и используют те химические группы, которые находятся на удалении от сайта связывания с антителом или меняют антиген и антитело местами для вычитания стерического эффекта.
На измерения также может повлиять скорость переноса антитела из подвижной фазы (буфера) в неподвижную (декстрановую матрицу), поэтому для подтверждения результата рекомендуется пользоваться независимым методом, например, KinExA, в котором измеряется взаимодействие антитела не с иммобилизованным антигеном, а со свободным [38–41].
Вторая проблема заключается в том, что свойства антитела и антигена в растворе и на поверхности отличаются от соответствующих свойств в организме, однако это фундаментальное затруднение характерно для всех аналитических методов in vitro.
Проточная цитофлуориметрия
Другой метод, который рутинно используют при разработке антител — FACS (fluorescence-activated cell-sorting — сортировка клеток с активацией флуоресценции или, по-другому, проточная цитофлуориметрия [32]). В случае антител с помощью FACS можно определить аффинность связывания с поверхностным рецептором клетки прямо на клеточной поверхности, не выделяя рецептор [40]. Это очень полезная особенность, так как поверхностные рецепторы являются мембранными белками, и манипуляции с ними in vitro сопряжены со множеством трудностей: для них требуется создавать особые условия, иначе они не сохраняют свою конформацию и агрегируют.
Для определения аффинности постоянное количество клеток, несущих рецептор, титруется возрастающей концентрацией антитела, при этом каждый раз устанавливается равновесие. Антитела, связавшиеся с клетками, детектируют с помощью других антител, меченых флуоресцентной меткой.
В связи с хорошей автоматизируемостью и высокой производительностью метода он хорошо подходит для скрининга библиотек клонов антител (см. раздел «Дисплейные методы»). Один и тот же клон проверяют на связывание с клетками, экспрессирующими и не экспрессирующими рецептор. Если отношение связывания больше определенного порога, клон отбирают для дальнейшей работы [41].
Методы in silico
После того, как методом дисплея получены фрагменты антител с высокой аффинностью к мишени, важно провести картирование эпитопов, то есть определение того, с каким участком мишени связываются антитела-кандидаты. Кандидаты, связывающиеся с разными участками мишени, лучше подходят для дальнейшего тестирования, так как в случае неудачи одного из кандидатов больше шансов, что другой кандидат будет успешен [42].
Экспериментальное картирование, например, с помощью мутагенеза или рентгено-структурного анализа — долгий и трудоемкий процесс, который не подходит для анализа кандидатов на начальном этапе. Поэтому прибегают к картированию эпитопов in silico — то есть компьютерному расчету эпитопов исходя из аминокислотной последовательности мишени, антиген-связывающего фрагмента антитела и сведений, содержащихся в базах данных эпитопов [43]. Алгоритмы на основе машинного обучения и больших баз данных белковых последовательностей и трехмерных моделей способны предсказывать как линейные, так и конформационные эпитопы. Точность таких предсказаний не стопроцентна, но для грубого отбора фрагментов-кандидатов она вполне достаточна.
Методы in silico применяют и на других стадиях разработки антител. Так, для поиска аминокислотных остатков, предположительно обусловливающих агрегацию антител, используют метод SAP (spatial aggregation propensity — пространственную склонность к агрегации). По этой технологии каждой аминокислоте в антителе присваивается величина SAP в зависимости от ее гидрофобности, степени доступности на поверхности, вкладов гидрофобных взаимодействий с другими аминокислотами в пределах заданного радиуса. Затем для антитела строится цветовая карта, из которой сразу видно, какие области молекулы отвечают за агрегацию. Экспериментально показано, что замена аминокислот в таких участках на более гидрофильные позволяет снизить агрегацию белка и тем самым улучшить его фармакологические свойства [44].
Для разработки стратегии гуманизации антитела также используют методы in silico. При вставке мышиной вариабельной последовательности в человеческий каркас аффинность антитела к антигену может быть снижена. В этом случае применяют «обратное» введение мутаций, отвечающих за более сильное связывание с антигеном. Такие мутации, в частности, можно выбирать путем статистического анализа последовательностей известных комплексов антитело—антиген [45].
Методы молекулярного моделирования с использованием расчета свободной энергии связывания антител с антигенами иногда используют на этапе созревания аффинности для поиска мутаций, обеспечивающих более высокую аффинность [46]. Эти методы предполагают применение энергетических функций, отражающих взаимодействия атомов антигена и антитела между собой. Такие функции могут быть или основаны на физических параметрах взаимодействия атомов, или рассчитаны исходя из статистических данных — как правило, извлеченных из трехмерных структур комплексов антиген—антитело [47]. Однако из-за сложности объекта моделирования и неизбежности многих допущений успехи в этой области пока не так велики, как хотелось бы.
Производство антител
Итак, мы получили генетическую конструкцию, кодирующую антитело с нужными нам свойствами, ввели ее в клетку-продуцент, получили в лаборатории нужные антитела и охарактеризовали их. Что же дальше? Теперь необходимо масштабировать производство и очистку антитела, чтобы получить его в достаточных количествах для последующих исследований, а потом, если все пойдет хорошо, и для продажи. Причем если в случае лабораторных процессов исследователи сами следят за их качеством, то как только лекарственный препарат доходит до стадии исследования токсичности на животных, он попадает под действие законодательства: регуляторные органы (FDA в США, Минздрав в РФ, EMA — Европейское медицинское агентство — в Евросоюзе и т. д.) принимают только такие исследования, которые соответствуют строгому набору правил. В частности, препарат должен быть произведен в соответствии с правилами GMP — Good manufacturing practice («Надлежащей производственной практики»). GMP регламентирует все аспекты производства, начиная от требований к устройству помещений и заканчивая контролем качества продукции. Регулятор имеет право в любой момент проверить соблюдение правил GMP производителем лекарства.
При производстве антител разработчики должны учитывать следующие критерии:
- качество получаемого продукта;
- себестоимость производства;
- время и сложность постановки процесса.
Более подробно об устройстве процесса производства рекомбинантных белков можно прочесть в статье на «Биомолекуле», посвященной Опытному биотехнологическому производству ИБХ [48].
Получение клона-продуцента
Для получения стабильного клона-продуцента антител разработчикам нужно добиться правильного встраивания вектора в геном клетки, модифицировать, если необходимо, аппарат трансляции и посттрансляционных модификаций (про модуляцию гликозилирования см. раздел «Гликозилирование»), добиться высокой жизнеспособности продуцента. В клетках CHO с этой целью снижали экспрессию про-апоптотических факторов и повышали экспрессию анти-апоптотических (например Bcl-2). Трансляцию белка увеличивали, сверхэкспрессируя шапероны, чтобы защитить клетку от апоптоза под воздействием стресса и обеспечить более правильное сворачивание антител [25]. Кроме того, в геном клетки-продуцента вносят модификации, обеспечивающие желаемый профиль гликозилирования.
После создания клеточной линии начинается подбор и оптимизация процесса культивирования, сначала в 96-луночных планшетах, затем в колбах и настольных биореакторах объемом 1–5 л. В результате скрининга сотен и тысяч клонов выбирают клон-продуцент с наилучшими характеристиками и переходят к пилотному культивированию в реакторах объемом 10–25 л, а затем масштабируют процесс до бóльших размеров (рис. 11) [49].
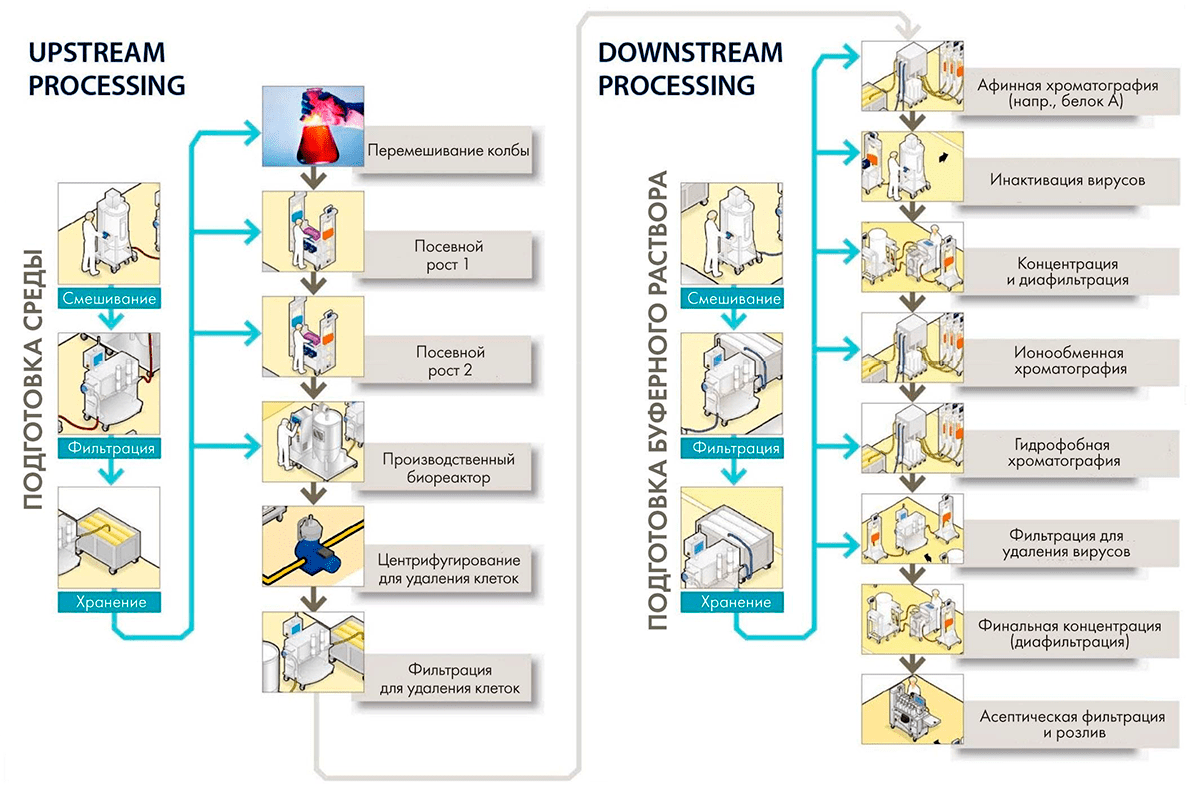
Рисунок 11. Производство антител и других рекомбинантных белков делится на две большие стадии: upstream process (USP), включающий все стадии от размораживания пробирки с клоном-продуцентом до сбора среды культивирования, и downstream process (DSP) — процесс выделения и очистки продукта.
Культивирование
Обычно клетки, производящие антитела, культивируют в биореакторах-ферментёрах объемом от 100 до 25 000 л (рис. 12). Традиционным способом культивирования являются процессы batch и fed-batch. В первом случае все компоненты среды и клон-продуцент загружают в реактор на несколько дней, после чего собирают культуральную среду для выделения белка. Во втором случае в среду периодически добавляют питательные вещества.
Важнейшим фактором обеспечения высоких выходов белка является культуральная среда. Причем прогресс в этой области продолжается, и если в 1990-х годах выходы составляли 0,1 г/л, в 2007 — до 5 г/л, то сейчас удается достигать 10 и более г/л. Такие успехи стали возможны благодаря переходу от сред, содержащих сыворотку животных к бессывороточным: сначала использовались гидролизаты белков, а сейчас — полностью химические среды с четко определенным составом. Дело в том, что вариабельность состава ухудшает параметры культивирования. Также оказалось плодотворным изменение состава среды в зависимости от стадии культивирования: применяются разные среды в фазе роста и в фазе накопления продукта.
Для повышения продуктивности применяют также тонкую настройку параметров среды с обратной связью: температуры, рН, солевого состава, уровней O2 и CO2, что позволяет добиться снижения концентрации токсичных побочных продуктов (молочной кислоты, аммиака) и более плавного расхода питательных веществ.
В настоящее время наблюдается тенденция к переходу на непрерывные процессы: на так называемое перфузионное культивирование, при котором свежая среда непрерывно добавляется к клеточной культуре, а продукт удаляется из нее. Такой подход лучше автоматизируется, дает продукт более высокого качества и с увеличенными выходами. Также разработчики переходят от стальных биореакторов к одноразовым контейнерам, так как у последних есть ряд преимуществ:
- они поставляются чистыми и стерильными, их не нужно готовить к работе;
- по этой же причине проще валидировать процесс производства;
- они обладают большей гибкостью в случае необходимости изменения параметров процесса;
- их не нужно долго вводить в эксплуатацию и очищать в случае контаминации [49].
Выделение и очистка антител
Антитела секретируются клетками-продуцентами в окружающую среду, и для получения чистого препарата требуется многоступенчатый процесс отделения антитела от всех ненужных и потенциально опасных примесей (рис. 11). Основными стадиями здесь являются различные виды хроматографии [50], диафильтрация и инактивация вирусов. Одна из особенностей очистки антител по сравнению с другими белками — использование хроматографии с белком А. Это белок клеточной стенки золотистого стафилококка, который сильно и селективно связывается с антителами при нормальном рН и слабо — при пониженном. Благодаря высоким выходам и чистоте получающегося продукта это предпочтительный метод на первом этапе очистки антител.
Важнейшим требованием и на стадии производства, и на стадии очистки антитела является постоянство состава продукта. Поскольку антитело — сложный объект и производится в биологической системе (в клетках), молекулы получаются не одинаковые, а с вариациями (рис. 13). Цель разработки процесса производства и очистки — добиться того, чтобы эти вариации не влияли на фармакологические характеристики продукта, его стабильность, и не слишком менялись от одной партии продукта к другой. Для этого проводится валидация процесса производства — экспериментальное подтверждение того, что процесс обеспечивает получение продукта с надлежащими характеристиками.
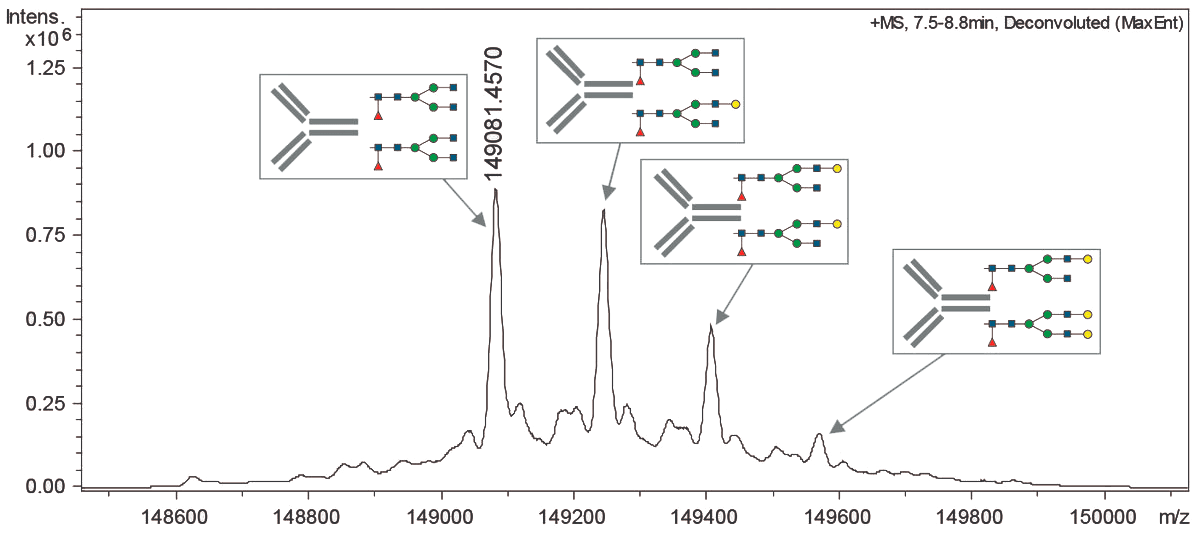
Рисунок 13. Профиль гликозилирования определяют методом масс-спектрометрии. На этом спектре видна типичная картина гетерогенности препарата антитела.
На некоторых промежуточных и на финальном этапе состав продукта контролируют аналитическими методами. Обязательно следят за:
- бактериальными эндотоксинами;
- белком А;
- наличием вирусов;
- белками и ДНК продуцента, остатками культуры (антибиотиками, сывороткой и пр.), остатками даунстрим-процессинга (ферментами; реагентами — цианогенбромидом, гуанидином и пр.; неорганическими солями, растворителями, носителями, лигандами и пр.).
- физико-химическими свойствами (углеводным составом, дисульфидными мостиками, вариабельностью N- и С-концевых остатков, четвертичной структурой);
- наличием изоформ, коэффициентом экстинкции, электрофоретическим, хроматографическим, спектроскопическим профилями, мультимерами и агрегатами, гетерогенностью заряда молекулы [25].
Часть этих показателей входит в спецификацию на субстанцию, из которой затем получают лекарственный препарат.
Методы производства антител все время совершенствуются: за 40 с лишним лет, прошедших с момента вывода первого антитела на рынок, изменилось многое — антитела научились гуманизировать, разработали способы их искусственного получения, усовершенствовали методы изучения аффинности и других свойств, достигли огромного прогресса в производстве и очистке, который позволил снизить себестоимость антител ниже $500 за 1 г [51]. Несмотря на все эти успехи, существует потребность в более быстрой и точной разработке антител против заданной мишени. В идеале было бы как можно больше операций проводить in silico, чтобы не тратить время и деньги на эксперименты, но пока у нас недостаточно знаний и мощностей для моделирования, например, фармакокинетики и фармакодинамики антител.
Тем не менее описанные в этой статье технологии уже позволили создать десятки лекарственных препаратов, которые помогают миллионам людей — о чем подробно будет рассказано в следующей статье цикла.
Литература
- Краткая история открытия и применения антител;
- Антитело: лучший способ распознать чужого;
- Masato Kiyoshi, Jose M. M. Caaveiro, Eri Miura, Satoru Nagatoishi, Makoto Nakakido, et. al.. (2014). Affinity Improvement of a Therapeutic Antibody by Structure-Based Computational Design: Generation of Electrostatic Interactions in the Transition State Stabilizes the Antibody-Antigen Complex. PLoS ONE. 9, e87099;
- 12 методов в картинках: клеточные технологии;
- 12 методов в картинках: «сухая» биология;
- Вычислительное будущее биологии;
- Я б в биоинформатики пошёл, пусть меня научат!;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств;
- Моноклональные антитела;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: иммунологические технологии;
- Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека;
- Ревматоидный артрит: изменить состав суставов;
- William J. J. Finlay, Juan C. Almagro. (2012). Natural and man-made V-gene repertoires for antibody discovery. Front. Immun.. 3;
- Sachdev S Sidhu, Frederic A Fellouse. (2006). Synthetic therapeutic antibodies. Nat Chem Biol. 2, 682-688;
- 12 методов в картинках: полимеразная цепная реакция;
- Patrick J. Kennedy, Carla Oliveira, Pedro L. Granja, Bruno Sarmento. (2018). Monoclonal antibodies: technologies for early discovery and engineering. Critical Reviews in Biotechnology. 38, 394-408;
- Sachdev S. Sidhu. (2001). Engineering M13 for phage display. Biomolecular Engineering. 18, 57-63;
- Hennie R Hoogenboom. (2005). Selecting and screening recombinant antibody libraries. Nat Biotechnol. 23, 1105-1116;
- Andrew E Nixon, Daniel J Sexton, Robert C Ladner. (2014). Drugs derived from phage display. mAbs. 6, 73-85;
- Johan Rockberg, Jochen M. Schwenk, Mathias Uhlén. (2009). Discovery of epitopes for targeting the human epidermal growth factor receptor 2 (HER2 ) with antibodies. Molecular Oncology. 3, 238-247;
- Wenyan Fu, Yuxiao Wang, Yunshan Zhang, Lijuan Xiong, Hiroaki Takeda, et. al.. (2014). Insights into HER2 signaling from step-by-step optimization of anti-HER2 antibodies. mAbs. 6, 978-990;
- Jasdeep K. Mann, Jordan F. Wood, Anne Fleur Stephan, Emmanuel S. Tzanakakis, Denise M. Ferkey, Sheldon Park. (2013). Epitope-Guided Engineering of Monobody Binders for in Vivo Inhibition of Erk-2 Signaling. ACS Chem. Biol.. 8, 608-616;
- Renate Kunert, David Reinhart. (2016). Advances in recombinant antibody manufacturing. Appl Microbiol Biotechnol. 100, 3451-3461;
- Juan C. Almagro, Tracy R. Daniels-Wells, Sonia Mayra Perez-Tapia, Manuel L. Penichet. (2018). Progress and Challenges in the Design and Clinical Development of Antibodies for Cancer Therapy. Front. Immunol.. 8;
- Важнейшие методы молекулярной биологии и генной инженерии;
- David M. Knight, Han Trinh, Junming Le, Scott Siegel, David Shealy, et. al.. (1993). Construction and initial characterization of a mouse-human chimeric anti-TNF antibody. Molecular Immunology. 30, 1443-1453;
- Рассеянный склероз: иммунная система против мозга;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Nils Lonberg, Lisa D. Taylor, Fiona A. Harding, Mary Trounstine, Kay M. Higgins, et. al.. (1994). Antigen-specific human antibodies from mice comprising four distinct genetic modifications. Nature. 368, 856-859;
- 12 методов в картинках: проточная цитофлуориметрия;
- Christiane Querfeld, Samantha Leung, Patricia L. Myskowski, Shane A. Curran, Debra A. Goldman, et. al.. (2018). Primary T Cells from Cutaneous T-cell Lymphoma Skin Explants Display an Exhausted Immune Checkpoint Profile. Cancer Immunol Res;
- Paul W. H. I. Parren, Paul J. Carter, Andreas Plückthun. (2017). Changes to International Nonproprietary Names for antibody therapeutics 2017 and beyond: of mice, men and more. mAbs. 9, 898-906;
- Aaron S. Miller, Max L. Tejada, Hélène Gazzano-Santoro. (2014). Methods for Measuring Antibody-Dependent Cell-Mediated Cytotoxicity In Vitro. Methods in Molecular Biology. 59-65;
- Yao-Yun Fan, Lindsay B. Avery, Mengmeng Wang, Denise M. O'Hara, Sheldon Leung, Hendrik Neubert. (2016). Tissue expression profile of human neonatal Fc receptor (FcRn) in Tg32 transgenic mice. mAbs. 8, 848-853;
- Setsuko Hashimoto. (2000). Principles of BIACORE. Real-Time Analysis of Biomolecular Interactions. 23-30;
- Kinetic exclusion assay theory. Sapidyne Instruments;
- Robert C. Blake, Andrey R. Pavlov, Diane A. Blake. (1999). Automated Kinetic Exclusion Assays to Quantify Protein Binding Interactions in Homogeneous Solution. Analytical Biochemistry. 272, 123-134;
- Diane R. Mould, Bernd Meibohm. (2016). Drug Development of Therapeutic Monoclonal Antibodies. BioDrugs. 30, 275-293;
- Yen Phung, Wei Gao, Yan-Gao Man, Satoshi Nagata, Mitchell Ho. (2012). High-affinity monoclonal antibodies to cell surface tumor antigen glypican-3 generated through a combination of peptide immunization and flow cytometry screening. mAbs. 4, 592-599;
- Robert C. Ladner. (2007). Mapping the Epitopes of Antibodies. Biotechnology and Genetic Engineering Reviews. 24, 1-30;
- Lenka Potocnakova, Mangesh Bhide, Lucia Borszekova Pulzova. (2016). An Introduction to B-Cell Epitope Mapping and In Silico Epitope Prediction. Journal of Immunology Research. 2016, 1-11;
- Vladimir Voynov, Naresh Chennamsetty, Veysel Kayser, Bernhard Helk, Bernhardt L. Trout. (2009). Predictive tools for stabilization of therapeutic proteins. mAbs. 1, 580-582;
- Pier Paolo Olimpieri, Paolo Marcatili, Anna Tramontano. (2015). Tabhu: tools for antibody humanization. Bioinformatics. 31, 434-435;
- Shaun M. Lippow, Bruce Tidor. (2007). Progress in computational protein design. Current Opinion in Biotechnology. 18, 305-311;
- Shaun M Lippow, K Dane Wittrup, Bruce Tidor. (2007). Computational design of antibody-affinity improvement beyond in vivo maturation. Nat Biotechnol. 25, 1171-1176;
- Основоположники отечественной биофармацевтики: опытное биотехнологическое производство ИБХ;
- Feng Li, Natarajan Vijayasankaran, Amy (Yijuan) Shen, Robert Kiss, Ashraf Amanullah. (2010). Cell culture processes for monoclonal antibody production. mAbs. 2, 466-479;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Wood J.S. (2013). Characterization of the N-glycosylation pattern of antibodies by complementary use of ESI and MALDI mass spectrometry. Laboratory Equipment;
- In vivo — in vitro — in silico;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- Azam Rahimpour, Hadi Bayat, Meysam Omidi, Morvarid Peyrovan, Omid Mohammadian, Fatemeh Naderi. (2016). Stable Expression of Anti-CD52 Monoclonal Antibody Using a Bicistronic Vector System. Biol Med (Aligarh). 08;
- Jiandong Li, Christian Menzel, Doris Meier, Congcong Zhang, Stefan Dübel, Thomas Jostock. (2007). A comparative study of different vector designs for the mammalian expression of recombinant IgG antibodies. Journal of Immunological Methods. 318, 113-124;
- Peter T. Jones, Paul H. Dear, Jefferson Foote, Michael S. Neuberger, Greg Winter. (1986). Replacing the complementarity-determining regions in a human antibody with those from a mouse. Nature. 321, 522-525;
- Alexandra Epp, Kathryn C. Sullivan, Andrew B. Herr, Richard T. Strait. (2016). Immunoglobulin Glycosylation Effects in Allergy and Immunity. Curr Allergy Asthma Rep. 16;
- Derry C. Roopenian, Shreeram Akilesh. (2007). FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol. 7, 715-725.