Что такое ДНК-вакцины и с чем их едят?
09 апреля 2015
Что такое ДНК-вакцины и с чем их едят?
- 13520
- 0
- 11
Новое поколение вакцин: революция в традиционном флаконе..
Рисунок в полном размере.
-
Автор
-
Редактор
ДНК-вакцины относятся к типу принципиально новых биологических препаратов. С их разработкой связывают большие надежды на повышение эффективности профилактики не только заболеваний бактериальной, вирусной и паразитарной природы, но и аллергических, аутоиммунных и даже онкологических болезней. Более двадцати лет назад возникла идея использовать гены возбудителей заболеваний для активации защитных механизмов. Конструкция ДНК-вакцин гениально проста: главные компоненты в ней — вектор и целевой иммуноген. Но, несмотря на это, ДНК-вакцины не стоят на страже нашего здоровья: их не вводят пациентам в поликлиниках, они не продаются в аптеках...
Более сотни лет прошло с введения Л. Пастером термина «вакцина» (лат. vacca — корова) и более двух сотен — с легендарных экспериментов Э. Дженнера по прививанию коровьей оспы ребенку с целью предупреждения развития опасного человеческого варианта болезни. Принцип защитного действия введенных в организм ослабленных инфекционных агентов или их частей научным языком объяснили уже в XX веке: безопасный чужеродный антиген учит иммунную систему в дальнейшем быстро распознавать и уничтожать активного и опасного возбудителя с точно такими же антигенами . Процесс часто сравнивают с раздачей фоторобота преступника сотрудникам полиции.
Хронологию разработки вакцин, информацию о влиянии вакцинации на характер эпидемий и численность человечества, доводы адептов движения антивакцинации и ответы на множество животрепещущих вопросов относительно целесообразности, пользы и вреда прививок можно найти в статье «Вакцины в вопросах и ответах» [1]. — Ред.
За 200 лет форма и содержание прививок претерпели существенные изменения: Дженнер инфицировал царапины содержимым оспинных пустул, Пастер облагородил процедуру, вводя ослабленных агентов шприцем, затем научились создавать вакцины из убитых и даже растерзанных возбудителей (сплит- и субъединичные вакцины), недавно начали использовать рекомбинантные вакцины, содержащие один или несколько антигенов (обычно белковых), синтезированных генно-инженерным путем. И вот в двери ВОЗ робко стучится новый плод, порожденный слиянием науки с фарминдустрией, — вакцина из нуклеиновых кислот [2].
Начало ДНК-вакцинологии связывают с работами Д. Танга (1992 г.), в которых была показана способность плазмидной ДНК, экспрессирующей гормон роста человека, индуцировать выработку антител.
В классическом варианте такие вакцины состоят из плазмидных ДНК, содержащих гены возбудителей инфекционных заболеваний (целевые гены, или иммуногены). Продукты данных генов способны вызывать развитие защитных реакций организма, выступая в этом случае в роли антигенов. Доставку ДНК в макроорганизм первоначально осуществляли в комплексе с катионными липидами, однако эффект от введения препарата чистой нуклеиновой кислоты оказался более выраженным. Введенная в организм ДНК проникает в клеточное ядро, превращая клетку в завод по производству вакцины. Такая ДНК длительное время существует вне хромосом без репликации, транскрибируется за счет ферментов хозяйской клетки и экспрессирует соответствующие гены, продукты которых вызывают формирование иммунитета (рис. 1).
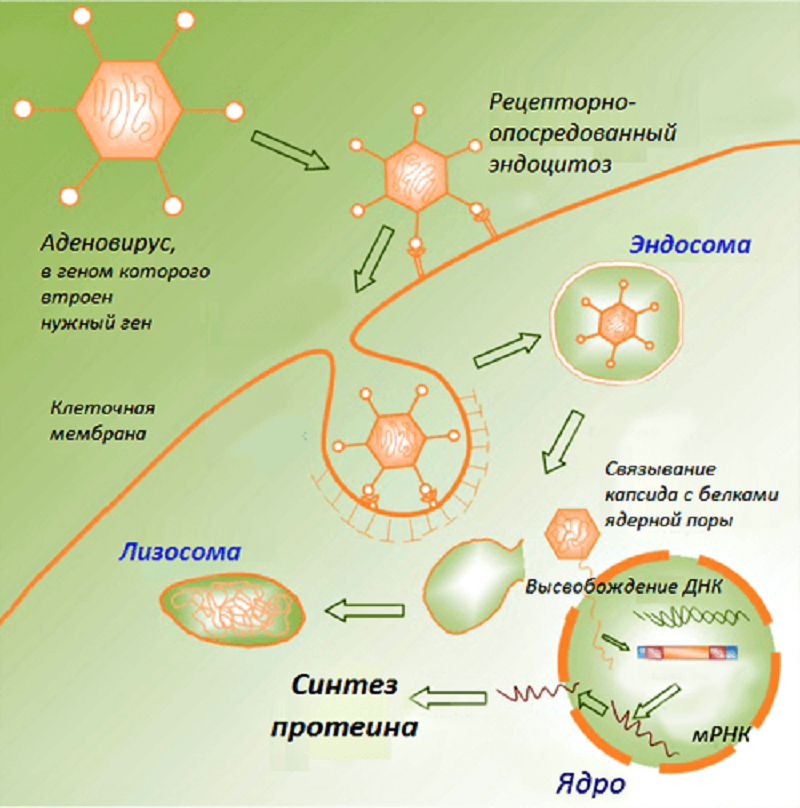
Рисунок 1. Схематическое изображение процессов в клетке после проникновения ДНК-вакцины.
рисунок из «Википедии»
ДНК-вакцины сохраняются в организме 3–4 недели. За это время они успевают индуцировать Т- и В-клеточный иммунитет (рис. 2). Однако, несмотря на кажущуюся простоту, многие механизмы развития иммунного ответа на ДНК-вакцины остаются малоизученными [3].
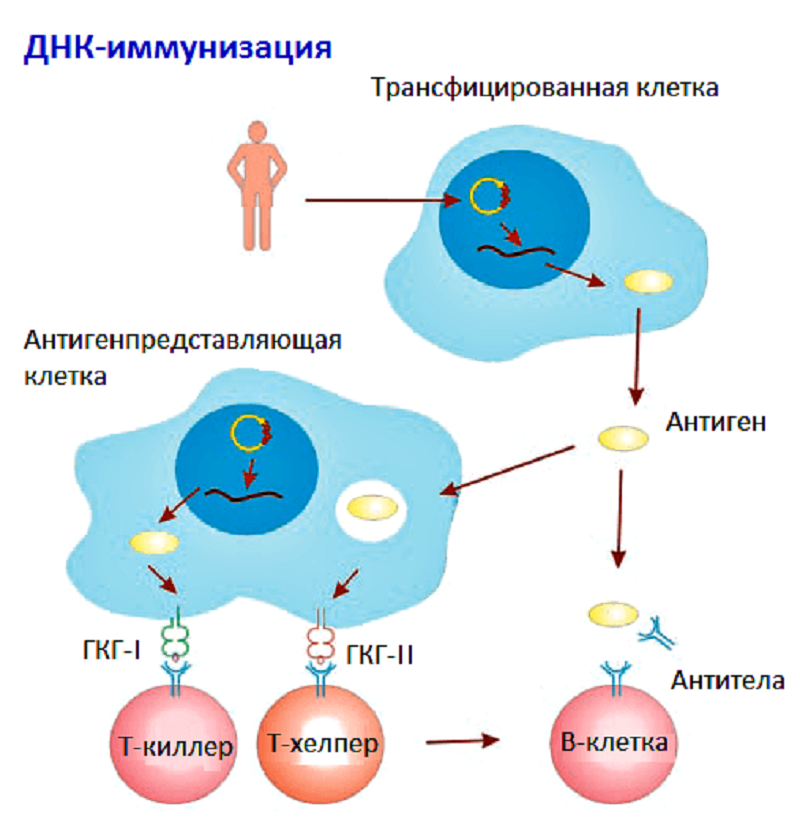
Рисунок 2. Схема развития иммунного ответа на ДНК-вакцину.
рисунок из «Википедии»
Более чем 20-летняя эволюция ДНК-вакцин продолжается и сегодня. Прогресс в дизайне кодирующих антигены нуклеотидных последовательностей, в оптимизации состава (в том числе включение молекулярных адъювантов), в совершенствовании форм и физических методов доставки позволил второму поколению ДНК-вакцин преодолеть такие проблемы первого поколения, как низкий уровень трансфекции и недостаточная иммуногенность.
Сейчас разработки в области генетических вакцин проводятся во многих странах мира. В настоящее время сконструированы экспериментальные ДНК-вакцины для профилактики инфекционных заболеваний паразитарной (шистосомоз, лейшманиоз), бактериальной (хламидиоз, сибирская язва, микоплазмозы) и вирусной (бешенство, лихорадки Западного Нила и Эбола) природы. На разных стадиях доклинических и клинических испытаний находятся генетические вакцины против вирусов гриппа, гепатитов А и В, герпеса, кори, геморрагических лихорадок, ВИЧ, собачьей чумы, ящура, папилломавирусов, цитомегаловирусов. Столь интенсивное развитие данного направления вакцинологии, вероятно, уже в ближайшей перспективе обеспечит реальный выход в виде эффективных и безопасных вакцинных препаратов, рекомендованных для применения в здравоохранении и ветеринарии.
Чем же ДНК-вакцины хороши?
- индуцируют гуморальный (образование антител) и клеточный (активация цитотоксических Т-лимфоцитов) иммунные ответы;
- активируют систему интерферонов;
- могут избирательно воздействовать на различные субпопуляции лимфоцитов. Принципиально возможна разработка ДНК-вакцин, которые избирательно активируют разные типы Т-хелперных лимфоцитов. Благодаря этому могут быть созданы генные вакцины для лечения лиц с аутоиммунными или аллергическими заболеваниями, патогенез которых связан с нарушением различных звеньев иммунной регуляции;
- способствуют формированию длительного иммунитета;
- отсутствует присущий живым вакцинам риск реверсии вирулентности;
- могут производить одновременно несколько антигенов;
- обладают широкими возможностями модификации (сайт-специфический мутагенез, включение различных регуляторных последовательностей);
- отличаются высокой стабильностью. Они способны выдерживать низкие и высокие температуры (немногим ниже температуры кипения воды) и разные условия влажности. Поэтому ДНК-вакцины не требуют организации «холодовых цепочек» (комплекса мероприятий, обеспечивающих хранение вакцин в холодильных установках на всем пути от места производства до конечного потребителя). Таким образом, стоимость транспортировки и хранения ДНК-вакцин значительно ниже.
Но... всё хорошее имеет свои недостатки
- более низкая по сравнению с живыми вакцинами эффективность, особенно по отношению к крупным млекопитающим и человеку, и потому необходимость многократной иммунизации;
- отсутствие эффективной доставки в антигенпрезентирующие клетки;
- формирование иммунитета только в отношении протеиновых компонентов болезнетворных микроорганизмов, поскольку целевые гены кодируют белки. ДНК-вакцины не могут заменить препараты, действие которых основано на использовании антигенных молекул другой природы, например капсульных антигенов, представленных полисахаридами (полисахаридные пневмококковые, менингококковые, брюшнотифозные вакцины и др.);
- вероятность атипического процессинга и биохимических изменений (например, гликозилирования) антигенов в эукариотических клетках;
- возможность ослабления иммунного ответа на целевой антиген из-за иммуногенности вирусных компонентов (при использовании вирусных систем доставки);
- отсутствие данных о безопасности таких вакцин, т.к. не изучены последствия, к которым приводит длительная экспрессия в макроорганизме чужеродной генетической информации;
- возможность развития нежелательных иммунологических реакций в виде хронических воспалительных процессов или генерализованной иммуносупрессии из-за пролонгированной экспрессии антигена в макроорганизме.
Конструкция ДНК-вакцин
Для получения ДНК-вакцин ген, кодирующий продукцию иммуногенного белка, необходимо встроить в вектор, роль которого выполняют бактериальная плазмида или вирус [4]. Вектор не должен реплицироваться в клетках макроорганизма, поэтому может содержать только прокариотические сайты инициации репликации.
Элементы конструктора
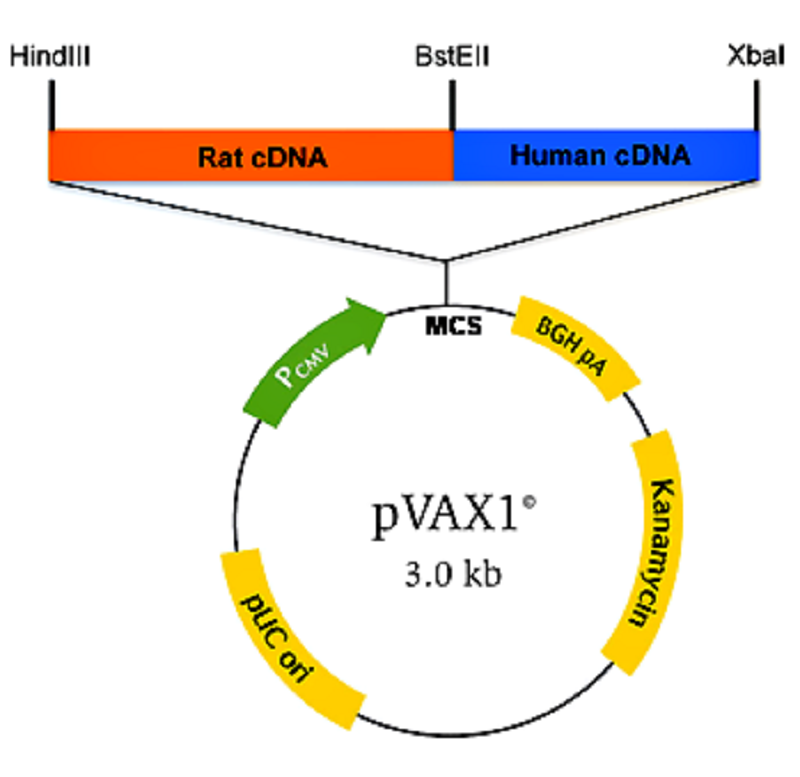
Рисунок 3. Конструкция ДНК-вакцины на основе вектора pVAX1 с химерным геном (Rat cDNA, Human cDNA). Pcmv — цитомегаловирусный промотор; MCS — сайт для множественного клонирования генов; BGH pA — терминатор с сигналом полиаденилирования гена гормона роста быка; Kanamycin — ген устойчивости к канамицину; pUC ori — участок начала репликации плазмид группы pUC; HindIII, BstEII, XbaI — сайты рестрикции.
Чтобы пригодиться для создания ДНК-вакцин, каждый уважающий себя вектор должен содержать необходимые конструкционные элементы (рис. 3).
- Структуры, обеспечивающие репликацию плазмиды (используются ori pUC19, pMB1), и сайты рестрикции.
- Селективные маркеры: гены устойчивости к антибиотикам (но не к пенициллину и другим β-лактамным антибиотикам) [5].
- СpG-мотивы бактерий, которые из-за отсутствия метилирования способны усиливать иммунную реакцию. Данный принцип лежит в основе разработки универсальной вакцины и подразумевает использование не генов, кодирующих белки-антигены микробов, а бактериальных последовательностей CG в качестве активного компонента вакцины [7].
- Последовательность Козак — консенсусная последовательность, окружающая старт-кодон (GCC(A/G)CCAUGG), которая играет важную роль в инициации трансляции у эукариот.
- Промотор для экспрессии целевого гена в клетках эукариот. Наиболее часто используют промоторы вируса SV40, цитомегаловируса (часто вместе с интроном А), промотор бета-актина, промоторы, специфичные для определенных видов ткани (например, промотор гена десмина для экспрессии в миоцитах, промотор гена гидроксилазы витамина D3 — в кератиноцитах, альбуминовый — в гепатоцитах). Применение промотора и системы синтеза бактериофага Т7 позволяет осуществлять экспрессию целевого гена без участия транскрипционной системы клеток макроорганизма и, соответственно, без перемещения вектора в ядро [8].
- Целевой ген, кодирующий белок патогена. Он также может содержать дополнительные нуклеотидные последовательности, кодирующие лиганды для рецепторов антигенпредставляющих клеток. Такими последовательностями могут выступать гены маркерного белка CD40, внеклеточного домена Fms-подобной тирозинкиназы-3 или антигена-4 Т-киллеров. Облегчение деградации антигена в протеасоме или лизосоме также будет стимулировать иммунную реакцию. Поэтому для усиления протеолитического расщепления антигена в его последовательность встраивают сигнал убиквитинирования [9], [10].
- После целевого гена следуют сигналы полиаденилирования, например, вируса SV40, гена β-глобина кролика или гормона роста быка.
- Замыкают эту цепочку стоп-кодоны, причем часто используются двойные или тройные терминирующие последовательности (TAGTGATGA).
Службы доставки
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.
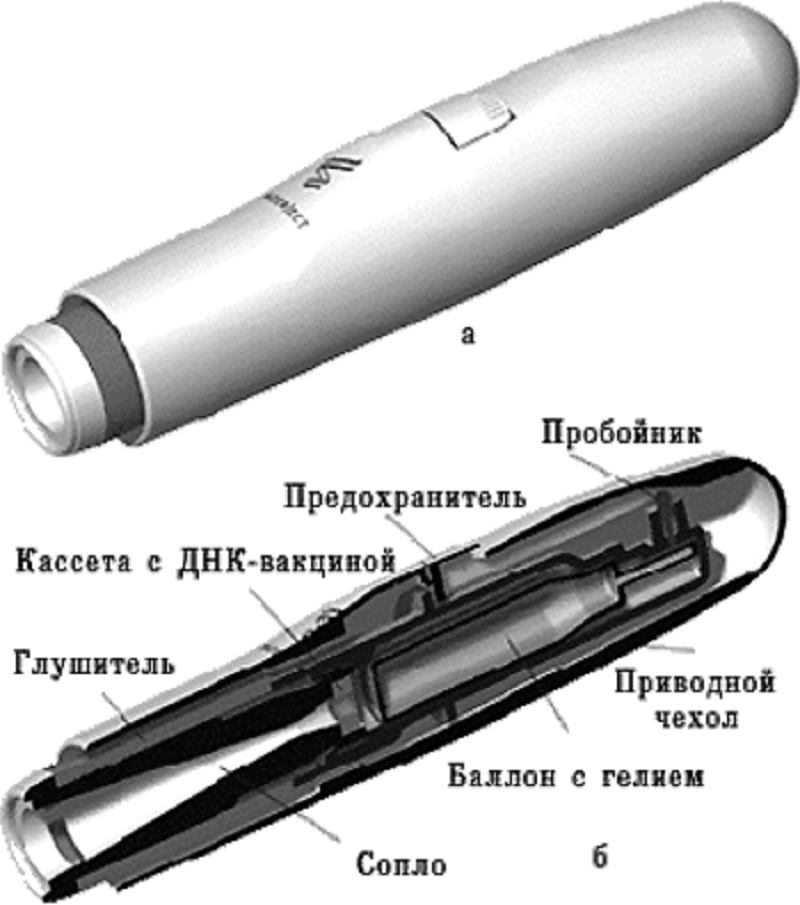
Рисунок 4. Одноразовый генный пистолет компании PowderJect. а — внешний вид; б — в разрезе.
рисунок с сайта www.apteka.ua
Самый простой — это парентеральный способ введения, который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
Использование генного пистолета. Для этого ДНК фиксируют на микроскопических золотых гранулах (около 1–2 мкм), а затем с помощью устройства, приводимого в действие сжатым гелием, гранулы «выстреливают» непосредственно внутрь клеток (рис. 4). Для данного способа доставки требуется значительно меньшее количество вводимого материала, чем для внутримышечной инъекции. Так, для инъекции мышам нужно 10-100 мкг препарата, а с использованием генного пистолета достаточно 0,1-1 мкг.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов. Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей. Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd. Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены [6]. Для перорального введения создан вектор на основе ослабленного штамма Salmonella, который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella, заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели [11].
Была предложена оригинальная система доставки ДНК с помощью «теней» — неживых клеток грамотрицательных бактерий, лишенных цитоплазматического содержимого, но сохраняющих морфологию и антигенные структуры, включая адгезивные факторы. «Тени» обладают тропностью к антигенпрезентирующим клеткам макроорганизма и адъювантными свойствами, усиливающими иммунный ответ. Кроме того, в лиофильно-высушенном состоянии препараты «теней» хранятся при комнатной температуре неопределенно долгое время, а их производство дешево [6].
Разработана технология доставки ДНК-вакцин с использованием бактериофагов [12]. В данном случае вакцинная ДНК встраивается в геном вектора-бактериофага, которым затем иммунизируют макроорганизм [13].
Нужно учитывать, что разные методы доставки ДНК-вакцин в организм обеспечивают развитие различных клеточных реакций, при этом важные иммунологические пути могут быть стимулированы или, наоборот, не задействованы в ходе развития защитного ответа. Способы и места введения ДНК-вакцин варьируют для разных видов организмов. Например, уши свиньи — отличное место для инъекций, а вот введение препарата в уши овец или коров неэффективно.
Помощники генетических вакцин
Для усиления иммунного ответа, вызванного ДНК-вакцинами, совместно с ними вводят различные адъюванты, например, плазмиды, кодирующие синтез цитокинов, гранулоцитарно-макрофагального колониестимулирующего фактора и других костимуляторных молекул (B7.1 (CD80), B7.2 (CD86) и CD40) [14].
Для ДНК-вакцины против ВИЧ создана конструкция, которая обеспечивает получение более высокого титра антител и его сохранность в течение более длительного времени по сравнению с обычной ДНК-вакциной. Эта молекулярная вирусоподобная конструкция представляет собой частицы диаметром 25-30 нм, содержащие в центре полинуклеотидный комплекс — рекомбинантную плазмиду pGEX-2T-TBI с генами инфекционного агента ВИЧ-1 или двухцепочечную РНК, которая является стимулятором неспецифической резистентности организма. На поверхности конструкции располагаются гибридные белки, содержащие эпитопы ВИЧ-1 и фермент (например, глутатион-S-трансферазу или галактозидазу). Связь между полинуклеотидным комплексом и гибридными белками осуществляется посредством конъюгата: спермидин (для связи конъюгата с полинуклеотидным комплексом) — полиглюкин — субстрат для фермента (например, глутатион или галактопиранозид; для аффинной сорбции гибридных белков на конструкцию).
Современное состояние ДНК-вакцинологии
В настоящее время в разработке находится около 420 ДНК-вакцин против заболеваний различной этиологии как человека, так и животных.
Бόльшая часть разрабатываемых противоинфекционных терапевтических ДНК-вакцин нацелена на ВИЧ-1. Существенные успехи достигнуты в активной иммунизации против вируса папилломы человека. Некоторые вакцины находятся на стадии клинических испытаний и, возможно, в скором времени будут введены в обязательную практику. Так, американская компания Inovio, специализирующаяся на разработке ДНК-вакцин, создала препарат против цервикальной дисплазии VGX-3100, который проходит вторую фазу клинических испытаний. В 2013 г. VGX-3100 удостоилась награды «Лучшая терапевтическая вакцина» на Всемирном конгрессе по вакцинам. В I или IIа фазах клинических испытаний находятся: вакцины против гепатита С, цервикального рака, рака головы и шеи, СПИДа, гриппа. Компанией Inovio также ведется активная разработка вакцин против лихорадки Эбола и рака простаты.
О более привычном, но не менее перспективном методе борьбы с вирусом Эбола — с помощью «коктейля» из моноклональных антител — читайте в статье «Вирус Эбола и макак-резус: получено новое эффективное лекарство» [15]. — Ред.
Разработке способов вакцинотерапии онкологических заболеваний при помощи рекомбинантных ДНК большое внимание уделяют и другие организации. Хорошую эффективность показала ДНК-вакцина против лейкемии, созданная в Саутгемптонском университете (но вводимая с помощью электропоратора всё той же Inovio). Вакцина направлена на подавление в организме активности гена WT1 (Wilms tumor gene). Именно повышенная активность этого гена отмечается в опухолевых клетках различных видов. В ходе I фазы клинических испытаний у пациентов наблюдалось развитие иммунного ответа, в том числе активация Т-киллеров и выработка антител; была также доказана безопасность новой вакцины. Испытания перешли в фазу II, однако из-за проблем с финансированием организаторы пока не могут увеличить число участников [16].
Животные нуждаются в такой же защите, как и люди. В связи с этим для ветеринарии разрабатываются ДНК-вакцины против бычьего и лошадиного герпесвирусов, собачьего вируса чумы, вируса классической свиной лихорадки, кроличьей папилломы, ящура, вируса инфекционного гемопоэтического некроза, вируса гриппа, вируса японского энцефалита, вируса бешенства, вируса везикулярного стоматита и т.д. [13]. Много ДНК-вакцин создается для борьбы с вирусными, бактериальными и эукариотическими патогенами рыб [17].
Активно разрабатываются ДНК-вакцины для повышения иммунитета птиц. Многокомпонентные ДНК-вакцины могут сократить количество прививок, необходимых во время короткой жизни птиц и позволят избежать риска увеличения вирулентности некоторых патогенов. В случае птицеводства проблема связана с тем, что вакцины вводятся в амниотическую жидкость яиц, которая обладает ДНКазной активностью, поэтому свойства ДНК-вакцины могут ухудшиться. Заключение ДНК в катионные липосомы, скорее всего, поможет решить эту проблему.
Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, причем повезло в этом плане только животным (табл. 1).
Торговое название вакцины | Год лицензирования | Мишень | Животное | Продукт вакцины | Цель создания вакцины |
|---|---|---|---|---|---|
«Вэст Найл-Инноватор» (США) | 2005 | Вирус лихорадки Западного Нила | Лошади | Структурный белок вируса PreM-E | Защита против вируса |
«Апекс-ай-эйч-эн» (Канада) Apex-IHN | 2005 | Возбудитель инфекционного некроза гемопоэтической ткани (ИНГТ) | Рыбы семейства лососевые | Вирусный гликопротеин | Повышение количества и качества рыбной продукции |
«ЛайфТайд Эс-Даблъю 5» (Австралия) LifeTide® SW 5 | 2008 | Свиньи и другой домашний скот | Соматолиберин свиньи | Увеличение выводка у свиноматок; значительно уменьшает перинатальную смертность и заболеваемость | |
«Онцепт» (США) | 2006 | Собаки | Тирозиназа человека | Как альтернатива лучевой терапии и операционному вмешательству при лечении меланомы | |
(Бразилия) | 2001 | Пневмония | Исследована на мышах | Поверхностный адгезин А пневмококка | Борьба со Streptococcus pneumoniae |
West Nile Virus DNA Vaccine (США) USDA: 1995.D0 | Вирус лихорадки Западного Нила | Сейвал (сайдяной, или ивасёвый кит) | Структурный белок вируса | Защита от вируса |
Данные вакцины, одобренные Управлением по контролю над продуктами питания и лекарственными препаратами США (FDA), созданы на основе плазмид. Для первых трех из них рекомендованный производителем способ введения — внутримышечно, для вакцины «ЛайфТайд» — внутримышечная инъекция, совмещенная с электропорацией. Если остальные вакцины направлены на активацию иммунитета, то для препарата «ЛайфТайд» иммуностимулирующее действие является дополнительным. Продукт вакцины — соматолиберин — стимулирует высвобождение гипофизом гормона роста и пролактина. Их действие у свиней приводит к росту массы животных и увеличению численности выводка. Вместе с тем, введение плазмиды, которая кодирует соматолиберин, стимулирует выработку Т-лимфоцитов и естественных киллеров, следовательно, увеличивает иммунную сопротивляемость организма.
Процедура внедрения препаратов в ветеринарную практику проще, чем в клиническую человеческую, поэтому некоторые ДНК-вакцины уже применяются для иммунизации животных.
Рутинно используются вакцины для оральной иммунизации лисиц против бешенства. Рекомбинантные вакцины V-RG (Vaccinia Rabies Glyсoprotein — оспенный гликопротеин вируса бешенства) созданы путем введения в геном вируса оспы последовательности ДНК, кодирующей гликопротеин вируса бешенства. Вакцинация лисиц была начата в 2007 году, а к 2009 г. заболеваемость сократилась на 85% [19].
Созданы противоопухолевые препараты, которые продемонстрировали высокую эффективность на животных и применяются в ветеринарной практике. Для лечения меланомы у собак в ветеринарии США с 2007 года используется ДНК-вакцина «Онцепт» (рис. 5). Как показала практика, этот препарат излечивает от меланомы или существенно продлевает больным собакам жизнь [20].

Рисунок 5. Препарат ДНК-вакцины против меланомы собак.
Более новый препарат «Еленаген» (Elenagen) был разработан международным консорциумом под руководством компании CureLab Oncology (США). Хотя «Еленаген» является новым препаратом, с ним уже были проведены обширные исследования на различных опухолях мышей и крыс. Эти исследования с использованием сотен животных показали, что препарат подавляет рост саркомы, рака молочной железы, карциномы легких и меланомы, т.е. быстрорастущих и очень агрессивных опухолей. «Еленаген» не продемонстрировал токсического побочного действия. Более того, препарат оказался эффективным и в случае лимфосаркомы собак. В настоящее время начато исследование спектра противоопухолевого действия «Еленагена» у собак и кошек. В отличие от «Онцепта», который эффективен только при меланоме, вакцина «Еленаген» подавляет рост как меланомы, так и других злокачественных опухолей. За счет более разнопланового механизма действия новый препарат может оказывать дополнительное оздоровляющее и укрепляющее влияние на организм животного.
Таким образом, с помощью ДНК-вакцин можно сформировать устойчивый иммунитет против инфекционных агентов различной природы. Их разработкой уже более 20 лет занимаются в различных лабораториях мира, но, несмотря на это, такие вакцины практически не используются в клинической практике. Это связано с тем, что пока нет ответов на ряд вопросов, касающихся в первую очередь безопасности ДНК-вакцин. Хотя имеющиеся данные не дают оснований для особенного волнения: эти препараты не опаснее многих факторов, воздействию которых человек сознательно подвергает себя ежедневно. ДНК-вакцины вполне могут оказаться чудесным открытием, которое спасет многие жизни.
Литература
- Вакцины в вопросах и ответах;
- Википедия: «ДНК-вакцина»;
- Зверев В.В. (2006). Вакцинопрофилактика: прошлое, настоящее, будущее. Вестник биотехнологии. 2, 58–62;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Donna L. Montgomery, Kristala Jones Prather. (). Design of Plasmid DNA Constructs for Vaccines. DNA Vaccines. 11-22;
- Попов Ю.А., Микшис Н.И. (2010). Генетические (ДНК) вакцины. Проблемы особо опасных инфекций. 105, 20–24;
- Олишевский С.В., Козак В.В., Яниш Ю.В., Рыбалко С.Л., Шляховенко В.А. (2006). Иммуностимулирующая CpG-ДНК: перспективы клинического применения в онкологии. Онкология. 8, 209–217;
- J.J. Donnelly, J.B. Ulmer. (1999). DNA vaccines for viral diseases. Braz J Med Biol Res. 32, 215-222;
- Стародубова Е.С., Исагулянц М.Г., Карпов В.Л. (2010). Регуляция процессинга иммуногена: сигнальные последовательности и их использование для создания нового поколения ДНК-вакцин. Acta Naturae. 2, 59–65.;
- Вездесущий убиквитин;
- Wei Kong, Matthew Brovold, Brian A. Koeneman, Josephine Clark-Curtiss, Roy Curtiss. (2012). Turning self-destructing Salmonella into a universal DNA vaccine delivery platform. Proc. Natl. Acad. Sci. U.S.A.. 109, 19414-19419;
- Вирусы-платформы: яд во благо;
- M. A. Liu. (2003). DNA vaccines: a review. J Intern Med. 253, 402-410;
- «Мусорная» ДНК управляет эволюцией млекопитающих?;
- Вирус Эбола и макака резус: получено новое эффективное лекарство;
- DNA vaccine for leukemia. Сайт компании Inovio Pharmaceuticals;
- Kurath G. (2008). Biotechnology and DNA vaccines for aquatic animals. Rev. Sci. Tech. 27, 175–196;
- DNAVaxDB: DNA Vaccine (электронная база данных ДНК-вакцин);
- Горбачева П., Макаров В.В. (2010). Рекомбинантная антирабическая вакцина для оральной иммунизации лисиц. Ветеринарная патология. 2, 16–18;
- ONCEPT® Web Site (сайт препарата Oncept, Merial Ltd)..