CRISPR/Cas9 на службе у эмбриологов
15 августа 2018
CRISPR/Cas9 на службе у эмбриологов
- 1374
- 0
- 11
Последние несколько лет методы и технологии, основанные на системе CRISPR/Cas9, адаптируют для самых разных задач, в том числе и связанных не с биотехнологией и медициной, а с фундаментальной наукой. На этот раз CRISPR/Cas9 «взяли на вооружение» эмбриологи с целью отследить биографии отдельных клеток в ходе онтогенеза мыши.
-
Автор
-
Редактор
Темы
За последние несколько лет систему CRISPR/Cas9, казалось, попробовали применить во всех направлениях генной инженерии. С помощью этого мощнейшего инструмента редактировали геномы хозяйственно важных животных и растений, вредителей, переносчиков инфекций, модифицировали метаболические пути промышленно важных микроорганизмов. Разумеется, самые активные разработки ведутся в области применения CRISPR/Cas9 в медицине. Однако этот инструмент имеет не только прикладное значение, но и может пригодиться ученым, занимающимся фундаментальной наукой. В начале августа 2018 года Science опубликовал статью, авторы которой использовали CRISPR/Cas9 для отслеживания судьбы отдельных клеток в ходе развития организма мыши. О деталях этой замечательной работы мы сегодня и поговорим.
Отследить судьбы отдельных клеток в ходе развития сложного многоклеточного организма — задача в высшей степени нетривиальная. Самый простой объект для этой задачи — эутелические организмы, число клеток которых постоянно и генетически определено, например, модельный червь Caenorhabditis elegans. Восстановить биографию каждой из его 959 клеток удалось довольно давно. Однако подавляющее большинство многоклеточных организмов свойством эутелии не обладают. Наиболее общая идея для отслеживания жизненных путей отдельных клеток заключается в том, что, если клетка приобрела некоторую мутацию, не отразившуюся на ее жизнеспособности, то все ее дочерние клетки тоже будут нести эту мутацию. Если эта клетка дает начало целой ткани или органу, то все клетки этой ткани или органа будут также нести ее мутацию. Иными словами, наличие специфической мутации в клеточном геноме будет свидетельствовать о происхождении этой клетки от той предковой клетки, в геноме которой впервые появилась эта мутация. Таким образом, с помощью мутаций-меток можно устанавливать происхождение каждой клетки организма от той или иной зародышевой структуры.
Идея, в общем-то, несложная, а вот ее осуществление — задача не из легких. Первоначально в качестве меток использовали определенные кусочки ДНК (штрихкоды, или баркоды), которые вставляли в геном клеток-прародительниц. Этот метод получил название баркодирования ДНК. Однако такое мечение статично: оно позволяет лишь увидеть картину в данный момент времени, а восстановить промежуточные этапы оказывается невозможным. Впоследствии разработали методы, с помощью которых удавалось вносить мутации в клетки в условиях in vivo, то есть определенные мутации-метки (баркоды) появлялись на определенных стадиях онтогенеза, а не были искусственно введены в самом начале эксперимента. С помощью такого подхода удалось не только пронаблюдать за последовательностью клеточных делений в культуре, но и поклеточно проследить за развитием низших позвоночных животных.
Разумеется, нам больше всего хочется узнать подробности развития нашего, человеческого, организма. Низшие позвоночные состоят с нами в слишком далеком родстве, чтобы данные об их развитии можно было экстраполировать на нас. Поэтому ученые задумались о том, как бы проследить за путями отдельных клеток при развитии млекопитающих. В случае млекопитающих и без того замысловатые методики осложняются еще и тем, что эмбриональное развитие протекает внутри организма матери, что делает манипуляции с эмбрионами крайне сложными.
Группа американских ученых нашла в высшей степени изящное решение этой проблемы. В качестве объекта для изучения они выбрали мышь. Основная революционная идея их работы заключалась в том, чтобы с помощью системы CRISPR/Cas9 создавать мутантные аллели на протяжении всего эмбрионального развития, то есть штрихкодировать (или баркодировать) ДНК [1]. Анализируя мутации отдельных клеток на разных этапах развития, можно восстановить, когда обособилась та или иная клеточная линия, и какая клетка стала ее предшественником (рис. 1а).
Всё о CRISPR/Cas, анти-CRISPR/Cas, их работе и практическом применении вы найдете в статьях «Просто о сложном: CRISPR/ Cas» [2], «Как CRISPR/ Cas работает не по специальности» [3], «Анти-CRISPR: ответ вирусов» [4] и в теме CRISPR/Cas на нашем сайте.
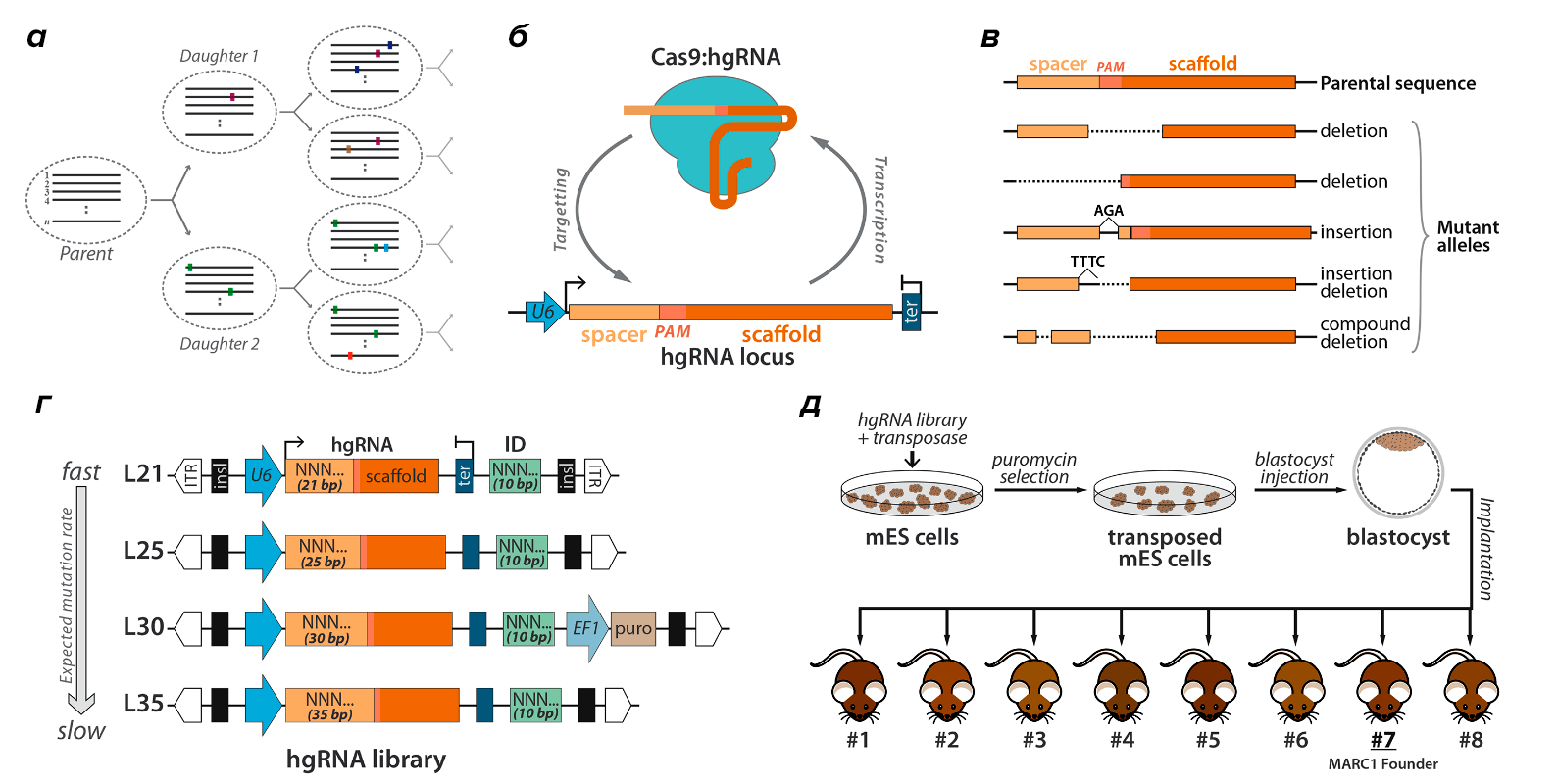
Рисунок 1. In vivo баркодирование ДНК с помощью hgRNA и стратегия получения мышей с множественными встройками hgRNA. а — Схема наследования маркерных мутаций (баркодов) при клеточных делениях. б — Схема строения комплекса самонаправленной направляющей РНК (homing guide RNA, hgRNA) и Cas9. в — Разнообразие мутантных аллелей, которое может появиться от исходного аллеля после воздействия Cas9 и репарации. г — Схема библиотеки конструктов, кодирующих hgRNA. Обратите внимание на инвертированные концевые повторы (ITR), благодаря которым транспозаза вставила их в геном. д — Схема эксперимента. После трансфекции и обработки транспозазой отобрали эмбриональные стволовые клетки с большим количеством вставок. Их внедрили в бластоцисты, которые имплантировали в матки самок. Из получившегося потомства выбрали особь с наибольшим числом вставок.
Однако в какие локусы вводить мутации, чтобы при этом не нарушить нормальное развитие животного? Ученые взяли мышиные эмбриональные стволовые клетки, растущие в культуре, и трансфецировали их ДНК-конструктами, представляющими собой транспозоны с вставленными в них генами направляющих РНК, а также подействовали на клетки ферментом транспозазой (рис. 1д). Каждый конструкт содержал полный набор элементов, которые должны быть в транскрипте, взаимодействующем в качестве направляющей РНК (guide RNA, gRNA) с Cas9: спейсер, содержащий уникальную нуклеотидную последовательность, PAM (protospacer adjacent motif) и скэффолд, необходимый для взаимодействия с Cas9 (рис. 1б). Стоит отметить, что конструкты отличались по степени того, в каком проценте клеток кодируемые ими направляющие РНК вместе с Cas9 вызывали мутации. По этому признаку конструкты условно подразделили на «быстрые» и «медленные» (рис. 1г). Транспозаза обеспечила интеграцию этих конструктов в геномы мышиных эмбриональных стволовых клеток. С помощью пуромицина отобрали клетки с большим количеством вставок. Их ввели в бластоцисты, которые, в свою очередь, имплантировали в матки самок. Из получившегося потомства отобрали мышь с наибольшим количеством вставок.
О транспозонах и других мобильных генетических элементах подробно рассказывает статья «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [5].
Далее эту мышь скрестили с несколькими мышами, конститутивно синтезирующими Cas9. И вот тут началось самое интересное. Клетки зародышей, содержащие вставки, начали производить Cas9. Изначально ДНК-конструкты были подобраны таким образом, чтобы считываемые с них направляющие РНК (homingguide RNA, hgRNA) притягивали Cas9 к их собственным генам в составе конструкта. В результате Cas9 вносил разрывы в гены самих направляющих РНК. Когда разрывы репарировались путем негомологичного соединения концов, в них появлялись мутации, которые делали дальнейшее образование функциональных направляющих РНК невозможным (рис 1в). Таким образом, каждая направляющая РНК была одноразового действия. На разных этапах развития активировались разные конструкты, кодирующие самонаправленные направляющие РНК, и по мере развития зародыша каждая его клетка не только наследовала весь багаж маркерных мутаций, приобретенных ее предшественницами, но и получала свои собственные баркоды [1].
Анализируя совокупность баркодов отдельных клеток на разных этапах эмбрионального развития, исследователям удалось восстановить картину того, из каких зародышевых структур происходят те или иные органы. Результат совпал с общепринятыми представлениями, что подтвердило достоверность новой методики.
Поскольку методику разработали именно для поклеточного отслеживания развития тканей и органов, ученые решили с ее помощью пронаблюдать за развитием мозга. Им удалось выделить среди клеток мозга те, которые происходят от эктодермы, и клетки мезодермального происхождения. Они установили также, что нейроны определенной области одного полушария ближе к нейронам этой же области другого полушария, чем к нейронам из других областей своего полушария. Из этого следует, что в ходе развития мозга первой устанавливается передне-задняя ось, а лево-правосторонняя ось устанавливается позже.
Таким образом, разработанная методика на основе CRISPR/Cas9 позволяет наблюдать за развитием даже сложных многоклеточных организмов на уровне отдельных клеток. Несомненно, с ее помощью мы еще сможем узнать немало новых деталей о развитии многоклеточных животных.
Литература
- Reza Kalhor, Kian Kalhor, Leo Mejia, Kathleen Leeper, Amanda Graveline, et. al.. (2018). Developmental barcoding of whole mouse via homing CRISPR. Science. eaat9804;
- Просто о сложном: CRISPR/Cas;
- Как CRISPR/Cas работает не по специальности;
- Анти-CRISPR: ответ вирусов;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов.