Действие алкоголя на мозг: найден сайт связывания молекул спиртов
25 августа 2009
Действие алкоголя на мозг: найден сайт связывания молекул спиртов
- 9064
- 5
- 18
Рецептор спирта — то есть, белок, избирательно связывающий этанол, — до недавнего времени был неизвестен
-
Автор
-
Редакторы
Эффект от употребления алкогольных напитков известен практически каждому, однако молекулярный механизм действия этанола на мозг долгое время был совершенно не изучен — не было понятно даже, является ли действие специфическим (то есть, основанным на механизме лиганд–рецептор) или неселективным (когда этанол просто нарушает физико-химическое равновесие внутренней среды организма). В свете последних исследований можно отдать предпочтение первому варианту: в структуре G-белóк–зависимых K+-каналов входящего выпрямления мембран нейронов (GIRK) найден сайт, специфически связывающий низкомолекулярные спирты, что активирует канал (независимо от действия G-белкá) и меняет характер взаимодействия между нервными клетками.
Эффект действия этилового спирта на мозг известен человечеству ещё со времён, когда целенаправленное изготовление алкогольных напитков было делом далёкого будущего: известно, что приматы с удовольствием пьют естественным образом образовавшееся «вино», поедая перебродившие фрукты и ягоды, когда удаётся достать это «лакомство». Напитки, содержащие спирт, занимают почетное место во всех известных культурах — очевидно, не только из-за благородного вкуса некоторых из них, но и благодаря пьянящему действию, оказываемому ими на сознание.
Несмотря на крайне простое строение молекулы этилового спирта — «активного вещества» этих напитков — молекулярный механизм действия алкоголя на нервную систему долгое время был совершенно неизвестен; понятно было только, что он как-то нарушает взаимодействие между нервными клетками в мозгу. Мнения колебались между двумя крайними случаями: от варианта неспецифического взаимодействия — когда этанол сдвигает физико-химический и биохимический баланс организма (гомеостаз) и влияет, в частности, на свойства клеточных мембран, — до механизма лиганд-рецепторного взаимодействия. (Последний случай подразумевает существование особого рецептора спирта, который был неизвестен, и существование которого представлялось сомнительным с учётом малого размера молекулы этанола.)
Сравнительно недавно стали появляться биохимические данные, говорящие о чувствительности многих ионных каналов, присутствующих в мембранах нервных клеток (например, управляемых лигандами: γ-аминомасляной кислотой, глицином, ацетилхолином, серотонином и другими) к действию этанола и других низкомолекулярных спиртов [1], [2]. Ранние гипотезы объясняли этот эффект модификацией вязкости и текучести липидных мембран клеток, но позднее учёные стали склоняться к идее специфических сайтов связывания молекул спиртов в этих каналах.
Исследователи из института Солка в Калифорнии (США) подробно исследовали этот вопрос, и им удалось окончательно подтвердить гипотезу специфического взаимодействия спиртов с каналами белковой природы в нервных клетках [3]. Объектом их исследований стали (в отличие от уже упомянутых лиганд-управляемых каналов) мембранные калиевые каналы входящего выпрямления, также реагирующие на присутствие спиртов: G-белок–зависимые (GIRK, G-protein–gated inwardly rectifying potassium channel) и G-белок–независимые (IRK, G-protein–insensitive inwardly rectifying potassium channel) K+-каналы. Белки этого семейства являются мишенью действия многих токсинов; нарушение их работы приводит к ряду серьёзных заболеваний. Их особенностью является односторонняя проницаемость: они впускают ионы K+ в клетку более «охотно», чем выпускают их; одной из их функций считается поддержание потенциала покоя нейронов на заданном уровне. GIRK запускаются Gβγ-субъединицами G-белка, активируемого посредством ряда G-белоксопряжённых рецепторов (GPCR), — в частности, m2-мускаринового рецептора. (Другими известными представителями семейства мембранных рецепторов GPCR являются фоторецептор родопсин [4] и адренорецепторы [5].) Результатом их работы стала идентификация и характеристика молекулярных сайтов связывания молекул спиртов в структурах этих рецепторов.
Несколько лет назад этой же группой учёных была получена кристаллографическая структура цитоплазматического домена G-белок–независимого K+-канала входящего выпрямления (IRK1) со связанными молекулами спирта [6] (правда, это не этанол, а более крупный двухатомный 2-метил-2,4-пентадиол, МПД). Обнаружилось, что четыре «кармана», связывающих по молекуле спирта, образованы парами смежных субъединиц в составе тетрамера, формирующего активную форму канала IRK1. На основе структурного сходства каналов GIRK1 и GIRK2 с каналом IRK1 (структуры всех трёх цитоплазматических доменов известны) исследователи предположили общий механизм связывания спиртов этими рецепторами (рис. 1).
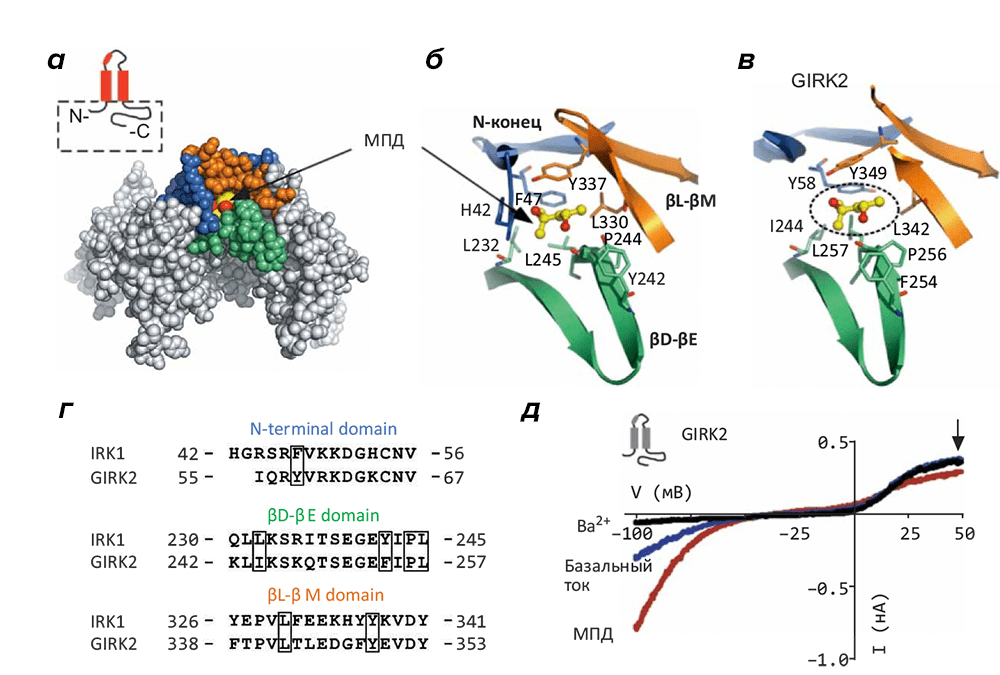
Рисунок 1. Консервативные спирт-связывающие сайты в структурах K+-каналов входящего выпрямления IRK1 и GIRK2. а — Структура цитоплазматического домена канала IRK1 в комплексе с молекулой двухатомного спирта 2-метил-2,4-пентандиола (МПД). Сайт связывания, образованный контактом двух смежных субъединиц, состоит из трёх структурных элементов: N-концевого участка, βL–βM «шпильки» одной субъединицы и βD–βE «шпильки» другой субъединицы. (На врезке схематично изображена структура одной субъединицы IRK-канала, включая поровую петлю, два трансмембранных сегмента и цитоплазматический домен, изображённый на этой картинке [показан пунктиром].) б, в — Детальное представление спирт-связывающих сайтов в комплексе с МПД в структуре канала IRK1 (Б) и в полученной по аналогии модели комплекса с GIRK2 в — (Предполагаемое положение МПД во втором случае [показано пунктиром] получено путём совмещения структур цитоплазматических доменов IRK1–МПД и GIRK2.) г — Выравнивание аминокислотных последовательностей IRK1 и GIRK2 в области трёх структурных доменов, образующих сайт связывания спиртов (остатки, непосредственно формирующий сайт, обведены в рамку). д — Вольт-амперная характеристика канала GIRK2: базальный ток и активированный ток в присутствии 100 мМ МПД, составляющий ~246% от базального. Для сравнения приведён ток канала, ингибированного 1 мМ ионами Ba2+ (чёрным).
Данные об активации каналов GIRK спиртами с числом атомов углерода до четырёх (метанолом, этанолом, 1-пропанолом и 1-бутанолом) и блокировании более длинными спиртами говорят об ограниченном объёме сайта связывания; эти же сведения легли в основу проведённого эксперимента по характеристике этого сайта с помощью точечного мутагенеза. Замена функционально важного аминокислотного остатка L257 в сайте (рис. 1) на ряд других подтвердила, что взаимодействие осуществляется именно в этом месте, и показала, что объём сайта связывания спиртов и его гидрофобность являются критически важными параметрами: увеличение объёма замещающего остатка или усиление его полярных качеств снижает способность к активации в присутствии спиртов. Фактически, спирты активируют каналы IRK и GIRK «паразитным» образом, то есть, в обход активации через G-белóк. объём сайта связывания спиртов в структурах каналов GIRK составляет ~250 Å3, что позволяет связывать спирты настолько объёмные как МПД, действие которого на каналы GIRK аналогично действию этанола (однако н-пентанол и все более крупные линейные спирты уже ингибируют канал).
Что интересно, схожие по форме и объёму активные сайты обнаружены и в других белкáх, связывающих спирты, — в частности, в алкогольдегидрогеназе, расщепляющей этанол в клетках печени, и в белке дрозофилы LUSH, ответственном за рецепцию алкоголя в окружающей среде.
Активация каналов GIRK приводит к общему снижению активности нейронов, что согласуется с депрессорным влиянием алкоголя на центральную нервную систему. Исследователи считают, что это свойство может быть использовано при лечении эпилепсии, характеризующейся эпизодическими аномальными всплесками электрической активности мозга, внешне проявляющимися в виде печально известных припадков. «Если бы удалось разработать новое соединение, конкурирующее с алкоголем за связывание в активных сайтах GIRK-каналов, этим можно было бы подавлять вспышки ненормальной активности нейронов и, возможно, получить новое лекарство от эпилепсии», — говорит Пол Слезингер, руководитель исследования [7].
Эта работа финансировалось американскими институтами алкогольной зависимости и алкоголизма, так что результаты, возможно, будут использованы и в лечении более распространённого заболевания.
Литература
- S. John Mihic, Qing Ye, Marilee J. Wick, Vladimir V. Koltchine, Matthew D. Krasowski, et. al.. (1997). Sites of alcohol and volatile anaesthetic action on GABAA and glycine receptors. Nature. 389, 385-389;
- D. Lovinger, G White, F. Weight. (1989). Ethanol inhibits NMDA-activated ion current in hippocampal neurons. Science. 243, 1721-1724;
- Prafulla Aryal, Hay Dvir, Senyon Choe, Paul A Slesinger. (2009). A discrete alcohol pocket involved in GIRK channel activation. Nat Neurosci. 12, 988-995;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Scott Pegan, Christine Arrabit, Paul A. Slesinger, Senyon Choe. (2006). Andersen's Syndrome Mutation Effects on the Structure and Assembly of the Cytoplasmic Domains of Kir2.1†,‡. Biochemistry. 45, 8599-8606;
- Site for alcohol’s action in the brain discovered. (2009). ScienceDaily.