Дизайнерские ферменты на службе общества
21 марта 2008
Дизайнерские ферменты на службе общества
- 1661
- 0
- 5
Искусственные ферменты — перспективный инструмент, место которому найдётся и в научных исследованиях, и в биотехнологии, и даже в оборонных разработках
коллаж на основе картинки jay_d@Flickr
-
Автор
-
Редакторы
Ферменты — лучшие катализаторы биохимических реакций, протекающих в живых организмах, — могут функционировать и вне клетки, работая на пользу человечества. Однако не для каждой реакции существуют природные белки, способные ускорить её ход. Если раньше создание новых ферментов осуществляли, оптимизируя уже существующие белки по механизму, аналогичному естественной эволюции, то теперь учёным удалось сконструировать несколько белков полностью на компьютере, проектируя их функцию «с нуля».
Ферменты — катализаторы белковой природы — способны ускорять протекание биохимических реакций в миллионы раз, и даже осуществлять катализ термодинамически невыгодных превращений за счёт сопряжения «целевой» реакции и гидролиза макроэргических связей, источником которых является преимущественно АТФ — универсальная «энергетическая валюта» клетки. Люди давно научились использовать многие ферменты в своих целях — от научных исследований до биотехнологии и промышленности. Сейчас главным образом используются природные ферменты, эффективность и стабильность которых часто улучшены за счёт подбора бактериальных (как правило, более стабильных) гомологов или введения направленных мутаций. Так, полимеразная цепная реакция — меч и орало молекулярной биологии — проводится с помощью термостабильного гомолога ДНК-полимеразы, полученного из бактерии Thermus aquaticus и обладающего высокой стабильностью, требующейся для этого многостадийного процесса.
Мощный набор молекулярно-биологических методов, накопленных к настоящему времени, скромно сдобренный пониманием механизмов химических реакций и принципов работы ферментов, уже позволяет создавать новые ферменты, более активные и/или стабильные, чем встречающиеся в живой природе, и даже проектировать белки с доселе не наблюдавшейся каталитической функцией [1]. Делается это, как правило, с использованием механизма, называемого «in vitro-эволюцией», суть которого заключается в создании большого числа (обычно 106–108, до 1012) вариантов гена, кодирующего исходный фермент, обладающий хотя бы следовой активностью требуемого рода, и сканировании получаемого после трансляции «ферментного супа» на предмет выявления белков, по случайности обладающих улучшенными качествами. Многократное повторение этого процесса позволяет создать новые ферменты, характеристики которых намного превосходят «стартовую точку», — хотя и «не дотягивающие» по эффективности до уровня природных белков-катализаторов [1].
Однако прогресс не стоит на месте: американские учёные разработали методику получения совершенно «новых» ферментов, катализирующих реакции, для которых отсутствуют белки-катализаторы в живых организмах [2], [3]! Эта работа является плодом совместного труда групп исследователей из Университета Калифорнии под руководством Кендалла Хоука (Kendall Houk) и Университета Вашингтона под руководством Дэвида Бэйкера (David Baker).
«Дизайн новых ферментов для реакций, не катализируемых в природе, вполне осуществим, — говорит Хоук. — Целью нашей работы является разработка компьютерных подходов для конструкции каталитических сайтов в белках, осуществляющих требуемые реакции».
Реакция, создание белка-катализатора для которой было задумано исследователями [2], носит название элиминации Кемпа, и заключается в отщеплении атома водорода от неионизуемого углеродного атома (рис. 1). Реакция предположительно одностадийна и протекает с образованием одного промежуточного состояния, в котором основание — положительно заряженный аминокислотный остаток — отщепляет протон, а другая группа — донор водородной связи — стабилизирует частичный отрицательный заряд на атоме бензоксазольного кислорода (превращающегося в результате расщепления конденсированного ароматического кольца в фенольный кислород). Основываясь на этом механизме, учёные предложили два варианта строения «идеального» каталитического центра — включающего один карбоксильный остаток (аспарагиновая или глутаминовая кислоты) или пару из остатка гистидина и того же карбоксильного остатка в качестве основания, катализирующего депротонирование.
Ключевым моментом предложенной методики является поиск белкового «каркаса», способного ориентировать каталитические аминокислотные остатки в пространстве наилучшим для протекания реакции образом. (Оптимальное положение каталитических групп было получено в квантово-механических расчетах переходного состояния субстрата и ключевых остатков сайта связывания.) Подбор нужного «каркаса» осуществлялся среди известных структурных мотивов в белках с помощью программы RosettaMatch — варианта программы Rosetta, разрабатываемой в лаборатории Бэйкера и уже снискавшей славу на ниве предсказания структуры небольших глобулярных белков [4]. Число комбинаций, перебираемых программой, выглядит совершенно астрономическим — ~1018 — однако в публикации уверяют, что подавляющая часть из них отсеивается с крайне низкими затратами компьютерного времени, а оставшиеся эффективно ранжируются по предсказанной энергии связывания переходного состояния, что позволяет сконцентрироваться на очень небольшом числе искусственных ферментов (порядка нескольких десятков). Хотя без распределённых вычислительных сетей тут не обошлось — на благо учёных постарались также пользователи программы Rosetta@Home, предоставляющие доступ к ресурсам своих компьютеров Дэвиду Бэйкеру и его коллегам.
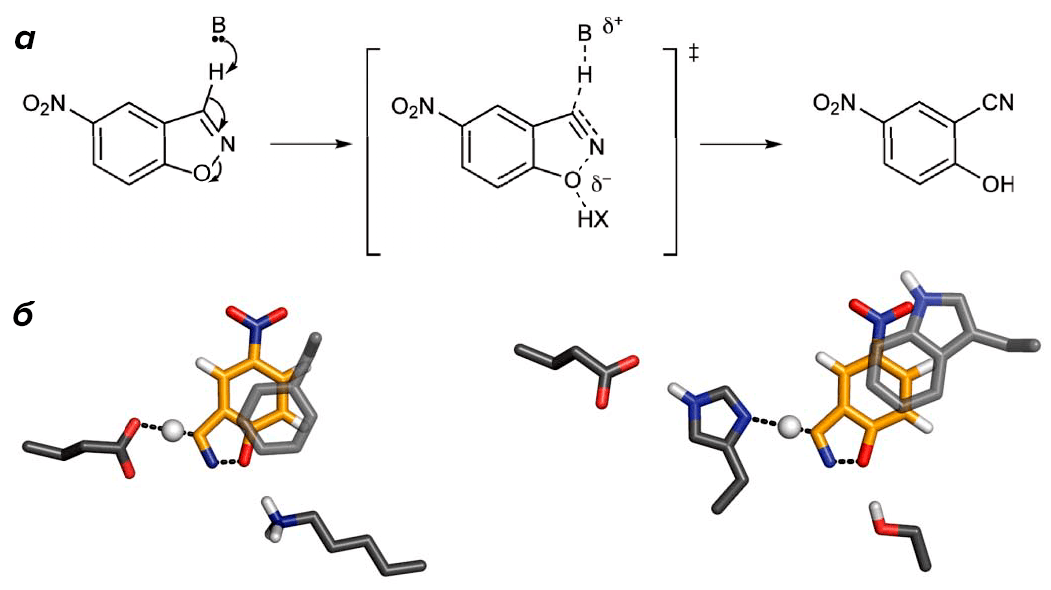
Рисунок 1. Схема реакции и каталитический центр «дизайнерских» ферментов. а — Элиминация Кемпа происходит в одну стадию и может быть ускорена за счёт стабилизации переходного состояния (изображено в квадратных скобках). Стабилизация может быть осуществлена за счёт депротонирования атома углерода основанием (B), а также при помощи водородной связи. б — Два из возможных вариантов строения каталитического центра: одиночный карбоксильный остаток (слева) или каталитическая пара His–Asp (справа) депротонируют субстрат, а ароматические остатки сайта связывания ещё больше способствуют стабилизации переходного состояния за счёт стэкинга. Для каждого варианта каталитического основания были перепробованы все возможности по стэкингу (Trp, Tyr, Phe) и донору водородной связи (Lys, Arg, Ser, Tyr, His, молекула воды) — и эти конфигурации служили «отправной точкой» для программы RosettaMatch, «достраивавшей» фермент на одном из выбранных вариантов остова белка.
Список типов укладки, способных поддержать в пространстве проектируемый активный сайт (например, основанный на паре His-Asp для реакции Кемпа), очень широк: тут оказываются и α/β-«бочонки», и β-«пропеллеры», и Россмановский мотив, и даже некоторые мембранные белки. Среди уже оптимизированных низкоэнергетических вариантов фермента 71% составили белки с типом организации α/β-«бочонок» (TIM barrel), который часто встречается в природных ферментах. На этом варианте учёные и сосредоточили свои усилия.
Мутагенез каталитических остатков в «новорожденных» ферментах доказал, что именно они отвечают за ферментативную активность, как и было задумано изначально, а полученная кристаллографическая структура оказалась практически идентичной созданной на компьютере модели (рис. 2).
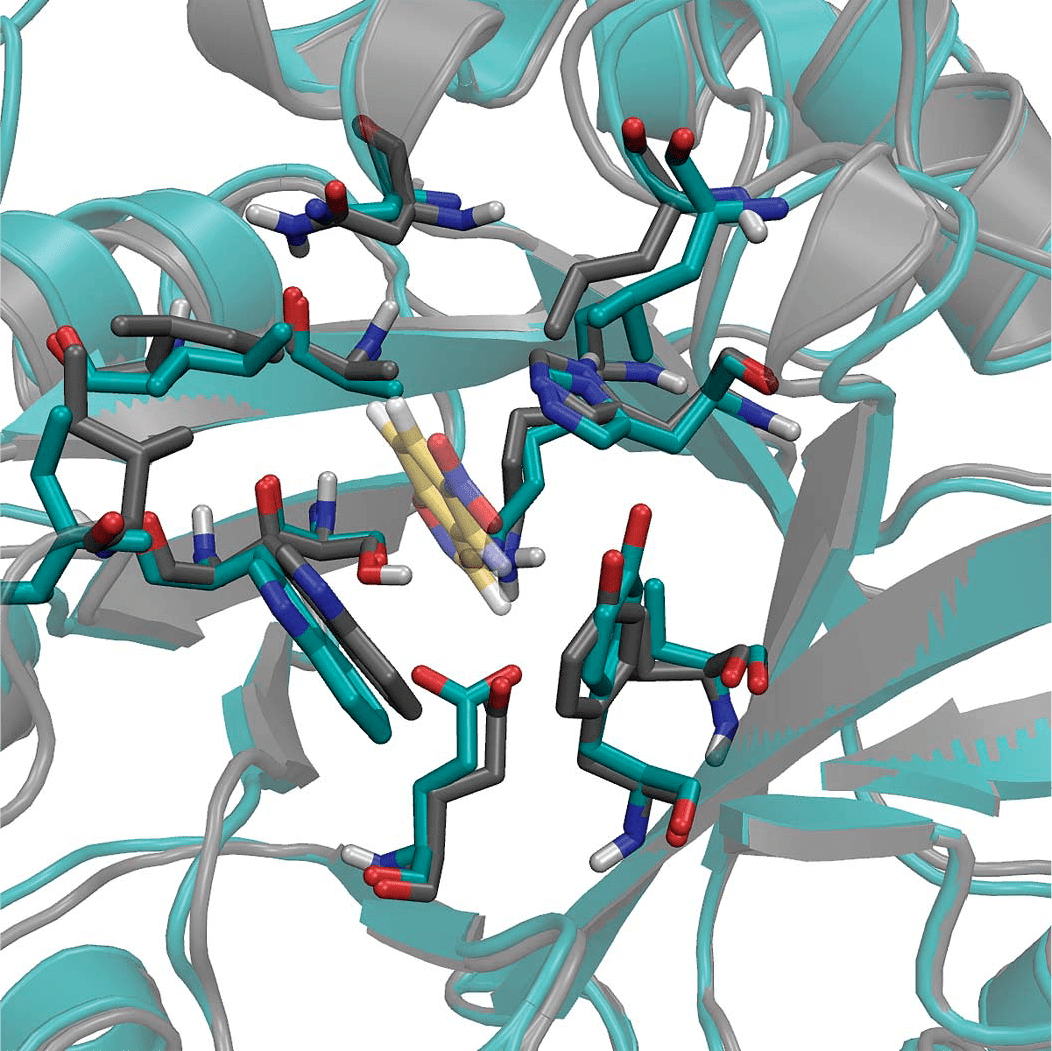
Рисунок 2. Сравнение кристаллографической структуры (голубой) и компьютерной модели (серый) «дизайнерского» фермента. Хотя экспериментальная структура была получена в отсутствие субстрата, боковые остатки активного центра фермента не сильно сместились — среднеквадратичное отклонение в этой области составляет всего 0,95 Å. Жёлтым показана молекула субстрата в компьютерной модели комплекса. Эта структура (обозначенная в статье [2] KE07 — седьмой белок в серии предсказаний) помещена в банк данных PDB под кодом 2rkx; там же можно ознакомиться и со структурой шаблона, использованного для дизайна — имидазолглицеролфосфатсинтазы (PDBId: 1thf).
Исследователи не остановились на достигнутом: компьютерный дизайн белка-катализатора был дополнен направленной эволюцией полученного фермента in vitro. «Оптимизированные» ферменты содержали 4–8 аминокислотных замен, не затрагивающих ключевых остатков каталитического центра, а активность этих белков возросла более чем в 200 раз.
Как довольно часто бывает, когда учёные докладывают в научной периодике о своих успехах, которые они считают исключительными, результаты исследования опубликованы сразу в двух ведущих журналах — в Nature [2] (пример с реакцией Кемпа) и Science [3], статья в котором посвящена разработке фермента для многостадийной (в отличие от реакции элиминации) ретроальдольной реакции. (Нужно, впрочем, отметить, что не только сами исследователи, но и строгие рецензенты посчитали достижения значительными, — что доказывается парой мартовских статей.) В публикации в Science рассказывается о разработке ферментов, также осуществляющих некатализируемый в природе процесс, обратный реакции альдольной конденсации, являющейся важным этапом метаболизма углеводов. Всего было синтезировано 72 белка, для 32 из которых обнаружили желаемую активность — и кристаллографические структуры двух лучших ферментов также совпали с предсказанным строением этих белков.
«Предыдущие попытки дизайна ферментов были не очень-то успешными, а некоторые из них оказались просто фальсификацией, пусть и не намеренной, — говорит Хоук. — И наш нынешний успех тем более удивителен, если учесть, что Природе требуются миллионы лет, чтобы сделать то, что у нас занимает считанные недели. Однако каталитическая активность искусственных ферментов пока довольно далека от той, которой обладают природные катализаторы». Де Чанси (DeChansie) — один из авторов статьи в Science — надеется на ещё большие успехи: «При условии, что нам удастся оптимизировать эту технологию, разрыв между природными белками-катализаторами и „дизайнерскими“ ферментами удастся существенно сократить» [5].
Работа обеих групп учёных — и команды Хоука, предлагающей каталитический механизм реакции и строение активных сайтов новых белков на основе квантово-химических расчётов, и группы Бэйкера, занимающейся компьютерным дизайном «целиковых» ферментов, — поддерживаются грантом Управления перспективных исследований Министерства обороны США (DARPA), что однозначно указывает на заинтересованность военных в разработках белков с заданной каталитической функцией. Остаётся надеяться, что новые поколения «дизайнерских» ферментов будут использоваться в биотехнологии и обороне — например, для нейтрализации химического и биологического оружия или последствий техногенных аварий, — но не для создания новейшего биохимического и вирусологического вооружения.
Литература
- Ферменты haut couture;
- Daniela Röthlisberger, Olga Khersonsky, Andrew M. Wollacott, Lin Jiang, Jason DeChancie, et. al.. (2008). Kemp elimination catalysts by computational enzyme design. Nature. 453, 190-195;
- L. Jiang, E. A. Althoff, F. R. Clemente, L. Doyle, D. Rothlisberger, et. al.. (2008). De Novo Computational Design of Retro-Aldol Enzymes. Science. 319, 1387-1391;
- Новые успехи в предсказании пространственной структуры белков;
- „Designer enzymes“ created by chemists have defense and medical uses. (2008). ScienceDaily.