
Электроника и генетика: несовместимы или...
08 февраля 2024
Электроника и генетика: несовместимы или...
- 429
- 0
- 1
Рисунок в полном размере.
коллаж автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Возможность управлять работой генов... Звучит весьма заманчиво, не правда ли? Однако все не так радужно, как может показаться на первый взгляд: применение «переключателей» для генов зачастую ограничено биодоступностью и цитотоксичностью организма. Именно поэтому при выборе управляющего стимула ряд ученых склоняется к применению электрического тока, способного быстро генерировать в тканях свободные электроны и радикалы для образования нецитотоксических концентраций активных форм кислорода. А те, в свою очередь, могут влиять на работу генов.
Надеюсь, вас заинтересовала идея управляемой экспрессии генов при помощи электричества. Выглядит впечатляюще, верно? Однако для начала я хотела бы дать небольшой обзор технических достижений в современной медицине, так как считаю, что продукты синтетической биологии (в том числе генной инженерии) со временем должны стать основным инструментом при лечении заболеваний. Ну что же, начнем!
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Последние десятилетия позволили разработать множество цифровых инструментов, ставших неотъемлемой частью нашей жизни и важных для здоровья. Не верите? Тогда сейчас я попрошу вас взглянуть на свою руку. Скорее всего, на ней вы увидите умные часы или фитнес-браслет для измерения ваших физиологических показателей здоровья, подсчета шагов и калорий, а также отслеживания качества сна. Даже если вы не являетесь обладателем носимых электронных устройств, на вашем телефоне точно найдется хотя бы одно приложение, позволяющее регистрировать состояние здоровья. Технологический прогресс сумел добраться и до современной системы здравоохранения, которую теперь трудно представить без новых усовершенствованных систем на основе искусственного интеллекта и интерфейсов [1].
Электроника, генетика и медицина: best friends forever?

Рисунок 1. Электроника, генетика и медицина.
коллаж автора статьи
Давайте пофантазируем и представим, что благодаря нательным датчикам станет возможно не только отслеживать показатели здоровья человека или активно корректировать состояние организма, но и даже управлять процессами вашего метаболизма за счет электрического тока!
Вы удивитесь, но на самом деле мы очень близки к тому, когда такие устройства появятся в нашей повседневной жизни. Это стало возможным благодаря синтетической биологии — молодому естественно-научному направлению, основанному на принципах инженерного дела для создания искусственных биологических систем. С ее помощью ученые научились создавать сложные генетические контуры, это такие «переключатели» работы генов для управления клеткой [2].
Генная терапия — это весьма многообещающий метод лечения заболеваний за счет внесения точечных изменений в геном соматических клеток. До настоящего времени не было изобретено ни одного электронного устройства, напрямую помогающего контролировать работу генов.
Много работ посвящено перспективам данного метода лечения, и, кстати, далеко не зря [3].
Суть данной терапии заключена в том, что гены с «вредными» мутациями «лечат» через доставку «правильных» генов в клетку. Именно ей мы обязаны возможности лечения врожденных иммунологических заболеваний, врожденных болезней крови, наследственной дистрофии сетчатки и даже онкогематологических заболеваний (с ними «бороться» помогают CAR-T-клетки — это Т-клетки иммунной системы с химерным рецептором антигена CAR,способные связываться с рецепторами на раковых клетках) [4].
На применение методов генной терапии в современной медицине возлагаются большие надежды при лечении болезней крови, нейромоторных заболеваний (например, бокового амиотрофического склероза, спинальной мышечной атрофии и дистрофии), рака и даже некоторых опасных наследственных заболеваний (например, наследственная дистрофия сетчатки и гемофилия) за счет пренатального переноса генов — метода, позволяющего корректировать генетические аномалии внутриутробно [5–8].
Так могут электронные устройства помочь в управлении генами, или же нет?
Проблема заключается в том, что электронные и биологические системы функционируют совершенно по-разному и во многом несовместимы. Биологические системы медленно изменяются в ходе эволюции, кодируются (говоря в общем и целом) аминокислотными последовательностями в генах и контролируются потоками ионов, протекающими через клеточные мембраны. Электронные же системы быстро обновляются и управляются электронами, протекающими по изолированным проводам. Для понимания уровня различия между этими двумя системами приведу пример: вспомните, сколько занимает обновление программного обеспечения вашего смартфона и сравните со временем обновления популяции клеток, выстилающих ротовую полость, желудок и кишечник, занимающее, в общей сложности, от 2 до 10 дней. Отмечу, что данный процесс смены старых клеток на новые является одним из самых быстрых в человеческом организме.
Огонь и вода, две абсолютно несовместимые вещи. Но это только на первый взгляд. Оказывается, что даже противоположности можно объединить воедино, не зря же говорят, что они притягиваются.
Решением проблемы объединения электроники и генетики стало создание посредника между ними, а именно — специального электрогенетического интерфейса, позволяющего электронным устройствам контролировать экспрессию генов.
Во многом стоит поблагодарить вмешательство синтетической биологии, сумевшей объединить простые аналоговые генные переключатели (переключатели, которые, влияя на экспрессию генов, контролируют выработку молекул в клетке и работают, в данном случае, от электрического сигнала) в сложные генные схемы, способные на программирование клеточного поведения при помощи функций логической обработки электронных схем (рис. 2).
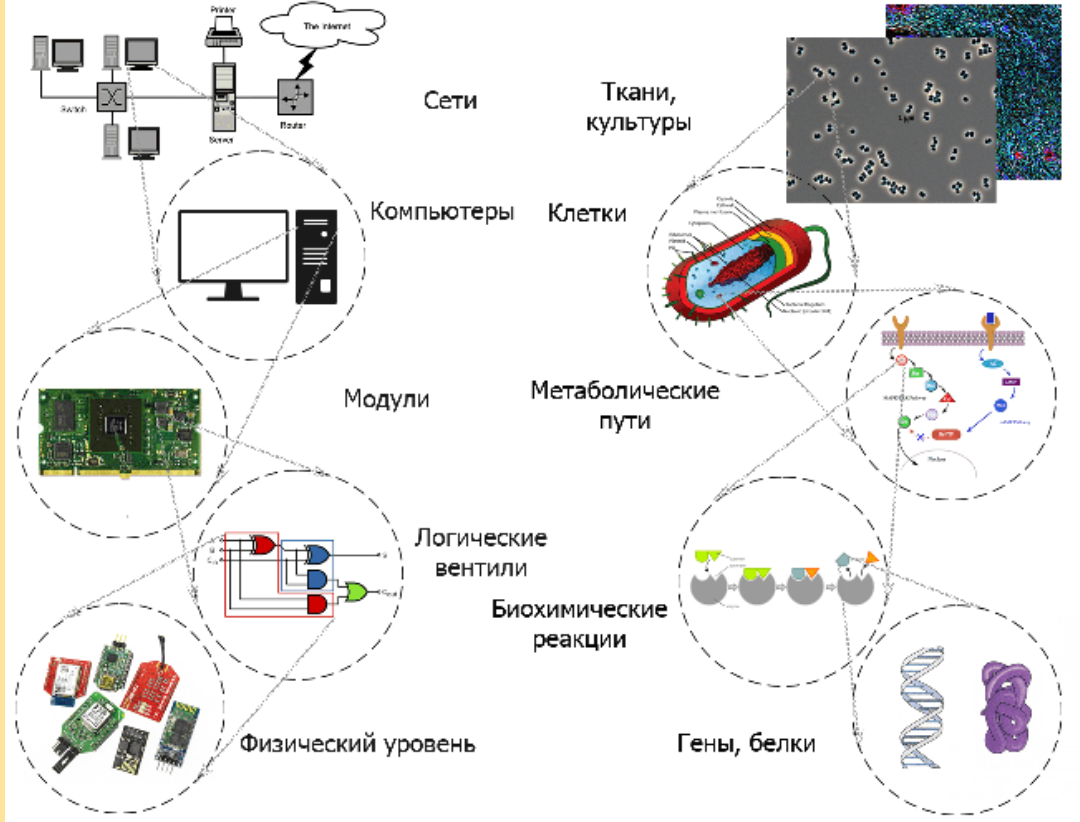
Рисунок 2. Аналогия между иерархической абстракцией в электроинженерии и биологическими объектами.
Ранее уже проводились попытки разработать электроиндуцируемую экспрессию генов и в бактериях, и клетках млекопитающих [9–11]. Но они оказались по итогу провальными из-за:
- цитотоксичности;
- ограниченной биодоступности (недостаточного объема и скорости вещества, доходящего до места его действия);
- требований переменного тока высокого напряжения, что не подходило для создания удобных носимых устройств, способных заменить многоразовые инъекции и прием.
Глядя на все эти сложности, становится понятно, насколько сложна задача. Подружить генетику с электроникой сумела команда Мартина Фуссенеггера (Martin Fussenegger) из Швейцарской высшей технической школы Цюриха (ETH Zurich) благодаря своей инновационной методике DART (DC-Actuated Regulation Technology, «Технология регуляции (генов) постоянным током») [12].
В чем суть?
У млекопитающих активные формы кислорода (АФК) образуются в результате многих жизненно важных реакций окисления (например, при переносе электронов во время дыхательных процессов, а также при протекании иммунных реакций в иммунных клетках). Нормальные функции АФК включают индукцию иммунной системы и мобилизацию систем ионного транспорта. Однако повышенная продукция активных форм кислорода приводит к оксидативному стрессу, вызывающему необратимое отрицательное воздействие на такие молекулы, как ДНК, РНК, белки, липиды, что может приводить к старению и многочисленным заболеваниям (болезни Альцгеймера, хореи Хантингтона, меланоме, диабету, болезни Паркинсона).
Ученых заинтересовал Кельх-подобный ЭХГ-ассоциированный белок 1 (KEAP1), который является важным супрессором опухолей и метастазов, действующий также как биосенсор АФК.
Для снижения окислительного стресса, как раз возникающего под действием АФК, KEAP1 взаимодействует с Nrf2-главным регулятором антиоксидантного ответа.
В условиях покоя Nrf2 с легкостью присоединяется к KEAP1, а при накоплении активных форм кислорода, KEAP1 высвобождает сигнальный протеин NRF2, запускающий ряд антиоксидантных и противовоспалительных механизмов в ядре (рис. 3).
Разработанный учеными электрогенетический интерфейс (DART- система) позволил сделать человеческие клетки восприимчивыми к электростимуляции, обеспечив тем самым экспрессию трансгенов — дополнительных генов KEAP1/NRF2, а также измененных промоторных участков ДНК, запускающих работу того или иного гена, на которые воздействует NRF2.
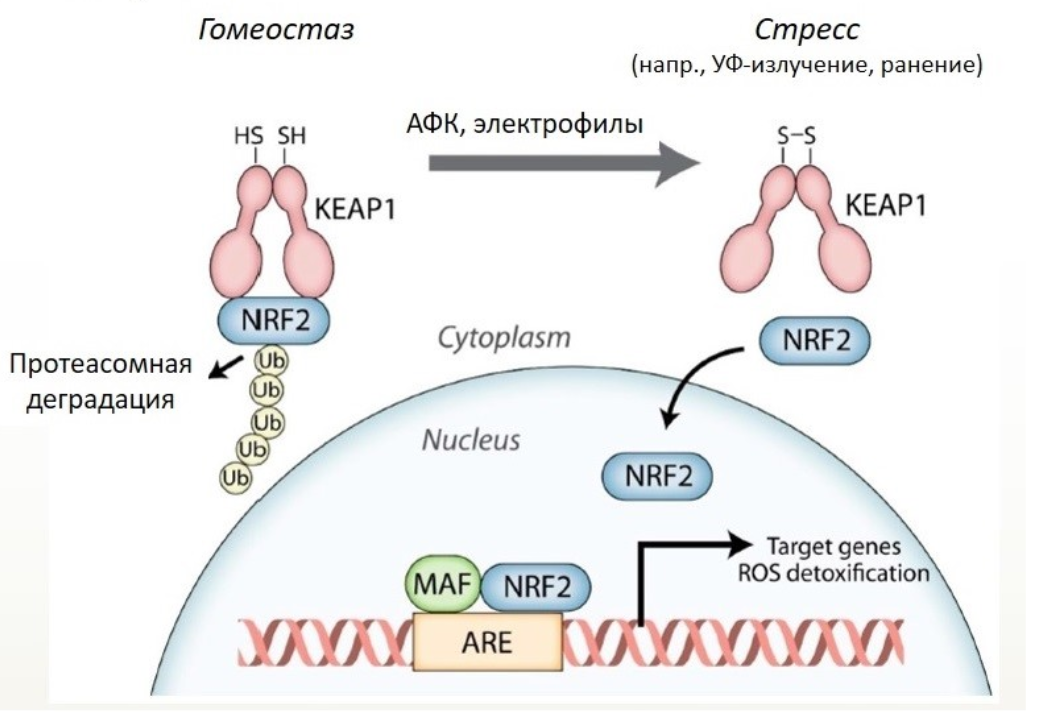
Рисунок 3. Транскрипционный фактор Nrf2 в защите от окислительного стресса и канцерогенов.
Nrf2 — редокс-чувствительный транскрипционный фактор, защищающий клетки и ткани от токсинов, окислительного стресса и канцерогенов. Nrf2 высвобождается в состоянии клеточного стресса и индуцирует экспрессию гена-мишени путем связывания ARE (антиоксидант-отвечающего элемента).
Система основана на увеличении концентрации активных форм кислорода за счет поступления в клетку свободных пар электронов при кратковременном воздействии слабым током.
Для контроля экспрессии генов при помощи электрического тока исследователи использовали эмбриональные клетки почек человека с конститутивными KEAP1 и NRF2, репортерную конструкцию pJH1005, кодирующую секретируемую щелочную фосфатазу, представляющую собой сокращенную версию щелочной фосфатазы плаценты человека. И все это привело к выработке АФК, способного вызвать высвобождение NRF2 из KEAP1, для экспрессии интересующего гена из синтетического промотора (рис. 4).
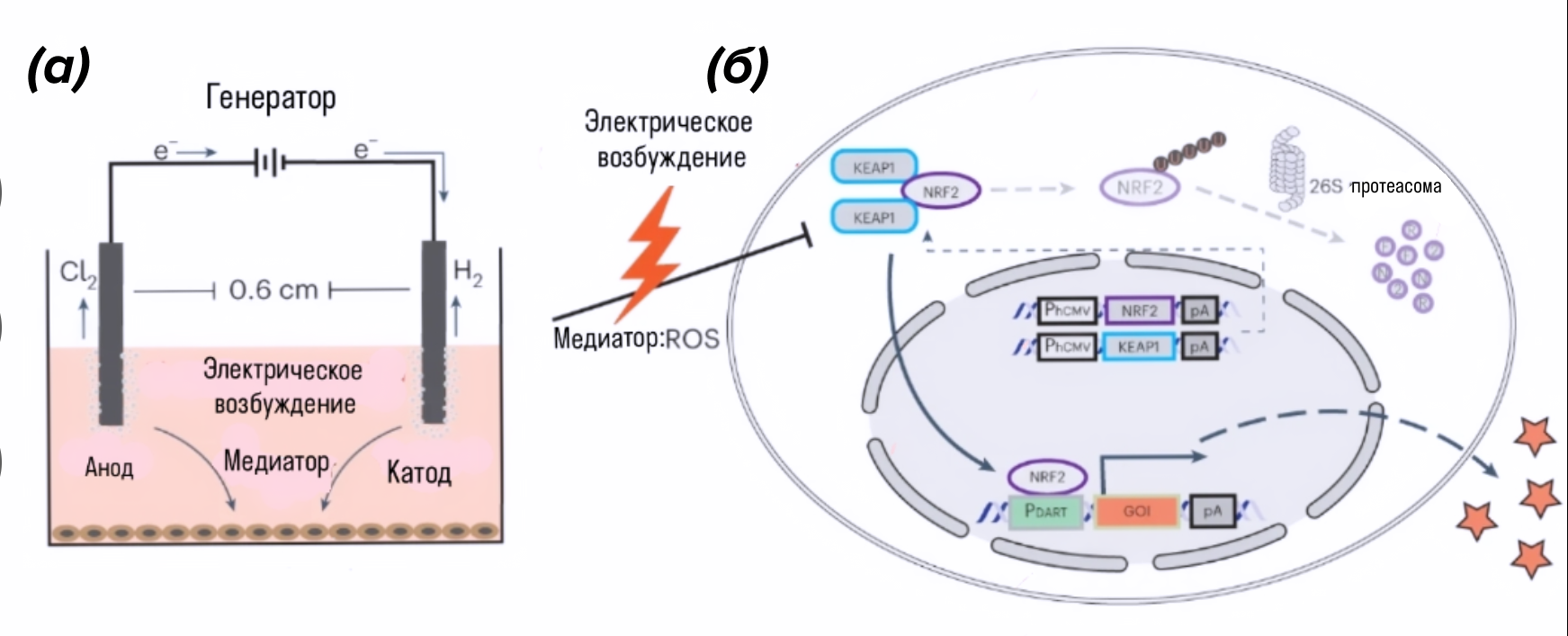
Рисунок 4. (а) — схематическая иллюстрация установки для стимуляции монослойных культур. Каждая лунка 24-луночного планшета имеет две платиновые проволоки, выполняющие функции анода и катода, расположенные на расстоянии 0,6 см друг от друга и погруженные в культуральную среду. При подаче электрического тока вокруг электродов образуются пузырьки с выделением газообразного хлора на аноде и газообразного водорода на катоде.
(б) — схематическое изображение электрогенетической цепи, основанной на антиоксидантном ответе NRF2/KEAP1.
При электрической стимуляции образование АФК фиксируется конститутивно экспрессируемыми комплексами NRF2 и KEAP1, локализованными в цитоплазме, что запускает транслокацию NRF2 в ядро, где он активирует экспрессию интересующего гена путем связывания с сайтами ARE в вышестоящих синтетических структурах.
Для проверки концепции ученые решили реализовать дистанционный контроль экспрессии инсулина на основе DART у мышей с диабетом 1 типа (инсулинозависимым типом, требующим введения инсулина извне), так как диабет является хроническим заболеванием, распространенность которого резко возрастает во всем мире и требует ускоренного поиска эффективных методов лечения.
Поскольку экспрессия инсулина, контролируемая электростимуляцией постоянного тока DART, не требует какой-либо сложной управляющей электроники, ученые использовали тройной батарейный блок типа АА, обеспечивающий напряжение 4,5 В постоянного тока, подключенный через простой ручной выключатель питания к двум индивидуальным платиновым иглам для акупунктуры, расположенным на расстоянии 6 мм друг от друга в месте имплантации для стимуляции введённых в спину больных мышей клеток (рис. 5).
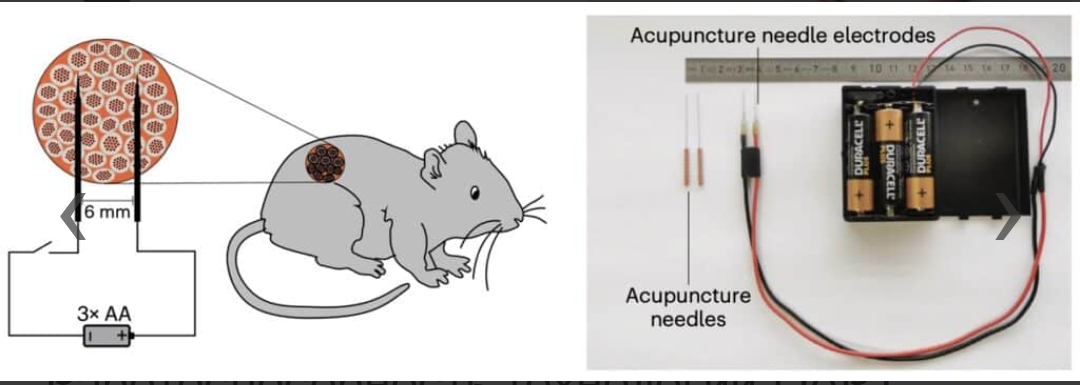
Рисунок 5. ГМ-клетки в лабораторных мышах активировались через электроды, связанные с тремя обычными батарейками АА.
Технология DART использует внутриклеточные датчики АФК, которые повышают чувствительность клеток, инкапсулированных в альгинат, к прямой стимуляции низким напряжением постоянного тока с питанием от батареи в течение нескольких секунд с помощью двух простых акупунктурных игл и без необходимости использования или имплантации какой-либо электроники.
Полученные результаты привели к открытию зависимости синтеза инсулина от силы и времени включения «генно-электрического» интерфейса DART.
Поскольку системе требуются всего несколько секунд при более низких напряжениях, чтобы активировать экспрессию трансгена, она имеет более высокую энергоэффективность и безопасность, а тройной аккумуляторный блок типа АА рассчитан на работу более 5 лет, обеспечивая при этом удобство и долговечность при использовании.
Серия стимуляций производила эффект, сопоставимый нескольким уколам инсулина в сутки, требующегося многим больным диабетом.
Возможно, в будущем генная терапия, дополненная электронными имплантами, избавит их от этой мучительной процедуры. Во всяком случае, сегодня с полной уверенностью можно сказать, что сделан первый серьезный шаг на пути объединения методов генетики и электроники, способный изменить наше представление о способах регуляции активности генов, привнеся в них множество новых открытий [12].
Литература
- «Большой брат следит за тобой», или Как развитие технологий меняет нашу жизнь;
- Синтетическая биология: от программирования компьютеров к программированию клеток;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Генная терапия нейромоторных болезней;
- Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии;
- Успех в борьбе с лейкозом: на шаг ближе к клиническому применению геномного редактирования;
- Фетальная генная терапия: от теории — к практике;
- Tanya Tschirhart, Eunkyoung Kim, Ryan McKay, Hana Ueda, Hsuan-Chen Wu, et. al.. (2017). Electronic control of gene expression and cell behaviour in Escherichia coli through redox signalling. Nat Commun. 8;
- Haijie Zhao, Shuai Xue, Marie-Didiée Hussherr, Ana Palma Teixeira, Martin Fussenegger. (2022). Autonomous push button–controlled rapid insulin release from a piezoelectrically activated subcutaneous cell implant. Sci. Adv.. 8;
- Krzysztof Krawczyk, Shuai Xue, Peter Buchmann, Ghislaine Charpin-El-Hamri, Pratik Saxena, et. al.. (2020). Electrogenetic cellular insulin release for real-time glycemic control in type 1 diabetic mice. Science. 368, 993-1001;
- Jinbo Huang, Shuai Xue, Peter Buchmann, Ana Palma Teixeira, Martin Fussenegger. (2023). An electrogenetic interface to program mammalian gene expression by direct current. Nat Metab. 5, 1395-1407.






